CHRONIC KIDNEY DISEASE CONCOMITANT WITH EHRLICHIOSIS: CASE REPORT
REGISTRO DOI: 10.69849/revistaft/ni10202411121342
Layse Tamyla Gomes1*, Eloísa Araújo Matara1, Roberta Lauriano Rossi1, Luana Karolina Serra da Rocha1, Thais Agostinho Martins1
RESUMO
A doença renal pode variar de lesão renal aguda até doença renal crônica, frequentemente causada por inflamações que comprometem a filtragem. Quando a função renal é prejudicada, há acúmulo de toxinas, podendo levar à falência renal. Em casos avançados, o tratamento com hemodiálise se torna necessário. Outras patologias podem estar associadas tornando os casos irreversíveis, como a erliquiose. A erliquiose provoca uma resposta inflamatória que afeta os rins, com a formação de imunocomplexos durante a infecção. Esses complexos se depositam nos capilares renais, causando glomerulonefrite, uma inflamação que compromete a função dos glomérulos, responsáveis pela filtragem sanguínea. O objetivo deste relato é apresentar um caso em que a doença renal se desenvolveu concomitantemente à erliquiose. No caso em questão, um animal foi encaminhado a um hospital veterinário para tratamento dialítico devido à doença renal, foram realizados exames laboratoriais, incluindo hemograma, bioquímico, teste rápido para erliquiose e PCR, que confirmaram a presença da infecção ativa por erliquiose, ademais, foram realizadas sessões de hemodiálises e diálises, entre outros tratamentos. O caso sublinha a complexidade e os desafios do tratamento de doença renal crônica agravada pela erliquiose, destacando a importância do uso de terapias avançadas e a necessidade de um planejamento ético para equilibrar recursos disponíveis e qualidade de vida do animal. A conscientização dos tutores sobre os riscos, a relevância do diagnóstico precoce, o tratamento correto e o acompanhamento contínuo do animal são medidas fundamentais que podem ajudar na detecção antecipada do comprometimento renal e aumentar as chances de sucesso do tratamento.
Palavras-chave:Azotemia. Cão. Ehrlichia spp. Hemodiálise.
ABSTRACT
Kidney disease can range from acute kidney injury to chronic kidney disease, often caused by inflammation that impairs filtration. When kidney function is compromised, toxins accumulate, which can lead to kidney failure. In advanced cases, dialysis treatment becomes necessary. Other associated pathologies, such as ehrlichiosis, can make the condition irreversible. Ehrlichiosis triggers an inflammatory response affecting the kidneys, with the formation of immune complexes during infection. These complexes deposit in the renal capillaries, causing glomerulonephritis, an inflammation that impairs the function of the glomeruli, responsible for blood filtration. The purpose of this report is to present a case where kidney disease developed concomitantly with ehrlichiosis. In this case, an animal was referred to a veterinary hospital for dialysis treatment due to kidney disease. Laboratory tests were conducted, including a complete blood count, biochemical analysis, rapid ehrlichiosis test, and PCR, which confirmed the presence of active ehrlichiosis infection. Additionally, hemodialysis and dialysis sessions were performed, among other treatments. This case highlights the complexity and challenges of treating chronic kidney disease aggravated by ehrlichiosis, emphasizing the importance of advanced therapies and the need for ethical planning to balance available resources and the animal’s quality of life. Raising awareness among pet owners about the risks, the importance of early diagnosis, correct treatment, and continuous monitoring are fundamental measures that can help in the early detection of kidney impairment and increase the chances of successful treatment.
Keywords:Azotemia. Dog. Ehrlichia spp. Hemodialysis.
INTRODUÇÃO
Os rins desempenham diversas funções essenciais para o organismo, como a filtração e eliminação de substâncias tóxicas do sangue, incluindo ureia, creatinina e ácido úrico. Além disso, os rins mantêm o equilíbrio ácido-base, produzem eritropoetina e regulam a pressão arterial (Bragato, 2013). Eles também controlam a quantidade de água e eletrólitos, como sódio, cloro, potássio, bicarbonato e fosfato (Ellenport, 1986).
Tais funções renais são realizadas por diferentes tipos de células que compõem a unidade funcional do rim, o néfron. Cada rim contém milhões de néfrons, e em cada um deles encontra-se um glomérulo, responsável pela filtração do sangue (Klein, 2014). A ocorrência de lesões estruturais irreversíveis no parênquima renal pode evoluir gradualmente para uremia, doença renal crônica (DRC) e falência renal (Polzin, Osborne & Ross, 2005).
A Doença Renal Crônica (DRC) é uma condição progressiva, e a gravidade da disfunção renal está diretamente relacionada à severidade da doença e ao seu prognóstico. Portanto, é crucial distinguir entre os estágios da DRC, classificados de I a IV, para definir as abordagens terapêuticas adequadas, visando melhorar a qualidade de vida e retardar a progressão da doença (Polzin et al., 2009).
A diminuição da síntese de eritropoetina pelos rins favorece o aparecimento da anemia (Polzin & Osborne, 1997), fator que compromete a vida dos pacientes que estão nos estágios III e IV da DRC (Waki et al., 2010). Desta forma, a Erliquiose pode apresentar uma anemia normocítica normocrômica suave, podendo estar relacionada à supressão da produção e à destruição acelerada destas células (Fraser, 1996). No entanto, a combinação de ambas as condições agrava o quadro anêmico.
A Ehrlichia canis é uma bactéria gram-negativa intracelular obrigatória, pertencem à Ordem Rickettsiales, Família Anaplasmataceae e ao gênero Erlichia spp. Ela parasita leucócitos (monócitos, macrófagos e granulócitos) e são transmitidas principalmente por carrapatos (Greene, 2011). O Rhipicephalus sanguineus, também conhecido como carrapato marrom do cão, é o reservatório e o vetor responsável da transmissão natural desta riquétsianos cães.
Essa enfermidade apresenta as fases aguda, subclínica e a crônica. Durante a fase aguda, a migração de células mononucleares infectadas para pequenos vasos sanguíneos provoca vasculite. A fase subclínica pode persistir por até cinco anos em cães naturalmente infectados, com alguns animais mantendo o microrganismo na corrente sanguínea durante esse período, podendo persistir intracelularmente. Isso pode levar à fase crônica, a qual pode ser afetada por fatores como a suscetibilidade racial, imunossupressão e a virulência da cepa infectante (Nelson & Couto, 2001).
Em cães infectados por E. canis concomitante à doença renal crônica, é observada alta incidência de nefrite intersticial, relacionada a intensa vasculite (Castro, Machado & Aquino, 2004).
A vasculite, comum nos órgãos e tecidos de animais infectados, decorrente da inflamação generalizada nos vasos sanguíneos, pode desempenhar um papel central na patogênese da doença, sendo desencadeada por um mecanismo imunomediado (Castro et al., 2004), resultando na ativação da cascata de coagulação, trombocitopenia por consumo, nefrite intersticial, inflamação perivascular no fígado com degeneração hidrópica, meningoencefalite não supurativa, esplenomegalia e hiperplasia dos cordões medulares (Castro et al., 2004).
Ehrlichia spp. está dentre os principais hemoparasitas encontrados no Brasil. Sendo o Brasil um país endêmico para a erliquiose, esta se destaca como uma das mais significativas doenças infecciosas, especialmente em áreas urbanas de clima tropical e subtropical, que abrigam as maiores populações de carrapatos (Abbiati, Freitas & Alves, 2019). Considerando a relevância e ocorrência de erliquiose no país, e a ocorrência de doenças renais por ela ocasionadas, o presente trabalho tem como objetivo relatar um caso de doença renal concomitante à erliquiose em cão.
RELATO DE CASO
No dia 05 de junho de 2023, foi atendido, em um centro de referência para doença renal, um canino, bull terrier, macho, castrado, 7 anos, pesando 28,5kg, encaminhado por outro profissional afim de ser submetido a avaliação renal. O animal apresentava-se apático, anoréxico, com êmese, hipertensão e azotemia. No exame físico, não apresentava dor abdominal, pressão arterial 170mmHg, frequência cardíaca de 112 batimentos por minuto (bpm), frequência respiratória de 20 movimentos por minutos (mpm), temperatura retal de 38,3oC e mucosas normocoradas.
O animal foi internado, iniciado o tratamento com fluidoterapia por ringer com lactato em bomba de infusão (60ml/h IV), acetilcisteína (10mg/kg IV) a cada 12h durante 7 dias, enrofloxacina 5% (1ml/10kg SC) a cada 12h durante 10 dias, citrato de maropitant (1ml/10kg IM) a cada 24h durante 5 dias, cobalzan (2-5ml/animal IM) a cada 38h durante 4 dias, doxiciclina (10mg/kg VO) a cada 24h durante 28 dias, mercepton (2-10ml/animal IV) diluído em solução de ringer lactato a cada 12h por 3 dias, dipirona (5mg/kg IV) a cada 8h durante 4 dias, apevitin (0,1ml/kg VO) a cada 12h durante 6 dias, e beneflora (1g/5kg VO) a cada 12h durante 7 dias.
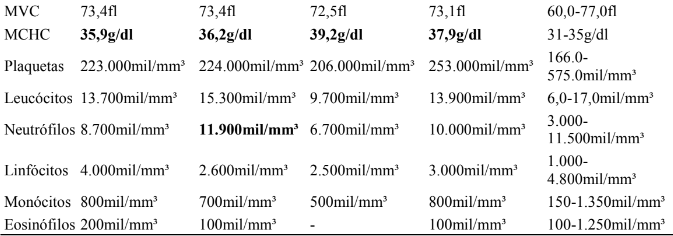
Após a instituição do tratamento imediato, no dia seguinte, com base nos resultados das análises hematológicas e bioquímicas, decidiu-se pela necessidade de iniciar a hemodiálise, para isso, foi implantado um cateter de duplo lúmen. O animal foi monitorado durante treze dias, neste período foram realizadas as análises hematológicas, cujos resultados foram acompanhados do primeiro ao terceiro dia de internamento. O animal permaneceu com anemia normocítica normocrômica durante todo o período. A evolução dos dados pode ser observada na Tabela 1.
Tabela 1
Resultados de análise hematológica realizada de 06 a 08 de junho de 2023.

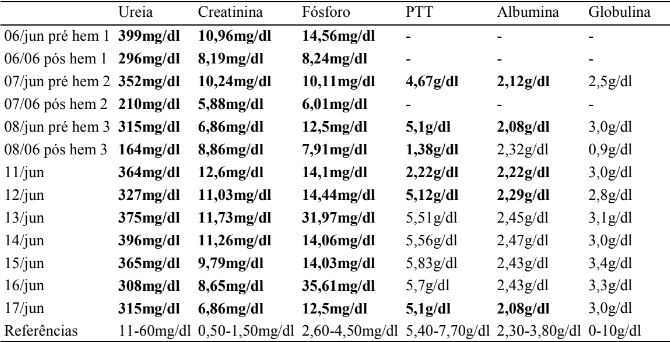
Além das análises hematológicas, foram realizadas análises bioquímicas, porém, estas seguiram, até o final do internamento, evidenciando azotemia e hiperfosfatemia e, em alguns momentos, hipoproteinemia e hipoalbuminemia, conforme os resultados apresentados na Tabela 2.
Tabela 2
Resultados de análise bioquímica sérica de ureia, creatinina, fósforo, proteína total, albumina e globulina, entre os dias 06 e 17 de junho de 2023.
Após dois dias de tratamento não foi observada melhora na anemia, então, foi instituído eritropoetina (100-150µi/kg SC) a cada 24h por 48 dias. Os procedimentos seguiram com a realização de hemodiálise, administração de fármacos, internamento e fluidoterapia continuada. Observou-se melhoria significativa nos marcadores bioquímicos renais após a segunda hemodiálise, e o animal manteve-se estável. Foi feito teste rápido 4Dx (Teste snap plus – IDEXX®) positivado para erliquiose, confirmando diagnóstico, utilizando sangue total com EDTA para a realização do método de reação em cadeia da polimerase qualitativa (PCR), confirmando a presença de Erlichia spp.
No dia 08 de junho de 2023, durante a terceira sessão de hemodiálise, houve uma intercorrência, onde foi necessária a interrupção do procedimento, onde o cateter venoso central se tornou inviável devido à coagulação e flebite. Houve uma nova tentativa de acesso, porém sem sucesso. O cateter venoso central foi mantido para dar seguimento na sessão do dia seguinte, pois, de acordo com os exames, o animal permaneceu com azotemia e hiperfosfatemia. Ademais, devido ao quadro de anemia apresentado no hemograma, o animal precisou ser submetido à transfusão sanguínea, foi administrada dexametasona (1mg/kg, IV) 10 minutos antes do início do procedimento.
No dia seguinte, devido a questões financeiras e pessoais, os tutores solicitaram a alta do paciente, mesmo sendo contraindicado pelos médicos veterinários. O animal foi liberado para casa com retorno solicitado em 1 dia, juntamente a medicações, incluindo doxiciclina (10mg/kg VO) a cada 24h durante 10 dias, beneflora (1g/5kg VO) a cada 12h durante 90 dias, ácido eicosapentaenóico (1cp/33kg VO) a cada 24h durante 10 dias, dipirona (25mg/kg VO) a cada 12h, ondansetrona (0,5-1mg/kg VO) a cada 8h, se houvesse vômito.
Após seu retorno, o animal foi novamente internado. Ao exame físico apresentava-se estável e alerta, alimentando-se com ração seca, sem constatação de êmese, mucosas normocoradas, PAM 180mmHg, frequência cardíaca de 120 bpm, frequência respiratória 24 mpm e temperatura retal de 37,8oC. Na análise bioquímica, após retornar para o hospital, ainda apresentava resultados de azotemia e hiperfosfatemia. Permaneceu, portanto, com o mesmo tratamento instaurado anteriormente.
Posteriormente, no 6° dia de internação, o animal apresentou piora no quadro clínico, ao exame físico apresentava prostração, anorexia, mucosas levemente hipocoradas, PAM 190mmHg, frequência cardíaca de 156 bpm, frequência respiratória 16 mpm, temperatura retal de 37,9oC. Com isso, foi adicionado ao tratamento prednisolona (0,5-1mg/kg VO), um comprimido a cada 24h durante 10 dias.
Devido a inviabilidade do cateter venoso central, optou-se por diálise peritoneal (500ml de peritosteril) a cada 2h por 48h, onde a solução de diálise é introduzida na cavidade peritoneal, permanecendo por um período antes da drenagem. Além disso, foi feita a sondagem uretral, para controlar o débito urinário, e sondagem nasogástrica devido à piora no quadro de anorexia. O animal se manteve estável e com boa resposta clínica ao tratamento da diálise.
No décimo dia de internamento, a sonda uretral foi removida e o animal continuou a ser submetido a diálise peritoneal (500ml de peritosteril). Apresentou PAM de 150mmHg, frequência cardíaca de 104 batimentos por minuto (bpm), frequência respiratória 24 movimentos por minuto (mpm), temperatura retal de 37,5oC, mucosas normocoradas, normoquesia, e se alimentou com ração úmida, entretanto, posteriormente fora constatada êmese. Houve mudança na inserção da diálise para 1L de ringer com lactato com 20ml de glicose.
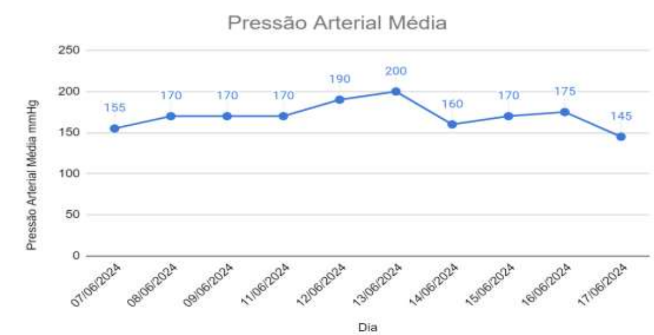
No décimo primeiro dia de internamento, foi acrescido o medicamento Meropeném (24mg/kg IV) ao tratamento, cuja administração era realizada a cada 12h, e Foli B (0,5ml/5kg VO) a cada 24h. No último dia de internamento, foi efetuada uma comparação entre as análises bioquímicas de ureia e creatinina, através da qual, foi averiguado que não existiram melhoras significativas (Gráficos 1 e 2). Ademais, realizou-se um comparativo da média das mensurações de Pressão Arterial Sistêmica (Gráfico 3).
Gráfico 1
Histórico da Ureia
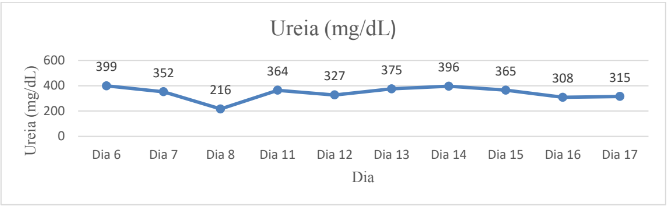
Gráfico 2
Histórico da Creatinina
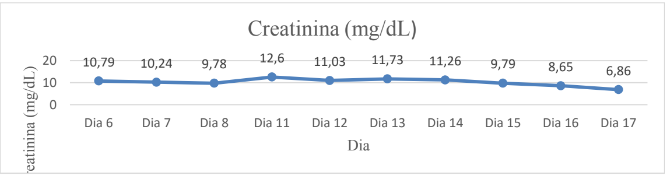
Gráfico 3
Histórico da Pressão Arterial Média.
Considerando a evolução e perspectiva do prognóstico, após 13 dias de terapia sem resultados favoráveis, médicos veterinários e tutores optaram pela realização da ortotanásia, morte natural sem interferência, apenas dando conforto para o paciente.
DISCUSSÃO
Segundo a literatura, a doença renal crônica (DRC), resulta em alterações irreversíveis na estrutura renal, levando à deterioração da função renal (S. A. Brown, Crowell & C. A. Brown, 1997; McGrotty, 2008). Ela pode ser agravada pela erliquiose canina, que causa glomerulonefrite devido ao acúmulo de imunocomplexos nos glomérulos, comprometendo a filtração glomerular (Costa, Buffon & Chaves, 2022). A Erliquiose Canina é uma doença infecto-contagiosa que afeta cães de todas as idades, independentemente da raça ou sexo, e pode evoluir para um quadro severo e potencialmente letal (Armando, 2022).
A literatura descreve sinais clínicos de doença renal crônica como apatia, náusea, vômito, anorexia e perda de peso. O vômito pode ocorrer decorrente da ação de toxinas urêmicas sobre a zona quimiorreceptora do centro bulbar do vômito (Galvão, Borges, Vieira, Ferreira, Léga & Pinto, 2010). Outro sinal comum é a hipertensão arterial, relacionada à sobrecarga salina e de volume, aumento da atividade do sistema reninaangiotensina-aldosterona (SRAA) e disfunção endotelial (Bortolotto, 2008). Sinais esses, que coincidem com os observados no animal do relato.
Em relação aos achados laboratoriais a fim de analisar o doente renal, é necessária a mensuração dos níveis de ureia e creatinina para avaliar a taxa de filtração glomerular (Lopes, Biondo & Santos, 2007).
Na análise bioquímica renal, pode haver um quadro de azotemia e hiperfosfatemia (Brown et al., 1997; Lees, 2004; McGrotty, 2008), semelhantes ao relato. Em casos de doença renal, tais compostos não são excretados, devido à diminuição de filtração, aumentando sua concentração na circulação sanguínea (Lopes et al., 2007). O mesmo se dá com o fósforo absorvido da dieta, que também é normalmente eliminado pelos rins.
Em relação à hipoproteinemia, é causada principalmente pela hipoalbuminemia, que pode estar relacionada à anorexia observada no paciente e às proteínas perdidas na urina (Queiroz, 2015). No hemograma, a alteração mais frequente é a anemia normocítica normocrômica não regenerativa, resultante da diminuição da produção de eritropoietina (Almeida, 2014).
A Erliquiose possui três fases, aguda, subclínica e crônica, que se tratadas tardiamente podem acarretar em óbito. Conforme a literatura, os sinais clínicos em cães afetados são geralmente inespecíficos, como hipertermia, apatia, letargia, anorexia, perda de peso e taquipneia (Almosny, 2002). Ao quadro descrito no relato, os dados que não correspondem em relação são hipertermia, letargia, leucopenia, trombocitopenia e petéquias.
Ainda segundo a literatura existente, nos achados hematológicos, é comum encontrar trombocitopenia ou pancitopenia (Crivellenti, L. Z., & S. B. Crivellenti 2023) e anemia normocítica normocrômica (Birchard & Sherding, 1998). Quanto a isso, o animal apresentou somente a anemia, decorrente da destruição dos eritrócitos e da diminuição da eritropoiese devido à redução da eritropoietina.
A trombocitopenia pode ser causada pelo aumento no consumo e sequestro esplênico de plaquetas, destruição imunomediada ou redução na vida útil das plaquetas, a infecção por E. canis também leva à lise plaquetária, embora alguns casos ocorram sem trombocitopenia (Almonsy, 2002; Accetta, 2008). É sabido, também, que os cães podem manifestar tendências a sangramentos, especialmente petéquias e equimoses na pele e nas membranas mucosas, além de episódios ocasionais de epistaxe decorrentes a trombocitopenia, entretanto, no caso relatado não houve tais manifestações.
A confirmação do diagnóstico de erliquiose deve ser associada o teste sorológico positivo e a realização de PCR para Ehrlichia spp., essa técnica é realizada por meio de amostra de sangue do paciente, sendo confirmada a presença do material genético, que, em conjunto com os sinais clínicos, podem caracterizar a doença (Castro et al., 2004; Alves, Linhares, Chaves, 2005; Nakashi et al., 2008). O diagnóstico foi fechado através do PCR.
O diagnóstico para a doença renal foi realizado através dos exames bioquímicos que obtiveram os resultados citados no relato. A creatinina sérica é o marcador endógeno mais comum para ser usado na avaliação da função renal (Freitas, Veado & Carregaro, 2014). Seguindo a literatura, o diagnóstico da DRC não deve se basear exclusivamente nos níveis séricos de ureia e creatinina. É fundamental que o veterinário considere o histórico do paciente, realize o exame físico, mensure a pressão arterial, solicite exames de imagem, urinálise e, se necessário, proceda com a biópsia renal (Cortadellas, 2012; Almeida, 2014).
De acordo com a Sociedade Internacional de Interesse Renal (IRIS, 2009), a doença renal crônica é classificada em quatro estágios com base em ureia, creatinina, análise de urina, UPC e pressão arterial (PA). No caso relatado, o estadiamento foi possível com base em ureia, creatinina e PA, embora a urina não tenha sido analisada, o que poderia auxiliar no diagnóstico. Considerando o estadiamento de I a IV, elencada pela IRIS, o quadro do animal se enquadraria no nível IV (creatinina em cães >5,0mg/dL), visto que o paciente permaneceu durante todo o período com creatinina acima desse valor descrito.
Animais no estadiamento IV apresentam azotemia renal severa e perda da função renal, associada à falência renal. A pressão arterial variou entre risco moderado (160-180 mmHg) e alto risco (acima de 180 mmHg), revelando hipertensão constante, comum em casos de doença renal, causada pela perda da habilidade de autorregulação, enfrentando efeitos nocivos do aumento da pressão arterial, ou seja, se o animal apresenta hipertensão sistêmica, ocorre hipertensão glomerular e lesões progressivas no tecido renal, dando-se alteração na função do órgão (Maggio e Davidson, 2007), justificando a oscilação da pressão arterial marcante no paciente do relato.
A hipertensão arterial sistêmica (HAS) pode se manifestar em qualquer fase da doença renal crônica (DRC), e o tratamento deve ser iniciado se a pressão arterial ultrapassar 180/120 mmHg em cães e gatos (Polzin et al., 2009). O objetivo principal da terapia é diminuir progressivamente a pressão arterial para menos de 160/100 mmHg, a fim de prevenir danos aos órgãos-alvo e episódios de hipotensão súbita (Elliott & Watson, 2009).
Os inibidores da enzima conversora de angiotensina (iECA), como enalapril e benazepril, e bloqueadores dos canais de cálcio (CCB), como amlodipina, são os medicamentos anti-hipertensivos mais recomendados para cães e gatos. Embora os iECA proporcionem apenas reduções moderadas na pressão arterial, são benéficos para as alterações hemodinâmicas intraglomerulares e ajudam a diminuir a proteinúria e a fibrose causadas pelo sistema renina-angiotensina-aldosterona (SRAA) renal, oferecendo proteção aos rins mesmo quando o controle da pressão arterial não é ideal.
A amlodipina também se mostrou eficaz no tratamento da hipertensão em cães e gatos com doença renal crônica, apresentando poucos efeitos colaterais e um início de ação relativamente rápido. No caso relatado, não foi administrado nenhum desses exemplos, o que pode justificar o quadro de hipertensão constante do paciente.
Durante o internamento, no período de 06 a 17 de junho de 2023, a partir dos diagnósticos, o tratamento instituído envolveu terapias intensivas, com fluidoterapia de manutenção na bomba de infusão (60ml/h IV) com ringer lactato, sendo a base do tratamento clínico da insuficiência renal aguda (IRA) em animais (Rieser, 2005). O antioxidante N-acetilcisteína também foi instituído, sendo reconhecido por sua ação protetora na membrana dos eritrócitos, além de outros efeitos antioxidantes benéficos, inclusive para os rins (Galvão & Carvalho, 2015). Juntamente com a Ondansetrona, indicado para controle e prevenção de vômito e náusea (Maranhão et al., 1996).
Os antibióticos utilizados foram doxiciclina, enrofloxacina e, posteriormente, meropeném. A doxiciclina é o principal medicamento de escolha para o tratamento da erliquiose em todas as suas etapas (Tilley, Smith & Francis, 2003), é lipossolúvel e atinge uma alta concentração no sangue e nos tecidos, penetrando rapidamente na maioria das células, quando administrada por via oral resulta em uma menor taxa recidiva comparada a outras tetraciclinas.
Em pacientes com insuficiência renal, devido à eliminação acontecer via fecal, as concentrações não aumentam no sangue, portanto, mostra-se ideal para tratamento de infecções suscetíveis quando a insuficiência renal é um fator complicante, como em infecções por E. canis (Almosny, 2002; Adams, 2003). Um medicamento que poderia ter sido utilizado no tratamento é o imunossupressor Dexametasona, uma vez que melhora a eficácia da Doxiciclina.
Associada a doxiciclina, foi utilizada a enrofloxacina, que possui amplo espectro de ação contra bactérias Gram-positivas, Gram-negativas, espiroquetas e micoplasmas, foi escolhida para prevenir infecções bacterianas secundárias, embora deva ser usada com cautela em animais com nefropatias e não haja estudo do uso de ambas no tratamento de erliquiose concomitante à DRC.
Posteriormente, o meropeném foi indicado para tratar uma infecção urinária persistente no paciente, porém, a sua aplicação veterinária só é válida se a infecção for definitivamente confirmada com base em sinais clínicos, cultura e anomalias citológicas, e se o agente patogênico mostrar resistência a todas as alternativas viáveis e for suscetível ao antimicrobiano selecionado. Antimicrobianos de importância crítica nunca devem ser utilizados para bacteriúria subclínica. Além disso, antimicrobianos considerados essenciais não devem ser empregados em infecções intratáveis ou em animais com prognóstico desfavorável (Dorsch, Knorr & Lund, 2019).
Dietas formuladas especificamente para pacientes renais, como rações adequadas, são recomendadas para cães com doença renal crônica, sendo a alteração dietética uma prática fundamental na terapia para esses pacientes (Bartges, 2012). Entretanto, há discussão sobre a necessidade de modificar a alimentação mesmo antes de surgirem sinais clínicos, visando iniciar um tratamento precoce que produza melhores resultados.
Embora Brown (1997) indique que não existem evidências claras de que a redução proteica retarde a progressão da doença renal, na prática, observa-se que dietas com teor proteico moderado influenciam positivamente a sobrevida dos pacientes. Assim, o suporte nutricional para esses pacientes deve oferecer proteínas de alto valor biológico em níveis controlados, limitando a formação de compostos nitrogenados não proteicos. A dieta deve conter baixos níveis de sódio, evitando hipertensão arterial, fibras, que servem como substrato para bactérias que utilizam a ureia, e ácidos graxos ômega-3 para redução de processos inflamatórios (Elliott e Lefebvre, 2009).
Durante o tratamento, foi utilizado o Cobalzan, indicado em estados anêmicos provocados por infestações parasitárias, e o Mercepton, que ajuda na eliminação de toxinas do organismo, possui ação hepatoprotetora, é utilizado como estimulante do processo digestivo, porém, ambos contraindicados para insuficiente renal. Também foi instituído tratamento sintomático com Dipirona, que possui ação analgésica, antipirética e pertence à classe dos anti-inflamatórios não-esteroides (Andrade, 2017), porém, há bulas que alertam o uso da sobredose em pacientes que apresentam problemas renais, já outras, contraindicam o uso da medicação.
Ademais, foi utilizado Cerenia® (Citrato de maropitant) sendo indicado para prevenção e tratamento do vômito agudo. Juntamente com Apevitin® (cloridrato de ciproeptadina) que reduz a atividade da histamina, serotonina e acetilcolina, estimulando o apetite e agindo na reposição de vitaminas, melhorando o funcionamento do organismo, embora o mecanismo promotor do apetite ainda não esteja totalmente compreendido, e probiótico (Beneflora® VET) que auxilia na recomposição da microbiota intestinal, mantendo-a equilibrada (Andrade, 2017).
O uso de hidróxido de alumínio (10-30 mg/kg por via oral) a cada 8h poderia ter sido considerado. Este antiácido, indicado para o tratamento e controle de úlceras gastrointestinais, também funciona como quelante de fósforo em casos de hiperfosfatemia associada à insuficiência renal (Nelson & Couto, 2015).
Depois de instituído o tratamento, de início foi realizada hemodiálise para filtrar adequadamente o sangue e excretar substâncias tóxicas que apareciam em excesso (ureia e creatinina), este procedimento é um tratamento que emprega a circulação extracorpórea para ajustar os desequilíbrios na composição e volume dos fluidos corporais, além de remover toxinas acumuladas (Cowgill & Langston, 1996; Elliot, 2000).
Durante o processo de hemodiálise, o sangue é retirado do paciente pela linha arterial do dispositivo e bombeado para o dialisador, onde circula por uma série de microtúbulos antes de retornar ao paciente pela linha venosa (Cowgill & Langston, 1996; Elliott, 2000), porém, houve complicações em uma das sessões no cateter venoso central, com formação de coágulos e flebites.
A flebite consiste na inflamação das células endoteliais da parede venosa, podendo ocorrer por fatores mecânicos, traumas, durante a inserção, retirada, movimentação do CVC; químicos, devido à agressão da parede da veia ou soluções medicamentosas irritantes diluídas de maneira errada; infecciosos, devido à inflamação da parede interna da veia associada à infecção por microrganismos. A trombose ocorre pela aderência de plaquetas e fibrinas que obstruem o CVC (Jesus & Secoli, 2007).
Nesses casos, recomenda-se a lavagem regular do cateter com solução fisiológica a 0,9% administrada em flushing, solução anticoagulante ou agentes fibrinolíticos, como baixas doses de heparina ou varfarina, para prevenir a formação de coágulos (Vendramin 2005, Secoli 2006). O padrão é que seja realizado o procedimento dentro dos atendimentos clínicos realizados nesse setor, contudo, ainda assim ocorreu a formação de coágulos nesse caso em específico.
Após a complicação, optou-se pela diálise peritoneal, que consiste na transferência de líquidos e solutos dos capilares peritoneais para o dialisato introduzido na cavidade peritoneal. Como recomendado pela literatura, a diálise peritoneal é amplamente utilizada em casos de injúria renal aguda (IRA) e para animais em estágios avançados de DRC (Labato, 2000).
O dialisato é administrado com uma taxa de 20 a 40 ml/kg, ao longo de 10 a 15 minutos. Inicialmente, o volume de dialisato deve ser infundido a uma taxa de 10 a 20 ml/kg, para evitar complicações cardiovasculares, e permanecer no abdômen entre 30 e 40 minutos. Ciclos de diálise precisam ser repetidos a cada uma ou duas horas até que o animal apresente melhora clínica, as concentrações séricas de creatinina e ureia tenham diminuído, e a sobrecarga de volume tenha sido resolvida. Esta terapia dialítica inicial dura, em média, de 24h a 48h (Labato, 2011).
Outro estudo relata que a diálise peritoneal ambulatorial contínua é a opção mais recomendada em casos de DRC, com duração de aproximadamente quatro a seis horas por sessão, sendo comum a necessidade de hospitalização do paciente para o procedimento, porém essa técnica não é muito utilizada na medicina veterinária (Cooper & Labato, 2011). Neste relato o paciente seguia com o procedimento utilizando 17ml/kg de peritosteril a cada 2h durante 48h. O animal apresentou melhora, porém não significativa.
A partir da análise das tabelas 1, 2 e 3 é possível observar uma redução de 66,42% da ureia e de 17,89% da creatinina com as sessões de hemodiálise. Porém, com a devida intercorrência e a interrupção do tratamento da hemodiálise com o retorno do animal para a casa, foi observada uma piora do quadro clínico, aumento de 135% de ureia e redução de 22,57% da creatinina. Isso sugere que a continuidade da hemodiálise teria sido crucial para manter os níveis de ureia e creatinina sob controle, prevenindo a deterioração do estado de saúde do animal. Portanto, a interrupção do tratamento foi um fator determinante para a piora do quadro clínico.
Mesmo com os tratamentos, os resultados dos exames persistiam com anemia, sendo essa uma das alterações mais frequentemente observadas em cães com erliquiose (Almosny, 2002), fato também constatado em pacientes nefropatas.
A situação citada ocorre devido à alta concentração de toxinas urêmicas e ao aumento do hormônio paratireoideano, reduzindo a vida útil das hemácias (hemólise) e a eritropoiese (Barber, 2003; Barros, Neto & Vaz, 2011; Cowgill, 1992; King, Giger & Diserens, 1992; Lopes et al., 2007), assim, foi adicionado ao tratamento a terapia com eritropoetina recombinante humana, uma alternativa terapêutica disponível no mercado, que, apesar da potencial causa de efeitos adversos como hipertensão arterial, convulsões, hipercalemia, entre outros, demonstra benefícios significativos em casos de doença renal crônica (DRC) avançada, superando essas limitações.
Contudo, no caso relatado, o animal apresentava hipertensão arterial acentuada que poderia ser atribuída a esse tratamento. Normalmente, os pacientes respondem positivamente ao tratamento com eritropoietina, com aumento do hematócrito, melhora do apetite, ganho de peso e uma notável melhora no bem-estar geral (Barber, 2003; Bartges, 2012).
Afirma-se que a administração de eritropoetina recombinante humana é benéfica em tratamento de pacientes renais crônicos em estágio avançado (Minuzzo, 2020). Contudo, esses resultados não foram observados no animal. Além da eritropoetina recombinante humana, outra medicação que poderia ter sido aplicada é o Decanoato de Nandrolona, um anabolizante que favorece o crescimento e a resistência celular, e pode ser administrado como uma tentativa de obter resposta terapêutica pode, também, ser utilizado na regeneração de diversos tecidos, como o sanguíneo, córneo e outros (Larsson et al., 2002).
Com apenas o histórico e a apresentação clínica, não é possível afirmar que a erliquiose seja a causa da doença renal neste caso. No entanto, a literatura indica que a erliquiose canina é uma condição que pode afetar vários órgãos, incluindo os rins.
Assim, pode resultar em glomerulonefrite, levando inicialmente a uma insuficiência renal aguda, que pode evoluir para uma doença renal crônica (DRC) (Costa et al., 2022). É importante destacar que a DRC pode apresentar complicações graves, especialmente em casos concomitantes à Erliquiose. Esse relato, portanto, contribui para a discussão sobre o agravamento do caso em decorrência da Erliquiose associada à doença renal.
O prognóstico para doença renal pode variar de acordo com o paciente. As mudanças que indicam um prognóstico desfavorável incluem anemia grave de difícil controle, dificuldade em manter o equilíbrio hídrico e aumento progressivo de azotemia, mesmo com o tratamento clínico conservador e fluidoterapia (Nelson & Couto, 2015). Já o prognóstico para a Erliquiose, depende da gravidade das lesões (Oriá, Pereira & Laus., 2004). São classificadas em prognósticos desfavoráveis se a medula óssea apresentar hipoplasia acentuada. (Tilley, et al. 2003)
A ortotanásia é o processo em que não há mais possibilidade de cura para o paciente, permitindo que a morte ocorra naturalmente, sem a intervenção de aparelhos ou métodos que atrasem o fim da vida (Villas-Bôas, 2008). Assim, é fundamental que o médico veterinário forneça orientação clara sobre todas as opções de tratamento disponíveis, e esclareça ao tutor as opções terapêuticas disponíveis para o controle da dor e as expectativas de eficácia a curto, médio e longo prazo. (Dethioux, Goy Thollot, 2007).
O tutor é legal e financeiramente responsável pelo paciente, tanto em relação aos cuidados quanto ao tratamento, sendo assim, cabe a ele a tomada de decisões em quaisquer situações (Paiva, 2016). Dessa forma ressalta-se a importância da comunicação eficaz entre o veterinário e o tutor, garantindo que esse último esteja plenamente informado sobre as implicações de cada escolha.
CONCLUSÃO
O presente caso clínico ilustra a complexidade e os desafios no tratamento da doença renal crônica, agravada por uma infecção por Erliquiose. Apesar das medidas terapêuticas intensivas e dos avanços na medicina veterinária, o paciente não respondeu de forma satisfatória ao tratamento, evidenciando as limitações das abordagens disponíveis para casos de insuficiência renal terminal.
O caso sublinha a relevância de uma abordagem multidisciplinar no tratamento de doenças graves, incluindo o uso de terapias avançadas como a hemodiálise, e ressalta a importância de um planejamento ético e cuidadoso no manejo de pacientes, equilibrando os recursos disponíveis com a qualidade de vida do animal. Contudo, o quadro concomitante pode contribuir para a dificuldade no tratamento e agravamento do caso.
Assim, é extremamente importante conscientizar os tutores sobre os riscos associados à doença, a importância do diagnóstico precoce, o tratamento correto e o acompanhamento contínuo do animal ao longo da vida. Essas medidas podem contribuir para a detecção antecipada do comprometimento renal e permitir um aumento das chances de cura do animal.
REFERÊNCIAS
Abbiati, T., Freitas, D., Alves, L., Freitas, B., Rezende, R., Barbosa, S., … Lopes, M. (2019, 9 de abril). Leishmaniose visceral canina: Relato de caso. Pubvet, v. 13, pp. 1-8.
Accetta, E. M. T. (2008). Ehrlichia canis e a. (Dissertação de Mestrado em Medicina Veterinária). Universidade Federal Rural do Rio de Janeiro, Seropédica, Brasil.
Adams, H. R. (2003). Farmacologia e terapêutica em veterinária. Rio de Janeiro, Brasil: Guanabara Koogan.
Almeida, T. L. A. (2014). Análises laboratoriais: principais alterações e como interpretá-las. In Almeida, T.L.A (Org), Guia Prático de Nefrologia em Cães e Gatos (Cap.7. pp.143-156). Rio de Janeiro, Brasil: L.F. Livros.
Almosny, N. R. P. (2002). Hemoparasitoses em pequenos animais domésticos e como zoonoses. Rio de Janeiro, Brasil: L.F. Livros de Veterinária Ltda.
Alves, L. M., Linhares, G. F. C., Chaves, N. S. T, Monteiro, L. C., Linhares, D. C. L. (2006, 28 de outubro). Avaliação de iniciadores e protocolo para o diagnóstico da pancitopenia tropical canina por PCR. Ciência Animal Brasileira, 6, pp.49- 54.
Andrade, S. F. (2017). Manual de terapêutica veterinária: consulta rápida (1a ed.) Rio de Janeiro, RJ: Roca.
Apevitin® [Bula]. São Paulo: EMS Pharma. Disponível em: https://www.ems.com.br/arquivos/produtos/bulas/bula_cloridrato_de_ciproeptadinaclori drato_de_tiamina_riboflavina_cloridrato_de_piridoxina_nicotinamida_acido_asco rbico_1001_1529.pdf. Acesso em: 24 jun. 2024.
Armando, C. (2022). Erliquiose canina: revisão de literatura (Trabalho de Conclusão de Curso em Especialização em Biologia Animal: Animais de Interesse em Saúde). Centro de Formação de Recursos Humanos para o SUS/SP do Instituto Butantan, São Paulo, Brasil.
Barber, P. (2003). Diagnosis and management of chronic renal failure in the cat. In Practice, 25(6), pp. 306–313. doi: https://doi.org/10.1136/inpract.25.6.306
Barros, F., Neto, R., Vaz, R., & Pestana, M. (2011, 31 de dezembro). Anemia in chronic kidney disease: from facts to clinical practice. Acta Médica Portuguesa, 24, pp. 869– 874.
Bartges, J. W. (2012, 21 de maio). Chronic kidney disease in dogs and cats. Veterinary Clinics: Small Animal Practice, 42(4), pp. 669–692.
Beneflora®VET [Bula]. São Paulo: Avert. Disponível em: https://www.biolabfarma.com.br/produto/beneflora-vet/. Acesso em: 24 jun. 2024.
Birchard, S. J., Sherding, R. G. (1998). Manual Saunders: clínica de pequenos animais (pp. 139-142). São Paulo, SP: Roca.
Bortolotto, L. A. (2008, julho-setembro). Hipertensão arterial e insuficiência renal crônica. Rev Bras Hipertens, 15(3), pp. 152-155.
Bragato, N. (2013). Fisiologia renal e insuficiência aguda em pequenos animais: causas e consequências (Seminários Aplicados – Programa de Pós Graduação em Ciência Animal). Universidade Federal de Goiás, Escola de Veterinária e Zootecnia, Goiás, Brasil.
Brown, S. A., Crowell, W. A., Brown, C. A., Barsanti, J. A., & Finco, D. R. (1997). Pathophysiology and management of progressive renaldisease. The Veterinary Journal, 154(2), pp. 93–109. Disponível em: https://doi.org/10.1016/s1090-0233(97)80048-2
Castro, M. B., Machado, R. Z., Aquino, L. P. C. T., Alessi, A. C., Costa, M. T. (2004, 5 de janeiro). Experimental acute canine monocytic ehrlichiosis: clinicopathological and immunopathological findings. Veterinary Parasitology, pp. 73-86.
Cerenia [Bula]. São Paulo: Zoetis. Disponível em: https://www.zoetis.com.br/global\assets/private/cerenia_0.pdf. Acesso em: 24 jun. 2024.
Cobalzan [Bula]. Rio de Janeiro: Bravet. Disponível em: https://www.agroline.com.br/produto/cobalzan-100-ml-bravet-96870. Acesso em: 24 jun. 2024.
Cooper, R. L., Labato, M. A. (2011). Peritoneal dialysis in veterinary medicine. Veterinary Clinics Small Animal Practice, pp. 91-113. doi: 10.1016/j.cvsm.2010.10.002
Cortadellas, O. (2012). Manual de nefrologia e urologia clínica canina e felina (1a ed., p. 246) São Paulo. SP: Medvet.
Costa, A. A., Buffon, F. S. N., Chaves, R., Sanches, R. R. (2022). Doença renal secundaria a erliquiose em cão: estudo de caso (Projeto de pesquisa em Medicina Veterinária). UniFTC, Salvador, Brasil.
Cowgill, L. D. (1992, agosto). Pathophysiology and management of anemia in chronic progressive renal failure. Seminars in Veterinary Medicine and Surgery (Small Animal), pp. 175–182.
Cowgill, L. D., Langston, C. E. (1996). Role of hemodialysis in the management of dogs and cats with renal failure. Veterinary Clinics of North America: Small Animal Practice, 26(6), pp.1347-1378. doi: 10.1016/s0195-5616(96)50132-4
Crivellenti, L. Z., Crivellenti, S. B. (2023). Casos de rotina em medicina veterinária em pequenos animais. (3a ed., pp. 159-160). São Paulo, SP: Medvet.
D-500 [Bula]. São Paulo: Zoetis. Disponível em: https://www.zoetis.com.br/_localeassets/arquivos/bovinos/bula-d-500.pdf. Acesso em: 24 jun. 2024.
Dethioux, F.; Goy-Thollot, I. (2007). Guia prático de medicina de emergência no cão e no gato. Aimargues, França: Royal Canin.
Dorsch, R. et al. (2019). Urinary tract infection and subclinical bacteriuria in cats: A clinical update. Journal of Feline Medicine and Surgery, 21(11), pp. 1023–1038. doi: 10.1177/1098612X19880435
Ellenport, C. R. (1986). Aparelho urogenital do carnívoro. In Getty, R. Sisson e Grossman: anatomia dos animais domésticos. (ed. 5(2), pp.1481-1482). Rio de Janeiro, RJ: Guanabara Koogan.
Elliott, D. A., & Lefebvre, H. (2009). Textbook of veterinary internal medicine. In Pibot, P.; Biourge, V. & Elliot, D. (Ed), Encyclopedia of canine clinical nutrition royal canin (pp. 252-282). Ithaca, USA: Royal Canin.
Elliott, D. A. (2000). Hemodialysis. Clinical Techniques in Small Animal Practice, 15(3), pp. 136-148. doi: 10.1053/svms.2000.18297
Elliott, J.; Watson, A. D. J. (2009). Chronic kidney disease: staging and management. In Bonagura, J. D.; Twedt, D. C. (Ed). Kirk’s current veterinary therapy XIV (pp.883-891). St. Louis, Missouri: Saunders Elsevier.
Fraser, C. M. (1996). Manual Merck de veterinária (7a ed.). São Paulo, SP: Roca.
Freitas, G. C. F., Veado, J. C. C., Carregaro, A. B. (2014). Testes de avaliação de injúria renal precoce em cães e gatos. Semina: Ciências Agrárias, 35(1), pp.411-426. doi: 10.5433/1679-0359.2014v35n1p411
Galvão, A. L. B.; Borges, J. C.; Vieira, M. C.; Ferreira, G. S., Léga, E., & Pinto, M. L. (2010). Hipertensão arterial na doença renal crônica em pequenos animais: revisão de literatura. Nucleus Animalium, 2, pp. 9-20. doi: 10.3738/1982.2278-369
Galvão, A. L. B., Carvalho, M. B. (2015, novembro). Perfil hematológico de cães idosos sadios ou com doença renal crônica tratados com n-acetilcisteína. Nucleus Animalium, 7(2), p. 1. doi: 10.3738/1982.2278.147
Greene, C. E., Sykes, J. (2011). Infectious diseases of the dog and cat (4a ed.). Oxford, Reino Unido: Elsevier.
IRIS (2009). IRIS Staging of CKD. Disponível em: http://www.iriskidney.com/guidelines/staging.html. Acesso em: 01 nov. 2024.
Jesus, V. C. D., Secoli, S. R. (2008, 25 de junho). Complicações acerca do cateter venoso central de inserção periférica (PICC). Ciência, cuidado e saúde, 6(2), pp. 245251. doi: 10.4025/ciencuidsaude.v6i2.4174
King, L. G., Giger, U., Diserens, D., & Nagode, L. A. (1992). Anemia of chronic renal failure in dogs. Journal of Veterinary Internal Medicine, 6(5), pp. 264–270. doi: https://doi.org/10.1111/j.1939-1676.1992.tb00350.x
Klein, B. G. (2014). Cunningham tratado de fisiologia veterinária (5a ed.). Rio de Janeiro, RJ: Elsevier.
Labato, M. A. (2000). Peritoneal dialysis in emergency and critical care medicine. Clinical Techniques in Small Practice 15(3), pp. 126-135. doi: 10.1053/svms.2000.16542
Labato, M. A. (2011). Peritoneal dialysis. In Bartges, J., Polzin, D. J. (Ed), Nephrology and urology of small animals (pp. 293-305). doi: 10.1002/9781118785546
Larsson, C. E. et al. (2002). Terapêutica tópica e sistêmica: pele, ouvido e olho. In: Andrade, S. F. (Ed.), Manual de terapêutica veterinária (2a ed., pp. 116-178). São Paulo, SP: Roca.
Lees, G. (2004). Early diagnosis of renal disease and renal failure. The Veterinary Clinics of North America: Small Animal Practice, pp. 867-885. doi: 10.1016/j.cvsm.2004.03.004
Lopes, S. T. A., Biondo, A. W., Santos, A. P. (2007). Manual de patologia clínica (3a ed.). Santa Maria, RS: UFSM.
Maggio, F., & Davidson, M. (2007). The eye as a target organ. In B. Egner, A. Carr & S.A. Brown (Eds.), Essential facts of blood pressure in dogs and cats (4a ed., pp.146154). Babenhausen, Germany: VBS VetVerlag.
Maranhão, M., Viana, R., Melo, J., Pereira, M., Farias, P., Sarubbi, A., Silva, J. (1996, 5 de setembro-outubro). Farmacologia e Emprego Clínico do Ondansetron. Revista Brasileira de Anestesiologia, pp. 362-369.
McGrotty, Y. (2008, 1 de outubro). Diagnosis and management of chronic kidney disease in dogs and cats. In Practice, 30(9), pp. 502–507.
Mercepton [Bula]. Rio de Janeiro: Bravet. Disponível em: https://www.campoonline.com.br/produtos/mercepton100ml/?gad_source=1&gclid=Cj0KCQjwsuSzBhCLARIsAIcdLm4t7utN_faGKdUuJLLZziR2nBaSCU9MR7yBsxB hDTHqtayvpum6xkaAuDfEALw_wcB. Acesso em: 24 jun. 2024.
Meropeném [Bula]. São Paulo: Eurofarma. Disponível em: https://cdn.eurofarma.com.br//wp-content/uploads/2016/09/meropenem-bula-po-liopaciente-eurofarma.pdf. Acesso em: 18 set. 2024.
Minuzzo, T., Silveira, S., Batschke, C., Correia, F., Agostini, P. (2020, 23 de outubro). Uso de eritropoietina recombinante humana em um cão com doença renal crônica: Relato de Caso. PUBVET, 14, pp 1-6.
Nakashi, A. C. H., Machado, R. Z., Costa, M. T., André, M. R., Baldani, C.D. (2008). Canine ehrlichiosis: clinical, hematological, serological and molecular aspects. Ciência Rural, 38(3), pp. 766-700. doi: 10.1590/S0103-84782008000300027
Nelson, R. W., Couto, C. G. (2001). Distúrbios dos nervos periféricos e da junção neuromuscular (2aed., pp. 819-828) Rio de Janeiro, RJ: Guanabara Koogan.
Nelson, R. W., Couto, C. G. (2015). Medicina interna de pequenos animais (2a ed.). Rio de Janeiro, RJ: Elsevier.
Ondansetrona [Bula]. São Paulo: Blau Farmacêutica S.A. Disponível em: https://www.blau.com.br/storage/app/media/bulas/novas/Bula_Ontrax.pdf. Acesso em: 21 out. 2024.
Oriá, A. P., Pereira, P. M., Laus, J. L. (2004). Uveitis in dogs infected with ehrlichia canis. Ciência Rural, 34(4), pp.1289-1295. doi: 10.1590/S0103-84782004000400055
Paiva, J. N. (2016). Considerações sobre a eutanásia na medicina veterinária (Monografia Graduação em Medicina Veterinária). Universidade de Brasília, Brasília, DF.
Polzin, D. J., Osborne, C. A., Ross, S. (2005). Chronic renal failure. In Ettinger, S. J., Feldman, E. C. (Ed.) Textbook of veterinary internal medicine (p. 1756-1785). Filadélfia, Pensilvânia: W. B. Saunders.
Polzin, D. J. et al. (2009). Calcitriol. In Bonagura, J. D., Twedt, D. C. (Ed.), s current veterinary therapy XIV (pp. 892-895). St. Louis, Missouri: Saunders Elsevier.
Polzin, D. J., Osborne, C. A. (1997). Chronic renal failure: what’s new? Compendium on continuing educ pract vet. Supplement, 19, pp.69-74.
Queiroz, L. L. (2015). Abordagem diagnóstica e terapêutica de cães com doença renal crônica com ênfase na hiperfosfatemia (Diss. Master’s Thesis), Universidade Federal de Goiás, Goiânia, Brasil.
Rieser, T. M. (2005, março). Urinary tract emergencies. Vet. Clin. Small Anim. Pract, pp. 359-373. doi: 10.1016/j.cvsm.2004.12.001
Secoli, S. R., Kishi, H. M., Carrara, D. (2006). Inserção e manutenção do PICC: aspectos da prática clínica de enfermagem em oncologia. Prática Hospitalar, 7(47), pp. 155-162.
Tilley, L. P., Smith, J., Francis, W. K. (2003). Consulta veterinária em 5 minutos. Barueri, Brasil: Manole.
Vendramin, P. (2005). Cateter central de inserção periférica (CCIP). In Harada, M. J. C. S., Rego, R. C., (Org). Manual de terapia intravenosa em pediatria. São Paulo, Brasil: ELLU.
Villas-Bôas, M. E. (2008, 3 de julho). A ortotanásia e o direito penal brasileiro. Revista Bioética, pp. 61-83.
Waki, M. F. et al. (2010, outubro). Classificação em estágios da doença renal crônica em cães e gatos: abordagem clínica, laboratorial e terapêutica. Ciência Rural, pp. 22262234. doi: 10.1590/S0103-84782010005000168
1 UNINGÁ – Centro Universitário Ingá, Departamento Medicina Veterinária
* laysetamylagomes@gmail.com
