NUTRITIONAL INTERVENTIONS TO IMPROVE SLEEP QUALITY IN ADULTS
REGISTRO DOI: 10.69849/revistaft/th102411119351
Ana Janaina Ramos da Silva1
Caroline Duarte Fernandes2
Caroline Sales dos Santos3
Erica de Jesus Santana4
Gabrielly Pinheiro Foge de Sá5
Gabriel Torres Sanches6
Giovanna Rocha Araujo7
Heloisa Helena Chagas Cajueiro de Freitas8
Janderson da Costa Albano9
Julia Ferrari de Claris10
Luísa Beatriz Averbach Lopes Pacheco11
Marco Antonio Fernandes Macedo12
Maria Carolina Melo da Silva 13
Mayara Chianca de Medeiros14
Maria Eduarda Barbosa Faria15
Micaelly Ramos de Brito 16
Nádia Melissa Damasceno Magalhães17
RESUMO
O sono é um processo complexo e essencial para a saúde e o bem-estar geral. Fatores como hábitos de vida, saúde mental e alimentação influenciam diretamente a qualidade do sono. Esta revisão objetiva identificar intervenções nutricionais eficazes para aprimorar a qualidade do sono e determinar os nutrientes que promovem um descanso adequado. Os resultados indicam que a qualidade do sono é impactada tanto pela dieta quanto pela composição e distribuição de macro e micronutrientes. Foram analisados artigos em inglês publicados nos últimos cinco anos, com buscas realizadas nas bases de dados MEDLINE, PubMed e SciELO. A pesquisa conclui que são necessários estudos adicionais para aprofundar o entendimento sobre as interações nutricionais e seu potencial impacto na qualidade do sono.
Palavras-chave: Qualidade do sono. Nutrientes. Melatonina. Nutrição. Ciclo circadiano.
ABSTRACT
Sleep is a complex and essential process for overall health and well-being. Factors such as lifestyle habits, mental health, and diet directly influence sleep quality. This review aims to identify effective nutritional interventions to improve sleep quality and determine nutrients that promote adequate rest. The findings indicate that sleep quality is impacted not only by diet but also by the composition and distribution of macro- and micronutrients. Articles in English published over the last five years were analyzed, with searches conducted in the MEDLINE, PubMed, and SciELO databases. The research concludes that additional studies are necessary to deepen the understanding of nutritional interactions and their potential impact on sleep quality.
Keywords: Sleep quality. Nutrients. Melatonin. Nutrition. Circadian rhythm.
1. INTRODUÇÃO
O sono é um processo vital e complexo que desempenha um papel fundamental na saúde e no bem-estar. Este estado de fácil reversão e reduzida responsividade ao ambiente influencia inúmeras funções físicas e mentais, abrangendo desde a regulação hormonal até a consolidação da memória. Dentro do cérebro, a alternância entre o sono e a vigília é orquestrada por complexas interações entre centros promotores do sono e da vigília, todos regulados pelo relógio circadiano no núcleo supraquiasmático (Zou et al., 2022).
A deficiência do sono é definida como quantidade ou qualidade insuficiente de sono que prejudicam o bem-estar. Ela pode ser causada por duração total inadequada de sono, acordar durante a noite ou alteração do horário do sono (jet lag) (Gohari et al., 2022). A partir da década de 60, pesquisas revelaram que indivíduos que não dormiam o suficiente ou acordavam frequentemente durante a noite estavam mais propensos a comprometer sua saúde a longo prazo (Gohari et al., 2022).
A falta de sono está diretamente associada a problemas psicológicos, como redução no desempenho cognitivo e impactos negativos na saúde do coração e do metabolismo. Além disso, foi encontrada uma associação com o risco de desenvolvimento de hipertensão, diabetes, obesidade, depressão, ataque cardíaco e derrame. Estudos conduzidos nos últimos anos identificaram que, à medida que o grau de privação de sono aumenta, o efeito adverso aparente também se intensifica (Colten & Altevogt, 2006). Entretanto, é importante notar que a maioria desses estudos é de natureza observacional, o que significa que não é possível estabelecer conclusões causais definitivas.
O termo ‘qualidade do sono’ é utilizado para descrever um conjunto de critérios, como o tempo total de sono (tempo total dormido durante a noite), latência de início do sono (tempo que o indivíduo utiliza entre deitar para dormir e começar a dormir de fato), manutenção do sono (tempo de sono REM e NREM), tempo total de despertar (período da vigília durante a noite posterior ao início do sono) e eficiência do sono (proporção de tempo que uma pessoa gasta dormindo em relação ao tempo total que passa na cama tentando dormir) (Fabbri et al., 2021). A duração de sono ideal pode variar de acordo com diversos fatores, dentre eles, a idade do indivíduo. Segundo Vasey et al. (2021), adultos necessitam de 7 a 8 horas de sono por noite.
A qualidade do sono é essencial para o desempenho cognitivo e afeta a concentração, a tomada de decisões e a resolução de problemas. Além disso, é durante o sono REM que as memórias são consolidadas. Portanto, a privação de sono ou uma noite de sono de má qualidade pode prejudicar significativamente a função cognitiva, a produtividade e o aprendizado (Craven et al., 2022).
No âmbito da privação de sono, quando considerada total, ocorre um período de vigília prolongado associado a situações em que há incapacidade de dormir durante um período igual ou maior que 24 horas. Na privação parcial, há redução da duração do sono em comparação ao hábito normal do indivíduo, levando-o a dormir menos do que o necessário (Craven et al., 2022).
Por conta disso, fatores como estilo de vida, saúde mental e alimentação podem interferir de forma significativa na qualidade do sono. Após a pandemia da COVID-19, a população experimentou mudanças significativas em seus padrões de sono. Um estudo conduzido por Moreno et al. em 2022 mostrou que 69,4% dos entrevistados relataram ter problemas para dormir três ou mais vezes na semana, sendo que, antes do início da pandemia, o percentual era de 53,8% (Moreno et al., 2022).
Nesse contexto, a melatonina, um hormônio derivado da serotonina produzido pela glândula pineal, desempenha um papel crucial na regulação do ciclo sono-vigília. A exposição à luz influencia diretamente a produção de melatonina, com sua secreção suprimida na presença de luz (Guaragna, 2022; Zhang et al., 2023). Para que a síntese de melatonina seja adequada, a ingestão de nutrientes específicos, como vitaminas do complexo B (B6 e B9) e magnésio, é essencial (Alghamdi, 2018). Esses nutrientes são encontrados em fontes de carboidratos, o que destaca a importância de uma dieta equilibrada na promoção de um sono saudável.
Diante da importância do sono para a saúde e do papel dos nutrientes na sua regulação, este trabalho se propõe a identificar as possíveis intervenções nutricionais efetivas para melhorar a qualidade do sono. Além disso, busca determinar as quantidades adequadas de nutrientes necessários para otimizar o sono, bem como explorar os mecanismos pelos quais esses nutrientes afetam positivamente a qualidade do sono. Esta pesquisa visa contribuir para uma compreensão mais abrangente do sono e fornecer orientações práticas para a promoção de hábitos alimentares que favoreçam um sono saudável e restaurador.
2. MÉTODO
O presente estudo trata-se de uma pesquisa descritiva qualitativa por meio de uma revisão bibliográfica, conduzida no período de setembro a novembro de 2023, com buscas realizadas nas bases de dados da MEDLINE (Medical Literature Analysis and Retrieval Sistem on-line), via PubMed, SciELO (Scientific Electronic Library Online), utilizando os descritores “SLEEP”, “QUALITY”, “NUTRIENTS”, “TREATMENT” e “MELATONIN”. Os critérios de inclusão foram: artigos originais, publicados nos idiomas português e inglês no período de 2018 a 2023. Foram considerados 16 artigos, 1 nacional e 15 internacional.
Como critérios de exclusão foram considerados faixa etária (crianças, adolescentes e idosos), artigos que abordam fitoterápicos, artigos que abordam fisiopatologias oncológicas.
Figura 1. Fluxograma de pesquisa e filtragem dos artigos científicos encontrados na base de dados e por outras fontes.
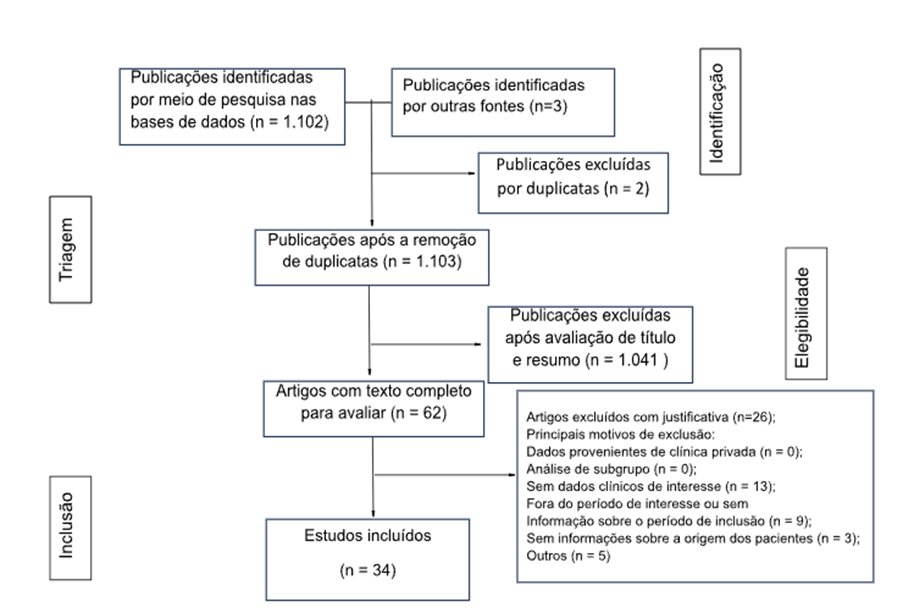
Fonte: os autores (2024)
- RESULTADOS E DISCUSSÃO
3.1. Sono e sua qualidade: aspectos fisiológicos e ciclo circadiano
O sistema biológico complexo conhecido como ciclo circadiano é responsável por regular uma variedade de processos fisiológicos ao longo de aproximadamente 24 horas, desempenhando um papel crucial na preservação da saúde humana. Recentemente, tem-se observado um aumento substancial no interesse pela pesquisa que explora a ligação entre o ciclo circadiano e doenças crônicas não transmissíveis. Essa constatação assume uma importância significativa, uma vez que há correlações entre disfunções nos ritmos circadianos e várias doenças crônicas, tais como diabetes, doenças cardíacas, distúrbios metabólicos e câncer (Zou et al., 2022).
O ciclo circadiano é controlado por um relógio biológico interno que se ajusta às variações ambientais, como a alternância entre luz e escuridão. A precisa regulação dos ritmos circadianos é essencial para manter o equilíbrio interno e o funcionamento adequado do organismo. Quando esses ritmos são perturbados, seja devido à exposição constante à luz artificial durante a noite, ao trabalho noturno, a viagens frequentes por diferentes fusos horários ou por outras razões, isso pode acarretar uma série de efeitos adversos à saúde (Zou et al., 2022).
Através da via retino-hipotalâmica, as células especializadas da retina desempenham um papel crucial ao enviar informações visuais para o cérebro, como a percepção de luz no ambiente. Estas células desempenham a função central na fototransdução, enquanto as células ganglionares assumem a responsabilidade de transmitir essas informações ao cérebro, desempenhando um papel vital na sincronização do ciclo claro e escuro. Para esse processo ocorrer, os axônios ipRGC (células ganglionares intrinsecamente fotossensíveis) liberam glutamato e, em menor medida, o polipeptídeo ativador da adenilato ciclase (PACAP) nos neurônios do núcleo supraquiasmático. Esses neurotransmissores co-liberados nos neurônios do Núcleo Supraquiasmático ativam receptores, promovendo o influxo de cálcio nos neurônios centrais do NSQ através da abertura dos receptores de glutamato NMDA permeáveis ao cálcio (Oh J et al.,2018).
Essa sinalização é subsequentemente conduzida intracelularmente até o núcleo do relógio molecular por meio da ativação de quinases dependentes de cálcio, incluindo CLOCK, BMAL1, CRY e PER, desencadeando um processo de regulação genética. Durante o período diurno, observa-se uma elevação na expressão de BMAL1 e CLOCK, enquanto à noite ocorre o fenômeno oposto, com um aumento na expressão de PER e CRY. Essa alternância coordenada na atividade gênica é fundamental para a manutenção dos ritmos circadianos e a harmonização do relógio biológico com os padrões ambientais (Franzago et al., 2023)ea oscilação desses genes ao longo do dia gera uma espécie de relógio, regulando as diversas funções na região do encéfalo e a nível sistêmico (Zou et al., 2022; Oh J et al.,2018).
Diante das discussões sobre a regulação circadiana e o papel central da via retino-hipotalâmica, uma investigação conduzida por Chamorro et al. em 2023 contribui significativamente para a compreensão dos efeitos da privação do sono nos processos metabólicos. Os resultados indicaram que a restrição aguda do sono levou a uma maior sensação de fome, aumento do apetite e maior ingestão de energia (Franzago et al., 2023).Isso está em consonância com as descobertas anteriores que apontam para a grelina como um mediador chave nesse processo. Essas descobertas destacam a influência crucial do ciclo circadiano e da privação do sono nas regulamentações metabólicas e na fome, tendo implicações importantes no entendimento e manejo de distúrbios metabólicos, como diabetes e obesidade (Chamorro et al., 2022).
3.2. Sono e resistência à insulina
A correlação entre doenças metabólicas e má qualidade do sono tem sido objeto de crescente interesse, com várias pesquisas recentes estabelecendo uma associação mútua entre esses dois fatores. Isso se deve, em parte, ao papel do ciclo circadiano na regulação de enzimas e hormônios em todo o corpo e tecidos (Zou et al., 2022).
O núcleo supraquiasmático (NSQ), que é sincronizado pela luz, desempenha um papel fundamental na coordenação dos ritmos circadianos em todo o corpo, assegurando que os processos fisiológicos estejam alinhados com o ciclo claro-escuro de 24 horas (Giovanni, Soares & Gonçalves, 2023). Além disso, o NSQ interage com relógios periféricos que mantêm seus próprios ritmos diários e respondem a diversos mecanismos regulatórios, incluindo sinalização endócrina, neurológica, térmica e detecção de nutrientes provenientes da alimentação (Chamorro et al., 2022).
A forma como nos alimentamos em resposta à luz afeta a regulação da glicose nos músculos, pâncreas, tecido adiposo e fígado. Mudanças no comportamento alimentar e exposição à luz alteram a produção hormonal pancreática, impactando a metabolização da glicose no fígado, tecidos adiposo e muscular, essenciais para a homeostase glicêmica (Pickel & Sung, 2020). Distúrbios no sistema intestinal devido à interrupção do ciclo circadiano e alterações no comportamento alimentar reduzem a produção de hormônios anorexígenos, afetando o controle da fome e saciedade (Perakakis, Farr & Mantzoros, 2021). A regulação hormonal e fatores ligados à alimentação e luz desempenham papel vital na complexa rede de eventos que influenciam o metabolismo glicêmico e o desenvolvimento de condições metabólicas adversas.
Consumir alimentos durante a noite estimula o pâncreas a produzir insulina. No entanto, os hormônios relacionados com os processos de reparo, regeneração e eliminação de resíduos são antagonistas aos responsáveis pela metabolização do nutriente. Portanto, padrões alimentares inadequados especialmente à noite resultam em complicações como resistência à insulina e, a longo prazo, no desenvolvimento de diabetes (Godos et al., 2021).
Ademais, a incorreta metabolização da leptina causada pelo excesso de inflamação crônica impede a emissão de sinais anorexígenos que indicam a saciedade, resultando em um padrão desregulado de alimentação (Perakakis, Farr & Mantzoros, 2021). Isso culmina na hipertrofia do tecido adiposo devido ao aumento de glicose e insulina circulante. A inflamação resultante amplifica a resistência tanto à insulina quanto à leptina, iniciando um ciclo vicioso no qual a glicose não é metabolizada eficientemente, gerando estresse oxidativo e agravando a inflamação que, por sua vez, desregula o ciclo circadiano do organismo (Pickel & Sung, 2020). Por este motivo, para regular eficazmente o ciclo circadiano, elementos como exposição à luz e hábitos alimentares desempenham papeis cruciais (Freitas, Mattos & Rodrigues, 2021).
Figura 2. Impacto do ciclo circadiano e disponibilidade de alimentos no metabolismo
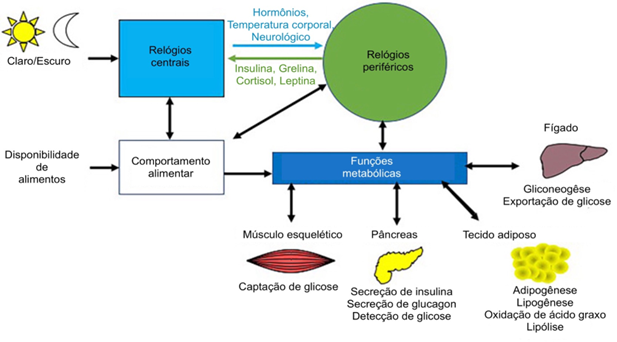
Fonte: Adaptado de Karl Chan et al. (2022)
- ALIMENTAÇÃO E SONO
4.1. Impacto da alimentação da alimentação no sono e na produção de melatonina
A melatonina é um hormônio indol derivado da serotonina, sendo produzido e secretado de maneira ritmada pela glândula pineal por meio da via triptofano-serotonina. A glândula pineal produz em média de 0,1 a 0,9 mg de melatonina por dia, no entanto, essa produção é suprimida na presença de luz, resultando na redução da melatonina circulante no plasma sanguíneo (Cincotta, 2023).
É importante ressaltar que hábitos alimentares, uso de medicamentos e estilo de vida podem influenciar na produção adequada de melatonina (Cincotta, 2023). Como exemplo, destacam-se os medicamentos β-bloqueadores, os quais diminuem a produção de melatonina ao inibir especificamente os receptores β1-adrenérgicos, os quais podem impactar diretamente a qualidade do sono do paciente (Alghamdi, 2018).
A distorção da produção da melatonina tem se tornado uma observação cada vez mais comum na sociedade contemporânea. Essa alteração é, em grande parte, atribuída à presença da luz artificial, que não apenas desregula o ritmo por si só, mas também introduz a possibilidade do desenvolvimento de comportamentos prejudiciais ao padrão natural de sono. Isso inclui a oportunidade de trabalhar até tarde da noite ou realizar refeições em horários anteriormente inviáveis (Cincotta, 2023).
Em ambientes mais escuros, ocorre a geração de estímulos nervosos direcionados para o Núcleo Supraquiasmático (NSQ). Posteriormente, um estímulo é transmitido através do gânglio cervical, conduzindo o impulso nervoso até a glândula pineal, onde se inicia a produção do hormônio. Quando o estímulo alcança a glândula pineal, a síntese de melatonina tem início a partir do triptofano, considerado seu principal precursor (Vetter et al., 2018).
A melatonina exerce sua influência diretamente no núcleo supraquiasmático, por meio de feedback, e também em outros núcleos cerebrais. Além disso, é conhecido que a melatonina desempenha um papel nos estágios de sono NREM e REM, agindo por meio de dois principais tipos de receptores seletivos, os MT1 e MT2 (Cerf, 2013).
No contexto alimentar, a fim de garantir a síntese adequada de melatonina, é essencial a presença do triptofano, um precursor vital, assim como das vitaminas B6 (piridoxina) e B9 (folato) (Alghamdi, 2018). Em mamíferos, a produção de melatonina é regulada pela noradrenalina, liberada pelas fibras nervosas simpáticas exclusivamente durante a noite. A norepinefrina eleva a concentração intracelular de AMPc por meio de receptores beta-adrenérgicos, ativando a proteína quinase A dependente de AMPc (PKA). Essa via é crucial para a regulação da penúltima enzima da biossíntese de melatonina. A figura 3 ilustra de forma esquemática o processo de produção de melatonina. A retina detecta a escuridão através do trato retino-hipotalâmico, que transmite a informação ao núcleo supraquiasmático. A partir daí, a sinalização segue para a medula cervical e, posteriormente, atinge a glândula pineal, onde a melatonina é sintetizada e liberada na corrente sanguínea.
Figura 3. Representação esquemática da produção de melatonina
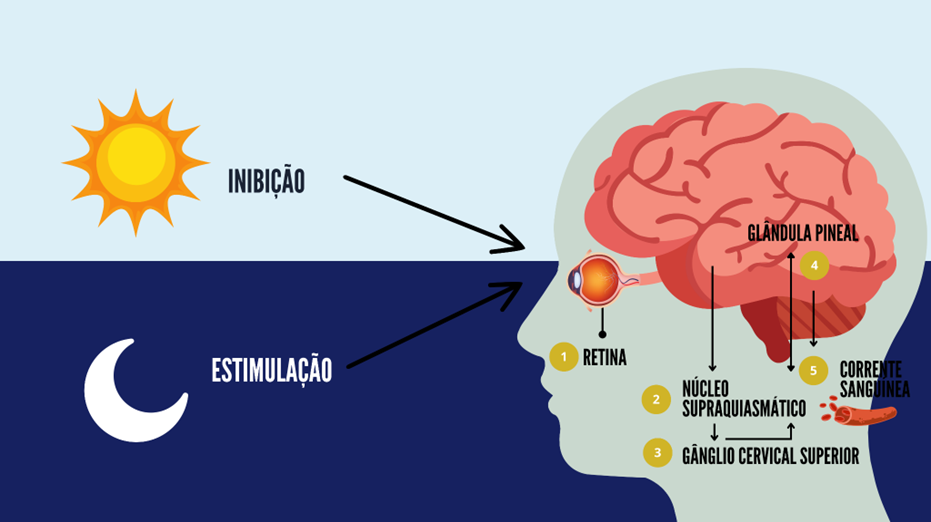
Fonte: Adaptado de Ostrin (2018).
A melatonina também é produzida de forma endógena por animais e plantas. Dessa forma, pode ser encontrada abundantemente em diversos alimentos de origem animal e vegetal. Ao mensurar a ingestão de melatonina nos alimentos, devem ser considerados os níveis de triptofano presentes, que irão converter-se em serotonina e, finalmente, em melatonina. Minich et al. (2022) ressalta que embora a melatonina seja encontrada em plantas, a quantidade contida é relativamente baixa.
Segundo Minich et al. (2022) ,leite e laticínios, ovos, peixes e carnes bovina, de cordeiro e porco possuem alguma quantidade de melatonina. Contudo, os alimentos de origem animal tendem a ser melhores fontes de triptofano em comparação aos alimentos de origem vegetal.No entanto, é necessário considerar a conversão final dos alimentos em quantidades expressivas de melatonina (Cincotta, 2023).
Do ponto de vista nutricional, evidencia-se que os níveis de triptofano contido nos alimentos são mais elevados comparando-se aos níveis de melatonina. Em uma revisão narrativa realizada por Castellucci et al. (2021) (Roh, Song & Kim, 2016), observou-se que o consumo de alimentos de origem animal (ovos, peixes e leite), frutas (morangos, cerejas, uvas e kiwi) e cereais (arroz, milho e aveia), devido ao seu alto teor de melatonina, está associado a uma maior duração do sono, menor tempo de latência e melhor qualidade do sono.
Outro estudo conduzido por Garrido M. et al. em 2013 comparou os efeitos da ingestão de um produto à base de cereja do Vale de Jerte com um placebo, avaliando a qualidade do sono e a concentração de citocinas pró-sonogênicas em voluntários jovens com idades entre 20 e 85 anos que não apresentavam diagnóstico de distúrbios do sono, não faziam uso de álcool ou medicamentos e foram considerados saudáveis após exames laboratoriais de rotina (Lopez et al., 2018). O estudo envolveu dois períodos de tratamento, cada um com duração de 5 dias, utilizando o suco de cereja ou o placebo. Esses períodos foram separados por uma semana de washout, durante a qual os participantes não consumiram o produto. Os resultados revelaram melhorias no tempo real de sono entre os participantes mais jovens. Nos adultos, ocorreu uma redução nos despertares noturnos e na atividade noturna. Notavelmente, apenas nos idosos houve um aumento significativo na eficiência do sono (Lopez et al., 2018).
Visando estratégias que garantam níveis adequados de melatonina, Minich et al. (2022) sugere que a adoção de padrões alimentares como o consumo adequado de proteínas, dispensar o uso de estimulantes e conter-se de comer antes de dormir podem ser relevantes. Além disso, adotar comportamentos relacionadas à exposição à luz, como evitar o uso de dispositivos eletrônicos antes de dormir, ações básicas como praticar a higiene do sono, regular a temperatura do ambiente, o deixando fresco, adaptar uma escuridão adequada, sem barulhos e dispor de cama e travesseiros que proporcionem conforto, seriam procedimentos recomendados para garantir um ambiente favorável para a promoção do sono. Aderir um estilo de vida saudável como praticar exercícios de relaxamento para reduzir o estresse também são estratégias que requerem consideração (Cincotta, 2023).
4.2. Recomendação nutricional para melhora do sono
Como citado anteriormente, o ciclo circadiano regula processos fisiológicos e comportamentais em um ciclo de aproximadamente 24 horas. No que diz respeito aos órgãos e ao sistema digestório, o corpo humano possui um ritmo circadiano que afeta a função de órgãos específicos, incluindo o trato gastrointestinal. O fígado, por exemplo, é um órgão chave na regulação metabólica e está envolvido na digestão e processamento de nutrientes. Ele segue um padrão circadiano, com variações em sua atividade ao longo do dia.
Geralmente, durante o período diurno (período de luz), há uma maior atividade metabólica e digestiva. Isso significa que a capacidade do sistema digestório para absorver nutrientes e processar alimentos está em seu pico durante o dia. O corpo está mais preparado para lidar com a ingestão de alimentos e assimilar nutrientes nesse momento. Por outro lado, à noite (período de escuridão), a atividade do sistema digestório diminui. Isso está em sintonia com o ciclo circadiano e reflete a preparação do corpo para o repouso noturno. No entanto, é importante notar que a digestão é um processo contínuo e pode ocorrer em algum grau ao longo de todo o dia e noite (Panda, 2019).
As oscilações circadianas são reguladas pelos genes conhecidos como CLOCK, BMAL1, PER e CRY, operando através de um sistema de feedback. Durante o dia, a ativação de BMAL1 e CLOCK resulta em uma expressão elevada, enquanto à noite ocorre o oposto, com o aumento da expressão de PER e CRY. Essa oscilação genética ao longo do dia forma um tipo de relógio interno, influenciando diversas funções no encéfalo e em nível sistêmico, sendo essencial para a regulação circadiana basal (Franzago et al., 2023).
Durante a noite, observa-se uma maior atividade dos genes CRY e PER, os quais inibem o CLOCK, resultando na diminuição da secreção de insulina. Além disso, o aumento do hormônio de crescimento (GH) durante a noite intensifica a lipólise, promovendo o uso de gordura como fonte de energia, uma vez que o organismo está em estado de jejum. Isso leva a uma maior concentração de glicose no sangue, que não é utilizada para síntese energética. Como consequência, as concentrações de insulina aumentam, podendo resultar em resistência à insulina momentânea. A perturbação do ciclo natural do sono contribui para a desregulação desse processo (Chan, Wong & Pearson, 2022).
Até o momento, embora as evidências disponíveis não permitam uma conclusão definitiva sobre a capacidade de influenciar a qualidade do sono por meio de intervenções nos hábitos alimentares ou componentes específicos da dieta, destaca-se a crononutrição como uma abordagem terapêutica. Desenvolvido pelo Dr. Alain Delabos em 1986, esse conceito refere-se a um regime nutricional que leva em consideração nosso relógio biológico, provocando alterações metabólicas ao longo do dia (Minich et al., 2022).
A crononutrição reconhece três dimensões do comportamento alimentar: tempo, frequência e regularidade. Um fracionamento irregular das refeições, realizado em horários desalinhados com o relógio biológico, tem sido associado a diversos problemas de saúde, incluindo aumento da adiposidade, diabetes tipo 2 e outros riscos cardiometabólicos.
Como estratégia para regular os distúrbios metabólicos, destaca-se o jejum fisiológico intermitente, que consiste em estabelecer um período de jejum das 19:00 até as 7:00 da manhã. Durante o intervalo das 6:00 às 18:00, o indivíduo estaria autorizado a realizar suas refeições. Essa abordagem fundamenta-se no ritmo circadiano do corpo humano, pressupondo que a ingestão de alimentos deve ocorrer durante os períodos em que o organismo está mais propenso à metabolização e ao melhor aproveitamento dos nutrientes (Ostrin, 2018).
Além de promover uma maior sensibilidade à insulina, essa estratégia de jejum também está associada ao aumento na produção de oxintomodulina. Esta substância é um precursor do glucagon, denominado pró-glucagon, sendo gerada e liberada principalmente pelas células endócrinas L intestinais, sobretudo durante o estado de jejum (Amaral & Cipolla, 2018).
Para justificar a relevância de adotar uma estratégia de jejum durante a noite, diversos fatores estão relacionados à ingestão calórica nesse período. Isso inclui o aumento na produção enzimática e liberação de catecolaminas, bem como a redução na produção enzimática e na síntese de melatonina. A ingestão noturna também pode estar associada a sintomas como queimação, refluxo e distensão abdominal. Em teoria, o corpo não estaria programado para digerir, absorver e metabolizar eficientemente esses nutrientes durante a noite, o que poderia resultar em desregulações na produção de diversos hormônios, catecolaminas e citocinas no organismo. Quando fazemos jejum, paramos a disrupção circadiana modulando inclusive possíveis polimorfismos nos genes relacionados ao sistema circadiano CLOCK, BMAL, PER e CRY (Ostrin, 2018; (Amaral & Cipolla, 2018).
Assim, a compreensão das interações entre nutrição, sono e ritmos circadianos ressalta a importância de estratégias integradas para promover um equilíbrio saudável. A adoção de práticas alimentares regulares, a evitação de refeições pesadas antes de dormir e a consideração do impacto do ciclo circadiano na rotina diária são elementos cruciais para melhorar a qualidade do sono e, por conseguinte, promover uma saúde mais abrangente (Minich et al., 2022; Castellucci et al., 2021).
4.3. Macronutriente: carboidrato, proteína e lipídio
Ao aprofundarmos os estudos nutricionais sobre a relação entre a alimentação e a qualidade do sono, surge a hipótese de que o consumo alimentar pode influenciar o ciclo circadiano. Portanto, a distribuição adequada dos macronutrientes desempenha um papel crucial na promoção do equilíbrio metabólico e na sincronização com o ritmo circadiano.
Um exemplo de estratégia para essa divisão é a “Zone Diet”, que preconiza a seguinte alocação diária dos macronutrientes: 40% de carboidratos (consumidos até às 15-16 horas), 30-35% de lipídios e 25-30% de proteínas. Essa abordagem específica na distribuição dos macronutrientes está diretamente relacionada à regulação da produção de cortisol, ao aumento da atividade imunológica, particularmente no que se refere aos monócitos, e à redução de marcadores inflamatórios. Dessa forma, a escolha cuidadosa de como distribuir esses nutrientes ao longo do dia pode impactar positivamente vários aspectos do metabolismo e da resposta imunológica, contribuindo para a manutenção da saúde e respeitando o ciclo circadiano (Garrido et al., 2013).
Portanto, o artigo de revisão conduzido por Pickel et al. (2020) investiga os mecanismos e os efeitos metabólicos relacionados ao desalinhamento circadiano no contexto da temporalidade das escolhas alimentares. A pesquisa revelou que mudanças nos ritmos do comportamento alimentar, seja devido a turnos de trabalho irregulares ou à presença constante de alimentos altamente palatáveis, desencadeiam impactos significativos nos relógios moleculares periféricos. Essas variações na programação dos hábitos alimentares podem resultar em níveis diversos de desalinhamento sistêmico nos processos metabólicos (Ostrin, 2018).
Outro estudo relevante foi conduzido por Vlahoyiannis et al. (2021), no qual avaliaram os efeitos da quantidade, qualidade e periodização do consumo de carboidratos no sono, por meio de uma revisão sistemática, meta-análise e meta-regressão, analisando 11 artigos que totalizaram 27 ensaios nutricionais. Os estudos foram realizados utilizando polissonografia, eletroencefalograma ou actigrafia, com o intuito de medir os parâmetros do sono (Fagiani et al., 2022).
Ao analisar os resultados da meta-análise, evidenciou-se que o consumo baixo de carboidrato (Low Carbohydrate Intake) aumentou consideravelmente a duração e a intensidade do estágio N3 do sono (fase de transição entre o sono leve e o profundo), em contrapartida o alto consumo de carboidratos prolongou a duração e a intensidade do estágio REM (Rapid Eye Movement) do sono. Ao que parece, a qualidade do consumo de carboidratos não afetou os estágios do sono (Fagiani et al., 2022).
Além disso, o artigo evidenciou que os efeitos da quantidade e qualidade de carboidratos na latência da fase inicial do sono, pode ocorrer devido às alterações e oscilações dos níveis de ingestão diária de carboidrato em termos de porcentagem da ingestão diária de energia, assim como as alterações na carga glicêmica possui, não só efeitos durante o sono, mas também nos casos em que ocorre o despertar após o início do sono (Fagiani et al., 2022).
O trabalho concluiu que a quantidade de carboidratos ingeridos afetou a arquitetura do sono, em destaque aos estágios N3 e REM do sono. Alterações na quantidade e qualidade de carboidratos resultaram em efeitos significativos no início do ciclo circadiano (Fagiani et al., 2022). O artigo de revisão publicado por Pickel L et al (2020) abordou sobre os mecanismos e os efeitos metabólicos do desalinhamento circadiano no contexto da escolha do momento da ingestão alimentar. Contudo, o artigo sugere que é plausível realizar mais estudos para avaliar o efeito das intervenções de longo prazo com carboidratos e seus efeitos no sono.
Uma pesquisa de Sejbuk et al. (2022) revelou que o consumo excessivo de alimentos ricos em ácidos graxos saturados está associado ao desenvolvimento de doenças não transmissíveis (DNT). Indivíduos com insônia tendem a consumir mais alimentos ricos em gordura do que aqueles sem distúrbios do sono. O estudo também destaca que o consumo de peixes gordurosos, como salmão, cavala e truta, está positivamente relacionado à qualidade do sono devido à presença de ácidos graxos ômega-3 e ômega-6, que influenciam a regulação da serotonina, contribuindo para a melhoria na regulação do sono. Em contraste, evidências indicam que o consumo de ácidos graxos saturados pode estar associado a um aumento dos despertares noturnos e à redução na duração das fases de sono de ondas lentas, essenciais para a recuperação do corpo (Moris, Aeschbach & Scheer, 2012).
Em relação à ingestão de proteínas, estas estão associadas ao aminoácido triptofano, um precursor da serotonina cerebral, conhecido por seu papel indutor do sono. A baixa ingestão de alimentos ricos em triptofano pode resultar em sua deficiência, levando a distúrbios do sono. No entanto, um excesso de proteína na dieta pode diminuir os níveis de triptofano no cérebro, uma vez que a proteína também contém outros aminoácidos neutros grandes (LNAAs) que competem pela sua absorção (Moris, Aeschbach & Scheer, 2012).
Um estudo com 4.435 trabalhadores fora do turno constatou que a ingestão de proteínas desempenha um papel crucial nos sintomas da insônia. Foi observado que uma baixa ingestão de proteínas (<16% da energia total) estava associada a dificuldades para adormecer e má qualidade do sono, enquanto uma alta ingestão de proteínas (≥19% da energia total) estava relacionada a problemas em manter o sono. O estudo destaca um efeito positivo da ingestão de proteínas durante a noite na síntese de proteínas musculares durante o sono. Consumir proteínas antes de dormir aumenta a disponibilidade de aminoácidos durante a noite, contribuindo para uma melhor eficiência na síntese de proteínas musculares. Com base nessas descobertas, o estudo sugere que a ingestão de proteínas deve representar entre 16 e 19% da eficiência energética total da dieta para otimizar a qualidade do sono (Moris, Aeschbach & Scheer, 2012).
Os alimentos que as pessoas consomem não só afetam a vigília durante o dia, mas também a qualidade do sono. O sono é influenciado não apenas pela eficiência energética da dieta, mas também pelo conteúdo de macronutrientes, como proteínas, carboidratos e gorduras (Moris, Aeschbach & Scheer, 2012).
4.4. Micronutrientes: vitaminas e minerais
Atualmente a nutrição se destaca como uma das principais ferramentas para aprimorar diversos aspectos do sono, especialmente sua qualidade, dado que evidências indicam que a composição da dieta desempenha um papel significativo na regulação desses aspectos. Como mencionado anteriormente, alimentos ricos em triptofano, um aminoácido essencial que atua como precursor tanto da serotonina quanto da melatonina, são reconhecidos por contribuir para a melhoria da qualidade do sono. Fontes primárias desse componente incluem banana, leite, chocolate, ovos, peixes, queijos, pães integrais e vegetais de folhas verdes.
Um estudo conduzido em por Huiberts et al. (2021), analisou 11 estudos observacionais relacionando a qualidade do sono e a suplementação de vitamina D, explorando como o status dessa vitamina pode desempenhar um papel significativo na regulação do sono e na produção de melatonina.
A revisão destaca a importância potencial da vitamina D na modulação da serotonina e melatonina, substâncias cruciais para os ritmos circadianos e a qualidade do sono. Com base na via serotoninérgica da vitamina D, o estudo propõe que níveis adequados de 25(OH)D, precursor da vitamina D, podem aumentar a expressão de enzimas necessárias para a produção de serotonina durante o dia, enquanto, à noite, a transformação dessa serotonina em melatonina é crucial para a indução do sono.
Além disso, ressalta que o horário da ingestão da suplementação de vitamina D pode desempenhar um papel crucial, indicando que a regulação do sono pode ser influenciada não apenas pela quantidade total, mas também pelo momento específico da ingestão de vitamina D. Essas descobertas sugerem uma conexão potencial entre a vitamina D, os ritmos circadianos, a síntese de melatonina e, por conseguinte, a melhoria da qualidade do sono. Portanto, otimizar o status de vitamina D pode ser considerado como um fator relevante para promover uma boa higiene do sono e manter um ciclo saudável de vigília-sono (Vlahoyiannis et al., 2021).
Em um estudo conduzido por Hudson et al. (2005), foi observado que a ingestão de 250 g de triptofano teve um impacto positivo no sono, reduzindo o tempo de latência, mitigando a intensidade da insônia e aprimorando sua qualidade. Por sua vez, Yu et al. (2017) constataram que o consumo de carnes, aves, ovos, frutas e lácteos estava associado à diminuição da dificuldade em iniciar ou manter o sono, assim como dos despertares noturnos. Esses alimentos, ao serem ricos em vitaminas do complexo B, vitamina D, ômega 3 e outros nutrientes, promovem a síntese aprimorada de triptofano, explicando seu efeito benéfico no sono (Sejbuk, Mirończuk-Chodakowska & Witkowska, 2022).
Também pensando na influência das vitaminas na melhora do sono, Santana (2022) buscou investigar o efeito dos alimentos ricos em triptofano, melatonina e vitaminas do complexo A, B, C, D e E associados à administração de melatonina na qualidade do sono de trabalhadores noturnos com excesso de peso. A qualidade do sono foi avaliada utilizando o Índice de Qualidade do Sono de Pittsburgh (PSQI), composto por 19 questões que abordam diversos aspectos, incluindo duração, latência, frequência e gravidade de problemas específicos relacionados ao sono. Antes do início do estudo, 37,04% das participantes apresentavam uma qualidade de sono ruim, e 18,52% relataram ter uma qualidade de sono muito ruim (Sejbuk, Mirończuk-Chodakowska & Witkowska, 2022).
No estudo, a interação entre melatonina, vitaminas D3 e B12 mostrou consistentemente benefícios na qualidade do sono, mesmo após ajustes para a dessincronização circadiana. A administração isolada de melatonina também melhorou o sono independentemente da dessincronização. Por outro lado, a interação inicialmente positiva entre melatonina e vitaminas E e B6 perdeu significância após ajustes. A vitamina E melhorou a qualidade do sono independentemente da dessincronização, enquanto a vitamina A teve benefícios apenas antes do ajuste, indicando interferência negativa da dessincronização. O consumo de vitamina B12 revelou melhorar o sono somente após o ajuste para a dessincronização circadiana, destacando a complexidade dessas interações (Sejbuk, Mirończuk-Chodakowska & Witkowska, 2022).
A fim de observar a influência da ingestão de magnésio (Mg) na qualidade e duração do sono, foi conduzido um estudo por Zhang et al em 2022, no qual os resultados revelaram uma associação positiva entre a ingestão total de Mg e a qualidade do sono. Indivíduos com maiores níveis de ingestão de Mg apresentaram maior probabilidade de desfrutar de uma qualidade de sono aprimorada. Além disso, a ingestão de Mg também se correlacionou significativamente com uma maior duração do sono, indicando que aqueles com maior ingestão tinham menos probabilidade de ter uma quantidade insuficiente de sono (menos de 7 horas). Essas associações foram mais pronunciadas em indivíduos sem transtorno depressivo. Em resumo, os resultados sugerem que uma ingestão elevada de magnésio pode estar positivamente associada a uma melhor qualidade e duração do sono (Zhang et al., 2022).
Dado que uma alimentação saudável é um importante determinante da própria saúde, é essencial considerar até que ponto a dieta pode atuar como um mediador dos seus efeitos sobre o sono. Embora estudos investigando a influência direta da alimentação na qualidade do sono ainda não tenham resultados definitivos, há evidências que apontam para a interação de fatores nutricionais nas vias metabólicas que regulam o sono.
- CONSIDERAÇÕES FINAIS
Até o momento, não há conclusões definitivas sobre a influência direta da dieta na qualidade do sono, mas existe uma correlação direta entre uma rotina adequada, dieta equilibrada em micro e macronutrientes, e a sincronização eficaz do ciclo circadiano. Não foram identificados alimentos específicos que melhorem diretamente o sono, mas os micronutrientes desempenham papeis distintos. Para garantir a produção adequada de melatonina no corpo, é crucial ter quantidades adequadas de vitaminas B6, B9 e magnésio.
No entanto, é importante notar que a suplementação isolada de vitamina B6 não demonstrou impacto significativo na qualidade do sono. Por outro lado, constatou-se que a suplementação de vitamina E e altas doses de magnésio podem melhorar a qualidade do sono. O alto consumo de carboidratos afeta a arquitetura do sono, com impactos na fase N3 e REM, enquanto o excesso de gordura saturada tem efeitos negativos, ao contrário dos ácidos graxos insaturados que mostram efeitos positivos. A ingestão de proteína à noite está associada a uma melhora na qualidade do sono, mas são necessários mais estudos para entender as interações de longo prazo dos macronutrientes.
Em resumo, a relação entre alimentação, ciclo circadiano e regulação hormonal desempenha papel crucial na saúde metabólica e equilíbrio do organismo. Escolhas alimentares inadequadas, especialmente à noite, podem contribuir para distúrbios metabólicos. Compreender e ajustar os hábitos alimentares em sincronia com os ritmos naturais do corpo é crucial para promover uma saúde metabólica otimizada e prevenir complicações a longo prazo. Além disso, a atenção à produção de melatonina é essencial, requerendo abordagens que otimizem seus níveis, incluindo práticas alimentares e comportamentais, como restrição de dispositivos eletrônicos e exposição à luz antes de dormir.
É importante salientar que a suplementação isolada de vitamina B6 não demonstrou impacto significativo na qualidade do sono, já a vitamina E e doses elevadas de magnésio podem apresentar melhorias. Adotar um padrão alimentar não saudável como o consumo em excesso de carboidratos e gorduras saturadas pode prejudicar e afetar a arquitetura do sono.
O que os estudos mostram, a fim de adequar a alimentação com ciclo circadiano e regular quadros inflamatórios como a resistência à insulina, é que precisamos adotar um padrão alimentar saudável e consumir durante o dia quantidades suficientes de triptofano provindo de proteínas como carnes, ovos e peixes, vitaminas B6, B9, magnésio e antioxidantes encontrados em alimentos como grãos e cereais integrais, frutas, verduras e legumes e ingerir fontes de ácidos graxos mono e poli-insaturados como sementes e salmão.
REFERÊNCIAS
ALGHAMDI, B. S. The neuroprotective role of melatonin in neurological disorders. Journal of Neuroscience Research, 2018. 96(7): 1136-1149. doi: 10.1002/jnr.24220. Epub 2018 Mar 1. PMID: 29498103; PMCID: PMC6001545. Disponível em: https://pubmed.ncbi.nlm.nih.gov/29498103/.
AMARAL, F. G. do; CIPOLLA-NETO, J. A brief review about melatonin, a pineal hormone. Archives of Endocrinology and Metabolism [Internet]. 2018 Aug 1;62(4):472–9. Disponível em: https://pubmed.ncbi.nlm.nih.gov/30304113/.
CASTELLUCCI, B.; BARREA, K.; LAUDUSIO, D. et al. Improving sleep disturbances in obesity by nutritional strategies: review of current evidence and practical guide. International Journal of Food Science & Nutrition, v. 72, n. 5, p. 579-591, 2021. doi: 10.1080/09637486.2020.1851659. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33238797/.
CERF, M. E. Beta cell dysfunction and insulin resistance. Frontiers in Endocrinology (Lausanne), 2013. 4: 37. doi: 10.3389/fendo.2013.00037. PMID: 23542897; PMCID: PMC3608918. Disponível em: https://pubmed.ncbi.nlm.nih.gov/23542897/.
CHAMORRO, R. et al. A single night of moderate at-home sleep restriction increases hunger and food intake in overweight young adults. Nutrition, 2023. 108: 111962. doi: 10.1016/j.nut.2022.111962. Epub 2022 Dec 31. PMID: 36669367; PMCID: PMC9991999. Disponível em: https://pubmed.ncbi.nlm.nih.gov/36669367/.
CHAN, K.; WONG, F. S.; PEARSON, J. A. Circadian rhythms and pancreas physiology: A review. Frontiers in Endocrinology (Lausanne), 2022. 10 ago; 13: 920261. doi: 10.3389/fendo.2022.920261. PMID: 36034454; PMCID: PMC9399605. Disponível em: https://pubmed.ncbi.nlm.nih.gov/36034454/.
CHAN, K.; WONG, F. S.; PEARSON, J. A. Circadian rhythms and pancreas physiology: A review. Front Endocrinol (Lausanne), 2022 Aug 10; 13:920261. doi: 10.3389/fendo.2022.920261. PMID: 36034454; PMCID: PMC9399605. Available: https://pubmed.ncbi.nlm.nih.gov/36034454/
CINCOTTA, A. H. Brain Dopamine–Clock Interactions Regulate Cardiometabolic Physiology: Mechanisms of the Observed Cardioprotective Effects of Circadian-Timed Bromocriptine-QR Therapy in Type 2 Diabetes Subjects. International Journal of Molecular Sciences, 2023. 24(17): 13255. Disponível em: https://pubmed.ncbi.nlm.nih.gov/37686060/.
COLTEN, H. R.; ALTEVOGT, B. M. (Eds.). Sleep disorders and sleep deprivation: an unmet public health problem [Internet]. Washington (DC): National Academies Press (US), 2006. Disponível em: https://pubmed.ncbi.nlm.nih.gov/20669438/.
CRAVEN, J. et al. Effects of acute sleep loss on physical performance: a systematic and meta-analytical review. Sports Medicine, v. 52, n. 11, p. 2669-2690, 2022. doi: 10.1007/s40279-022-01706-y. Epub 2022 Jun 16. PMID: 35708888; PMCID: PMC9584849. Disponível em: https://pubmed.ncbi.nlm.nih.gov/35708888/.
FABBRI, M. et al. Measuring subjective sleep quality: a review. International Journal of Environmental Research and Public Health, v. 18, n. 3, p. 1082, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33530453/.
FAGIANI, F.; DI MARINO, D.; ROMAGNOLI, A.; TRAVELLI, C.; VOLTAN, D.; MANNELLI, L. D. C. et al. Molecular regulations of circadian rhythm and implications for physiology and diseases.Signal Transduction and Targeted Therapy, v. 7, n. 1, 8 fev. 2022. Disponível em: https://pubmed.ncbi.nlm.nih.gov/35136018/.
FRANZAGO, M. et al. Chrono-Nutrition: Circadian Rhythm and Personalized Nutrition. International Journal of Molecular Sciences, 2023. 24(3): 2571. doi: 10.3390/ijms24032571. PMID: 36768893; PMCID: PMC9916946. Disponível em: https://pubmed.ncbi.nlm.nih.gov/36768893/.
FREITAS, NF; MATTOS, MS; RODRIGUES, MCC A influência da luz e da alimentação no ciclo circadiano. Revista Brasileira de Nutrição Clínica , v. 2, pág. 123-130, 2021.
GARRIDO, M.; GONZÁLEZ-GÓMEZ, D.; LOZANO, M.; BARRIGA, C.; PAREDES, S. D.; RODRÍGUEZ, A. B. A Jerte valley cherry product provides beneficial effects on sleep quality. Influence on aging. The Journal of Nutrition, Health & Aging [Internet]. 2013;17(6):553–60. Disponível em: https://pubmed.ncbi.nlm.nih.gov/23732552/.
GIOVANNI, C.; POLIANA OLIVEIRA SOARES; GONÇALVES, S. O Papel da crononutrição nas desordens do metabolismo: uma revisão de literatura. 2023 Jun 15;12(6):e15212642105-e15212642105. Disponível em: https://rsdjournal.org/index.php/rsd/article/view/42105/34121.
GODOS, J.; GROSSO, G.; CASTELLANO, S.; GALVANO, F.; CARACI, F.; FERRI, R. Association between diet and sleep quality: a systematic review. Sleep Medicine Reviews. 2021 Jan;57:101430. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33549913/.
GOHARI, A. et al. Sleep deficiency: epidemiology and effects. Clinics in Chest Medicine, v. 43, n. 2, p. 189-198, jun. 2022. DOI: 10.1016/j.ccm.2022.02.001. Disponível em: https://pubmed.ncbi.nlm.nih.gov/35659018/.
GUARAGNA, J. B. de A. Melatonina nos distúrbios do sono em pediatria: revisão sistemática. Lume UFRGS, 2023. Disponível em: https://lume.ufrgs.br/handle/10183/259791.
HUDSON, C.; HUDSON, S. P.; HECHT, T.; MACKENZIE, J. Protein source tryptophan versus pharmaceutical grade tryptophan as an efficacious treatment for chronic insomnia. Nutritional Neuroscience, 2005. abr; 8(2): 121-127. doi: 10.1080/10284150500069561. PMID: 16053244. Disponível em: https://pubmed.ncbi.nlm.nih.gov/16053244/.
HUIBERTS, L. M.; SMOLDERS, K. C. H. J. Effects of vitamin D on mood and sleep in the healthy population: interpretations from the serotonergic pathway. Sleep Medicine Reviews, 2021. fev; 55: 101379. doi: 10.1016/j.smrv.2020.101379. Epub 2020 set 9. PMID: 32987320. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32987320/.
LOPEZ-MINGUEZ, J. et al. Late dinner impairs glucose tolerance in MTNR1B risk allele carriers: A randomized, cross-over study. Clinical Nutrition, 2018. Aug; 37(4): 1133–40. Disponível em: https://pubmed.ncbi.nlm.nih.gov/28455106/.
MINICH, D. M. et al. Is Melatonin the “Next Vitamin D”?: A Review of Emerging Science, Clinical Uses, Safety, and Dietary Supplements. Nutrients, 2022. 22 set; 14(19): 3934. doi: 10.3390/nu14193934. PMID: 36235587; PMCID: PMC9571539. Disponível em: https://pubmed.ncbi.nlm.nih.gov/36235587/.
MORENO, C. R. C. et al. COVID-19 pandemic is associated with increased sleep disturbances and mental health symptoms but not help-seeking: a cross-sectional nation-wide study. Sleep Science, v. 15, n. 1, p. 1-7, 2022. doi: 10.5935/1984-0063.20220027. PMID: 35662970; PMCID: PMC9153976. Disponível em: https://pubmed.ncbi.nlm.nih.gov/35662970/.
MORRIS, C. J.; AESCHBACH, D.SCHEER, F. A. J. L. Circadian system, sleep and endocrinology. Molecular and Cellular Endocrinology. 2012 Feb;349(1):91–104. Disponível em: https://pubmed.ncbi.nlm.nih.gov/21939733/.
OH, J. et al. The role of co-neurotransmitters in sleep and wake regulation. Molecular Psychiatry, 2019. 24(9): 1284-1295. doi: 10.1038/s41380-018-0291-2. Epub 2018 Oct 30. PMID: 30377299; PMCID: PMC6491268. Disponível em: https://pubmed.ncbi.nlm.nih.gov/30377299/.
OSTRIN, L. A. Ocular and systemic melatonin and the influence of light exposure. Clinical and Experimental Optometry. 2018 Aug 3;102(2):99–108. Disponível em: https://pubmed.ncbi.nlm.nih.gov/30074278/.
PANDA, S. The arrival of circadian medicine. Nature Reviews Endocrinology, 2019. Jan 2; 15(2): 67–9. Disponível em: https://pubmed.ncbi.nlm.nih.gov/30602736/.
PERAKAKIS, N.; FARR, O.; MANTZOROS, C. S. Fasting oxyntomodulin, glicentin, and gastric inhibitory polypeptide levels are associated with activation of reward- and attention-related brain centres in response to visual food cues in adults with obesity: A cross-sectional functional MRI study. Diabetes Obes Metab. 2021 May;23(5):1202-1207. doi: 10.1111/dom.14315. Epub 2021 Jan 22. PMID: 33417264. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33417264/.
PICKEL, L.; SUNG, H. K. Feeding Rhythms and the Circadian Regulation of Metabolism. Front Nutr. 2020 Apr 17;7:39. doi: 10.3389/fnut.2020.00039. PMID: 32363197; PMCID: PMC7182033. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32363197/.
ROH, E.; SONG, D. K.; KIM, M. S. Emerging role of the brain in the homeostatic regulation of energy and glucose metabolism. Experimental & Molecular Medicine, 2016. Mar 11; 48(3): e216. Disponível em: https://pubmed.ncbi.nlm.nih.gov/26964832/.
SANTANA, P. T. de. Efeito dos alimentos ricos em triptofano, em melatonina e vitaminas do complexo A, B, C, D e E associados à administração de melatonina na qualidade do sono de trabalhadoras noturnas com excesso de peso. tedeunisantosbr [Internet], 2022. 19 dez. Disponível em: https://tede.unisantos.br/handle/tede/795.
SEJBUK, M.; MIROŃCZUK-CHODAKOWSKA, I.; WITKOWSKA, A. M. Sleep quality: a narrative review on nutrition, stimulants, and physical activity as important factors. Nutrients, 2022. 2 mai; 14(9): 1912. doi: 10.3390/nu14091912. PMID: 35565879; PMCID: PMC9103473. Disponível em: https://pubmed.ncbi.nlm.nih.gov/35565879/.
VASEY, C.; MCBRIDE, J.; PENTA, K. Circadian rhythm dysregulation and restoration: the role of melatonin. Nutrients, v. 13, n. 10, p. 3480, 2021. doi: 10.3390/nu13103480. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34684482/.
VETTER, C. et al. Night Shift Work, Genetic Risk, and Type 2 Diabetes in the UK Biobank. Diabetes Care, [Internet]. 2018. 41(4): 762–9. Disponível em: https://pubmed.ncbi.nlm.nih.gov/29440150/.
VLAHOYIANNIS, A. et al. A systematic review, meta-analysis and meta-regression on the effects of carbohydrates on sleep. Nutrients, 2021. 14 abr; 13(4): 1283. doi: 10.3390/nu13041283. PMID: 33919698; PMCID: PMC8069918. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33919698/.
YU, C. et al. Dietary patterns and insomnia symptoms in Chinese adults: The China Kadoorie Biobank. Nutrients, 2017. 4 mar; 9(3): 232. doi: 10.3390/nu9030232. PMID: 28335373; PMCID: PMC5372895. Disponível em: https://pubmed.ncbi.nlm.nih.gov/28335373/.
ZHANG, Y. et al. Association of magnesium intake with sleep duration and sleep quality: findings from the CARDIA study. Sleep, 2022. 45(4): zsab276. doi: 10.1093/sleep/zsab276. PMID: 34883514; PMCID: PMC8996025. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34883514/.
ZOU, H. et al. Chronotype, circadian rhythm, and psychiatric disorders: recent evidence and potential mechanisms. Frontiers in Neuroscience, 2022. p. 811771. DOI: 10.3389/fnins.2022.811771. Disponível em: https://pubmed.ncbi.nlm.nih.gov/36033630/.
1. Bacharel em Nutrição pela Faculdade Pernambucana de Saúde – FPS
2. Bacharel em Nutrição pelo Centro Universitário da Faculdades Metropolitanas Unidas – FMU
3. Acadêmica de Nutrição pelo Centro Universitário Fametro
4. Acadêmica em Nutrição pela Universidade Salvador- Unifacs
5. Bacharel em Nutrição pela Universidade Paulista – UNIP
6. Bacharel em Nutrição pelo Centro Universitário da Faculdades Metropolitanas Unidas – FMU
7. Bacharel em Nutrição pelo Centro Universitário da Faculdades Metropolitanas Unidas – FMU
8. Bacharel em Nutrição pelo Centro Universitário de Maceió – UNIMA/AFYA
9. Bacharel em Nutrição pela Universidade Federal de Lavras – UFLA
10. Bacharel em Nutrição pelo Centro Universitário da Faculdades Metropolitanas Unidas – FMU
11. Bacharel em Nutrição pela Universidade Veiga de Almeida – UVA
12. Bacharel em Nutrição pelo Centro Universitário da Faculdades Metropolitanas Unidas – FMU
13. Bacharel em Nutrição pelo Centro Universitário Maurício de Nassau – UNINASSAU
14. Bacharel em Nutrição pelo Centro Universitário Facex – UNIFACEX
15. Acadêmica de Nutrição pelo Centro de ensino unificado de Brasília – CEUB
16. Bacharel em Nutrição pelo Centro Universitário da Faculdades Metropolitanas Unidas – FMU
17. Bacharel em Nutrição pelo Centro Universitário Estácio São Luís
