EPIDEMIOLOGICAL PROFILE OF EXPOSURE TO HUMAN RABIES VIRUS IN PORTO NACIONAL – TO BETWEEN 2013 AND 2023
REGISTRO DOI: 10.69849/revistaft/th102411081742
Leonardo Castelo Branco Oliveira1
Caroline Rodrigues De Sousa Carvalho2
Rafaella Mota Vaz3
Isabella Afonso de Souza4
Camila Leinerh Nogueira Queiroz5
Leovegildo Caldas Carneiro6
Maria Fernanda Formehl7
Fernanda Chaveiro Da Silva8
Fabrícia Amaral Gonçalves Pontes9
Marcus Vinicius Moreira Barbosa10
Resumo
Introdução: A raiva é uma zoonose de alto impacto na saúde pública, causado pelo vírus Layssavirus da família Rhabdoviridae, cuja notificação é compulsória, com um curso clínico que evolui dos tecidos periféricos ao Sistema Nervoso Central. As principais manifestações incluem a salivação, hidrofobia e paralisia, apresentando como complicações as convulsões e até mesmo o óbito. Portanto, o manejo anti-rábico, através das profilaxias pré e pós-exposição pode ajudar na redução no perfil epidemiológico mais acometido. A notificação dos casos suspeitos pelos profissionais de saúde no Sistema de Informação de Agravos de Notificação (SINAN) é crucial para implementação de medidas de controle. Objetivos: Avaliar evolução histórica do perfil epidemiológico da exposição ao vírus da raiva humana no município de Porto Nacional no período de 2013 a 2023. Metodologia: trata-se de um estudo transversal e retrospectivo, relacionado ao perfil de exposição ao vírus da raiva, no período de 2013 a 2023, sendo realizado a coleta de dados pelo Sistema de Informação de Agravos de Notificação (SINAN). Além disso, foram realizadas pesquisas bibliográficas bases de dados PUBMED, Scielo, Google acadêmico para fundamentação teórica. Resultados Esperados: espera-se identificar as variáveis relacionadas com o perfil epidemiológico da raiva, a fim de avaliar se o manejo atual corresponde com as demandas atuais.
Palavras-chave: Raiva. Manejo anti-rábico. SINAN.
Abstract
Introduction: Rabies is a zoonosis with a high impact on public health, caused by the Layssavirus virus of the Rhabdoviridae family, whose notification is mandatory, with a clinical course that progresses from the peripheral tissues to the Central Nervous System. The main manifestations include salivation, hydrophobia and paralysis, with complications such as convulsions and even death. Therefore, anti-rabies management, through pre- and post-exposure prophylaxis, can help reduce the most affected epidemiological profile. Reporting of suspected cases by health professionals to the Notifiable Diseases Information System (SINAN) is crucial for implementing control measures. Objectives: To evaluate the historical evolution of the epidemiological profile of exposure to the human rabies virus in the municipality of Porto Nacional from 2013 to 2023. Methodology: This is a cross-sectional and retrospective study related to the profile of exposure to the rabies virus from 2013 to 2023, with data collection carried out by the Notifiable Diseases Information System (SINAN). In addition, bibliographic searches were carried out in the PUBMED, Scielo, and Google Scholar databases for theoretical basis. Expected Results: The aim is to identify the variables related to the epidemiological profile of rabies, in order to assess whether current management corresponds to current demands.
Keywords: Rabies. Anti-rabies management. SINAN.
1 INTRODUÇÃO
A raiva é uma doença infectocontagiosa aguda que pode causar encefalomielite, afetando o sistema nervoso central e resultando em múltiplas lesões inflamatórias no encéfalo e na medula espinhal (SCHNEIDER; BURGOA, 1994). Esta zoonose tem um alto impacto na saúde pública e é provocada pelo vírus do gênero Lyssavirus, da família Rhabdoviridae, que apresentou diversas evoluções ao longo dos anos (WILSON et al., 2020).
Os estudos sobre a raiva começaram com o cientista francês Louis Pasteur, que, em 1880, desenvolveu a vacina anti-rábica. Seu trabalho culminou na criação de um instituto em Paris em 1888, que difundiu o conhecimento sobre a doença para outros países, chegando ao Brasil em 1903, inicialmente entre a elite paulista, com o objetivo de controlar e ampliar a compreensão da raiva (VARGAS, 2018).
O vírus é transmitido aos humanos principalmente por mordeduras de animais ou pelo contato com mucosas em cortes ou lacerações. Após a introdução, o vírus se replica até atingir o sistema nervoso central, marcando o início da fase neurológica, que é precedida pela fase prodrômica (ABREU; CONCEIÇÃO, 2021). O quadro clínico da raiva é caracterizado por hipersalivação, hiperexcitabilidade, hidrofobia e outros sinais, como paralisia extensa, que em casos avançados podem evoluir para convulsões frequentes (LU; ZHU; WU, 2018). Os sinais clínicos surgem devido à replicação do vírus em tecidos periféricos, inicialmente imitando sintomas gripais como fraqueza, mal-estar e febre, antes de avançar para o sistema nervoso central (MACHADO; MIRABET; NOA, 2019).
Nesse contexto, o Sistema de Informação de Agravos de Notificação (SINAN) organiza informações epidemiológicas sobre agravos à saúde, incluindo os atendimentos anti-rábicos (LAGUARDIA et al., 2004). Os profissionais de saúde registram no SINAN os casos suspeitos de exposição ao vírus da raiva, cuja notificação é compulsória e imediata em todos os níveis (BRASIL, 2022). Além disso, é responsabilidade dos profissionais de saúde identificar os requisitos necessários para a indicação de profilaxia pré e pós-exposição ao vírus, conforme as Normas Técnicas de Profilaxia da Raiva Humana estabelecidas pelo Ministério da Saúde (MS). Isso visa evitar o desperdício de insumos imunobiológicos (EVANGELISTA et al., 2022).
Os objetivos deste trabalho visam, em primeiro lugar, avaliar a evolução histórica do perfil epidemiológico da exposição ao vírus da raiva humana no município de Porto Nacional, abrangendo o período de 2013 a 2023. Para isso, é fundamental comparar os perfis de exposição e os animais vetores envolvidos nos casos notificados, além de avaliar variáveis como sexo e idade que estão relacionadas a esses casos. Por fim, o estudo busca reconhecer quais regiões do município apresentam maior incidência de casos relatados, permitindo uma análise detalhada das particularidades locais na propagação da doença.
A importância do estudo se reflete na necessidade de compreensão dos perfis epidemiológicos, que é essencial para a identificação e tratamento precoces da raiva, uma doença de alta letalidade e complicações severas. Além de ser uma zoonose com implicações diretas à saúde pública, a raiva representa um desafio para os sistemas de saúde, cuja prevenção depende da clara compreensão dos padrões de transmissão e das populações mais vulneráveis.
O estudo do perfil epidemiológico do manejo anti-rábico é crucial não apenas para identificar os principais grupos populacionais e regiões mais afetadas, mas também para elucidar os locais e formas de transmissão mais comuns. Ao focar em Porto Nacional, Tocantins, este estudo poderá revelar fatores contextuais específicos que contribuem para a incidência da doença.
Adicionalmente, os dados obtidos poderão informar políticas públicas de saúde mais direcionadas, promovendo campanhas de conscientização e educação da população, além de otimizar o uso de recursos na prevenção e controle da raiva. Investigando as causas preveníveis da doença, a pesquisa não apenas contribuirá para a redução da incidência de casos, mas também para a proteção da saúde pública e o bem-estar da comunidade.
2 REFERENCIAL TEÓRICO
2.1 DEFINIÇÃO E EPIDEMIOLOGIA
A raiva humana é considerada um problema de saúde pública em cerca de 150 países desenvolvidos no mundo (CONCEIÇÃO; ABREU, 2021). Conforme Taylor et al. (2023), existe uma relação estatisticamente relevante entre o Índice de Pobreza Multidimensional (IPM) e a taxa de mortalidade por raiva em 98 países (valor p= 6,4e-15 IC 95%), sendo a probabilidade de receber a profilaxia pós-exposição mais difícil nos países com maior IPM.
No que concerne ao perfil epidemiológico da raiva no Brasil, segundo Estima et al. (2022), a maioria dos casos acontece entre indivíduos do sexo masculino (no período de 2014 a 2019), raça/cor da pele parda (46,5%) ou branca (45,7%), acometendo mais aqueles com nível de escolaridade fundamental II (34,5%), principalmente na área urbana (88,1%).
As regiões com maior notificação predominam no nordeste (55%) e norte do país (34%), nos Estados Maranhão, Pará, Ceará e Amazônia majoritariamente, ocorrendo um surto em comunidade ribeirinha do Município Tapira – AM, onde 3 irmãos foram infectados pelo vírus (VARGAS, 2018).
Segundo dados do Ministério da Saúde, o Brasil alcançou significativa redução nas taxas de mortalidade pelo vírus, em razão da diminuição na incidência de casos de Raiva humana (BRASIL, 2023).
2.2 CLASSIFICAÇÃO DO TIPO DE EXPOSIÇÃO
O risco de exposição ao patógeno é classificado de acordo com o animal envolvido e o tipo de contato sofrido. Ambas informações devem ser apuradas já no início do atendimento médico para se determinar o devido manejo para com o paciente (FRIAS et al., 2016).
Quanto ao animal agressor, devem ser diferenciados entre cães e gatos; mamíferos domésticos de interesse econômico (bovinos, caprinos, equídeos, suínos e ovinos) e mamíferos silvestres como morcegos por exemplo (ACHA; SZYFRES, 2003).
Dita-se como contato indireto quando as secreções do animal entram em contato com a pele íntegra do indivíduo. O acidente leve se refere aos ferimentos superficiais em regiões de tronco e membros (exceto pés e mãos) e a lambedura de lesões já estabelecidas (BRASIL, 2021).
Por fim, acidente grave se estabelece na presença de ferimento ou lambedura de mucosas, lesões profundas no segmento cefálico, mãos ou pés e ferimento causado por qualquer mamífero silvestre (BRASIL, 2021).
2.3 FISIOPATOLOGIA E MANIFESTAÇÕES CLÍNICAS
Este vírus tem a capacidade de escapar da resposta imune do hospedeiro podendo infectar a maioria das células humanas, não tendo sua relação totalmente compreendida. Sabe-se que a transmissão ocorre por saliva de animais contaminados sendo a profundidade da lesão importante para desenvolvimento da doença visto que o vírus infecta placas motoras musculares e nervos periféricos (GOMES et al., 2012).
Após sua entrada nos receptores na placa motora os vírus ficam contidos em vesículas e são transportados retrogradamente até os axônios. A produção das proteínas virais acontece na soma neural através de ribonucleoproteínas (RNPs), que são complexos formados pelo RNA viral, nucleoproteínas e fosfoproteínas, sendo liberadas no citoplasma a partir das vesículas levando a uma transcrição primária (FOOKS et al., 2017).
O acúmulo dessas proteínas virais leva a formação de corpos de inclusão citoplasmáticos com transcrição secundaria de RNA viral que são transportados para membranas pós-sinápticas, onde os novos vírions são montados e transmitidos transsinapticamente (GOMES, et al., 2012).
O agente etiológico se dissemina ao longo dos nervos periféricos, em direção ao sistema nervoso central onde se replica e atinge a medula espinhal e os gânglios da raiz dorsal. A replicação viral causa inflamação, que provoca dor, parestesia e/ou prurido (FOOKS et al., 2017).
A disseminação para sistema nervoso central parece ser facilitada pelo fluido cérebroespinhal (liquor), ocorrendo deslocamento viral para sítios anatômicos como: rins, pulmões, coração, glândula salivar, pâncreas, córtex adrenal, cavidade nasal, intestino, folículos capilares, retina e córnea. A destruição celular é mínima comparada a disfunção neural que resultam na anormalidade da neurotransmissão principalmente o ácido g-aminobutírico (SANTOS et al., 2021).
A capacidade de manter a viabilidade dos neurônios infectados e escapar do sistema imune apoiam a hipótese que as respostas imunes adaptativas estão prejudicadas nas infecções pelo RABV (FOOKS et al., 2017). A vacinação desempenha um importante mecanismo de defesa visto que neutraliza as partículas virais antes da interação com receptores celulares, visto que a proteína G é único antígeno viral indutor de anticorpos neutralizantes que confere imunidade impedindo a disseminação para SNC (SANTOS et al., 2021).
Os aspectos clínicos da raiva são similares na maioria das espécies, com período de incubação que varia bastante, de apenas 10 dias a vários meses ou anos, com uma média de 45 dias, apesar de 75% dos pacientes adoecerem nos primeiros 3 meses após a exposição. Esse período recebe influência de fatores como: carga viral inoculada, local e profundidade do ferimento, cujas lesões próximas a cabeça tendem a evoluir mais rápido (GOMES et al., 2012).
A fase prodrômica é relativamente curta com sinais e sintomas inespecíficos como mialgia, febre, cefaleia, indisposição e tosse produtiva. Com a evolução da doença começam a surgir hiperestesia (sensibilidade excessiva a qualquer estímulo) e parestesia (sensações subjetivas como frio, calor, coceira, dormência) perto do local da mordida, e/ou sensações anormais de ansiedade, irritabilidade, insônia e alucinações sensoriais com indicativos de encefalite como redução da acuidade visual, diplopia e até surdez (GOMES et al., 2012).
Já fase neural aguda é dividida em duas formas clássicas: a furiosa e a paralítica ambas apresentam encefalite. A forma furiosa apresenta clínica bem característica, diferente da forma paralítica que muitas vezes possui diagnóstico errôneo adiando o tratamento correto (LEDESMA, 2020).
Na forma furiosa geralmente ocorre após dez dias da fase prodrômica, o vírus alcança o sistema límbico onde ocorre biossíntese intensa, causando a liberação de fatores corticais que controlam o comportamento. O quadro neurológico apresenta convulsões, aumento da libido, ansiedade, agitação, arritmias cardíacas e respiratória, fotofobia, aerofobia, salivação excessiva e a hidrofobia como um sintoma patognomônico, não sendo encontrado em nenhuma outras afecções do SNC (SANTOS et al., 2021).
Os pacientes que sobrevivem à excitação aguda passam para fase paralítica que atinge o neurocórtex, caracterizada coma, parada respiratória seguida de morte. Sua apresentação clínica pode ser confundida com síndrome de Guillain-Barré por apresentar paralisia ascendente, fraqueza nos membros e envolvimento da bexiga, o que demonstra um comprometimento maior da medula espinhal (SANTOS et al., 2021).
2.4 DIAGNÓSTICO E PROFILAXIA
BRASIL, (2022). Levanta-se a suspeita clínica de de raiva humana mediante a identificação de sintomas prodrômicos, antecedentes epidemiológicos e vacinais, presença de hiperacusia, hiperosmia, fotofobia, aerofobia, hidrofobia e alterações do comportamento (WORLD HEALTH ORGANIZATION, 2018).
A confirmação laboratorial dos casos de raiva humana pode ser realizada através de imunofluorescência direta, prova biológica por isolamento do vírus, detecção de anticorpos específicos no soro ou líquido cefalorraquidiano (em pacientes sem antecedentes de vacinação antirrábica) e reação em cadeia da polimerase (PCR), com detecção e identificação de RNA do vírus da raiva (BRASIL, 2008).
Em 1973, foi instituido no Brasil o Programa Nacional da Profilaxia da Raiva que propõe medidas de prevenção contra a raiva humana por intermédio de ações de vigilância através de vacinação, captura e diagnóstico da infecção viral na população animal, além da educação em saúde e atendimento aos indivíduos em risco de exposição ao vírus (SCHNEIDER et al., 1996).
No contexto hodierno, nota-se que a redução dos casos de raiva humana decorre de um conjunto de ações preconizadas e destinadas tanto aos animais (cobertura vacinal), como à população geral, em função da notificação compulsória e do manejo adequado pelos profissionais da saúde, além de medidas educativas com ações de planejamento de programas de controle de zoonoses contra a afecção (SANTOS et al., 2021).
A profilaxia pré-exposição (PrEP) é uma medida de prevenção realizada através da administração da vacina antirrábica inativada. Está indicada para indivíduos que lidam diariamente com mamíferos domésticos, silvestres e/ou de produção (bovinos, caprinos, equídeos, suínos e ovinos), em razão do risco de exposição permanente ao vírus da raiva durante atividades ocupacionais (WORLD HEALTH ORGANIZATION, 2022).
A PrEP deve seguir o esquema vacinal de duas doses de vacina raiva inativada, sendo elas realizadas nos dias 0 e 7. O Ministério da Saúde preconiza a administração da dose por Via Intradérmica (ID) no antebraço ou na região de delimitação do músculo deltoide, obedecendo o volume de 0,2ml dividido em duas aplicações em sítios distintos (BRASIL, 2022).
Outrossim, há ainda a possibilidade de administração Via Intramuscular (IM) de todo o volume do frasco (0,5mL ou 1,0 mL dependendo do laboratório produtor) no músculo deltoide ou vasto lateral da coxa em crianças menores de 2 anos (BRASIL, 2022).
O esquema pós-exposição é composto por condutas que vão desde lavagem do local da agressão, com água e sabão, até a profilaxia pós-exposição (PEP) com vacina e soro antirrábico (FRIAS et al., 2016). A indicação da PEP deve ser identificada mediante anamnese detalhada do caso e vai depender da natureza da exposição e do animal agressor envolvido (BRASIL, 2014). Portanto, a conduta médica adequada deve seguir criteriosamente o esquema para profilaxia da raiva humana pós-exposição (BRASIL, 2022).
Na PEP, é recomenda a administração da vacina raiva inativada em quatro doses divididas entre os dias 0, 3, 7 e 14, seguindo as mesmas recomendações quanto a volume e local de aplicação da PrEP. Quando indicado, o soro deve ser administrado o mais rápido possível, no máximo em até 7 dias após a 1° dose de vacina. O uso do soro não é necessário quando o paciente recebeu esquema completo da PrEP previamente (BRASIL, 2022).
A dose indicada para a administração do Soro Antirrábico (SAR) heterólogo é de 40 UI/kg de peso do paciente, enquanto a Imunoglobulina Humana Antirrábica (IGHAR) é de 20 UI/kg de peso do paciente. Para ambas, deve-se infiltrar na(s) lesão(ões) a maior quantidade possível da dose. A quantidade restante, deve ser aplicada por via intramuscular na região acometida (BRASIL, 2022).
Quando identificados acidentes por contato indireto, mediante ao atendimento médico, independente do mamífero envolvido, deve o profissional proceder apenas com lavagem do local com água e sabão, o mesmo se aplica a acidentes leves por cão ou gato sadio e passível de observação (WORLD HEALTH ORGANIZATION, 2022).
Para acidentes leves provocados por cão ou gato não passível de observação por 10 dias ou com sinais sugestivos de raiva ou animais de produção, a indicação corresponde a lavagem adequada somada a administração da vacina raiva inativada (BRASIL, 2022).
Em casos de acidentes leves causados por animais silvestres ou acidentes graves por cão ou gato não passível de observação por 10 dias ou com sinais sugestivos de raiva ou animais de produção, o manejo consiste na lavagem local somado a PEP completa com vacina e soro (BRASIL, 2022).
2 METODOLOGIA
Trata-se de um estudo transversal e retrospectivo, focado no perfil epidemiológico do manejo anti-rábico, a partir de uma análise quantitativa dos dados do Sistema de Informação de Agravos de Notificação (SINAN) referente ao período de 2013 a 2023. As informações foram fornecidas pela Secretaria de Vigilância Sanitária e Epidemiológica do município de Porto Nacional, no Estado do Tocantins.
A população envolvida no estudo corresponde aos residentes do município que tiveram algum risco de exposição ao vírus da raiva e buscaram os serviços de atendimento para o manejo em questão. O estudo foi realizado com amostragem aleatória, enfatizando quais regiões apresentam maior incidência e o perfil epidemiológico mais acometido. Informações demográficas adicionais, como faixa etária e condição socioeconômica, foram coletadas para uma compreensão mais abrangente do perfil dos indivíduos atendidos.
Os critérios de inclusão foram: (1) residentes do município de Porto Nacional; (2) indivíduos que relataram risco de exposição ao vírus da raiva e buscaram atendimento; e (3) casos notificados no SINAN entre 2013 e 2023. Os critérios de exclusão incluíram: (1) indivíduos que não procuraram atendimento após a exposição; (2) dados incompletos nos registros do SINAN; e (3) casos fora do período de estudo.
Identificam-se como principais indicadores abordados neste estudo: sexo, tipo de exposição (arranhadura, mordedura, lambedura, outro), localização (mãos/pés, cabeça/pescoço ou tronco), tipo de ferimento (profundo, superficial, dilacerante), espécie do animal vetor (canino, felino, morcego, etc.), tratamento indicado (profilaxia pré e pós-exposição) e localidade do acidente no município. Os dados foram analisados de maneira descritiva, sendo apresentadas as frequências absolutas e relativas, além de serem dispostos no software Microsoft Word para a elaboração das tabelas, facilitando a análise quantitativa e a identificação das relações causais ou precipitantes desse agravo.
Dada a utilização de dados provenientes do SINAN e da vigilância em saúde, foi imprescindível submeter o estudo à apreciação do Comitê de Ética em Pesquisa (CEP), com o objetivo de assegurar a conformidade com os princípios éticos estabelecidos, bem como a proteção de informações sensíveis envolvidas.
Por fim, o estudo reconhece suas limitações, como possíveis vieses nos dados e a ausência de informações qualitativas sobre a percepção de risco entre os atendidos e profissionais de saúde. Sugestões para pesquisas futuras incluem investigações longitudinais e avalições do impacto de campanhas de vacinação e conscientização.
3 RESULTADOS E DISCUSSÕES
Os dados sobre o atendimento anti-rábico humano, no período entre 2013 e 2023 revelam um total de 5.411 casos, com uma predominância significativa entre homens (57%), que totalizaram 3.092 casos, em comparação com 2.319 casos em mulheres (43%). %). Lopes et al. (2024), encontrou resultados similares em seu estudo verificando uma grande discrepância entre o sexo masculino e o feminino.
Notou-se uma tendência geral de aumento nos casos, especialmente nos anos mais recentes, culminando em um pico em 2023, quando foram registrados 564 casos. Enquanto os números masculinos apresentam variações mais acentuadas ao longo do período, os casos femininos mostram uma trajetória de crescimento mais estável (Gráfico 1).
Gráfico 01 – Frequência por ano da notificação segundo sexo
Masc.: Sexo masculuno
Fem.: Sexo feminino
A análise dos dados de incidência de raiva humana entre 2013 e 2023 mostra que os cães são a principal fonte de transmissão, com um total de 4.554 casos, representando aproximadamente 84% do total de 5.411 casos. Os gatos também têm uma contribuição significativa, somando 657 casos (cerca de 12%). Apesar de representarem uma fração menor, os morcegos, com 39 casos, apresentam uma leve tendência de aumento nos registros, o que pode indicar uma crescente preocupação com a transmissão da raiva por essas espécies (Gráfico 02). Estudos recentes mostram que a transmissão do vírus da raiva pelos morcegos tem crescido nos últimos anos principalmente nos estados do Amazonas e Pará, dados estes comprovados no estudo de Andrade 2020, verificando -se também o desconhecimento populacional acerca dos riscos e das altas taxas de letalidade.
Outros grupos, como primatas e herbívoros domésticos, contribuíram com 7 e 33 casos, respectivamente, mostrando que, embora menos comuns, também são fontes potenciais de infecção. A categoria “outra”, que inclui diversas espécies, totaliza 121 casos, indicando uma diversidade de possíveis vetores.
Gráfico 02 – Frequência por ano da notificação segundo espécie animal agressora
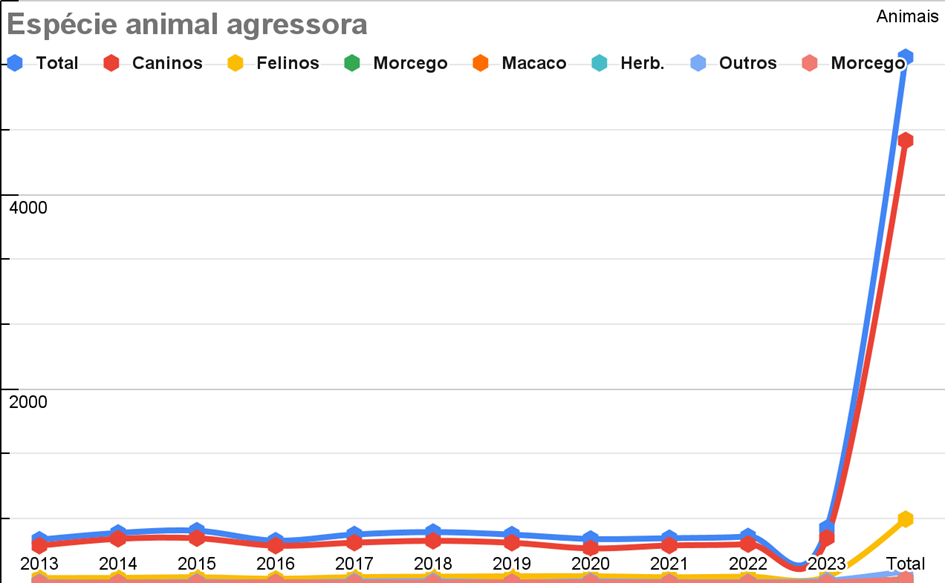
Herb.: herbívoros
Conforme os dados levantados, é passível a confirmação de que o tipo de exposição mais frequente envolvido nos ataques, ocorre através de mordeduras, uma vez que esteve presente em 5017 (90,26%) dos casos. Quanto ao localização da lesão, foi possível concluir , apresentandoa região corporal predominantemente acometida foram os membros inferiores, envolvidos em 2190 dos eventos (38,22%) (Tabela 2). Essas variáveis revelam a natureza comportamental do animal agressor, podendo ainda afirmar que resultados diferentes seriam esperados se felinos fossem o principal vetor, haja visto que estes, quando ameaçados, tendem a agredir utilizando suas garras e não os dentes.
Ainda quanto ao comportamento animal, outra observação levantada aponta para a possibilidade de um mesmo episódio envolver mais de um mecanismo de lesão, distribuídas em diferentes superfícies corporais, justificando assim os números excedentes de lesões em comparação ao número de acidentes notificados.
No tangente a profundidade das lesões, diferentes mecanismos traumáticos tendem a provocar ferimentos de graus variados de extensão, desde o acometimento superficial, correspondente a 51,40%, até lesões profundas e dilacerantes observados em 45,35% e 3,24% dos eventos respectivamente. Moriwaki et al. encontraram valores muito similares em um estudo realizado no Paraná em 2013, onde lesões superficiais foram observadas em 51,22% dos 37.996 casos registrados.
Além disso, observou-se que os bairros com maior proporção de casos são o Centro, o Jardim Brasília e a Vila Nova. O Centro, com 364 atendimentos, representa aproximadamente 6,73% do total, destacando-se como a área com a maior incidência. Em seguida, o Jardim Brasília, com 426 casos (7,87%), e a Vila Nova, com 409 atendimentos (7,56%), também demonstram uma significativa presença de casos, refletindo a necessidade de estratégias direcionadas de conscientização e prevenção nestas regiões. Dados estes que divergem com o estudo de Oliveira et al. (2021), onde a maior proporção de casos notificados foi prevalente na zona rural, porém com exposição e contato a animais domésticos semelhantes aos encontrados no presente estudo.
Tabela 01 – Frequência por ano da notificação segundo tipo de exposição
Tipo de exposição 2013 2014 2015 2016 2017 2018 2019 2020 2021 2022 2023 TOTAL 466 530 542 448 502 526 521 471 479 496 577 Arranhadura 49 54 47 47 45 39 45 39 46 41 47 Mordedura 413 472 494 399 455 484 470 431 427 448 524 Lambedura 4 4 1 2 2 3 6 1 6 7 6
Tabela 02 – Frequência por ano da notificação segundo localização da lesão
Local da lesão 2013 2014 2015 2016 2017 2018 2019 2020 2021 2022 2023 Toral 485 529 550 448 519 550 552 516 506 504 570 Tronco 22 18 17 16 24 20 15 24 28 18 19 Membros inf. 207 231 235 188 207 228 177 157 184 184 192 Membros sup. 84 88 82 72 69 78 92 88 72 79 73 Mãos/pés 139 159 174 130 178 170 209 193 176 183 230 Mucosa 8 6 6 4 4 10 17 8 6 12 11 Cabeça/ pescoço 25 27 36 38 37 44 42 46 40 28 45
Inf.: inferiores
Sup.: superiores
Tabela 03 – Frequência por ano da notificação segundo tratamento indicado
Tratamento indicado 2013 2014 2015 2016 2017 2018 2019 2020 2021 2022 2023 TOTAL 445 515 538 435 499 524 498 453 461 479 564 Ign/Branco 2 18 43 9 3 5 4 1 3 – 3 Pré exposição 2 1 1 1 11 2 4 1 2 1 8 Dispensa de tratamento 8 4 2 5 1 3 5 13 7 2 11 Observação do animal (se cão ou gato) 72 70 74 134 103 101 122 104 85 228 334 Observação + vacina 203 239 253 192 238 235 200 183 195 105 19 Vacina 71 91 114 61 96 101 88 99 138 113 146 Soro + vacina 87 92 51 33 47 77 75 52 31 30 43
Em relação ao tratamento indicado observou-se uma maior quantidade de animais observados ( 334 cães e gatos) por um período de 10 dias, sendo que a apenas 11 teve dispensa ao tratamento. Valores estes que vem aumentando com decorrer dos anos levando a preocupação quanto a efetividade de políticas públicas voltadas para aumento das estatísticas ,visto ser uma doença de alta letalidade.
Segundo o ministério da saúde a profilaxia pré-exposição compreende em administrar vacina raiva inativada em quatro doses divididas entre os dias 0, 3, 7 e 14, sendo o ano de 2015 com porcentagem de 12% da população vacinada seguida de observação animal.
Nos anos de 2013 a 2023 teve um total de 1118 indivíduos vacinados contra a raiva humana, sendo que a maior prevalência para administração de soro mais vacina foi no ano de 2014. Dados estes que merecem atenção visto que o tratamento é somente de suporte clínico com altas taxas de morbimortalidade, a capacitação da equipe multidisciplinar se torna o ponto chave para que a doença não evolua e não atinja as terminações nervosas assim como o investimento em educação continuada levando informação e sensibilização da população geral.
4 CONSIDERAÇÕES FINAIS
O presente estudo alcançou seus objetivos ao descrever o perfil epidemiológico da exposição ao vírus da raiva em Porto Nacional – TO, entre 2013 e 2023. As análises revelaram uma prevalência significativa entre homens, evidenciando possíveis fatores comportamentais que aumentam o risco de exposição nesse grupo. As campanhas de conscientização e as estratégias de manejo direcionadas a esses indivíduos podem ser fundamentais para a redução dos casos.
Foi possível identificar que a mordedura, especialmente em membros inferiores, é o principal tipo de exposição, responsável pela maioria dos casos registrados. Além disso verificou-se que os cães são os principais vetores da transmissão do vírus reforçando a necessidade de políticas públicas voltadas ao controle e à vacinação destes animais, em especial nos setores de maior predominância como o Jardim Brasília, ações estas que visa prevenir a disseminação da doença e a quebra da cadeia de transmissão.
Em relação ao tratamento, assim como abordado acima há necessidade de maior ampliação em estratégias de saúde pública voltada para medidas comportamentais através de ações que visem sensibilizar e conscientizar a população, reduzindo assim a morbimortalidade e evitando os gastos indevidos e a sobrecarga no serviço de saúde.
Foram identificadas limitações do estudo quanto aos casos nos quais houve a indicação de soro e vacina, não foi possível determinar com precisão se essa indicação correspondeu a quadros clínicos graves, ou seja, se foi realizada de acordo com os critérios estabelecidos de gravidade, como profundidade da lesão, localização em região de face, entre outros. Tal limitação decorre do fato de os dados analisados serem exclusivamente quantitativos, o que não necessariamente reflete o manejo clínico ideal.
Em suma, o estudo trouxe novas contribuições ao evidenciar a necessidade de intervenções mais focadas nas áreas de maior incidência e nos grupos populacionais mais vulneráveis, além de destacar a importância de um contínuo monitoramento epidemiológico para a prevenção da raiva humana.
4 REFERÊNCIAS BIBLIOGRÁFICAS
ACHA, P. N.; SZYFRES, B. (orgs.). Zoonoses and communicable diseases common to man and animals: Chlamydioses, rickettsioses and viroses. 3. ed. Washington, 2003.
ANDRADE, Etiene Monteiro. Raiva humana e transmissão do vírus rábico por morcegos: o que sabe e como se informa a população de um município sob risco na amazônia brasileira. Programa de Pós-Graduação em Estudos Antrópicos na Amazônia, Campus Universitário de Castanhal, Universidade Federal do Pará, Castanhal, 2020.
BRASIL. Raiva humana. Disponível em: <https://www.gov.br/saude/pt-br/assuntos/saude-de-a-a-z/r/raiva/raiva-humana>. Acesso em: 9 out. 2023
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Articulação Estratégica de Vigilância em Saúde. Guia de Vigilância em Saúde. 5. ed. Brasília, 2021.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Manual de diagnóstico laboratorial da raiva. Brasília, 2008.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Normas Técnicas de Profilaxia da Raiva Humana. ed.1. Brasília, 2014.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Imunização e Doenças Transmissíveis. Coordenação Geral de Vigilância de Zoonoses e Doenças de Transmissão Vetorial. Nota Técnica nº 08/2022 – CGZV/DEIDT/SVS/MS. Brasília, 2022.
BRASIL. Orientações para Profissionais de Saúde. Disponível em: <https://www.gov.br/saude/pt-br/assuntos/saude-de-a-a-z/r/raiva/orientacoes-para-profissionais-de-saude>. Acesso em: 12 set. 2023
BRASIL. Ministério da Saúde, Secretaria de Vigilância em Saúde, Departamento de Vigilância Epidemiológica. Brasilia, 2002. Disponível em: <https://bvsms.saude.gov.br/bvs/publicacoes/funasa/guia_vig_epi_vol_l.pdf>. Acesso em: 7 out. 2023.
BRASIL. Ministério da Saúde, Raiva humana. Sistema de informação de Agravos de Notificação, 2016. Disponível em: < http://www.portalsinan.saude.gov.br/raiva-humana>. Acesso em: 7 out. 2023.
CONCEIÇÃO, Paulo; ABREU, Cândida. Human rabies: optimization of prevention and paths towards the cure. Acta Medica Portuguesa, vol. 34 (11), p. 767-773, 2020.
ESTIMA, N. M. et al. Descrição das notificações de atendimento antirrábico humano para profilaxia pós-exposição no Brasil, 2014-2019. Epidemiol. serv. saúde, p. e2021627–e2021627, 2022.
EVANGELISTA A. F, SAMPAIO C. F, MORAIS N. B, Sousa G. S, Oliveira L. M. B. Profilaxia antirrábica humana: um diagnóstico de riscos e desperdícios em Fortaleza, Ceará, 2009 a 2019. Vet. e Zootec. 2022; v29: 001-011, 2022.
FOOKS, A. R. et al. Rabies. Nature Reviews Disease Primers, v. 3, p. 17091, 30 nov. 2017.
FRIAS, D. F. R., Nunes, J. O. R., & Carvalho, A. A. B. Proposta De Nova Metodologia De Apoio Para Indicação Racional De Profilaxia Antirrábica Humana Pós-exposição. Arquivos de Ciências Da Saúde Da UNIPAR, 20(1), 2016. Disponível em: https://doi.org/10.25110/arqsaude.v20i1.2016.4955
GOMES, Andréia Patrícia et al. Raiva Humana. Rev Bras Clin Med. São Paulo, 2012.
IBGE – INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA. População e área de unidade territorial de Porto Nacional. Rio de Janeiro: IBGE, 2022. Disponível em: <https://cidades.ibge.gov.br/brasil/to/porto-nacional/panorama> Acesso em 7 out. 2023.
LAGUARDIA, Josué et al. Sistema de informação de agravos de notificação em saúde (Sinan): desafios no desenvolvimento de um sistema de informação em saúde. Epidemiologia e Serviços de Saúde, v. 13, n. 3, p. 135-146, 2004.
LEDESMA, Leandro Augusto. Casos de Raiva Humana Notificados no Brasil entre 2001 e 2018: da epidemiologia ao protocolo terapêutico. Dissertação (Mestrado)-Instituto Oswaldo Cruz. Rio de Janeiro, 2020.
LOPES, J. et al. Análise Epidemiológica dos casos de raiva humana no Brasil entre o período de 2007 a 2021. Brazilian Journal of Implantology and Health Sciences Volume 6, Issue 7 (2024).
Lu XX, Zhu WY, Wu GZ. Rabies virus transmission via solid organs or tissue allotransplantation. Infect Dis Poverty. 2018 Aug 15;7(1):82. doi: 10.1186/s40249-018-0467-7. PMID: 30107857; PMCID: PMC6092857.
Moriwaki, Adriana Mayumi et al. Avaliação da profilaxia no primeiro atendimento pós-exposição ao vírus da raiva. Acta Paulista de Enfermagem [online]. 2013, v. 26, n. 5 [Acessado 18 Outubro 2024], pp. 428-435. Disponível em: <https://doi.org/10.1590/S0103-21002013000500005>. Epub 13 Jan 2014. ISSN 1982-0194. https://doi.org/10.1590/S0103-21002013000500005.
SANTOS, Norma Suely de Oliveira; ROMANOS, Maria Teresa Villela; WIGG, Marcia Dutra. Introdução a virulogia humana. 4.ed. Rio de Janeiro: Guanabara Koogan, 2021.
SCHNEIDER MC, BURGOA CS. Tratamiento contra la rabia humana: un poco de su história. Rev Saúde Pública, 1994.
SCHNEIDER, M. C. et al.. Controle da raiva no Brasil de 1980 a 1990. Revista de Saúde Pública, v. 30, n. 2, p. 196–203. 1996.
OLIVEIRA, I. et al. Perfil Epidemiológico da raiva no Brasil de 2010 a 2019. Revista de Patologia do Tocantins, Vol. 7 No. 4, fevereiro 2021.
TAYLOR, E. et al. Quantifying the interconnectedness between poverty, health access, and rabies mortality. PLOS Neglected Tropical Diseases, p. e0011204–e0011204, 2023.
TORRES MACHADO, Belkis Beatriz; DOMINGUEZ MIRABET Yaima y RODRIGUEZ NOA, José Antero. La rabia como enfermedad re-emergente. Medicentro Electrónica [online]. 2019, vol.23, n.3, pp.238-248. ISSN 1029-3043
VARGAS, Alexander. Perfil epidemiológico da Raiva Humana no Brasil, 2000-2017. Dissertação (Mestrado em Saúde Coletiva) —Universidade de Brasília, BRASÍLIA, 2018.
VARGAS, Alexander; ROMANO, Alessandro Pecego Martins; MERCHÁN-HAMANN, Edgar. Human rabies in Brazil: a descriptive study, 2000-2017. Epidemiologia e Serviços de Saúde, v. 28, 2019.
WILSON, Pamela J.; ROHDE, Rodney E.; OERTLI, Ernest H.; JR. Rodney E. Willoughby. Anger Clinical considerations and exposure assessment. Elsevier, 2020.
WORLD HEALTH ORGANIZATION. Expert consultation on rabies: third report. Genebra: WHO, 2018. Disponível em: https://apps.who.int/iris/ handle/10665/272364.
WORLD HEALTH ORGANIZATION. Guide to introducing human rabies vaccine into national immunization programmes. Geneva: WHO, 2022.
1 Discente do Curso Superior do curso de Medicina do ITPAC – Porto Nacional. e-mail: leooliveiraleo2@hotmail.com
2 Discente do Curso Superior do curso de Medicina do ITPAC – Porto Nacional. e-mail: caroline_enf@hotmail.com
3 Discente do Curso Superior do curso de Medicina do ITPAC – Porto Nacional. e-mail: rafaella_vzz@outlook.com
4 Discente do Curso Superior do curso de Medicina do ITPAC – Porto Nacional. e-mail: bella_afonso@hotmail.com
5 Discente do Curso Superior do curso de Medicina do ITPAC – Porto Nacional. e-mail: camila_leinerh@hotmail.com
6 Discente do Curso Superior do curso de Medicina do UFT – Palmas. e-mail: leocaldascarneiro@gmail.com
7 Discente do Curso Superior do curso de Medicina do ITPAC – Porto Nacional. e-mail: mariafformehl@gmail.com
8 Discente do Curso Superior do curso de Medicina do ITPAC – Palmas. e-mail: fernandachaveiro89@hotmail.com
9 Docente do Curso Superior do curso de Medicina do ITPAC – Porto Nacional. e-mail: fabricias2@live.com
10 Docente do Curso Superior do curso de Medicina do ITPAC – Porto Nacional. e-mail: marcus.barbosa@itpacporto.edu.br
