EVALUATION OF IN VITRO BLOOD GLUCOSE STABILITY: A COMPARATIVE STUDY ON THE INFLUENCE OF TIME ON DOSING UNDER THE ABSENCE OF REFRIGERATION
REGISTRO DOI: 10.69849/revistaft/ra10202410281458
Maria Rita Noronha Cunha¹
Pâmela Rodrigues de Castro Caixeta¹
Orientadora: Esp. Cristina Barbosa Soares Fernandes²
Coorientadora: Dra. Lorena Gomes Caixeta³
RESUMO
A dosagem de glicemia em jejum é um dos exames laboratoriais bioquímicos mais solicitados, por isso a determinação deve ser exata e precisa. A escolha do tubo é fundamental para reduzir possíveis erros pré-analíticos e diagnósticos não coerentes com a real situação do paciente. Esse estudo teve como objetivo realizar uma comparação entre 3 tubos contendo: ativador de coágulo/gel separador, fluoreto de sódio/EDTA e citrato de sódio submetidos em condições de armazenamento com ausência de refrigeração ao longo de 24 horas após a coleta. A coleta foi realizada por punção venosa a vácuo em 20 indivíduos, coletada em 3 tipos de tubos e centrifugados 30 minutos após a coleta. A glicemia foi dosada nos tempos de 2 horas, 6 horas, 12 horas e 24 horas. Foi constatado que as amostras coletadas nos tubos de fluoreto de sódio/EDTA e ativador de coágulo/gel separador, não apresentaram estatisticamente nenhuma alteração significativa quando comparados entre si. Já o tubo contendo citrato de sódio teve um decaimento considerável, chegando a 77,4% em relação a dosagem feita nas primeiras 2 horas. Estudos utilizando tubos contendo citrato e uma combinação de outros anticoagulantes, como oxalato, EDTA, para qualificar o potencial de inibição da glicólise nas diferentes variações, podem contribuir na escolha do tubo apropriado para a realização da coleta da glicemia em jejum. Este estudo confirma que a escolha do tubo de coleta influencia diretamente na precisão do resultado, sendo necessário a criação de protocolos com normas para assegurar a excelência analítica. Entretanto, observa-se que o tubo com ativador de coágulo/gel é o mais indicado para dosagem de glicose considerando custo/efetividade.
Palavras-chave: glicólise, diabetes mellitus, pré-analíticos, glicose, tubo de coleta.
ABSTRACT
Fasting blood glucose levels are one of the most frequently requested biochemical laboratory tests, and therefore the determination must be accurate and precise. The choice of tube is essential to reduce possible pre-analytical errors and diagnoses that are not consistent with the patient’s actual situation. This study aimed to compare three tubes containing clot activator/separator gel, sodium fluoride/EDTA and sodium citrate, stored in non-refrigerated storage conditions for 24 hours after collection. The collection was performed by vacuum venipuncture in 20 individuals, collected in three types of tubes and centrifuged 30 minutes after collection. Blood glucose levels were measured at 2 hours, 6 hours, 12 hours and 24 hours. It was found that the samples collected in the sodium fluoride/EDTA and clot activator/separator gel tubes did not present any statistically significant changes when compared to each other. The tube containing sodium citrate had a considerable decay, reaching 77.4% in relation to the measurement performed in the first 2 hours. Studies using tubes containing citrate and a combination of other anticoagulants, such as oxalate and EDTA, to qualify the potential for inhibition of glycolysis in different variations, can contribute to the choice of the appropriate tube for collecting fasting blood glucose. This study confirms that the choice of collection tube directly influences the accuracy of the result, requiring the creation of protocols with standards to ensure analytical excellence. However, it is observed that the tube with clot activator/gel is the most suitable for glucose measurement considering cost/effectiveness.
Keywords: glycolysis, diabetes mellitus, pre-analytics, glucose, collection tube.
1 INTRODUÇÃO
As biomoléculas mais encontradas na natureza, são os carboidratos, os quais são a principal fonte de energia para a maioria dos organismos. Entre esses compostos, o monossacarídeo encontrado em abundância é a glicose, quase todas as células são capazes de atender às necessidades energéticas apenas utilizando-a. Para algumas células do corpo esse açúcar é indispensável, por ser o único substrato que permite sintetizar adenosina trifosfato (ATP) a partir dele. Para gerar essa energia, ocorre o processo de glicólise, que se resume em cada molécula de glicose convertida a duas de piruvato, que produzem quatro ATP (Marzzoco;Torres, 2015; Silva, Freitas Filho; Freitas, 2018).
A glicose apresenta fórmula C6H12O6, sendo uma molécula polar e sua forma de transporte pelo corpo ocorre através da membrana, por meio de difusão facilitada, a favor do gradiente de concentração. O fígado é um local de armazenamento da glicose, assim como o músculo, onde é contida sob o formato de glicogênio. Os níveis de glicemia dependem do fígado, onde vai exercer efeitos da homeostasia da glicose, por meio da glicogênese e da glicogenólise (Saraiva 2012; Silva, Freitas Filho; Freitas, 2018).
A dosagem de glicemia em jejum é um dos exames laboratoriais bioquímicos mais solicitados, utilizado para auxiliar no diagnóstico e monitoramento de Diabetes Mellitus (DM), um conjunto de doenças metabólicas ligado à hiperglicemia crônica. (Rodacki; Teles; Gabbay; 2021).
A Organização Mundial de saúde afirma que:
A diabetes é uma doença metabólica crônica caracterizada por níveis elevados de glicose no sangue (ou açúcar no sangue), que conduz, ao longo do tempo, a danos graves no coração, vasos sanguíneos, olhos, rins e nervos. O mais comum é o diabetes tipo 2, geralmente em adultos, que ocorre quando o corpo se torna resistente à insulina ou não produz insulina suficiente. Nas últimas três décadas, a prevalência da diabetes tipo 2 aumentou dramaticamente em países de todos os níveis de rendimento. O diabetes tipo 1, antes conhecido como diabetes juvenil ou diabetes dependente de insulina, é uma condição crônica na qual o pâncreas produz pouca ou nenhuma insulina por si só (Organização Mundial da Saúde, 2021, p. 01).
O diagnóstico de DM é baseado em dosagens de glicose, através de testes como glicemia em jejum e teste oral de tolerância à glicose (TOTG) onde a dosagem é realizada após sobrecarga de 75g de glicose oral. Além destes, utiliza-se a dosagem da glico-hemoglobina, que não apresenta índice de exatidão necessário para confirmar o diagnóstico quando usado isoladamente, mas é imprescindível para controle glicêmico de portadores de DM. (Gross; Silveiro; Camargo; Reichelt; Azevedo, 2002).
Para confirmação do diagnóstico de DM é recomendado utilizar os três exames citados anteriormente (TOTG, glicose, jejum e Hba1c) tendo como referência para hiperglicemia relevante, glicose em jejum maior ou igual a 126 mg/dL. Além disso, valores entre 100 a 125 mg/dL estão ligados à pré-DM e os valores inferiores a 100 mg/dL são considerados normais. Portanto, é de extrema relevância que a dosagem de glicose seja precisa e exata, realizada em condições adequadas e confiáveis, contribuindo assim para melhor direcionamento médico ao tratamento efetivo (Schunck, 2022).
Um exame laboratorial é utilizado como uma forma de confirmação diagnóstica, por esse motivo a exatidão da dosagem de uma amostra é de suma importância. O processamento dessa amostra biológica é categoricamente dividido em três fases: pré-analítica, analítica e pós-analítica. A fase pré-analítica, é onde consiste a maioria dos equívocos, com taxas variando entre 46% a 68,2% dos erros laboratoriais. Sendo assim, a qualidade dos exames está ligada principalmente à fase inicial, categorizando a coleta de materiais biológicos, um grande fator. Para auxiliar na diminuição de falhas analíticas, a adoção de programas de garantia de qualidade (PGQ) é uma opção que resulta na maior precisão dos exames (Costa, Moreli, 2012; Morais, Galvão, Lima, Moreira, Varela, 2023).
Dentre os principais fatores pré-analíticos que influenciam a chegar no resultado preciso da amostra, possuem maior relevância, o tempo de processamento, a temperatura de conservação e mais intimamente relacionado a dosagem glicêmica, a glicólise “in vitro”, processo pelo qual há diminuição da concentração de glicose ocasionada pelo metabolismo de células sanguíneas, que a utilizam como fonte de energia (Lippi; Nybo; Cadamuro; Guimarães; Van Dongen-Lases; Simundic, 2018).
O decaimento dos níveis de concentração de glicose pode ser evitado através da coleta realizada em tubos contendo inibidor glicolítico, a centrifugação em até 30 minutos após a coleta, e refrigeração. Porém, não é a realidade de muitos laboratórios, tornando-se inviável em alguns casos em que o local de coleta é distante da área analítica, onde, mesmo com o surgimento de protocolos, exibem condutas negligenciadas (Lippi; Nybo; Cadamuro; Guimarães; Van Dongen-Lases; Simundic, 2018).
Um dos inibidores glicolíticos disponíveis para auxiliar na desaceleração da degradação da glicose “in vitro” é o fluoreto de sódio. Esse anticoagulante atua inibindo a enzima enolase e a concentração de glicose se mantém estável por até 48 horas entre 2 a 8 ºC. Sem a ação de um anti-glicolítico a concentração diminui cerca de 10 mg/dL por hora a 25 ºC (LABTEST, 2011). Pelo fato desse agente atuar apenas nas etapas finais da via glicolítica, as enzimas das etapas iniciais se mantêm ativas, logo a fosforilação dos carboidratos ocorre normalmente até que se esgote o ATP gerando o gasto da glicose. Por esse motivo, o fluoreto de sódio não tem uma ação imediata levando de 2 a 3 horas após a coleta venosa (Schunck, 2022).
A acidificação do sangue é uma alternativa que pode ser utilizada para sanar a problemática da inibição lenta quando utilizado o fluoreto de sódio. Tal acidificação é realizada com o citrato de sódio, que age inibindo instantaneamente as enzimas hexoquinase e fosfofrutoquinase que exercem sua função no início da via glicolítica, impossibilitando a cascata de coagulação seguir o fluxo (Schunck, 2022). A concentração do anticoagulante deve ser em razão de 1 parte de citrato para 9 partes da amostra, o sangue se mantém com pH entre 5,3 a 5,9 (Labtest, 2011).
Diferentemente dos tubos com anticoagulante, o tubo com ativador de coágulo/gel separador atua estimulando a liberação de fatores da coagulação pelas plaquetas, e como consequência disso, desencadeia a cascata de coagulação separando o soro da amostra. Além disso, há o gel separador, que após a centrifugação, gera uma barreira física entre o soro e os componentes celulares, impedindo o contato entre eles. Dessa forma, facilita o armazenamento, transporte, diminui a manipulação, e mantém a estabilidade da amostra (Schunck, 2022).
Segundo Sousa et al. (2021), os resultados dos testes laboratoriais são responsáveis por cerca de 60 a 70% das decisões médicas. Os laboratórios de análises clínicas tem inúmeras funções, mas imprescindivelmente e principalmente a promoção da saúde para os pacientes, mas também o propósito prestar apoio ao diagnóstico.
Este estudo objetivou-se em avaliar a estabilidade da glicose em relação ao tempo de processamento das amostras, comparando a inibição do tubo de fluoreto, a acidificação do tubo de citrato de sódio e o uso do tubo com ativador de coágulo e gel separador, em condições de rotina laboratorial, comparando as dosagens em até 24 horas com conservação em temperatura ambiente. Contando que é uma questão pouco avaliada nos laboratórios de análises clínicas, onde podem chegar a conclusão do melhor método, maior eficácia, confiabilidade e precisão nos resultados.
2 MATERIAL E MÉTODOS
A pesquisa tem por finalidade realizar uma comparação entre 3 tubos contendo:
ativador de coágulo/gel separador, fluoreto de sódio/EDTA e citrato de sódio 3,6% submetidos em condições de armazenamento com ausência de refrigeração, sendo matidos em temperatura ambiente e dosadas periodicamente obtendo uma análise do decaimento da concentração de glicose in vitro.
Esta pesquisa encontra-se aprovada pelo Comitê de Ética em Pesquisa (CEP) da Faculdade de Patos de Minas através do parecer 7.049.645.
2.1 Amostragem:
Para a realização do estudo, foram recrutados, de forma voluntária, 20 pessoas de ambos os sexos, maiores de 18 anos, sendo residentes em Patos de Minas. Como critério de inclusão ao estudo, foram aceitos aqueles indivíduos que aceitaram participar do projeto e não apresentavam diagnóstico prévio de DM, sendo, desse modo, o diagnóstico prévio de DM considerado critério de exclusão. As amostras de sangue foram coletadas por punção venosa e não houve necessidade de jejum.
2.2 Coleta e preparo das amostras:
Para a coleta de sangue venoso, foi escolhido o sistema de coleta a vácuo, para proporcionar maior rapidez e agilidade entre as coletas. Foram coletados 7,5 mL de sangue, de cada voluntário, distribuídos em 3 tubos diferentes (um com ativador de coágulo/gel separador, um com fluoreto de sódio/EDTA e um outro com citrato de sódio 3,6%) obedecendo as recomendações da CLSI (CLSI H3-A6, Procedures for the Collection of Diagnostic Blood Specimens by Venipunctures, 6th Ed) sobre a sequência de tubos durante a coleta, evitando a contaminação cruzada por aditivos.
Os tubos foram previamente identificados com o código do participante e a característica do respectivo tubo, sendo elas, 001 GEL, 001 FLUORETO, 001 CITRATO, 001 AC, 001 AF, continuando a sequência até a etiqueta 020 AF.
Todos os tubos foram encaminhados para centrifugação a 3.000 rpm por 10 minutos, após 30 minutos da realização da coleta. Posteriormente, foram retiradas as alíquotas de 500 µL de plasma dos tubos que possuem anticoagulante e aliquotados em tubo de transporte Sarstedt®. Foram realizadas as dosagens de glicose no tubo contendo soro, e nos plasmas aliquotados (identificados com AC e AF) e tubos contendo plasma não aliquotado (citrato e fluoreto), tornando-se assim, 5 dosagens de cada indivíduo, nos prazos de 2 horas, 6 horas, 12 horas e 24 horas após a coleta. Durante o período entre as alíquotas, as amostras não foram refrigeradas, sendo mantidas em temperatura ambiente entre 23°C e 26°C.
2.3 Avaliação bioquímica
A dosagem da glicose foi realizada pelo método enzimático colorimétrico, utilizando as enzimas Glicose Oxidase e Peroxidase disponíveis no Kit “Glicose PAP Liquiform” da Elitech®, de acordo com a metodologia do fabricante e protocolo de automação do equipamento ENVOY 500+ (Elitech®).
O processamento das amostras e a determinação da concentração de glicose nos diferentes tubos e nos diferentes tempos foi realizada no laboratório de Análises Clínicas da Faculdade Patos de Minas, na seção de bioquímica e hormônios.
2.4 Análises estatísticas
Os valores médios de glicemia para cada tubo de coleta foram expressos em média(m) e desvio padrão (dp). Para a comparação entre os valores de glicemia na segunda hora após a coleta entres os diferentes tubos analisados, utilizamos a análise de variância de uma via (anova) seguido do pós-teste de Bonferroni (p < 0,05). Para análise do efeito do tempo sobre a estabilidade da glicose nas amostras, empregamos a regressão linear de efeitos mistos. A glicemia foi considerada a variável dependente, o tempo e a variável independente de efeito fixo e a variabilidade intra indivíduo como componente aleatório do modelo. Foram considerados significativos os valores de p inferiores a 0,05.
3 RESULTADOS E DISCUSSÕES
3.1 Análise dos dados e estatística
Os valores médios de glicemia obtidos para cada um dos 3 tubos primários, nas primeiras 2 horas após a coleta foram descritos na figura 1. Percebe-se que as amostras coletadas em tubo de citrato de sódio como anticoagulante apresentaram a média (84,7 ± 12,5 mg/dL), estatisticamente inferior (p<0,05) quando comparada com a média de dosagem do tubo com ativador de coágulo/gel separador (94,2 ± 15,2 mg/dL) e ao tubo contendo fluoreto de sódio (95,9 ± 16,0 mg/dL).
Figura 1 – Valores médios de glicemia 2 horas após a coleta.
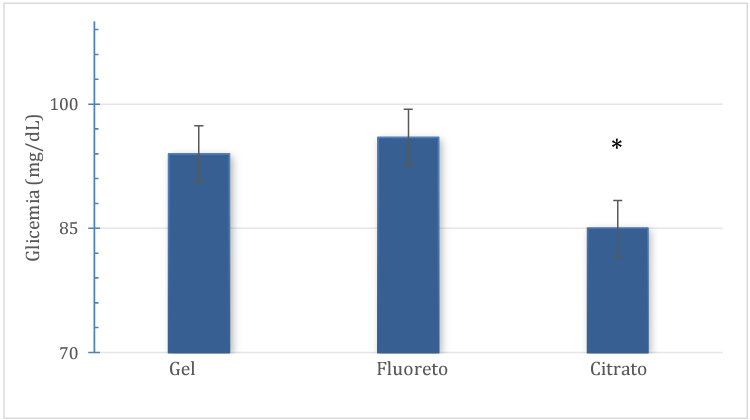
* Estatisticamente significativo em relação aos demais grupos. (p<0,05)
Somado a isso, a figura 2 mostra a degradação da glicose em função do tempo nos diferentes tubos, indicando em um modelo multivariado de efeitos mistos que a utilização dos tubos contendo ativador de coágulo/ gel separador e fluoreto não afetam os valores de glicemia quando comparados. O mesmo não ocorre quando comparado às dosagens obtidas no citrato, onde obteve diferença significativa em relação a dosagem realizada no fluoreto (p<0,05).
As dosagens realizadas em fluoreto não apresentaram estatisticamente nenhuma diferença comparando os valores entre 2 e 6 horas (p=0,255) e entre 2 e 24 horas (p=0,719). Com isso, é notável e comprovado estatisticamente nesse estudo que a glicose não foi degradada mesmo sendo mantida em temperatura ambiente e sem realizar alíquota. Na bula do fabricante a estabilidade da glicose é mantida em até dois dias em temperatura ambiente, o que é concordante com este estudo. Igualmente, as dosagens realizadas em ativador de coágulo/gel separador também não mostraram nenhuma diferença estatística, entre 2 e 24 horas (p=0,292). Seguindo o mesmo padrão das amostras citadas anteriormente, a alíquota de fluoreto se manteve sem nenhuma alteração significativa após a comparação entre 2 e 24 horas (p=0,198), sendo todas essas análises simplificadas ainda na figura 2.
Figura 2 – Modelo linear de efeitos mistos mostrando a variação dos valores de glicemia (mg/dL) com o tempo nos diferentes tubos de coleta.
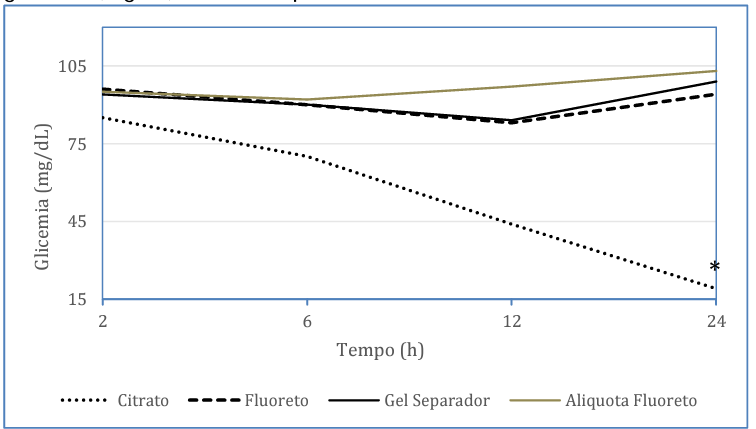
* Decaimento significativo da concentração de glicose em relação ao tempo (p < 0,05).
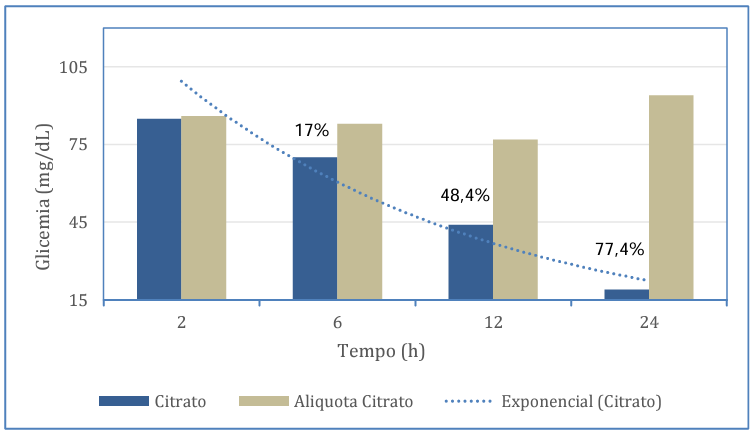
Entretanto, as amostras de citrato de sódio tiveram uma significativa diferença nas dosagens após a comparação entre 2 e 6 horas (p=0,003) e entre 2 e 24 horas (p< 0,0001), totalizando uma redução de até 77,4% em relação a dosagem feita após as primeiras 2 horas, isso é demonstrado na figura 4, que representa toda a degradação da glicose correlacionada com o tempo comparando o tubo de citrato e o plasma citratado aliquotado. Diferentemente da amostra sem alíquotar, a alíquota de plasma citratado, não apresentou nenhuma diferença estatística entre 2 e 6 horas (p=0,548) e entre 2 e 24 horas (p=0,078), como foi representado nas figuras 3 e 4. Observa-se que essas dosagens em citrato, quando há separação entre o plasma e as hemácias, não há perda da concentração de glicose, apesar de ser considerada uma dosagem estatisticamente inferior e não adequada quando comparado a outros métodos, conserva-se estável.
Figura 3 – Modelo linear de efeitos mistos mostrando a variação dos valores de glicemia (mg/dL) do tubo contendo citrato de sódio e tubo que realizou alíquota do plasma citratado.
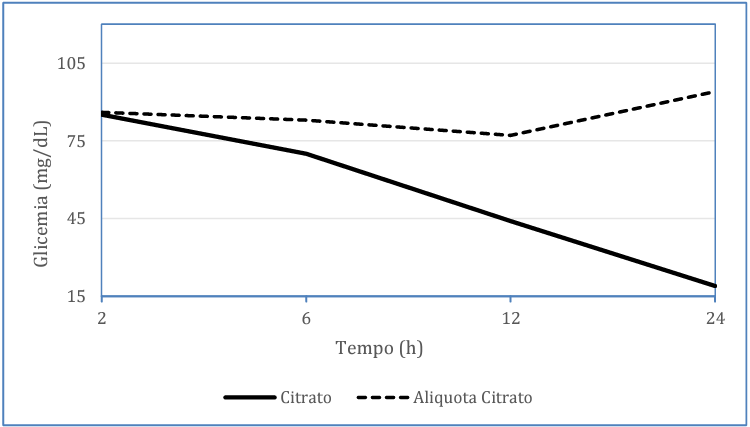
Figura 4 – Valores médios de glicemia (mg/dL) do tubo contendo citrato de sódio e tubo que realizou alíquota do plasma citratado.
3.2 Discussão
A glicemia é um dos principais exames requeridos nos laboratórios e a problemática sobre qual é o melhor tubo para se realizar essa coleta ainda abrange inúmeras discussões, no entanto ainda não se chegou a um consenso (Bruns; Knowler, 2009; Fobker, 2014; Barreto,2021).
Bruns e knowler (2009) afirmam que a degradação da glicose ocorre, utilizando termos absolutos, a uma diminuição de 12 mg/dL em uma concentração de 100 mg/dL após 2h com a amostra mantida em temperatura ambiente. Nesse estudo certificou-se que a estabilidade da glicose foi mantida até 24 horas após a coleta, utilizando os tubos de fluoreto de sódio e ativador de coágulo/gel separador.
Amostras de sangue coletadas em tubos de fluoreto de sódio e tubos com ativador de coágulo/gel separador são capazes de preservar a estabilidade da glicose “in vitro”, dessa forma reduzindo erros pré-analíticos. Nessa fase, existem fatores cruciais para a boa execução e resultados de uma amostra como, a ordem dos tubos e o tubo correto para a coleta daquele exame prescrito. Em uma coleta de glicose a parte mais importante é reduzir o tempo de degradação da glicose, para isso é possível utilizar tubos contendo anticoagulantes ou com ativador de coágulo, contendo gel separador ou não (Schunck, 2022).
Os dados obtidos nessa pesquisa mostraram que os tubos contendo fluoreto e ativador de coágulo/gel separador conseguem manter a linearidade da dosagem por 24 horas, mesmo estando em temperatura ambiente.
Resultados coerentes foram observados por Schunck (2022), que relatou a semelhança estatística em relação a variação da glicemia nas amostras coletadas nos tubos contendo ativador de coágulo/gel separador e fluoreto de sódio, sob a condição de que sejam centrifugadas dentro de 30 minutos após a coleta.
Barreto (2021) e Wiedmer (2016) também apresentam resultados concordantes em relação ao tubo com ativador de coágulo/ gel separador. Barreto relatou que o soro é capaz de manter a concentração de glicemia semelhante às amostras coletadas em tubo com fluoreto de sódio, considerado padrão ouro para esse teste. Somado a isso, Wiedmer descreveu que o soro quando centrifugado no máximo em 1 hora após a coleta, pode ser utilizado para substituir a amostra de plasma fluoretado.
Sendo assim, o uso do tubo contendo ativador de coágulo/gel separador traz inúmeras vantagens econômicas para o laboratório. Pode ser usado para a realização de outros exames, diminuindo a demanda de utilização de outros tubos, bem como o volume sanguíneo a ser coletado, além de possuir um custo benefício melhor do que o tubo com fluoreto de sódio. Desse modo, o tubo de fluoreto que normalmente é a primeira opção para a dosagem da glicose sanguínea, pode ser usado apenas quando não for possível certificar o processamento da amostra em tempo hábil. (Wiedmer,2016; Barreto,2021).
As diretrizes mais recentes da Associação Americana de Diabetes (ADA) propõem algumas sugestões para minimizar a glicólise, como resfriar o tubo da amostra logo após a coleta e imediata centrifugação da amostra. Caso não for possível, recomendam a utilização de um tubo contendo inibidor de glicólise (Gupta, 2016; Barreto, 2021).
Nesse estudo observou-se que as amostras coletadas em citrato não foram capazes de manter a exatidão da dosagem da glicose, como ocorreu nos tubos de fluoreto de sódio. Contrastando esse dado, Gambino et al (2008), constatou que a acidificação do sangue quando comparada ao fluoreto de sódio de forma isolada torna-se superior quando o assunto é inibição da glicólise, mantendo uma variação de 1,2% em 24 horas enquanto o fluoreto obteve variação de 7%.
Lippi et al (2018) afirma que a utilização do tubo contendo citrato pode fornecer grande apoio ao diagnóstico de DM sendo um passo relevante para garantir medições plasmáticas de glicose precisas e confiáveis. O que não condiz com esse estudo, uma vez que a dosagem inferior em comparação com outros métodos foi estatisticamente significativa.
Fobker (2014), concluiu que tubos que contém fluoreto de sódio, quando associado ao citrato, deixam a determinação da glicemia mais confiável, garantindo uma estabilidade maior e produzindo menos hemólise quando comparado com tubos contendo somente fluoreto de sódio/EDTA. Sendo assim, constata-se com essa pesquisa que o uso do citrato de sódio de forma isolada não é suficiente para obter dosagens exatas.
Assim sendo, poderia ser de muita valia um estudo utilizando tubos contendo citrato e uma combinação de outros anticoagulantes, como fluoreto de sódio, oxalato, EDTA, para qualificar o potencial de inibição da glicólise nas diferentes variações. Dessa forma, contribuindo na escolha do tubo apropriado para a realização da coleta da glicemia em jejum.
4 CONSIDERAÇÕES FINAIS
É de extrema importância que os laboratórios assegurem aos pacientes resultados confiáveis, pois através desses exames é possível chegar a diagnósticos finais. Buscando manter um padrão de qualidade das amostras coletadas, por meio da criação de protocolos com normas que iram assegurar a excelência das análises.
Os resultados do presente estudo comprovam a influência do tubo de coleta no valor da dosagem da glicemia, podendo levar a números incompatíveis com a real concentração do paciente, gerando interferência no diagnóstico final. Ademais a isso, é possível observar que o tubo contendo ativador de coágulo/gel separador é o mais indicado para a determinação da glicemia, caso seja possível realizar a centrifugação em até 1 hora. Caso contrário, o tubo de fluoreto de sódio seria a opção mais assertiva para a realização desse exame.
REFERÊNCIAS
1- SILVA, Rayane; FREITAS FILHO, João de; FREITAS, Juliano Rufino. DGlicose, uma Biomolécula Fascinante: História, Propriedades, Produção e Aplicação. Revista Virtual de Química, [S.L], v. 10, n. 4, p. 1-17, 15 out. 2018. Disponível em: http://rvq.sbq.org.br/. Acesso em: 10 maio 2024.
2 -MARZZOCO, Anita; TORRES, Bayardo Baptista. Bioquímica Básica. 4. ed. Rio de Janeiro: Editora Guanabara Koogan Ltda., 2015. 420 p.
3-PICHETH, Geraldo; JAWORSKI, Maria Cristina Guerra; PINTO, Adriana Pinho; KIKUTI, Marcelo Yukio; SCARTEZINI, Marileia; ALCANTARA, Vania M; PICHETH, Cyntia Fadel. Plasma Fluoretado comparado ao soro na determinação da glicose sanguinea. Revista Brasileira de Analises Clinicas, Curitiba, v. 33, n. 4, p. 167-170, 10 ago. 2001.
4-SARAIVA, Heloisa Helena Fonseca de Lima. Influência do tempo na dosagem de glicemia no plasma fluoreto e plasma edta. 2012. 16 f. TCC (Graduação) – Curso de Biomedicina, Uniceub, Brasília, 2012.
5-OMS. Organização Mundial de Saúde. Diabetes, [S.l]. Disponível em: https://www.who.int/health-topics/diabetes/diabetes#tab=tab 1. Acesso em: 10 de maio de 2024
6-SACHER, Ronald A.; MCPHERSON, Richard A.; CAMPOS, Joseph M.. Interpretação clínica dos exames laboratoriais. 11. ed. Barueri: Manole Ltda, 2022. 1090 p.
7-BARRETO, Matheus Eduardo do Nascimento. Influência do tipo de tubo de coleta de sangue na determinação da glicose: possível interferência da glicólise “in vitro”. 2021. 27 f. TCC (Graduação) – Curso de Farmácia, Centro de Ciências da Saúde da Universidade Federal do Rio Grande do Norte, Natal – Rn, 2021. Disponível em: https://repositorio.ufrn.br/handle/123456789/33410. Acesso em: 05 set. 2024.
8-SCHUNCK, Bruna Silvino. Estabilidade da glicose “in vitro”: comparação entre 4 tipos de tubo de coleta de sangue. 2022. 27 f. TCC (Graduação) – Curso de Farmacia, Centro de Ciências da Saúde da Universidade Federal do Rio Grande do Norte, Natal – Rn, 2022.
9-WIEDMER, Gabriel Pierin. Preservação da glicose sanguínea in vitro: efeito do fluoreto/edta comparado ao gel separador com ativador de coagulação. 2016. 16 f. Monografia (Especialização) – Curso de Farmácia, Universidade Federal do Paraná Programa de Pós-Graduação em Ciências Farmacêuticas, Curitiba, 2016.
10-PIMENTA, DALILA ZULATO; JÚNIOR, GERSON ZANUSSO. Principais fatores pré-analíticos interferentes nos exames laboratoriais do coagulograma completo. Uningá Review, v. 25, n. 3, 2016.
11-MORAIS, Raylla Pires Gonçalves et al. INTERFERÊNCIAS DOS FATORES PRÉANALÍTICOS NOS EXAMES LABORATORIAIS. Revista Interdisciplinar em Saúde. Disponível em, v. 10, n. 23587490, p. v10, 2023.
12-COSTA, Vivaldo Gomes da; MORELI, Marcos Lázaro. Principais parâmetros biológicos avaliados em erros na fase pré-analítica de laboratórios clínicos: revisão sistemática. Jornal Brasileiro de Patologia e Medicina Laboratorial, [S.L.], v. 48, n. 3, p. 163-168, jun. 2012. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/s167624442012000300003.
13-LABTEST. Amostras e critérios de uso: Anticoagulantes, 2011. Disponível em:https://labtest.com.br/wpcontent/uploads/2016/09/Bioquimica___Criterios_para_ Uso_Amostras.100211.pdf. Acesso em 01 de ago 2024
14-SOUSA, Rener Leite et al. Erros pré-analíticos em laboratórios de análises clínicas: uma revisão / pre-analytical erros in clinical analysis laboratories. Brazilian Journal Of Health Review, [S.L.], v. 4, n. 2, p. 9132-9142, 22 abr. 2021. South Florida Publishing LLC. http://dx.doi.org/10.34119/bjhrv4n2-416.
15-LIPPI, Giuseppe; NYBO, Mads; CADAMURO, Janne; GUIMARAES, Joao T.; VAN DONGEN-LASES, Edmée; SIMUNDIC, Ana-Maria. Blood Glucose Determination: effect of tube additives. Advances In Clinical Chemistry, [S.L.], p. 101-123, 2018. Elsevier. http://dx.doi.org/10.1016/bs.acc.2017.12.003.
16-BRUNS, David e; KNOWLER, William C. Stabilization of Glucose in Blood Samples: why it matters. Clinical Chemistry, [S.L.], v. 55, n. 5, p. 850-852, 1 maio 2009. Oxford University Press (OUP). http://dx.doi.org/10.1373/clinchem.2009.126037.
17- DIMESKI, Goce; YOW, Kong S.; BROWN, Nigel N. What is the most suitable blood collection tube for glucose estimation?. Annals of clinical biochemistry, v. 52, n. 2, p. 270-275, 2015.
18- GUPTA, Shalini et al. A study to compare the plasma glucose levels obtained in sodium fluoride and citrate buffer tubes at a tertiary care hospital in Punjab. International Journal of Applied and Basic Medical Research, v. 6, n. 1, p. 50, 2016.
19- .GAMBINO, Raymond. Sodium fluoride: an ineffective inhibitor of glycolysis. Annals of clinical biochemistry, v. 50, n. 1, p. 3-5, 2013.
20- ORTH, M.; HAWRAN, H.; ULLOOR, J.; BACHHAWAT, K.; LENNARTZ, L.Effects of different tube types on patient classification using current diabetes decision limits. Practical Laboratory Medicine, v. 17, p. e00134, 2019.
21-FOBKER, Manfred. Stability of glucose in plasma with different anticoagulants. Clinical Chemistry and Laboratory Medicine (CCLM), v. 52, n. 7, p. 1057- 1060, 2014.
22- LIPPI, G.; NYBO, M.; CADAMURO, J.; GUIMARAES, J. T.; VAN DONGENLASES, E.; SIMUNDIC, A. M.; Blood Glucose Determination: Effectof Tube Additives.Advances in Clinical Chemistry, v. 84, p. 101–123, 2018.
¹ Graduanda do curso de Biomedicina pela Faculdade de Patos de Minas. e-mail: mariaaritanoronhac@gmail.com ¹ Graduanda do curso de Biomedicina pela Faculdade de Patos de Minas. e-mail: pamelarccaixeta@gmail.com
² Docente do curso de Biomedicina na FPM com graduação em Biomedicina pela FPM, pósgraduação em citologia oncótica, e-mail: cristina.soares@faculdadepatosdeminas.edu.br
³ Coordenadora do curso de Biomedicina na FPM com graduação em Biomedicina pela FUMEC, doutorado em análises clínicas e toxicológicas pela UFMG, e-mail: caixetaloreta@gmail.com
