REGISTRO DOI: 10.69849/revistaft/th102410231527
Victória Raquel Eggers
Orientadora: Prof. Dr. Maurício Orlando Wilmsen
resumo
A anemia hemolítica imunomediada (AHIM) é uma condição grave em cães, caracterizada pela destruição acelerada de eritrócitos mediada pelo sistema imunológico. A micoplasmose, causada por parasitas do gênero Mycoplasma spp., é uma das infecções que pode desencadear AHIM em cães. Os principais sinais clínicos incluem icterícia, anemia, letargia. Os achados laboratoriais incluem esferocitose, corpúsculos de Howell-Jolly, anemia regenerativa, autoaglutinação, hemoglobinemia, hemoglobinúria, hiperbilirrubinemia e bilirrubinúria, além do aumento sérico de FA e ALT. O diagnóstico é confirmado através de exames laboratoriais, incluindo hemograma, teste de Coombs e PCR para Mycoplasma spp. O tratamento envolve o uso de imunossupressores, como corticosteroides, adjuvantes e antibióticos específicos contra Mycoplasma spp.
Palavras-chave: Doença auto imune, imunossupressão, Icterícia pré hepática.
ABSTRACT
Immunomediated haemolytic anaemia (IMAH) is a serious condition in dogs, characterized by accelerated destruction of erythrocytes mediated by the immune system. Micoplasmosis, caused by parasites of the genus Mycoplasma spp., is one of the infections that can trigger AHIM in dogs. The main clinical signs include jaundice, anaemia, lethargy. Laboratory findings include spherocytosis, Howell-Jolly corpusculus, regenerative anaemia, autoagglutination, haemoglobinemia, haemoglobinuria, hyperbilirubinemia, and bilirubinuria. The diagnosis is confirmed through laboratory tests, including a hemogram, Coombs test, and PCR for Mycoplasma spp. Treatment involves the use of immunosuppressants such as corticosteroids, adjuvants, and specific antibiotics against Mycoplasma spp.
Key-words: immunomediated haemolytic anaemia; Mycoplasma spp.; immunosuppressants.
INTRODUÇÃO
A anemia hemolítica imunomediada (AHIM) é a causa mais comum de hemólise em cães (Bestwick et al., 2021; Gianesini, Drigo e Zoia, 2023). Pode ser de origem primária ou secundária, sendo a primeira, normalmente de origem idiopática, visto que acontece sem que haja patologia ou afecção preexistente, já a AHIM secundária, deriva de fatores como uso de fármacos, substâncias químicas, neoplasias, doenças inflamatórias, toxinas, vacinas ou infecções, normalmente hemoparasitárias (Kjelgaard-Hansen et al., 2011; Nelson & Couto, 2023; Thrall et al., 2015; Tizard, 2019).
Segundo Santos e Alessi (2023), o principal mecanismo acerca da AHIM ocorre pela interação de antígenos e anticorpos. Assim, as imunoglobulinas ou o sistema complemento podem diminuir a sobrevida dos eritrócitos, através da fixação de complexos imunes junto à membrana eritrocitária e, portanto, causam opsonização e destruição dos eritrócitos pelo sistema monocítico fagocitário (Santos & Alessi, 2023; Ramos e Leite, 2017; Souza, 2021).
Esse tipo de anemia é mais comum em cães, principalmente das raças Cocker Spaniel, Poodle e Collie. Porém, não é incomum o desenvolvimento em outras espécies como felinos, bovinos e equinos (Gorenstein et al., 2019; Thrall et al., 2015).
Em cães, o principal sinal clínico é a anemia, palidez de mucosas, letargia, febre, icterícia e hepatoesplenomegalia. A anemia pode estar acompnhada de taquicardia, anorexia, êmese e diarreia (Castilho et al., 2016; Onuma, 2022; Souza; 2019). A manifestação dos sinais clínicos depende da progressão da doença, gravidade e mecanismo de destruição eritrocitária (Tizard, 2019).
Os anticorpos que estão normalmente associados à anemia hemolítica imunomediada pertencem à classe da IgG curso crônico e da IgM em cursos agudos (Gorenstein et al., 2019; Manev e Marincheva, 2018). Esses anticorpos se ligam às glicoproteínas das membranas eritrocitárias, quando há envolvimento de IgG, pode não ocorrer hemólise intravascular ou aglutinação no esfregaço sanguíneo, diferente da IgM, que causa aglutinação de eritrócitos, sendo possível observar macroscopicamente nos frascos de sangue (Kohn, 2011; Thrall et al., 2015).
Os achados laboratoriais podem ser variáveis e normalmente envolvem a diminuição do hematócrito, da contagem de eritrócitos e da concentração de hemoglobina (Ramos e Leite, 2017). Além disso, em casos em que o paciente apresenta hemólise intravascular, é possível verificar hemoglobinemia, hemoglobinúria, hiperbilirrubinemia e bilirrubinúria (Nelson & Couto, 2023; Souza, 2021).
A avaliação do esfregaço sanguíneo é importante, visto que é possível observar alterações morfológicas de eritrócitos, bem como a presença de hemoparasitas como o Mycoplasma spp, Babesia sp. e Erlichia canis (Thrall et al., 2015; Moura et al., 2021). O teste direto Coombs, com antissoro polivalente, pode ser utilizado no diagnóstico de AHIM quando não há presença de esferócitos ou autoaglutinação (Nelson & Couto, 2023).
A AHIM de origem infecciosa pode ser causada pela bactéria Mycoplasma spp., as principais espécies que acometem os cães são Mycoplasma haemocanis e Candidatus Mycoplasma haematoparvum(Botelho, 2017; Melo et al., 2017; Zachary, 2018) A transmissão desses hemoparasitas pode ocorrer via vetores artrópodes, iatrogênica ou de forma vertical, sendo o carrapato da espécie Rhipicephalus sanguineus o mais importante agente de transmissão e reservatório para cães (Baltazar et al., 2016; Melo et al., 2017).
Frequentemente, a AHIM associada à micoplasmose resulta em uma anemia regenerativa marcada pela presença de policromasia, anisocitose, hipocromia e corpúsculos de Howell-Jolly no esfregaço sanguíneo (Garden et al., 2019; Melo et al., 2017; Moura et al., 2021).
É de suma importância distinguir a anemia hemolítica imunomediada primária da secundária para que o tratamento seja efetivo. O diagnóstico definitivo deve levar em consideração o histórico do paciente, exame físico e exames complementares, achados laboratoriais bem como o entendimento do mecanismo fisiopatológico da doença para que ocorra a interrupção da destruição eritrocitária através de protocolos terapêuticos imunossupressores (Moura et al., 2021; Onuma, 2022).
REVISÃO DE LITERATURA
ERITROPOIESE
A hematopoiese é um processo que acontece de forma extravascular, na medula óssea de mamíferos, bem como em outros órgãos quando em fase embrionária ou pós- embrionária (Junqueira & Carneiro, 2023; Lopes, Biondo e Santos, 2007). Durante a vida embrionária a hematopoiese se inicia no saco vitelínico, onde acontece o início da formação vascular, durante o desenvolvimento fetal, outros órgãos como baço, fígado e medula óssea são os maiores responsáveis pela gênese de células sanguíneas (Lopes, Biondo e Santos, 2007; Silva, 2019)
Na segunda fase do desenvolvimento fetal, a medula óssea e órgãos linfoides periféricos são os responsáveis pela hematopoiese, na fase pós embrionária, à medida em que o animal chega a fase adulta, a hematopoiese fica restrita apenas à medula óssea de ossos chatos, epífise de ossos longos e esterno, em alguns animais adultos, pode ocorrer a hematopoiese extramedular, que ocorre quando o baço e o fígado retomam a função de produzir células sanguíneas (Junqueira & Carneiro, 2023; Lopes, Biondo e Santos, 2007; Silva, 2016).
A “stem cell” ou célula tronco, é precursora de todos os tipos celulares sintetizados pelos eixos mieloide e linfoide na medula óssea (Junqueira & Carneiro, 2023; Santos & Alessi, 2023; Silva, 2016). As mesmas possuem capacidade pluripotencial, que através de estímulos específicos, como o aumento sérico de eritropoietina, se diferenciam em precursores linfoides e mieloides multipotenciais (Lopes, Biondo e Santos, 2007; Silva, 2019)
Enquanto os precursores linfoides dão origem aos linfócitos T e B, os mieloides dão origem à série eritrocitária, leucocitária e de plaquetas (Junqueira & Carneiro, 2023; Stockham & Scott, 2011). As unidades formadoras de colônias (UFC) se originam de células unipotenciais provenientes das multipotenciais e são capazes de dar início à eritropoiese, leucopoiese e trombocitopoiese que tambem são dependentes da atividade renal e hepática (Silva, 2016; Stockham e Scott, 2011).
A eritropoiese é um complexo sistema que envolve células tronco e citocinas (Junqueira & Carneiro, 2023; Silva, 2019; Stockham e Scott, 2011). Neste processo, várias citocinas atuam de forma sinérgica à eritropoietina, interleucina (IL-3), hormônios tireoidianos e andrógenos a fim de estimular a replicação e diferenciação da unidade eritroide formadora de blastos (BFU-E) em unidade eritroide formadora de colônia (CFU-E) (Junqueira & Carneiro, 2023; Silva, 2016; Stockham e Scott, 2011).
A IL-3 e o fator estimulante de colônia granulocítica monocítica na presença de eritropoietina estimulam a linhagem mieloide a se proliferar e diferenciar através de mitoses sucessivas, a conversão de BFU-E (unidade eritroide formadora de blastos) em CFU-E (unidade eritroide formadora de colônia) é desencadeada pelas citocinas sintetizadas por macrófagos e linfócitos T ativados, além disso, essa diferenciação decorre de um microambiente medular local (Junqueira & Carneiro, 2023; Lopes, Biondo e Santos, 2007; Silva, 2019).
A eritropoietina é um hormônio considerado tambem como fator de crescimento essencial para a diferenciação de CFU-E em rubriblasto, que é a primeira célula morfologicamente reconhecível da linhagem eritroide (Lopes, Biondo e Santos, 2007; Silva, 2016).
Esse rubriblasto é grande, basofílico, de núcleo arredondado formado de cromatina fina, nucléolos e anéis nucleares evidentes, este rubriblasto dará origem a dois pré-rubrícitos que não apresentam nucléolo nem anel nuclear, posteriormente, são formados, rubrícitos policromáticos, que por conseguinte, formam um metarrubrícito; nas fases finais da eritropoiese, o metarrubrícito tem seu núcleo extraído e fagocitado por macrófagos, tornando-se uma célula anucleada denominada de reticulócito (Lopes, Biondo e Santos, 2007; Stockham e Scott, 2011; Silva, 2016; Silva, 2019).
Ainda segundo Silva (2019), os reticulócitos pertencem ao penúltimo estágio de maturação eritrocitária, sendo morfologicamente semelhantes aos rubrícitos policromáticos, porém, sem presença de núcleo. O eritrócito é o último estágio de maturação, cuja morfologia é arredondada, bicôncava e anucleada na maioria das espécies animais, o formato bicôncavo possibilita maior maleabilidade da célula e eficiência no carreamento de gases (Junqueira & Carneiro, 2023; Lopes, Biondo e Santos, 2007; Thrall et al., 2015).
Figura 1 – Morfologia eritrocitária normal de caninos, felinos, bovinos e equinos em coloração de Wright.
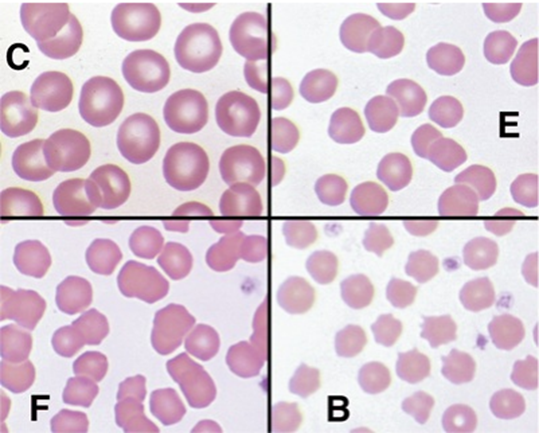
(C) Eritrócitos caninos, (E) eritrócitos equinos, (F) eritrócitos felinos e (B) eritrócitos bovinos.
Fonte: Thrall et al., (2015).
ANEMIA
A anemia consiste na diminuição da massa de eritrócitos que resulta na baixa oxigenação de tecidos e pode ser definida como diminuição do hematócrito (Ht), hemoglobina (Hb) ou no número de hemácias, que estão abaixo dos intervalos de referência para a espécie (Forte, 2021; Nelson & Couto, 2023; Thrall et al., 2015).
Os principais sinais clínicos que envolvem a anemia são a palidez de mucosas, icterícia, letargia, intolerância ao exercício, aumento da frequência respiratória e cardíaca, além de sopros que decorrem do aumento da turbulência sanguínea (Thrall et al., 2015).
A anemia apresenta diversas classificações fisiopatológicas, sendo uma delas, a AHIM, que decorre em consequência da destruição de eritrócitos de forma exacerbada e precoce, como resultado da ação de autoanticorpos ou adesão de complexos imunes aos eritrócitos (Santos & Alessi, 2023; Thrall et al., 2015).
ETIOPATOGENIA DA ANEMIA HEMOLÍTICA IMUNOMEDIADA
Atuação do sistema complemento na hemólise
Segundo Berentsen et al., (2019) o sistema complemento é composto por mais de cinquenta proteínas amplamente distribuídas através do sangue e de tecidos corporais e que são importantes na atuação da resposta imune inata.
A quebra de uma proteína é capaz de dar origem a uma enzima, que por sua vez, cliva seu substrato (outra proteína do sistema complemento) e se transforma em sua forma enzimática ativa, desencadeando a cascata de inflamação (Berentsen et al., 2019).
Esse processo, se ativado nas superfícies de membranas celulares, desencadeiam sucessivos processos de inflamação, proteólise e líticos. A via clássica do sistema complemento, forma uma ligação entre esse sistema e o sistema imune adaptativo (Berentsen et al., 2019; McCullough, 2003)
O sistema complemento é ativado através de três vias provenientes de uma cascata (Souza, 2021). As três vias são divididas em via clássica, via alternativa e via das lectinas (McCullough, 2003; Souza, 2021).
A via das lectinas ativa o fator C3, que se transforma em C3a e C3b, que opsoniza e fagocita a hemácia (Berentsen et al., 2019). O fator C5 é clivado pelo C3b, que por consequência, ativa o complexo de ataque à membrana (C5b-9), o C3a aumenta a permeabilidade da membrana celular e ativa os fagócitos (Berentsen et al., 2019; Souza, 2021; Stockham & Scott, 2011). Os processos de opsonização de hemácias, ativação do complexo de ataque à membrana e fagócitos e o aumento da permeabilidade da membrana resultam na fagocitose de eritrócitos (Berentsen et al., McCullough, 2003; Souza, 2021).
Normalmente, hemácias de cães saudáveis possuem um ciclo de vida médio de 100 a 120 dias, sendo removidas naturalmente pelo sistema monocítico fagocitário em órgãos como o baço e fígado, visto que apresentam anticorpos fixos à suas membranas celulares (Brunori e Fernandez, 2021; Gorenstein et al., 2019; McCullough, 2003).
Contudo, em cães acometidos pela AHIM, a destruição dos eritrócitos ocorre de forma precoce e patológica, através de uma reação de hipersensibilidade do tipo II (Gorenstein et al., 2019; Kohn, 2011; Onuma, 2022) que ocorre por meio da fagocitose de hemácias opsonizadas por imunoglobulinas pertencentes às classes IgG, IgM e IgA como também pelo sistema complemento (Kohn, 2011; McCullough, 2003).
Além disso, a presença desses fatores determinará se a hemólise será intra ou extravascular, sendo a última de maior prevalência (Nelson & e Couto, 2023; Gorenstein et al., 2019).
A hemólise intravascular acontece através da ação das IgM, pois ativam o sistema complemento pela fixação de imunoglobulinas, formando o complexo de ataque à membrana (C5b-9) que consiste em proteínas do complemento do tipo C5b, C6, C7, C8 e várias cópias de C9 que formam um anel na membrana do eritrócito (Gianesini, Drigo e Zoia, 2023; McCullough, 2003; Stockham & Scott, 2011).
Esse anel, por sua vez, lesiona a membrana eritrocitária por completo, tornando-a permeável para entrada de líquidos extravasculares e aumentando a pressão intracelular, rompendo o eritrócito ainda na corrente sanguínea, liberando hemoglobina e assim, manifestando quadros de hemoglobinemia e hemoglobinúria (Brunori e Fernandez, 2021; Gorenstein et al., 2019; Onuma, 2022).
A hemólise extravascular, no entanto, ocorre pela ação das IgG e componentes do sistema complemento como o fator C3b não ativado completamente, que atua como opsonina e promove fagocitose de hemácias (Berentsen et al., 2019; Gorenstein et al., 2019; Zachary, 2018).
Esses componentes atraem macrófagos que fagocitam e lisam hemácias sensibilizadas, esse processo ocorre no baço e no fígado, a hemoglobina proveniente dessa destruição entra no metabolismo de bilirrubina e causa hiperbilirrubinemia e bilirrubinúria, o fígado não consegue converter toda a bilirrubina não conjugada para conjugada e acaba atingindo a sua capacidade máxima com a progressão e cronicidade da doença, levando o animal a apresentar uma icterícia pré-hepática (McCullough, 2003; Onuma, 2022; Santos & Alessi, 2023).
Além disso, uma esplenomegalia ocorre uma vez que os macrófagos são encontrados majoritariamente no baço, que por sua vez, torna-se aumentado pela eritrofagocitose ativa (Onuma, 2022).
Figura 2 – Demonstração da diferença básica entre hemólise extravascular e intravascular.
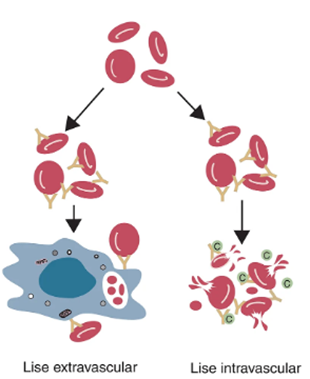
Fonte: Tizard (2019).
Nos caninos, os anticorpos são conduzidos contra as glicoforinas dos eritrócitos, bem como contra a espectrina, proteína encontrada no citoesqueleto e contra o CD33 (banda 3), proteína trocadora de ânions (Nelson & Couto, 2023; Tizard, 2019).
Segundo Tizard (2019), as anemias hemolíticas imunomediadas podem ter sua classificação de acordo com a classe de anticorpo, bem como a temperatura ideal de reação dos anticorpos e a natureza do processo hemolítico.
Na Classe I, ocorre aglutinação de hemácias à temperatura corporal por IgG e IgM, essa aglutinação pode ser avaliada ao depositar uma gota de sangue em uma lâmina de vidro; as hemácias são lisadas por fagocitose no baço, visto que a IgG não ativa o sistema complemento de forma eficaz (Borchert et al., 2020; Santos, 2022; Tizard, 2019).
Na Classe II, as IgM ativam o sistema complemento e ocorre hemólise intravascular, levando o paciente a desenvolver hemoglobinemia, hemoglobinúria, icterícia e anemia grave (Stockham & Scott, 2011; Tizard, 2019). Além disso, o animal pode apresentar hepatomegalia e linfadenomegalia, devido a remoção de hemácias recobertas por componentes do sistema complemento pelas células de Kupffer, localizadas no fígado, bem como macrófagos nos linfonodos (Tizard, 2019).
Já a Classe III é mediada por IgG1 e IgG4, que se fixam aos eritrócitos à temperatura de 37°C (Santos, 2022; Tizard, 2019). No entanto, não ativam o sistema complemento e nem aglutinam as células, visto que esses anticorpos não têm capacidade de neutralizar o potencial zeta dos eritrócitos. Uma esplenomegalia pode ser observada em pacientes com essa classificação de AHIM, visto que as hemácias afetadas são opsonizadas e destruídas por macrófagos do baço. (Berentsen et al., 2019; Tizard, 2019).
Na Classe IV, as IgM aglutinam as hemácias quando o sangue é resfriado, esses anticorpos são chamados de aglutininas frias, pois podem ser detectadas no sangue entre 4 e 10°C (Santos, 2022; Tizard, 2019; Zachary, 2018). Essa aglutinação é desfeita quando o sangue é reaquecido (Tizard, 2019).
Animais com essa classe de AHIM, podem apresentar estase vascular, bloqueio da circulação, isquemia tecidual e necrose nas extremidades do corpo como os dedos, cauda e pontas de orelhas, visto que essas localidades anatômicas podem ficar frias a ponto de ocorrer esse tipo de aglutinação, essa classe é mais grave em estações de frio (Santos, 2022; Stockham & Scott, 2011; Tizard, 2019; Zachary, 2018).
A Classe V é mediada por IgM que se fixam às hemácias a 4°C (Tizard, 2019). No entanto, não aglutinam, portanto, não causam necrose de extremidades, porém causam hemólise intravascular pois ativam o sistema complemento. Esses anticorpos podem ser identificados em testes de antiglobulina em baixa temperatura (Borchert et al., 2020; Stockham & Scott, 2011; Tizard, 2019; Zachary, 2018).
Tabela 1 – Classificação das anemias hemolíticas imunomediadas
Classe Anticorpo predominante Atividade Temperatura ideal (°C) Local de remoção das hemácias Efeito clínico I G>> M Aglutinina 37 Baço Aglutinação intravascular I M Hemolisina 37 Fígado Hemólise intravascular III G Incompleta 37 Baço Anemia IV M Aglutinina 4 Fígado Cianose e infarto de membros V M Incompleta 4 Fígado Anemia
Fonte: Tizard (2019).
Segundo Castilho et al., (2016), a anemia hemolítica imunomediada pode ser classificada de acordo com os mecanismos de gênese do processo hemolítico, podendo ser primária (idiopática) ou secundária.
Anemia hemolítica imunomediada primária
A AHIM primária em cães é idiopática e é caracterizada por uma desregulação do sistema imune e produção de anticorpos antieritrocitários (Kjelgaard-Hansen et al., 2011). A glicoforina é uma glicoproteína presente na membrana do eritrócito e atua como antígeno que se liga aos autoanticorpos e não provocam reações nos hospedeiros devido a ação supressora dos linfócitos T (Balch e Mackin, 2007).
Acredita-se que em animais acometidos pela AHIM primária tenham uma super estimulação do sistema imune ou atuação ineficaz dos linfócitos T, que acaba por permitir a que os autoanticorpos destruam os eritrócitos (Balch e Mackin, 2007). No entanto, a causa para essa reação autoimune permanece desconhecida (Santos, 2022).
Cães de meia idade, fêmeas e machos castrados normalmente estão mais predispostos em relação a machos não castrados (Brunori e Fernandez, 2021; Nelson & Couto, 2023). Cães da raça Cocker Spaniel demonstram ser mais predispostos em relação a outras raças, o que sugere predisposição genética à doença (Brunori e Fernandez, 2021; Kohn, 2011; Zachary, 2018).
Anemia hemolítica imunomediada secundária associada a micoplasmose
A ocorrência da AHIM secundária é dependente de causas primárias (Zachary, 2018). O surgimento dessa enfermidade está relacionado à quadros estressantes como vacinação, doenças hemoparasitárias e virais, desequilíbrios hormonais como piometra ou até mesmo prenhez (Kohn, 2011; Manev e Marincheva, 2018; Tizard, 2019).
Dessa forma, pode estar relacionada com distúrbios imunológicos, trombocitopenia autoimune, bem como neoplasias ou tumores linfoides (Kohn, 2011; Swann et al., 2019).
Fármacos também foram descritos como causas de AHIM secundária, sendo as sulfas, cefalosporinas, levamizol, dipirona, penicilinas e clorpromazina como exemplos (Manev e Marincheva; Moraes et al., 2016; Souza, 2021; Thrall et al., 2015). Esses fármacos, ao se ligarem às membranas do eritrócito, formam complexos medicamento-antígeno que induzem a formação de anticorpos hapteno-dependentes (Zachary, 2018).
A indução de um autoanticorpo verdadeiro direcionado aos antígenos eritrocitários também foi descrito como mecanismo de ação dos fármacos para o aparecimento de AHIM secundária (Stockham & Scott, 2011; Zachary, 2018).
Outras etiologias também são descritas, como defeitos intrínsecos (deficiência de fósforo, por exemplo), ingestão de cebola e alho, picadas de abelha e até infestações parasitárias por Ancylostoma caninum (Gorenstein, 2019 et al.; Moraes et al., 2016; Thrall et al., 2015, Tizard, 2019).
Parasitas hemotrópicos, como os micoplasmas, tendem a alterar a superfície eritrocitária pela produção de complexos imunes ou alteração dos autoantígenos da membrana dos eritrócitos, que acabam não sendo reconhecidos pelo sistema imune do hospedeiro, sendo assim, destruídos (Balch e Mackin, 2007; Santos, 2022; Zachary, 2018).
Os micoplasmas hemotrópicos são bactérias pleomórficas, epicelulares e gram negativas, infectam todas as espécies animais e crescem nas superfícies dos eritrócitos (Botelho, 2017; Messick & Harvey, 2015; Zachary, 2018). Em cães, entre as principais espécies que os infectam estão o Mycoplasma haemocanis e o Candidatus Mycoplasma haematoparvum (Botelho, 2017; Melo et al., 2017).
A transmissão de Mycoplasma haemocanis ainda não está completamente esclarecida, no entanto, acredita-se que o principal vetor da doença seja o carrapato marrom Rhipicephalus sanguineus, além disso, outras formas de transmissão de hemoplasmas também foram descritas, como a via iatrogênica por transfusão sanguínea(Botelho, 2017; Messick & Harvey, 2015).
Cães infectados podem manifestar sinais clínicos agudos quando esplenectomizados ou podem apresentar-se assintomáticos quando há cronicidade da doença (Botelho, 2017).
Os micoplasmas possuem uma membrana plasmática rica em lipoproteínas, que através de receptores Toll-like 2 e 6, ativa o sistema imune nato e, portanto, acaba por estimular uma resposta inflamatória pela ativação da via clássica do sistema complemento (McVey, Kennedy e Chengappa, 2016).
Os mecanismos de patogenicidade do agente ainda não são completamente elucidados, no entanto, acredita-se que esses hemoplasmas induzem aglutininas frias em pacientes acometidos devido a presença de um componente imunomediado ou pela lesão direta aos eritrócitos pelo agente patogênico (Stockham & Scott, 2011; Zachary, 2018).
Figura 3 – Esfregaço sanguíneo contendo micoplasmose hemotrópica em Coloração de Wright.
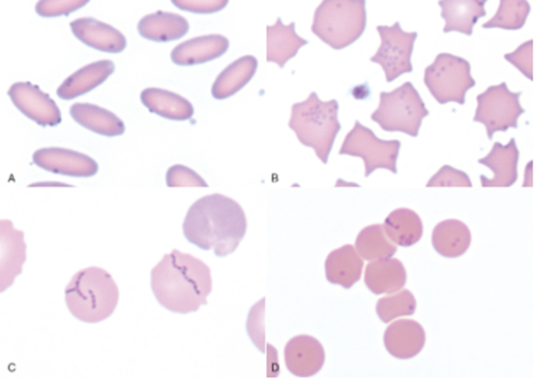
Esfregaços sanguíneos de alpaca (A) infectada por Mycoplasma haemolamae, de suíno (B) infectado por Mycoplasma suis, de um canino (C) infectado por Mycoplasma haemosuis e um felino (D) infectado por Mycoplasma haemominutum.
Fonte: Zachary (2018).
Ainda segundo Zachary (2018), a anemia decorrente da infecção por Mycoplasma spp. pode ser subclínica como também fatal, essa anemia é consequência de hemólise extravascular ou intravascular, sendo a primeira de maior predominância.
SINAIS CLÍNICOS DA ANEMIA HEMOLÍTICA IMUNOMEDIADA
A manifestação dos sinais clínicos é dependente da velocidade de progressão da enfermidade, gravidade e mecanismo de destruição das hemácias (Tizard, 2019). Frequentemente, cães acometidos pela AHIM, apresentam-se anêmicos, febris, ictéricos (fig. 4), não obstante, apresentam letargia, anorexia, fraqueza, êmese, palidez de mucosas, perda de peso, diarreia e intolerância ao exercício (Kohn, 2011; Nelson & Couto, 2023; Souza, 2021; Tizard, 2019). Pacientes com anemia aguda podem apresentar colapso (Thrall et al., 2015).
Figura 4 – Cão apresentando mucosas orais ictéricas
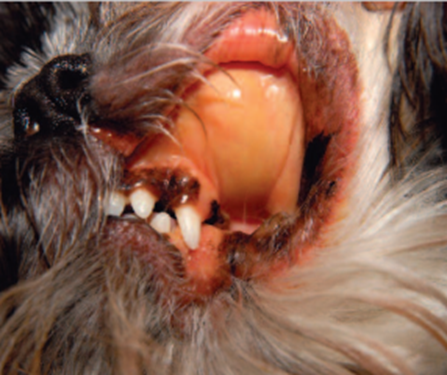
Fonte: Balch e Mackin (2007)
Não é incomum encontrar sopros cardíacos sistólicos, taquicardia, taquipneia e dor abdominal no exame físico, assim como esplenomegalia e hepatomegalia em exames de imagem (Gorenstein et al., 2019; Nelson & Couto, 2023; Thrall et al., 2015).
Achados laboratoriais
Em exames hematológicos, é frequente encontrar anemia grave e resposta altamente regenerativa da medula óssea (reticulocitose, policromasia e anisocitose), esferocitose, aglutinação de eritrócitos (salienta-se a diferenciação de formação de rouleaux), hemácias fantasmas, bem como evidência de inflamação, como o aumento de neutrófilos segmentados, bastonetes, metamielócitos e monócitos (Brunori e Fernandez, 2021; Gorenstein et al., 2019; Kohn, 2011; Nelson & Couto, 2023; Tizard, 2019).
A anemia regenerativa é marcada pela reticulocitose, policromasia, anisocitose, macrocitose e presença de corpúsculos de Howell-Jolly (Brunori e Fernandez, 2021). Em alguns casos, a anemia pode ter caráter arregenerativo devido a um início agudo de hemólise ou destruição de células precursoras na medula óssea (Onuma, 2022).
É frequente encontrar diminuição do volume globular, da concentração de hemoglobina e da contagem de eritrócitos (Thrall et al., 2015). O esfregaço sanguíneo normalmente revela presença de esferócitos, que são células pequenas, arredondadas, sem área central clara e que são resultantes de eritrofagocitose parcial, a relação entre a intensidade de destruição de hemácias e presença de esferócitos no sangue é proporcional (Balch e Mackin, 2007; Brunori e Fernandez, 2021; Tizard, 2019; Thrall et al., 2015).
Figura 5 – Esfregaço sanguíneo de cão em Coloração de Wright.
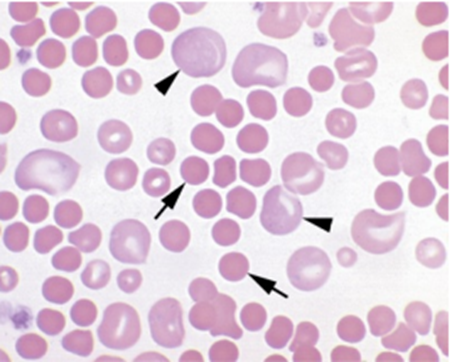
Esfregaço sanguíneo de cão com AHIM com presença de eritrócito policromatofílicos (pontas de seta) e esferócitos (setas).
Fonte: Thrall et al., (2015)
Quando a hemólise ocorre de forma intravascular, encontra-se hemoglobinemia, hemoglobinúria, hiperbilirrubinemia e bilirrubinúria, é importante salientar que o teor de hemoglobina pode estar falsamente aumentado em relação ao volume globular (Castilho et al., 2016; Gorenstein et al., 2019; Thrall et al., 2015). Além disso, hemácias fantasmas também são consideradas como sinais de hemólise intravascular, visto que elas são consequência da lise de eritrócitos que ainda mantém a estrutura de seu citoesqueleto (Brunori e Fernandez, 2021; Hill et al., 2017).
Na hemólise extravascular, os macrófagos degradam as hemácias e a hemoglobina não é liberada na circulação, portanto, não há ocorrência de hemoglobinemia nem hemoglobinúria, a não ser que haja hemólise intravascular concomitante à extravascular (Balch e Mackin, 2007; Brunori e Fernandez, 2021).
No leucograma, nota-se resposta inflamatória, marcada pela presença de neutrofilia com desvio à esquerda, aumento de bastonetes e monocitose (Kohn, 2011; Thrall et al., 2015). Os macrófagos ativados liberam fatores estimuladores de colônia que culminam nessa resposta inflamatória (Thrall et al., 2015).
Em geral, pode ocorrer trombocitopenia devido à destruição imunomediada concomitante, à coagulopatia intravascular disseminada (CID) ou ainda ao sequestro esplênico (Castilho et al., 2016; Thrall et al., 2015; Nelson & Couto, 2023).
Na bioquímica sérica pode haver hemoglobinemia, hemoglobinúria, hiperbilirrubinemia, hiperbilirrubinúria, aumento de alanina aminotransferase (ALT) e fosfatase alcalina (FA), que podem ser explicados pelo dano hepatocelular causado pelo aumento da chegada de bilirrubina no fígado e diminuição da capacidade de depuração do fígado (Brunori e Fernandez, 2021; Nelson & Couto, 2023).
Ainda pode ocorrer azotemia renal graças à hipoxia, bem como pela saturação da capacidade de reabsorção de hemoglobina pelos túbulos renais (Brunori e Fernandez, 2021; Thrall et al., 2015).
DIAGNÓSTICO
O diagnóstico de AHIM baseia-se na anamnese, sinais clínicos, exames físicos e laboratoriais, bem como na investigação para presença de hemoparasitoses, é importante ressaltar que a AHIM não apresenta nenhum sinal patognomônico, portanto, deve-se realizar um hemograma completo, bioquímica sérica e urinálise. (Manev e Marincheva, 2018; Nelson e Couto, 2023; Onuma, 2022). É importante salientar que cães portadores de AHIM em fase aguda possuem redução dos níveis séricos de albumina e aumento da concentração de proteína C reativa e glicoproteína ácida α-1 (Tizard, 2019).
Exames mais específicos como contagem de reticulócitos, teste de aglutinação salina, esfregaço sanguíneo e teste de Coombs também podem ser requisitados para um diagnóstico mais preciso (Castilho et al., 2016; Onuma, 2022).
Exames para detecção de hemoparasitas, como Reação em Cadeia Polimerase (PCR) e exames de imagem são indispensáveis para a diferenciação entre AHIM primária e secundária (Kohn, 2011; Nelson & Couto, 2023; Onuma, 2022).
Os exames de imagens são importantes para verificar se há presença de neoplasias, doenças cardíacas primárias (na anemia pode haver ocorrência de sopros cardíacos), bem como a avaliação de órgãos importantes para evolução da enfermidade, como o baço e o fígado, que podem estar aumentados (Andres et al., 2019; Balch e Mackin, 2007; Gorenstein et al., 2019; Onuma, 2022).
O teste de Coombs direto ou teste da antiglobulina direta (TAD) com antissoro polivalente, consiste em adicionar uma antiglobulina espécie-específica em uma suspensão de eritrócitos lavada em solução salina, em testes positivos, ocorrerá aglutinação, uma vez que os eritrócitos estarão recobertos por anticorpos, esse teste não é recomendado em casos em que já há presença de aglutinação (Garden et al., 2019; Nelson & Couto, 2023; Souza, 2021; Thrall et al., 2015)
É necessário se atentar aos resultados falso-positivos, que podem ocorrer em outras doenças inflamatórias, como também nos falsos negativos, que são consequência da baixa concentração de anticorpos (Nelson & Couto, 2023; Thrall et al., 2015).
A citometria de fluxo de imunofluorescência direta (IFD) também é um recurso que pode ser utilizado, entretanto, é menos específica e mais sensível que o teste de Coombs e é utilizada para a determinação da classe de anticorpos e a porcentagem de eritrócitos ligados a eles (Brunori e Fernandez, 2021; Thrall et al., 2015).
O teste de aglutinação em solução salina diferencia a autoaglutinação e a formação de rouleaux, esse teste consiste na mistura de uma pequena amostra de sangue com uma gota de solução salina, essa solução irá dispersar a formação de rouleaux enquanto a aglutinação permanecerá (Garden et al., 2019; Onuma, 2022; Swann et al., 2019; Thrall et al., 2015)
A aglutinação pode ser tão intensa que por vezes, é possível observar macroscopicamente no tubo com EDTA ou na lâmina do esfregaço sanguíneo (Castilho et al., 2016; Thrall et al., 2015). Em geral, a presença de aglutinação e esferócitos no esfregaço sanguíneo já é considerado diagnóstico para AHIM (Brunori e Fernandez, 2021; Nelson & Couto, 2023).
Figura 6 – Teste de aglutinação em solução salina de um cão com AHIM
Lâmina de teste de aglutinação em solução salina com resultado macroscópico positivo para AHIM.
Fonte: Brunori e Fernandez (2021)
O esfregaço sanguíneo é de grande importância para o diagnóstico de AHIM, visto que é possível observar a morfologia eritrocitária, detecção de hemoparasitas como o Mycoplasma spp. no interior das hemácias, detecção de esferócitos, autoaglutinação, anisocitose, corpúsculos de Howell-Jolly, entre outros achados importantes (Brunori e Fernandez, 2021; Jäger et al., 2019; Onuma, 2022).
Diagnósticos diferenciais
Nem toda hemólise tem origem imunomediada, algumas causas da anemia hemolítica em pequenos animais se relacionam com defeitos intrínsecos, toxinas, hipofosfatemia, deficiência de piruvato quinase, fragilidade osmótica de eritrócitos hereditária além de outras doenças imunomediadas como lúpus eritematoso sistêmico ou ainda, incompatibilidade de transfusão sanguínea (Balch e Mackin, 2007; McCullough, 2003; Souza, 2021).
TRATAMENTO
O objetivo do tratamento para AHIM consiste na prevenção da hemólise, redução da hipoxia tecidual por transfusão de sangue e a prevenção do tromboembolismo (Borchert et al., 2020; Nelson & Couto, 2023). O protocolo terapêutico se dá através da utilização de fármacos imunossupressores e terapia suporte (Borchert et al., 2022; Onuma, 2022; Souza, 2021). O tratamento pode influenciar no resultado dos exames, dito isto, é necessário realizar a coleta do material para testes diagnósticos antes do início do protocolo terapêutico (Swann et al., 2019).
Assim que for estabelecido o diagnóstico de AHIM, deve-se iniciar o tratamento com os glicocorticoides, pois esta classe de fármaco reduz a eritrofagocitose pela interferência na expressão e função de receptores Fc nos macrófagos, além de reduzir a ativação do sistema complemento e produção de citocinas como também inibir o sistema de reconhecimento do macrófago para IgG, IgM e C3b (Gorenstein et al., 2019; Kohn, 2011; McCullough, 2003; Nelson & Couto, 2023).
Para tratamento e prevenção de hemólise, é necessário administração de doses altas de glicocorticoides, sendo a prednisolona (2 – 4 mg/kg/ dia via oral) o fármaco de eleição (Goggs, 2020; Nelson & Couto, 2023; Silva, 2019). A dose de prednisolona deve ser diminuída de forma gradual (20 a 30% por mês durante 3 a 6 meses), assim que o hematócrito se estabilizar acima de 30% (Nelson & Couto, 2023; Onuma, 2022).
Em pacientes que não respondem aos primeiros 5 a 7 dias de tratamento apenas com glicocorticoides podem ser tratados com fármacos imunossupressores adjuvantes (McCullough, 2003; Nelson & Couto, 2023). Os mais utilizados são a azatioprina, a ciclosporina e o micofenolato, que devem ter suas doses mantidas enquanto as doses de prednisolona devem ser reduzidas gradualmente (Kohn, 2011; Nelson & Couto, 2023; Swann et al., 2019).
A ciclosporina é utilizada com mais frequência, no entanto, seu uso requer monitoramento frequente para detecção de infecções secundárias devido aos seus efeitos imunossupressores que se dão através da interferência da ativação de linfócitos e macrófagos (Kohn, 2011; Nelson & Couto, 2023; McCullough, 2003). Ainda, a ciclosporina é capaz de impedir que as células T-helper ativem fatores imunes como a interferon gama (IFN-gama) e fator de diferenciação do linfócito B (McCullough, 2003). A dose administrada normalmente é de 10mg/kg SID ou BID via oral (Gorenstein et al., 2019)
Anticoagulantes, como a heparina (200 a 300 U/kg a cada 6 horas via subcutânea) e varfarina, são classes de medicamentos que tem como função prevenir a formação de trombos, visto que cães acometidos pela AHIM podem apresentar eventos tromboembólicos importantes (Jäger et al., 2019; Nelson & Couto, 2023). Os principais distúrbios da hemostasia apresentados são o prolongamento do tempo de tromboplastina parcial ativada (TTPa) e do tempo de protrombina (Goggs, 2020; Nelson & Couto, 2023).
A transfusão de sangue depende da gravidade, cronicidade da anemia e doenças adjacentes como tromboembolismo pulmonar (Nelson & Couto, 2023; Swann et al., 2019). Pacientes com hematócrito abaixo de 15% devem receber transfusão independente da manifestação clínica da AHIM devido ao risco de necrose hepática e tromboembolismo (Jäger et al., 2019; Nelson & Couto, 2023; Swann et al., 2019)
Para o tratamento da micoplasmose, pode ser utilizado doxiciclina (5mg/kg a cada 12h) associada ao omeprazol, visto que esse antimicrobiano tem efeitos irritativos na mucosa gastrintestinal (Goggs, 2020). A doxiciclina é um antibiótico de amplo espectro da classe das tetraciclinas que tem capacidade de atingir hemoparasitas e como efeito adverso, pode provocar reações irritativas no sistema digestório quando administrada via oral (Silva, 2023).
A terapêutica para AHIM deve ser sempre monitorada, visto que complicações do tratamento com imunossupressores podem aparecer, como úlceras gastrintestinais, hiperadrenocorticismo iatrogênico, supressão de medula óssea, infecções e hemorragias gastrintestinais, outros cuidados envolvem a administração intravenosa de fármacos via cateterismo, pois isto está relacionado a tromboembolismo pulmonar e ainda à coagulopatias hemorrágicas, bem como hipercoagubilidade (Castilho et al., 2016; Nelson & Couto, 2023).
CONCLUSÃO
A anemia hemolítica imunomediada é um distúrbio autoimune que pode acometer determinadas espécies, sendo mais comum em cães. Pode ser dividida em primária e secundária, sendo a segunda mais prevalente, visto que possui inúmeras etiologias descritas, dentre elas, a infecção por Mycoplasma spp. A AHIM associada a micoplasmose é uma condição complexa e desafiadora que requer uma abordagem diagnóstica e terapêutica integrada. Não há um diagnóstico padrão ouro, entretanto, os achados laboratoriais são bem característicos desse distúrbio, mas não patognomônicos. A anamnese, exames físicos e complementares, assim como investigação e exclusão de outras doenças são de grande importância para um diagnóstico preciso e emprego de um protocolo terapêutico adequado.
REFERÊNCIAS
ANDRES, Michael et al. Diagnostic utility of thoracic radiographs and abdominal ultrasound in canine immune-mediated hemolytic anemia. Canadian Veterinary Journal. Davis, p. 1065-1071. out. 2019.
BALCH, Andrea; MACKIN, Andrew. Canine immune-mediated hemolytic anemia: pathophysiology, clinical signs, and diagnosis. Compend, v. 29, n. 4, p. 217- 225, 2007.
BALTAZAR, F. N.; SENA, A. L.; QUINZANI, M. A.; BEARL, C. A. Ocorrência e características clínicas e laboratoriais de cães infectados por micoplasmas hemotrópicos (Mycoplasma haemocanis e Candidatus Mycoplasma haematoparvum): estudo de quatro anos em animais atendidos em hospital veterinário localizado no município de São Paulo, Brasil. Revista de Educação Continuada em Medicina Veterinária e Zootecnia do CRMV-SP / Journal of Continuing Education in Animal Science of CRMV-SP. São Paulo: Conselho Regional de Medicina Veterinária, v. 14, n. 2, p. 26-29, 2016.
BERENTSEN, Sigbjørn et al. Novel insights into the treatment of complement-mediated hemolytic anemias. Therapeutic Advances In Hematology. [S.I.], p. 1-20. set. 2019.
BRUNORI, Lara; ROMERO-FERNANDEZ, Nora. Immune-mediated hemolytic anemia, part 1: pathophysiology and diagnosis. Companion Animal, [S.L.], v. 26, n. 4, p. 1-11, 2 abr. 2021.
BORCHERT, C., Herman, A., Roth, M., Brooks, A. C., & Friedenberg, S. G. (2020). RNA sequencing of whole blood in dogs with primary immune-mediated hemolytic anemia (IMHA) reveals novel insights into disease pathogenesis. PLOS ONE, 15(10), e0240975. https://doi.org/10.1371/journal.pone.0240975.
BOTELHO, Camila Flávia Magalhães. Diagnóstico molecular e avaliação hematológica de micoplasmas hemotróficos em cães domésticos (Canis familiaris) nas áreas urbana e rural de Araguaína, Tocantins, Brasil. 2017. 50 f. Dissertação (Mestrado em Medicina Veterinária, Ciências Clínicas). Instituto de Veterinária, Departamento de Medicina e Cirurgia Veterinária, Universidade Federal Rural do Rio de Janeiro, Seropédica, RJ, 2017. Disponível em: https://rima.ufrrj.br/jspui/handle/20.500.14407/14192. Acesso em: 9 de maio. 2024.
CASTILHO, R. C.; LIMA, M. O.; CRUZ, M. F. R.; MARQUEZ, E. S.; CALDERAN, C. Hemolytic Anemia Imunne-mediated in dogs. Scientific Electronic Archives, [S. l.], v. 9, n. 5, p. 72–84, 2016. DOI: 10.36560/952016288. Disponível em: https://sea.ufr.edu.br/SEA/article/view/288. Acesso em: 9 de maio. 2024.
FORTE, M.F., Classificação de Anemias em Cães Através de Diferentes Métodos Analíticos. 2021. 14f. Dissertação de Mestrado Integrado em Medicina Veterinária – Universidade de Lisboa, Lisboa, 2021. ProQuest Dissertations Publishing, 2021. 29281247.
GARDEN, Oliver A. et al. ACVIM consensus statement on the diagnosis of immunemediated hemolytic anemia in dogs and cats. Journal of Veterinary Internal Medicine. Philadelphia, p. 313-334. 18 jan. 2019.
GIANESINI, G., DRIGO, M., ZOIA, A. Immune-Mediated Hemolytic Anemia and Clinically Suspected Acute Pancreatitis in Dogs, a Pilot Study. Topics in Companion Animal Medicine, v.56, p.100-112. 2023.
GOGGS, Robert. Therapeutic Strategies for Treatment of Immune-Mediated Hemolytic Anemia. Veterinary Clinics of North America: Small Animal Practice, [S.L.], v. 50, n. 6, p. 1327-1349, nov. 2020. Elsevier BV. http://dx.doi.org/10.1016/j.cvsm.2020.07.010.
GORENSTEIN, T. G.; SANTOS, B. dos; BASSO, R. M.; TAKAHIRA, R. K. Anemia hemolítica imunomediada primária em cães – revisão de literatura. Arq. Ciênc. Vet. Zool. UNIPAR, Umuarama, v. 22, n. 2, p. 71-75, abr./jun. 2019.
HILL, Q.A., STAMPS, R., MASSEY E., et al. The diagnosis and management of primary autoimunne haemolytic anaemia. British Journal of Haematology, v.176, p. 395 – 411. 2017.
JÄGER, U., BARCELLINI, W., BROOME, C.M., et al. Diagnosis and treatment of autoimmune hemolytic anemia in adults: recommendations from the first international consensus meeting. Blood Reviews, n.41, p. 100648. 2020.
JASON, P., BESTWICK, B.J., SKELLY, J.W., SWANN, B. G., NICK, Z. G., DAVID, J. W., PAOLO, S., SOPHIE, A., MAYANK, S., JAMES, W. Splenectomy in the management of primary immune-mediated hemolytic anemia and primary immune-mediated thrombocytopenia in dogs. Journal of Veterinary Internal Medicine, v.36, n.4, p. 1267-1280. 2022.
JUNQUEIRA, Luiz Carlos Uchoa; CARNEIRO, José; ABRAHAMSOHN, Paulo (coord.). Junqueira & Carneiro Histologia básica: texto e atlas. 14. Rio de Janeiro: Guanabara Koogan, 2023. p. 257 – 266.
KJEELGARD-HANSEN, M., GOGGS, R., WIINBERG, B., & CHAN, D. L. (2011). Use of Serum Concentrations of Interleukin‐18 and Monocyte Chemoattractant Protein‐1 as Prognostic Indicators in Primary Immune‐Mediated Hemolytic Anemia in Dogs. Journal of Veterinary Internal Medicine, 25(1), 76–82. https://doi.org/10.1111/j.1939-1676.2010.0642.x.
KOHN, B. Management of Canine Immune-Mediated Hemolytic Anemia. World Small Animal Veterinary Association World Congress Proceedings, Germany, ano 2011, p. 583-596, 2011. Disponível em: https://www.vin.com/doc/?id=5124326. Acesso em: 9 out. 2024.
LOPES, S.T.A.; BIONDO, A.W.; SANTOS, A.P. Manual de patologia clínica veterinária. 3. ed. Santa Maria: UFSM/ Departamento de Clínica de Pequenos Animais, 2007. 107 p.
MANEV, I., MARINCHEVA, V. Canine immune-mediated hemolytic anemia – brief review. Tradition and Modernity in Veterinary Medicine, v.3, n.1, p.59-64, 2018.
MCCULLOUGH, S.. Immune-mediated hemolytic anemia: understanding the nemesis. The Veterinary Clinics Of North America – Small Animal Practice., Illinois, v. 6, n. 33, p.1295-12315, 2003.
MCVEY, Scott; KENNEDY, Melissa; CHENGAPPA, M.M. Microbiologia veterinária. 3. Rio de Janeiro: Guanabara Koogan, 2016. p. 294.
MESSICK, J.B. & HARVEY, J.W. Micoplasmose Hemotrópica (Hemobartonelose) In.:
GREENE, C.E. Doenças Infecciosas em cães e gatos. 4th ed. Rio de Janeiro: Guanabara Koogan, p. 325-335, 2015.
MORAES, L. F., TAKAHIRA, R. K., GOLIM, M. de A., & BAGGIO, M. S. (2016). Avaliação das alterações hemostáticas e do risco tromboembólico em cães com AHIM. Pesquisa Veterinária Brasileira, 36(5), 405–411. https://doi.org/10.1590/S0100-736X2016000500009.
MOURA, A. de L..; SOUSA, E. P. de.; MAGALHÃES, T. S.; ALVES, F. W. da S..; BARROSO, I. C.; SILVA, I. N. G. da.; SILVA, M. e. ANEMIA HEMOLÍTICA IMUNOMEDIADA ASSOCIADA À MICOPLASMOSE EM UM CÃO. Ciência Animal, [S. l.], v. 31, n. 1, p. 153–159, 2021. Disponível em: https://revistas.uece.br/index.php/cienciaanimal/article/view/9433. Acesso em: 9 maio. 2024.
NELSON, Richard W.; COUTO, C. Guillermo. Medicina interna de pequenos animais, 6. ed. Rio de Janeiro: Elsevier, 2023, p. 1216 – 1222.
ONUMA, T. P. Anemia Hemolítica Imunomediada em Pequenos Animais – Revisão De Literatura. Botucatu, 2022. 20p. Trabalho de Conclusão de Curso de Graduação (Medicina Veterinária, Área de Concentração: Clínica de Pequenos Animais) – Faculdade de Medicina Veterinária e Zootecnia, Campus Botucatu, Universidade Estadual Paulista “Júlio de Mesquita Filho”, Botucatu, 2022.
RAMOS, Luana Teles; LEITE, Ana Karine Rocha de Melo. Alterações clínicas e laboratoriais em um cão com anemia hemolítica imunomediada: Relato de caso. Revista Científica de Medicina Veterinária. João Pessoas, v. 28, p. 1-10, semestral, jan. 2017.
SANTOS, T.L., Diagnóstico da Anemia Hemolítica Imunomediada em Cães: Revisão de Literatura. 2022. 35f. Trabalho de Conclusão de Curso – Instituto Federal de Educação, Ciência e Tecnologia do Amazonas, Manaus, 2022. Disponível em: http://repositorio.ifam.edu.br/jspui/handle/4321/1195. Acesso em: 9 de maio. 2024.
SANTOS, Renato de Lima; ALESSI, Antonio Carlos. Patologia veterinária. 3. Rio de Janeiro: Roca, 2023. p. 365 – 366 e 427.
SILVA, Bianca de Jesus e. Prescrições antimicrobianas para cães com doenças respiratórias: um estudo retrospectivo no hospital veterinário da Universidade Federal de Uberlândia. 2023. 31f. Trabalho de Conclusão de Curso (Graduação em Medicina Veterinária) – Universidade Federal de Uberlândia, Uberlândia, 2023. Disponível em https://repositorio.ufu.br/handle/123456789/39385. Acesso em: 9 de maio. 2024.
SILVA, Lucas Cavalcante. Anemia hemolítica imunomediada: diagnóstico e terapêutica. 2019. 53 f. Trabalho de Conclusão de Curso (Bacharelado em Medicina Veterinária) – Unidade Acadêmica de Garanhuns, Universidade Federal Rural de Pernambuco, Garanhuns, 2019. Disponível em: https://repository.ufrpe.br/handle/123456789/1943. Acesso em 9 de maio. 2024.
SILVA, Malena Noro. Hematologia veterinária. 2017. p. 14 – 17.
SOUZA, Sara Dörr de. Anemia hemolítica imunomediada em cães e gatos: revisão de literatura. 2021. 28 f. Trabalho de Conclusão de curso – Centro Universitário de Brasília, Brasília, 2021. Disponível em: https://repositorio.uniceub.br/jspui/handle/prefix/15611. Acesso em: 9 de maio. 2024.
STOCKHAM, Steven L.; SCOTT, Michael A. Fundamentos de patologia clínica veterinária. Rio de Janeiro: Guanabara Koogan, 2011. p. 150 – 155.
SWANN, James W. et al. ACVIM consensus statement on the treatment of immunemediated hemolytic anemia in dogs. Journal Of Veterinary Internal Medicine. Oxford, p. 1141-1172. fev. 2019.
THRALL, M. A. et al. Hematologia e Bioquímica Clínica Veterinária. 2. ed. São Paulo: Rocca. 2015. p. 198 – 206.
TIZARD, Ian. Imunologia veterinária. 10. Rio de Janeiro: GEN Guanabara Koogan, 2019. p. 417 – 418.
ZACHARY, James F. Bases da patologia em veterinária. Rio de Janeiro: GEN Guanabara Koogan, 2018. p. 751 – 753.
