REGISTRO DOI:10.69849/revistaft/cl10202410181333
Bárbara Pereira Pais
Valentini Veronez
Prof. Orientadora: Dra. Aline Francielle da Silva dos Santos
RESUMO
O objetivo do trabalho é investigar, por meio de uma revisão de literatura, o fator de imunogenicidade da toxina botulínica tipo A (TBA) e comprovar através de estudo de caso seus efeitos negativos em tratamentos estéticos. A TBA é uma neurotoxina produzida pela bactéria Clostridium Botulinum, uma bactéria anaeróbica que, sob condições adequadas, produz sete sorotipos de toxina (A, B, C1, D, E, F e G). Dentre esses sorotipos, o tipo A é o mais amplamente utilizado para fins estéticos. A toxina botulínica A, quando aplicada em doses adequadas, atua bloqueando a liberação de acetilcolina nas sinapses neuromusculares, inibindo a contração de determinado músculo. Esse bloqueio temporário proporciona os efeitos desejados, como a melhora no aparecimento de linhas de expressão e do sorriso gengival, assim como, o controle de hiperidrose. No entanto, por ser originada de uma bactéria, o organismo humano pode identificar a toxina como um antígeno, desencadeando uma resposta imune. Essa resposta pode levar a produção de anticorpos contra a toxina, reduzindo sua eficácia e diminuindo o tempo de duração dos efeitos estéticos. A imunogenicidade da toxina botulínica A é um tema relevante, pois a formação de anticorpos neutralizantes pode comprometer a resposta ao tratamento, especialmente em aplicações repetidas. Portanto, esta revisão reúne e analisa estudos que investigam o fator de imunogenicidade da toxina botulínica A, assim como os fatores que influenciam o desenvolvimento dessa resposta imune, tais como a dose administrada, a frequência da aplicação, e a forma de restituição do produto.
Palavras-chave: toxina botulínica, imunogenicidade, anticorpos, sistema imunológico, resistência.
1. INTRODUÇÃO
A toxina botulínica é uma neurotoxina produzida pela bactéria Clostridium Botulinum, que é gram-positiva, anaeróbia. Essa bactéria produz sete sorotipos de toxina (A,B,C,D,E,F e G), que são liberados quando a célula bacteriana se rompe (Benecke, 2012; Silva, 2009).
A toxina foi inicialmente aprovada em 1989 para o tratamento de condições como estrabismo, blefaroespasmo e espasmo hemifacial. Durante os tratamentos para blefaroespasmos, observou-se um efeito colateral interessante: a redução das linhas finas faciais (rugas), o que motivou estudos sobre sua aplicação estética (LACORDIA, JANUÁRIO e PEREIRA, 2011). Desde então, a toxina botulínica tipo A tornou-se um dos procedimentos estéticos não cirúrgicos mais procurados nos Estados Unidos e no Brasil. No Brasil, o uso para fins estéticos foi liberado em 1992 pelo Ministério da Saúde.
De acordo com Santos (2013), a toxina botulínica A foi pioneira em tratamentos minimamente invasivos para o envelhecimento, abrindo caminho para a era dos injetáveis Botox®, marca registrada e licenciada pelo laboratório Allergan, lidera o mercado e é a mais reconhecida e utilizada no Brasil (SPOSITO, 2023). Hoje, existem sete marcas de toxina botulínica liberada pela ANVISA (Agência Nacional de Vigilância Sanitária), sendo elas: Botox®, Dysport®, Xeomin®, Prosigne®, Botulift®, Botulim®, Nabota®. Eles são comercializados como uma substância cristalina, estável, liofilizada em albumina e apresenta frascos estéreis.
Considerando a relevância crescente da toxina botulínica tipo A no campo da estética, o estudo sobre a imunogenicidade da TBA, tem se tornado um tema de grande importância, especialmente em pacientes submetidos a aplicações repetidas. Sabe-se que a formação de anticorpos neutralizantes pode comprometer a eficácia do tratamento, tornando-o menos duradouro ou ineficaz. Assim é essencial compreender os fatores que influenciam essa resposta imune, como a dosagem, a frequência de aplicação e as particularidades de cada produto. Dentro deste contexto, este estudo procurou apresentar os mecanismos que afetam a imunogenicidade da toxina botulínica tipo A, fornecendo subsídios para a otimização dos protocolos estéticos e garantindo maior segurança e eficácia nos tratamentos.
2. DESENVOLVIMENTO
2.1. Metodologia
Este trabalho foi desenvolvido por meio de uma revisão bibliográfica e a análise de três casos clínicos, com o objetivo de investigar a imunogenicidade da toxina botulínica tipo A (TBA) e seus efeitos adversos em tratamentos estéticos. A pesquisa bibliográfica teve como base artigos científicos, livros, teses e dissertações publicados nos últimos anos, selecionados através de bases de dados reconhecidas, como PubMed, SciELO, LILACS e Medical Literature Analysis and Retrieval System Online. Foram utilizados descritores como “toxina botulínica”, “imunogenicidade”, “tratamentos estéticos”, “anticorpos neutralizantes” e “eficácia clínica”, “Immunity to botulinum toxin A”. A análise dos textos focou em identificar os fatores que influenciam a resposta imune ao TBA, como a dosagem administrada, a frequência de aplicação e as características dos produtos disponíveis no mercado.
Para garantir a relevância e atualidade dos dados, foram priorizados estudos que abordam a imunogenicidade da TBA, seus impactos clínicos e os avanços na prevenção e manejo da produção de anticorpos neutralizantes. Após a seleção dos estudos, os resultados foram organizados e detalhados, buscando padrões e divergências nos dados. Além da revisão da literatura, foram incluídos três casos clínicos, obtidos de fontes próprias, que ilustram a ocorrência de resposta imune à toxina botulínica tipo A em pacientes submetidos a tratamentos estéticos. Esses casos foram selecionados para apresentar resultados relevantes relacionados à imunogenicidade, como a perda da eficácia do tratamento após repetidas aplicações de TBA. Os casos clínicos foram descritos de forma detalhada, destacando-se as características do paciente, o histórico de aplicação da toxina e a evolução clínica.
A combinação da revisão bibliográfica com a análise de casos clínicos procurou evidenciar na prática os conceitos apresentados na literatura e fornecer uma visão abrangente dos fatores que influenciam a imunogenicidade do TBA. Essa metodologia permite tanto uma discussão teórica quanto uma análise prática dos efeitos adversos relacionados ao uso da toxina botulínica tipo A em tratamentos estéticos, contribuindo para o avanço do conhecimento e otimização das práticas clínicas.
2.1.1. Histórico
Em 1895, o bacteriologista belga Emile van Ermengem identificou o Clostridium botulinum em um presunto curado em casa, que estava ligado a um surto de botulismo.
Descobriu-se que a bactéria Clostridium botulinum causa intoxicação alimentar em humanos. Após uma série de estudos, foram identificadas e classificadas sete cepas de toxina botulínica, rotuladas de A, B, C, D, E, F e G (MONTECUCCO & MOLGÓ , 2005).
Dentre elas, quatro cepas, A, B, E e F são responsáveis por doenças em humanos. Durante a Segunda Guerra Mundial, o Dr. Edward J. Schantz e sua equipe foram contratados pelo Exército dos EUA para estudar a toxina botulínica A em potencial para aplicações militares. Em 1946, Schantz e seus colegas conseguiram purificar a toxina botulínica tipo A em uma forma cristalina (JANKOVIC, 2017)
Pouco depois dessa descoberta, em 1953, o fisiologista Dr. Vernon Brooks descobriu que a injeção de quantidades extremamente pequenas de toxina em um músculo hiperativo provocava um efeito relaxante temporário. Essa descoberta abriu caminho para o potencial médico da neurotoxina. (GART & GUTOWSKI, 2016; JANKOVIC, 2016).
Na década de 1960, o pesquisador Dr. Alan B. Scott começou a usar injeções de toxina botulínica tipo A em macacos, buscando um tratamento não cirúrgico para estrabismo. Ele demonstrou com sucesso que as propriedades relaxantes musculares dessa toxina poderiam ser eficazes no tratamento da condição (JANKOVIC, 2017).
Em 1989 a Agência Federal do Departamento de Saúde e Serviços Humanos dos Estados Unidos autorizou o uso da toxina botulínica sorotipo A, após anos de estudo em voluntários e logo foi aprovada em tratamento de estrabismo e blefaroespasmo associado à distonia. (JANKOVIC, 2017).
Em 1992 foi liberado pelo Ministério da Saúde o uso da toxina botulínica A para fins estéticos no Brasil. Hoje em dia, existem algumas marcas de toxina no mercado, sendo eles: Botox®, Dysport®, Xeomin®, Prosigne®, Botulift®, Botulim®, Nabota®, que possuem efeitos semelhantes, mas, são estruturas diferentes, em mecanismos de ação e eficácia (GART & GUTOWSKI, 2016; JANKOVIC, 2016).
2.1.2. Fatores de imunogenicidade
A imunogenicidade é a capacidade de uma substância estranha, como um antígeno, de provocar uma resposta imune no corpo de um ser humano. Desde o início, pesquisadores expressam preocupações de que o aumento da dosagem da toxina botulínica poderia elevar o risco de formação de anticorpos contra a toxina (SILVA, 2016). Por exemplo, JANKOVIC et al. (2003) relataram que 4 de 42 (9,5%) pacientes com distonia cervical tratados com uma dosagem alta da toxina, desenvolveram taxas de anticorpos. Em contraste, 119 pacientes fizeram o tratamento com a toxina botulínica com dosagem inferior e nenhum deles desenvolveu taxas de anticorpos. Os resultados indicam que a dosagem quando manipulada de forma exagerada é parcialmente responsável pela formação de anticorpos.
Foram encontrados 22 artigos na base de dados “Medical Literature Analysis and Retrieval System Online” (Sistema de Análise e Recuperação de Literatura Médica Online) com a busca pelo termo “Immunity to botulinum toxin A” (Imunidade à toxina botulínica A). No entanto, selecionamos 7 estudos que analisam a presença de anticorpos após a aplicação ou repetição da toxina botulínica A para o tratamento de linhas faciais, dentro dos selecionados, 3 apresentavam estudo de caso.
Relação de artigos selecionados que incluem estudo de caso:
- Fischer et al. (2020) relatou que um grupo de 140 pessoas recebeu pela primeira vez uma aplicação de 50 U de toxina botulínica A, obtendo ótimos resultados que se mantiveram eficazes até a 7ª semana após a aplicação. A partir desse ponto, começou a ocorrer uma redução na atividade da toxina, e após 14 semanas, a musculatura já apresentava função de contração normal. Esse grupo de pessoas apresentou ausência de anticorpos.
- Hilton S. et al. (2022) apresentou um grupo de 110 pessoas que também aplicaram uma dosagem de 50 U da toxina botulínica A pela primeira vez e adquiriram bons resultados que permaneceram até a 8ª semana após aplicação, que foi quando começou ocorrer redução da atividade da toxina. Na 16ª semana o músculo alvo já praticava sua atividade de contração normalmente. Não apresentaram formação de anticorpos.
- Joseph J. et al. (2021) acompanhou um grupo de 350 pessoas que fizeram quatro aplicações, sendo duas aplicações de 50U da toxina e duas aplicações com a dosagem de 100U com intervalos corretos entre elas. Na primeira aplicação os resultados permaneceram em média de 8 a 12 semanas, já na segunda a durabilidade foi de 8 a 16 semanas. Na terceira aplicação e quarta aplicação a durabilidade foi ainda melhor, sendo de 16 a 20 semanas.
De acordo com (Joseph J. et al. 2021), não houve formação de anticorpos neutralizantes. Isso demonstra que a toxina botulínica A, em concentrações conhecidas, induz uma baixa resposta imune nos tratamentos estéticos. Assim, pode ser considerada segura e bem tolerada, apresentando um perfil de segurança estável, inclusive em casos de aplicação repetida se respeitada o intervalo de tempo correto entre as aplicações.
2.1.3. Mecanismo de ação da toxina botulínica
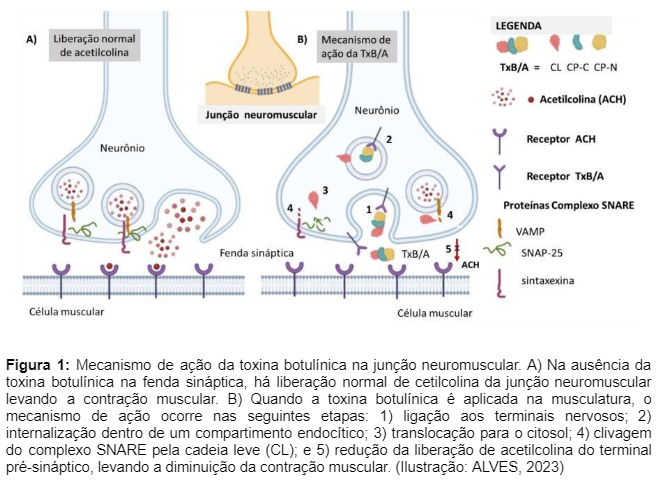
De acordo com a Revista do Centro Universitário FAI (2023), ocorre uma cascata fisiológica no corpo humano após a injeção da toxina botulínica, o que chamamos de mecanismo de ação, ou seja, como a toxina interage em nosso organismo. Basicamente, a toxina consegue paralisar a liberação pré-sináptica do neurotransmissor, a acetilcolina, na junção neuromuscular através de uma cascata de acontecimentos sendo eles:
- Injeção e distribuição: A toxina botulínica é injetada diretamente no músculo alvo.
- Entrada na célula nervosa: Após a injeção, a toxina se liga a receptores específicos na superfície das terminações nervosas.
- Inibição da liberação de acetilcolina: Dentro da célula nervosa, a toxina botulínica se liga a proteínas específicas da membrana das vesículas sinápticas (como SNAP25, Syntaxin e VAMP). Essa ligação impede que as vesículas contendo acetilcolina se fundam com a membrana celular.
- Bloqueio da transmissão neural: Sem a função das vesículas, a acetilcolina não é liberada na sinapse (junção neuromuscular). A falta de acetilcolina impede que o sinal nervoso chegue ao músculo. Dessa forma, sem acetilcolina, os receptores musculares não são ativados, resultando em uma redução ou bloqueio total da contração, levando a um relaxamento temporário do músculo.
Na figura 1, podemos observar o mecanismo de ação da toxina botulínica, onde ocorre a inibição de acetilcolina para paralisação temporária da musculatura.
2.1.4. Anticorpos e a toxina botulínica
De acordo com Delves (2024), o reconhecimento da toxina botulínica pelo sistema imunológico ocorre conforme descrito abaixo.
- Reconhecimento do Antígeno:Quando a toxina botulínica é injetada, as células do sistema imunológico, chamadas células apresentadoras de antígenos (APCs), identificam a toxina como uma substância estranha.
- Ativação do sistema imune: As APCs processam a toxina e a apresentam para os linfócitos T, que fazem parte da resposta imunológica adaptativa. Esses linfócitos T ativam os linfócitos B, que são responsáveis pela produção de anticorpos.
- Produção de anticorpos: Uma vez ativados, os linfócitos B começam a produzir anticorpos contra a toxina botulínica A. Existem dois tipos principais de anticorpos envolvidos no processo:
- Anticorpos não neutralizantes: eles podem se ligar à toxina, mas não bloqueiam seus efeitos estéticos.
- Anticorpos neutralizantes ou bloqueadores: eles ligam a parte ativa da toxina, impedindo que ela se conecte aos receptores neuromusculares e bloqueia a liberação e acetilcolina. Como resultado, a toxina perde sua capacidade de relaxar a musculatura, levando a ineficácia do tratamento.
2.1.5. Fatores que podem levar a resistência da toxina botulínica A
Segundo Witmanowsk e Błochowiak (2020), alguns fatores podem levar a formação de anticorpos pelo sistema imune como, altas dosagens da toxina, intervalos curto de aplicação e fatores genéticos essa resistência ao fármaco pode ser classificada em dois grupos:
- Resistência primária: Se dá em pacientes que no primeiro contato com a toxina já ocorre a falta de uma resposta clínica na primeira dose, é extremamente rara, é causada por fatores genéticos. Muitos estudos relataram que isso acontece possivelmente quando os pacientes possuem uma sensibilidade à TBA. Cerca de 4% da população brasileira é naturalmente resistente às neurotoxinas presentes na toxina botulínica.
- Resistência secundária: É a mais comum e ocorre nos pacientes que foram submetidos à aplicação da toxina diversas vezes, mas depois de algumas aplicações começam a perceber que os efeitos são menores ou nulos. Pode ser causada por altas dosagens da toxina ou por períodos curtos de intervalo. ALLERGAN, 2019 – A bula do Botox® por exemplo, apresenta que o prazo de intervalo entre as aplicações é de 3 meses.
3. Resultados e discussão
3.1. Estudo de caso
O estudo de caso ocorreu no estágio obrigatório externo da integrante do grupo Bárbara Pereira Pais, onde foram comparados os resultados de uma paciente com resistência a toxina botulínica A e outras duas pacientes que tiveram resultados efetivos com a aplicação da toxina.
Caso 1 – Adquiriu resistência secundária a toxina botulínica
A paciente do sexo feminino, 42 anos de idade, é educadora física e treina com intensidade todos os dias, ela já havia realizado a aplicação de toxina botulínica quatro vezes em intervalo entre 10 e 12 semanas entre elas, com outra profissional.
Procurou a Clínica Estética no dia 06/07/2024 para realizar o procedimento após 12 semanas da última aplicação e foi orientada para a realização do procedimento após 20 semanas da última aplicação. A paciente retornou para realizar o procedimento, no entanto, os resultados não foram o esperado devido alguns fatores ligados a aplicações passadas.
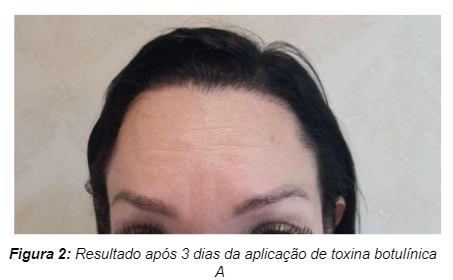
Na imagem 2 podemos observar o resultado após 3 dias da aplicação de toxina botulínica A com a finalidade de tratamento para linhas de expressão no terço superior do rosto.
Na figura 3 é possível verificar o resultado após 6 dias da aplicação de toxina botulínica A com a finalidade de tratamento para linhas de expressão no terço superior do rosto.

Caso 2 – Obteve resultado efetivo após contato com a toxina botulínica
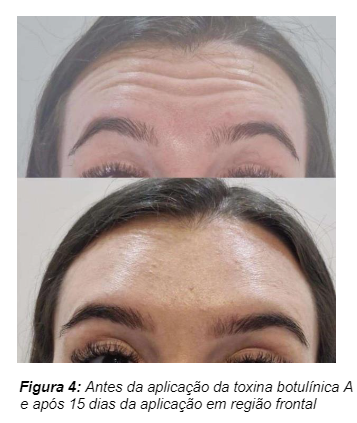
A Paciente do sexo feminino, 21 anos de idade, pratica atividade física intensa, realizou a primeira aplicação da toxina botulínica aos 19 anos, com perda do efeito da toxina após 4 meses. Com a última aplicação aos 21 anos e após 2 meses do procedimento não houve indícios de perda do efeito, relatou estar satisfeita com o resultado.
Figura 4 apresenta a comparação entre a musculatura antes do procedimento e 15 após o contato com a toxina botulínica.
Caso 3 – Obteve resultado efetivo após contato com a toxina botulínica
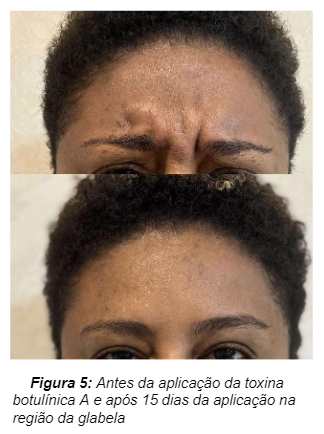
A Paciente do sexo feminino, 42 anos de idade, faz a aplicação da toxina botulínica aos 12 anos, sendo que nos primeiros 3 anos com intervalo de 12 meses entre as sessões, e nos últimos 9 anos reaplica com intervalo de 6 a 8 meses. Relatou que sua última aplicação da toxina começou a perder o efeito a partir do quinto mês e que em todas as aplicações obteve resultado satisfatório. Figura 5 apresenta a comparação entre a musculatura antes do procedimento e 15 após o contato com a toxina botulínica.
A toxina botulínica tipo A (TBA) é amplamente utilizada em tratamentos estéticos, principalmente para redução de rugas cutâneas, devido à sua capacidade de bloquear a liberação de acetilcolina nas sinapses neuromusculares, causando um relaxamento muscular temporário. No entanto, um dos desafios enfrentados em tratamentos repetidos com a toxina é o desenvolvimento de imunogenicidade, que ocorre quando o organismo do paciente identifica uma toxina como um antígeno, desencadeando a produção de anticorpos neutralizantes. Isto pode reduzir a eficácia clínica do tratamento e é um fator crucial na avaliação da resposta terapêutica dos pacientes (PICKETT, 2018).
No primeiro caso clínico investigado, o paciente desenvolveu imunogenicidade após múltiplas sessões de aplicação de TBA. Como resultado, o efeito esperado do tratamento foi insatisfatório, uma vez que a toxina não conseguiu inibir a contração muscular de forma adequada. Estudos mostram que a formação de anticorpos neutralizantes pode ocorrer devido à administração de doses elevadas ou intervalo de tempo inadequado, além do uso de produtos que contenham proteínas complexas associadas à toxina, o que aumenta a probabilidade do sistema imunológico sensível a uma substância como um invasor (FREVERT & DRESSLER, 2010). Isso justifica o fracasso terapêutico observado no paciente, que pode ter ocorrido devido a uma resposta imune neutralizando o efeito.
No segundo caso, a paciente não apresentou sinais de imunogenicidade, e o tratamento com TBA foi eficaz, resultando na melhora visível das linhas de expressão.
A ausência de imunogenicidade em pacientes como esta pode ser explicada pelo uso de doses terapêuticas adequadas e pela escolha de produtos com menor potencial imunogênico, como toxinas purificadas que contêm menos proteínas acessórias (CARRUTHERS & CARRUTHERS, 2007). Além disso, a individualidade imunológica do paciente, como a ausência de predisposições genéticas ou imunológicas para o desenvolvimento de anticorpos, pode ter contribuído para o sucesso do tratamento.
No terceiro caso, assim como no segundo, um paciente não desenvolveu imunogenicidade, e o tratamento com a toxina botulínica apresentou um efeito estético satisfatório. A manutenção da eficácia do tratamento ao longo do tempo sugere que fatores como a correta periodicidade das aplicações e o controle da dose são fundamentais para minimizar o risco de desenvolvimento de anticorpos (COTE et al., 2005). Estes casos reforçam a importância de uma avaliação clínica detalhada e de uma abordagem personalizada no uso de TBA, a fim de melhorar os resultados estéticos e reduzir o risco de imunogenicidade, garantindo a segurança e a eficácia do tratamento.
4. CONCLUSÃO
Dessa forma, concluímos com base nos estudos realizados que há comprovações concretas do poder da imunogenicidade nos resultados estéticos e de como ela interfere no resultado da aplicação toxina botulínica A. Existe o desenvolvimento de anticorpos que neutralizam o efeito da toxina, além disso, a concentração inadequada e o intervalo entre as aplicações aumentam as chances do desenvolvimento de anticorpos pelo sistema imunológico, interferindo diretamente no resultado dos pacientes.
É importante que os estudos continuem sendo realizados com a intenção de investigar os efeitos da toxina no sistema imunológico a longo prazo e avaliar o comportamento do sistema imune de pacientes que registraram maior concentração de anticorpos após um longo período sem o contato com a toxina botulínica A, a fim de observar se essas pessoas podem apresentar redução de anticorpos e se possuem chances de apresentarem resultados efetivos no futuro ou se a memória do sistema imune em contato com a toxina é duradoura.
5. REFERÊNCIAS BIBLIOGRÁFICAS
ALLERGAN. Produtos Farmacêuticos. Botox: bula para o profissional de saúde. 2019. Disponível em: https://allergan-web-cdnprod.azureedge.net/allerganbrazil/allerganbrazil/media/allerganbrazil/botox_bula_ profissional.pdf. Acesso em: 22 out 2024.
CARRUTHERS, JD, & CARRUTHERS, A. (2007). Um estudo prospectivo da longevidade do efeito da toxina botulínica tipo A em aplicações cosméticas. Journal of Cosmetic and Laser Therapy.
Cote, TR, Mohan, AK, Polder, JA, Walton, MK, & Braun, MM (2005). Injeções de toxina botulínica tipo A: eventos adversos relatados à US Food and Drug Administration em casos terapêuticos e cosméticos. Journal of the American Academy of Dermatology ,
DALPIAS, Thaís et al. MECANISMO DE AÇÃO DA TOXINA BOTULÍNICA TIPO A. Revista do Centro Universitário Fai, Itapiranga, v. 2, n. 1, p. 1-4, jan. 2023. Disponível em: https://revistas.uceff.edu.br/reviva/article/view/351/393. Acesso em: 23 out. 2024.
DELVES, Peter J.. Considerações gerais sobre o sistema imunológico. 2024.Disponível em: https://www.msdmanuals.com/pt/casa/doen%C3%A7as- imunol%C3%B3gicas/biologia-do-sistemaimunol%C3%B3gico/considera%C3%A7%C3%B5es-gerais-sobre-o-sistema- imunol%C3%B3gico?ruleredirectid=762. Acesso em: 22 out. 2024.
FERRÃO JÚNIOR, José Peixoto; FORNER, Wanessa. O uso da toxina botulínica como terapia adjuvante ao tratamento da cefaleia tensional em paciente portador de síndrome fibromiálgica: relato de caso. 2024. 1 f. Tese (Doutorado) – Curso de Odontologia, Harmonização Orofacial, Maringá, 2024.
FISCHER T., et al. Segurança, Tolerabilidade e Eficácia de Injeções de Dose Repetida de Incobotulinumtoxina no Tratamento de Linhas Faciais Superiores: Resultados de um Estudo Prospectivo. Journal of Drugs in Dermatology: JDD, v. 19, n. 5, pág. 461-469, 2020.
Frevert, J., & Dressler, D. (2010). Proteínas complexantes em drogas de toxina botulínica tipo A: uma ajuda ou um obstáculo? Biológicos , 38 Pickett, A. (2018). Produtos de toxina botulínica: quais são as diferenças? Journal of Drugs in Dermatology ,
GART, M.S. & GUTOWISKI, K.A. Overview of Botulinum Toxins for Aesthetic Uses. Clinics in Plastic Surgery. 2016, 43(3), pp. 459–471.
HILTON S., et al. Liquid AbobotulinumtoxinA: dados agrupados de dois estudos de fase III duplo-cegos, randomizados e controlados por placebo sobre o tratamento da linha glabelar. Cirurgia Dermatológica, pág. 10.1097, 2022.
JANKOVIC, J.; SCHWARTZ, K. Response and Immunoresistance to Botulinum Toxin Injections. Neurology. 1995, 45, 1743–1746.
JANKOVIC, J. Botulinum toxin: State of the art. Movement Disorders. 2017, 32(8), pp.1131–1138.
JANKOVIC, J.; VUONG, K.D. & AHSAN, J. Comparison of efficacy and immunogenicity of original versus current botulinum toxin in cervical dystonia. Neurology. 2003, 60(7), pp.1186–1188.
JOSEPH J., et al. AbobotulinumtoxinA para o tratamento de linhas glabelares moderadas a graves: um estudo randomizado, escalonado de dose, duplo-cego. Journal of Drugs in Dermatology: JDD, v. 20, n. 9, pág. 980-987, 2021.
Montecucco, C., & Molgó, J. (2005). Botulismo e tétano: armas neurotóxicas de destruição em massa. *Tendências em Ciências Bioquímicas*, 30(4), 164-172.
PRADO, Mônica Simon; ROCHA, Sara de Brito; ANDRADE, Luis Eduardo Coelho. Imunogenicidade dos fármacos imunobiológicos. Revista Paulista de Reumatologia, São Paulo, v. 15, n. 3, p. 1-1, set. 2016. Disponível em: https://www.reumatologiasp.com.br/artigos/imunogenicidade-dos-farmacos- imunobiologicos/. Acesso em: 23 out. 2024.
WITMANOWSKI, H.; BŁOCHOWIAK, K. The whole truth about botulinum toxin – a review. Postepy Dermatol Alergol. 2020.
