MULTIMODAL TREATMENT OF CANINE CUTANEOUS MASTOCYTOMA: RECONSTRUCTIVE SURGERY AND ADJUVANT CHEMOTHERAPY – CASE REPORT
REGISTRO DOI: 10.69849/revistaft/fa10202410141335
Quezia Silva Christ1,
Lucas Rosestolato2
RESUMO
A oncologia é considerada de grande importância na medicina veterinária, onde as neoplasias estão relacionadas como a primeira causa de morte de animais de companhia. O mastocitoma canino é um dos tumores de pele mais comum em cães e gatos, sendo considerada a segunda neoplasia maligna mais frequente em cães. Os sinais clínicos são variados e vão depender da localização e do avanço da doença. O diagnóstico é baseado na anamnese, histórico e evolução da lesão, realização de exames complementares como análises citopatológica e histopatológica. O principal método de tratamento em casos de mastocitoma canino é a excisão cirúrgica, outras abordagens terapêuticas estão relacionadas com controle local como eletroquimioterapia ou sistêmicos, como a quimioterapia. Sendo assim o objetivo deste trabalho foi relatar o tratamento cirúrgico para excisão de mastocitoma cutâneo grau II alto grau, associado a técnica reconstrutiva, seguido de quimioterapia para controle sistêmico. O tratamento multimodal se mostrou eficiente, onde a paciente teve uma recuperação satisfatória não demonstrando sinais de metástase até o final do tratamento.
Palavras-chave: cão;neoplasia; prednisona; retalho axial; vimblastina.
1 INTRODUÇÃO
A área oncológica na Medicina Veterinária é considerada de grande importância, onde as neoplasias estão relacionadas como a primeira causa de morte de animais de companhia. Atualmente, os tutores estão cada vez mais atentos às alterações que seus animais podem apresentar, sendo assim, procuram assistência veterinária rapidamente, o que leva ao diagnóstico precoce e contribui para o aumento da estimativa de vida (ROSSETTO et al., 2009).
O Mastocitoma canino é reconhecido como um dos tumores de pele mais comum em cães, sendo classificado como a segunda neoplasia maligna mais frequente em cães, depois dos tumores de glândula mamária (NARDI et al., 2022). O mastocitoma apresenta uma predisposição racial incluindo boxer, bull terrier, bulldog francês, golden, labrador, sharpei e dachshund. Até o momento, nenhuma predileção sexual foi considerada. Podendo se desenvolver em qualquer idade, mas é mais comum em cães adultos (SMIECH et al., 2018).
O diagnóstico é baseado na anamnese, histórico e evolução da lesão, realização de exames complementares como análises citopatológica e histopatológica (MASSERDOTTI, 2006).
Os métodos para diagnósticos podem ser por Aspiração por Agulha Fina, onde os mastócitos são facilmente esfoliados e identificáveis na amostra, mas este exame não fornecerá o grau tumoral; ou Biópsia Incisional, que é a coleta de um fragmento da massa, que fornecerá um resultado definitivo do grau para planejamento cirúrgico, a desvantagem é o risco de desgranulação local e também um custo mais elevado; ou a Biópsia Excisional, que é a remoção total da massa para avaliação, mas só é indicada para locais onde tem a possibilidade de ampla excisão cirurgia, para garantir margem livres. E uma vez definido o diagnóstico, o estadiamento deve ser realizado para identificar a natureza e a extensão da doença, e assim, definir o prognóstico do paciente (BLACKWOOD et al., 2012).
O principal método de tratamento em casos de mastocitoma canino é a excisão cirúrgica, sempre que possível, considerando as condições clínicas e estadiamento do paciente (OLIVEIRA et al., 2020).
Estudos recentes indicam diferentes abordagens terapêuticas relacionadas a fatores prognósticos específicos, principalmente estadiamento clínico e classificação histopatológica tumoral. Outras abordagens terapêuticas incluem, a eletroquimioterapia como terapia local, sendo eficaz e segura; a radioterapia, eficaz, mas ainda inacessível no Brasil; a quimioterapia é indicada como protocolo adjuvante e citorredutora; inibidores da tirosina quinase indicados em casos de resistência às outras terapias (NARDI et al., 2022).
Sendo assim, o objetivo deste trabalho foi relatar o caso de uma paciente canina diagnosticada com mastocitoma cutâneo e o tratamento instituído, que possibilitou a ressecção tumoral, associada à cirurgia reconstrutiva para fechamento do defeito cirúrgico por meio da técnica cirúrgica de exérese tumoral e aplicação de retalho axial de epigástrica superficial caudal esquerda e, após resultado histológico, a terapia quimioterápica.
2 RELATO DE CASO
Foi atendida na clínica veterinária uma paciente canina, sem raça definida, fêmea, castrada, com 6 anos de idade, pesando 25 quilos. Na anamnese, a tutora relatou 2 nódulos de crescimento rápido.
Ao exame clínico geral foram identificados 2 nódulos, não sendo observadas outras alterações clínicas. O primeiro nódulo estava localizado na face interna de membro pélvico direito, apresentando característica redonda, elevada, firme, aderido, medindo 3,5 centímetros, com linfadenomegalia de poplíteo direito, que estava bem próximo ao nódulo; o segundo nódulo em face interna de coxa de membro pélvico esquerdo, com característica redonda, elevada, eritematosa, pendular e não aderido, alopécico, ulcerado, medindo 1 centímetro. Na manipulação de ambos os nódulos surgiu eritema e pequenas pápulas, com demais parâmetros gerais sem alterações.
Figura 1: (A) nódulo em face interna de membro pélvico direito; (B) nódulo em face interna de coxa de membro pélvico esquerdo.
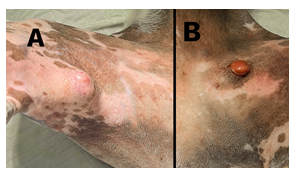
Fonte: arquivo pessoal, 2023.
A suspeita foi de neoplasia cutânea, sendo realizada a citologia aspirativa por agulha fina dos dois nódulos. Na citologia apresentou resultado sugestivo de mastocitoma cutâneo do primeiro nódulo, o segundo de resultado inconclusivo.
Diante do resultado, foram solicitados exames laboratoriais de rotina: hemograma, função renal, função hepática, radiografia torácica e ultrassonografia abdominal para estadiamento e planejamento cirúrgico.
Os exames laboratoriais estavam dentro dos parâmetros de normalidade, radiografia e ultrassonografia não evidenciaram metástase. Foi então programada a cirurgia para exérese tumoral, podendo ser necessário o emprego de técnica de reconstrução para fechamento do defeito cirúrgico do nódulo maior.
No dia da cirurgia, após preparo com jejum alimentar de 8 horas e hídrico de 2 horas, a paciente foi encaminhada para sala de preparo cirúrgico, onde iniciou-se o protocolo anestésico. As medicações pré-anestésica incluíram: antibiótico profilático – cefalotina via intravenosa; metadona, acepromazina, xilazina via intramuscular. Em seguida foi realizada a tricotomia ampla do abdômen, tórax ventral, membro pélvico direito até o calcâneo e de face interna da coxa de membro pélvico esquerdo, seguida de antissepsia prévia sucedida de clorexidina alcoólico 0,5% e a paciente foi encaminhada para sala cirúrgica.
Na sala cirúrgica a paciente foi induzida com fentanil e lidocaína por via intravenosa.. Após indução, foi intubada e mantida no oxigênio 100% com diluição de isofluorano, fluidoterapia e infusão contínua de fentanil e lidocaína. No trans-operatório, antes do início da cirurgia, foi administrada prometazina via intramuscular. A paciente foi posicionada na mesa cirúrgica em decúbito dorsal, com membro pélvico direito elevado fixado em um apoio, para melhor exposição e manipulação do nódulo maior.
Foi realizada a demarcação com caneta dermográfica de membro pélvico, com uma margem de 3 centímetros, e da cadeia mamária esquerda desde a terceira mama até a quinta mama, de onde seria confeccionado o retalho cirúrgico. O nódulo menor foi demarcado com margem de 2 centímetros.
Figura 2: paciente posicionada na mesa cirúrgica, demonstrando a demarcação com caneta dermográfica das margens cirúrgicas e do retalho de epigástrica superficial caudal esquerda.
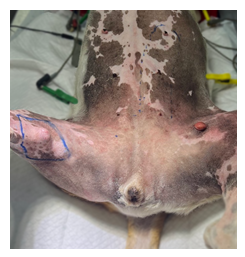
Fonte: arquivo pessoal, 2023
Com a cirurgiã responsável devidamente paramentada e a mesa cirúrgica organizada, realizada a antissepsia definitiva com iodo e álcool, e os panos de campo foram posicionados. Iniciou-se a cirurgia com a incisão de pele para ressecção tumoral de membro pélvico direito, em formato circular, seccionando pele e a primeira camada de fáscia muscular. Também foi realizada a linfadenectomia do linfonodo poplíteo direito, adjacente ao tumor.
Conforme o planejamento, não foi possível o fechamento primário da ferida, sendo assim, os materiais foram trocados para confecção do retalho. O retalho foi confeccionado por meio da incisão de pele e anexos da terceira até a quinta mama esquerda, todo tecido foi seccionado de forma delicada acima da aponeurose do músculo oblíquo abdominal externo. Ao final do retalho, na quinta mama, a pele não foi seccionada, para que a área doadora fosse mantida por um pedículo, onde emerge o ramo principal da epigástrica superficial caudal, responsável pela vascularização do retalho.
Em seguida, o retalho foi rotacionado em 90 graus e posicionado no defeito cirúrgico, sendo fixado com pinças backaus para seguir com a dermorrafia. Não foram empregados pontos de ancoragem a fim de evitar danos à vascularização do retalho. Diante disso, foi colocado um dreno de penrose e, em seguida, foi realizada a síntese de subcutâneo para aproximar as bordas com sutura simples separada, usando fio polidioxanona 2-0, em pontos cardeais. As pinças backaus foram soltas, e a sutura foi completada em toda a extensão do retalho. A dermorrafia foi realizada com sutura simples separado, utilizando fio nylon 3-0. Posteriormente foi realizado o fechamento do defeito cirúrgico do retalho, desta vez com pontos de ancoragem para reduzir espaço morto, e a síntese do subcutâneo foi feita com sutura simples contínua, utilizando fio polidioxanona 2-0. A dermorrafia foi concluída com sutura simples separada, com fio de nylon 3-0.
Figura 3: (A) após a excisão do nódulo de membro pélvico direito, sem possibilidade de fechamento primário; (B) confecção do retalho de epigástrica superficial caudal esquerda; (C) rotação 90 graus do retalho, posicionado ao defeito cirúrgico e fixado com pinças backaus.
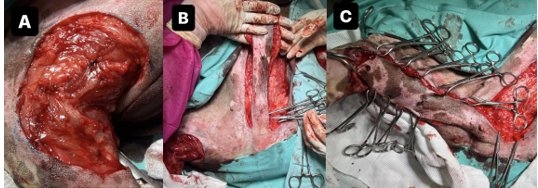
Fonte: arquivo pessoal, 2023.
O segundo nódulo foi removido com a incisão de pele em formato circular conforme as demarcações, seccionando pele e a primeira camada de fáscia muscular. Em seguida foi realizada divulsão dos tecidos para aproximação das bordas, sendo possível o fechamento primário. As bordas foram aproximadas com pontos de ancoragem, seguidos pela aproximação do subcutâneo, com padrão de sutura simples contínuo, utilizando fio polidioxanona 2-0, e a dermorrafia com padrão simples separado, utilizando fio de nylon 3-0. Foi realizada linfadenectomia de linfonodo inguinal esquerdo (regional) durante a confecção do retalho descrito anteriormente.
Figura 4: paciente após o resultado ao final da cirurgia.
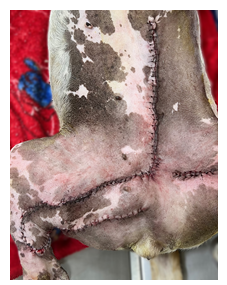
Fonte: arquivo pessoal, 2023.
Ao final do procedimento cirúrgico, foi realizado curativo nas feridas e colocada uma roupa cirúrgica. Em seguida, a paciente foi encaminhada à sala de recuperação e mantida sob observação.
A paciente teve um pós-operatório satisfatório e, após 24 horas de procedimento cirúrgico, recebeu alta médica com as medicações prescritas, uso de roupa cirúrgica durante 14 dias até retirada dos pontos, e orientação para limpeza e troca do curativo até retirada do dreno em 4 dias.
Os dois nódulos e linfonodos regionais foram enviados para análise histopatológica, onde foi confirmado o diagnóstico de mastocitoma cutâneo grau II (alto grau), com margens comprometidas de ambos os nódulos e metástase em linfonodo regional (poplíteo direito).
Após 4 dias de cirurgia a paciente retornou para retirada de dreno cirúrgico, apresentando uma boa recuperação, sem presença de líquido inflamatório, apenas com hematomas no abdome e membro pélvico direito. Quatorze dias após a cirurgia, foi realizado o retorno para retirada de pontos, e a paciente foi reavaliada, apresentando boa cicatrização e uma recuperação cirúrgica satisfatória, sem evidências de metástase local.
Figura 5: retorno da paciente, aqui já haviam sido retirados os pontos; estava com 20 dias de pós-cirúrgico, na sua primeira sessão de quimioterapia, apresentando boa cicatrização do retalho e sem evidências de complicações.
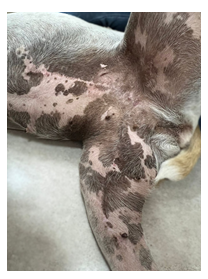
Fonte: arquivo pessoal, 2023.
Diante do resultado histopatológico, foi instituído tratamento quimioterápico de 8 sessões de vimblastina (2mg/m2) por via intravenosa, sendo 4 sessões semanalmente e 4 sessões quinzenais, associado a prednisona (2mg/kg) por via oral uma vez ao dia durante 1 semana, depois (1mg/kg) uma vez ao dia, durante 2 semanas e após (1mg/kg) em dias alternados por mais 1 semana. Antes de iniciar cada sessão de quimioterapia, foram realizados exames de sangue para avaliar o quadro geral da paciente.
Durante o tratamento com vimblastina associado a prednisona, a paciente apresentou efeitos colaterais brandos, como poliúria, polidipsia e polifagia pelo uso de corticoide, vômitos esporádicos e anemia discreta nas primeiras três sessões. Ao final do tratamento, na oitava e última sessão de quimioterapia, os parâmetros hematológicos se encontravam dentro da normalidade, paciente apresentava-se bem clinicamente e sem evidências de metástase. Sendo assim, o tratamento cirúrgico associado a quimioterapia pode ser considerado um sucesso, com resultados extremamente satisfatórios.
3 RESULTADOS E DISCUSSÕES
De acordo com Daleck e Nardi (2016) a maior ocorrência de mastocitoma cutâneo é em animais sem raça definida, mas também existe a predisposição racial para cães da raça boxer, bulldog, labrador, golden entre outros. Não há predisposição sexual, acometendo geralmente cães adultos entre 8 a 9 anos (ZAMBOM et al., 2015). Neste caso a paciente era sem raça definida, fêmea de 6 anos de idade.
De aparência clínica muito variada, o mastocitoma cutâneo tem duas apresentações, os dérmicos e os de tecido subcutâneo, sendo possível diferenciar apenas com o auxílio da análise histopatológica. (DALECK; NARDI, 2016). A paciente apresentava dois nódulos distintos, um apresentando característica dérmica, mais superficial e outro mais aderido, de característica dérmica com invasão do subcutâneo, no histopatológico foi confirmado que ambos eram de origem dérmica.
Os tumores podem ser delimitados, elevados, firmes, macios, com prurido e áreas eritematosas, com invasão de tecido subcutâneo e até ulcerações. Ou de apresentação irregular e elevada, com consistência suave, sem eritema e ulceração, podendo parecer microscópicamente com lipomas cutâneos (NARDI et al., 2022). Os dois nódulos presentes apresentavam características distintas, um era redondo, firme, elevado com invasão de tecido subcutâneo e aderido; o outro era redondo, elevado, pendular, não aderido, alopécico e ulcerado.
De acordo com Blackwood et al. (2012) o comportamento clínico do mastocitoma cutâneo sugestivo de agressividade são: crescimento rápido, inflamação local, infiltração local, ulceração, nódulos satélites, sinais paraneoplásicas. E aquelas nodulações que permanecem localizadas e presentes por períodos prolongados (meses ou anos), sem alterações significativas, tendem a ser benignas. Para Thamm e Vail (2007) pode ocorrer desenvolvimento de pequenos nódulos satélites em tecidos circunvizinhos. Neste caso havia quatro sinais sugestivos de malignidade, o crescimento rápido que se deu em dois meses, a presença de nódulo ulcerado, infiltração local em linfonodo regional e nódulo satélite.
Estudos já realizados confirmam que para o diagnóstico de mastocitoma a citologia é um dos métodos mais eficientes, sendo complementado pelo exame histopatológico para a graduação de malignidade (MASSERDOTTI, 2006). Por ser um exame rápido e de fácil execução, foi optado por realizar a citologia de punção por agulha fina, uma vez que a citologia pode ser eficiente na confirmação do diagnóstico, sendo assim em poucos dias foi possível planejar e realizar o procedimento cirúrgico. E após a exérese cirúrgica, enviado para análise histopatológica onde foi possível o estadiamento de grau e prognóstico.
O estadiamento é fundamental na determinação do prognóstico e da terapêutica do paciente, diante do alto potencial dos mastocitomas de desenvolver metástases. Para o estadiamento são necessários exames laboratoriais de rotina, exames de sangue e de imagem como, radiografia torácica e ultrassonografia abdominal, além de punções aspirativas de medula óssea e linfonodos. Visto que os sítios metastáticos do mastocitoma cutâneo são baço, fígado, linfonodos e medula óssea (NARDI; DALECK, 2016). Foram realizados exames de sangue, ultrassom abdominal e radiografia torácica e nenhuma evidência de metástase foi encontrada.
Os efeitos da desgranulação de mastócitos podem ser observados no exame físico, quando na palpação surge eritema, edema e formação de pápulas na região nodular, essa alteração é chamada de “sinal de Darier” (BLACKWOOD et al., 2012). Neste caso, no exame físico durante a manipulação dos nódulos surgiu eritema e pequenas pápulas, sugerindo o sinal de Darier positivo.
A escolha pelo tratamento mais adequado para esta neoplasia vai depender do estadiamento clínico, achados histopatológicos, imuno-histoquímicos e o prognóstico (NARDI et al., 2018). Para Blackwood et al., (2012) algumas abordagens de tratamento incluem a excisão cirúrgica, quimioterapia antineoplásica, eletroquimioterapia, os inibidores dos receptores tirosina quinase e a radioterapia. O tratamento de escolha para esta paciente foi da excisão cirúrgica, visando aplicação das margens de segurança e após o resultado do histopatológico, a quimioterapia sistêmica.
No tratamento cirúrgico estudos recentes mostram que para a maioria dos mastocitomas de grau I e II, uma margem lateral de 2 centímetros e uma margem profunda de um plano fascial é suficiente, a linfadenectomia associada é recomendada durante a intervenção cirúrgica inicial. Porém esta recomendação de margem não se enquadra para tumores maiores que 4 centímetros de diâmetro (SIMPSON et al., 2004; FULCHER et al., 2006). E de acordo com Blackwood et al. (2012) para tumores de grau III a recomendação é de uma margem lateral de pelo menos 3 centímetros, mais o plano fascial profundo. Porém o risco de recorrência local e metástase é alto, sendo assim é recomendado o tratamento multimodal. Sendo assim, o planejamento cirúrgico se deu visando uma margem de 3 centímetros do nódulo em membro pélvico direito, e do nódulo em membro pélvico esquerdo uma margem de 2 centímetros, mesmo ainda não sabendo o grau do mastocitoma, seguimos as recomendações de margem de acordo com seus tamanhos, e as margens ficaram comprometidas, acredita-se que pela sua classificação de alto grau, que só foi possível confirmar após análise histopatológica.
Existem várias técnicas atuais de reconstrução tecidual, permitindo que a neoplasia seja removida com a margem necessária, mesmo em locais onde seria difícil a oclusão primária do defeito cirúrgico, a cirurgia reconstrutiva permite seu fechamento evitando cicatrização por segunda intenção ou tensão na sutura (SLATER, 2007; FOSSUM 2021). Neste caso, o local onde encontrava-se o tumor não havia tecido para aproximação primária, sendo assim, o emprego de técnica reconstrutiva foi essencial para o fechamento do defeito cirúrgico, favorecendo para a ressecção com ampla margem cirúrgica.
O retalho de padrão axial é o mais utilizado, caracterizado pela presença de uma artéria e uma veia diretas em sua base, o que garante melhor perfusão sanguínea. Entre os retalhos de padrão axial, destaca-se o retalho da artéria epigástrica superficial caudal. Este retalho inclui as três últimas glândulas mamárias e é geralmente empregado para cobrir defeitos no abdômen caudal, flanco, prepúcio, períneo ou membros pélvicos (HUPPES et el., 2022). A técnica reconstrutiva de eleição para esta paciente foi o retalho axial de epigástrica superficial esquerda, devido a localização do tumor em membro pélvico direito, onde foi possível levar tecido suficiente para o leito da ferida, sem tensão na sutura, não havendo complicações pós-cirúrgica e apresentando bom resultado na cicatrização.
Independente da técnica utilizada para a exérese tumoral, é necessário evitar a manipulação excessiva da lesão, buscando evitar a estimulação da desgranulação dos mastócitos e seus consequentes efeitos adversos (FOSSUM, 2021). Em casos onde existe o risco de desgranular em resposta à manipulação cirúrgica, geralmente em massa tumoral volumosa, recomenda-se a administração trans-operatória de bloqueadores H1 e H2 para reduzir o risco de efeitos locais e sistêmicos. (GOVER, 2003; WEISSE; SHOFER; SORENMO, 2002). No trans-operatório foi administrado prometazina (bloqueador H1) via intramuscular, conforme recomendação e não foram constatados efeitos adversos devido a desgranulação de mastócitos.
Os sinais sistêmicos devido a desgranulação dos mastócitos são chamados de sinais paraneoplásicos, os mais comuns são as alterações gastrointestinais, a desgranulação de mastócitos leva a liberação de histamina, que estimula receptores gástricos, levando a supersecretação de ácido clorídrico e hipermotilidade gástrica, que ocasionam ulcerações gastrointestinais. E raramente, a liberação repentina e maciça de histamina de células neoplásicas podem causar reação anafilática aguda e episódios de colapso, ocorre geralmente em animais com a doença avançada e extensa (BLACKWOOD et al., 2012). Apesar da classificação de mastocitoma cutâneo de alto grau, a paciente não apresentou nenhum sinal grave da desgranulação de mastócitos e agravamento da doença, acredita-se que mesmo com essa classificação e também com as margens comprometidas após excisão cirúrgica, a intervenção ter sido precoce auxiliou para os resultados favoráveis.
Para abordagem das linfadenectomias é recomendado o mapeamento linfático por injeção de radionucleotídeos ou contrastes radiográficos, para auxiliar na localização do linfonodo sentinela, e posterior localização trans-cirúrgica com o uso de corantes fitais, como azul patente (FERRARI et al., 2020). Não foi utilizado nenhum método de mapeamento linfático para pesquisa de linfonodo sentinela, a linfadenectomia se deu somente dos nódulos regionais (poplíteo direito e inguinal esquerdo) que apresentavam consistência firme e linfadenomegalia discreta.
Para Patnaik et al., (1984) os critérios histológicos de mastocitoma cutâneo canino são baseados no grau de anaplasia celular, assim os tumores são classificados em: grau I (bem diferenciado), grau II (moderadamente diferenciado ou intermediário) e grau III (pouco diferenciado ou indiferenciado). Entretanto, na classificação de grau II, de grau intermediário, a avaliação torna-se subjetiva, resultando em variações de classificação entre os patologistas, devido a isso foi criada outra classificação, a de Kiupel. De acordo com Kiupel et al., (2011) os mastocitomas são divididos em duas classes: baixo grau e alto grau, os quais são baseados na frequência de mitose das células tumorais, núcleos múltiplos e bizarros e cariomegalia. As duas classificações histopatológicas são dependentes uma da outra, para cada grau de Patnaik, deve se esperar o grau de Kiupel. Por essa razão, os patologistas costumam utilizar ambas as classificações em seus laudos, até que se estabeleça qual delas oferece melhores resultados (CARVALHO et al., 2017; SABATINE et al., 2015). Para o laudo histopatológico da paciente, foram utilizadas ambas classificações, conforme descrito anteriormente: grau II na escala de Patnaik e alto grau na escala de Kiupel. Assim, proporcionando maior confiança no diagnóstico, definição do tratamento e o prognóstico da paciente.
Para Thamm (2013) o tratamento sistêmico é usado como adjuvante para o tratamento cirúrgico e é indicado em casos específicos, onde a doença apresenta um risco de morte intermediário a alto, particularmente em estágios avançados, mastocitoma de alto grau, com alta contagem mitótica. E de acordo com Taylor et al., (2009) a quimioterapia com ou sem outras modalidades de tratamento, também é indicada para doenças avançadas e/ou inoperáveis, seja devido às dimensões do tumor, ao número de lesões ou a presença de metástase, visando o controle paliativo, a estabilização da doença e a manutenção da qualidade de vida. Neste caso, após a excisão cirúrgica e análise histológica, foi confirmado mastocitoma cutâneo de alto grau, com metástase em linfonodo regional e margens comprometidas, sendo assim a paciente foi submetida ao tratamento quimioterápico adjuvante.
Em um estudo, 61 cães com mastocitoma de grau II ou III com alto risco de metástase foram tratados com prednisona e vimblastina (após excisão cirúrgica com ou sem radioterapia). Todos os pacientes estavam vivos 3 anos depois, com um intervalo livre de doença de 1305 dias (THAMM et al., 2006). Isso se compara favoravelmente com dados históricos sobre a sobrevida de pacientes com mastocitoma de grau III, tratados apenas com cirurgia, onde apenas 6-27% dos pacientes estavam vivos após 1 ano (BOSTOCK et al., 1989; PATNAIK, 1984). Até este presente relato, a paciente encontra-se saudável e sem indícios de recidiva ou metástase, apresentando 1 ano e 8 meses de sobrevida, onde o tratamento instituído foi da excisão cirúrgica associada a quimioterapia com vimblastina e prednisona.
4 CONCLUSÃO
Conforme apresentado neste estudo de caso, o tratamento multimodal do mastocitoma cutâneo canino classificação grau II – alto grau, envolvendo cirurgia reconstrutiva e quimioterapia adjuvante, mostrou-se eficaz no controle da neoplasia. A ressecção tumoral com margens adequadas, seguida pela aplicação do retalho de padrão axial, permitiu o fechamento eficiente da ferida cirúrgica, enquanto a quimioterapia adjuvante auxiliou no controle sistêmico da doença onde havia risco de metástase. A paciente teve uma recuperação satisfatória, sem sinais de complicações ou recidiva da doença até o término do tratamento, evidenciando o sucesso da abordagem terapêutica adotada.
REFERÊNCIAS
BOSTOCK, D. E.; CROCKER, J.; HARRIS, K.; SMITH, P. Nucleolar organiser regions as indicators of post-surgical prognosis in canine spontaneous mast cell tumours. British Journal of Cancer, v. 59, p. 915-918, 1989.
BLACKWOOD, L.; MURPHY, S.; BURACCO, P.; DE VOS, J. P.; DE FORNEL-THIBAUD, P.; HIRSCHBERGER, J.; KESSLER, M.; PASTOR, J.; PONCE, F.; SAVARY-BATAILLE, K. et al. European consensus document on mast cell tumours in dogs and cats. Veterinary and Comparative Oncology, v. 10, n. 3, p. e1–e29, set. 2012.
CARVALHO, A. P. M. et al. Comparação de duas classificações histopatológicas com o padrão de imuno-marcação para KIT, a avaliação da proliferação celular e com a presença de mutações no c-KIT de mastocitomas cutâneos caninos. Pesquisa Veterinária Brasileira, v. 37, n. 4, p. 359-367, abr. 2017.
DALECK, C. R.; DE NARDI, A. B. Oncologia em cães e gatos. Rio de Janeiro: Grupo Gen – Editora Roca Ltda, 2016. v. 2, p. 971-995.
DE NARDI, A. B. et al. Brazilian consensus for the diagnosis, treatment and prognosis of cutaneous mast cell tumors in dogs. Revista Investigação, v. 17, n. 1, p. 15, fev. 2018.
DE NARDI, A. B.; DOS SANTOS HORTA, R.; FONSECA-ALVES, C. E.; DE PAIVA, F. N.; LINHARES, L. C. M.; FIRMO, B. F.; RUIZ SUEIRO, F. A.; DE OLIVEIRA, K. D.; LOURENÇO, S. V.; DE FRANCISCO STREFEZZI, R. et al. Diagnosis, prognosis and treatment of canine cutaneous and subcutaneous mast cell tumors. Cells, v. 11, n. 4, p. 618, fev. 2022.
FOSSUM, T. W. Cirurgia de pequenos animais. 5. ed. Rio de Janeiro: Guanabara Koogan, p. 168-174, 2021.
FERRARI, R.; CHITI, L. E.; MANFREDI, M.; RAVASIO, G.; DE ZANI, D.; ZANI, D. D.; GIUDICE, C.; GAMBINI, M.; DVM, D. S. Biopsy of sentinel lymph nodes after injection of methylene blue and lymphoscintigraphic guidance in 30 dogs with mast cell tumors. Veterinary Surgery, v. 49, n. 6, p. 1099-1108, ago. 2020.
FULCHER, R. P.; LUDWIG, L. L.; BERGMAN, P. J.; NEWMAN, S. J.; SIMPSON, A. M.; PATNAIK, A. K. Evaluation of a two-centimeter lateral surgical margin for excision of grade I and grade II cutaneous mast cell tumors in dogs. Journal of the American Veterinary Medical Association, v. 228, n. 2, p. 210-215, jan. 2006.
GOVIER, S. M. Principles of treatment for mast cell tumors. Clinical Techniques in Small Animal Practice, v. 18, n. 2, p. 103–106, maio 2003.
HUPPES, R. R. et al. Cirurgia Reconstrutiva em Cães e Gatos. São Paulo: Medvet, 2022. 424 p.
KIUPEL, M.; WEBSTER, J. D.; BAILEY, K. L. et al. Proposal of a 2-tier histologic grading system for canine cutaneous mast cell tumors to more accurately predict biological behavior. Veterinary Pathology, v. 48, n. 1, p. 147-155, jan. 2011.
MASSERDOTTI, Carlo. Architectural patterns in cytology: correlation with histology. Veterinary Clinical Pathology, v. 35, n. 4, p. 388-396, dez. 2006.
OLIVEIRA, M. T.; CAMPOS, M.; LAMEGO, L.; MAGALHÃES, D.; MENEZES, R.; OLIVEIRA, R.; PATANITA, F.; FERREIRA, D. A. Canine and feline cutaneous mast cell tumor: a comprehensive review of treatments and outcomes. Topics in Companion Animal Medicine, v. 41, n. 100472, nov. 2020.
PATNAIK, A. K.; EHLER, W. J.; MACEWEN, E. G. Canine cutaneous mast cell tumor: morphologic grading and survival time in 83 dogs. Veterinary Pathology, v. 21, n. 5, p. 469-474, set. 1984.
ROSSETTO, V. J.; MORENO, K.; GROTTI, C. B.; DOS REIS, A. C.; BRACARENSE, A. P. Frequência de neoplasmas em cães diagnosticados por exame citológico: estudo retrospectivo em um hospital-escola. Semina: Ciências Agrárias, v. 30, n. 1, p. 189-200, jan./mar. 2009.
SIMPSON, A. M.; LUDWIG, L. L.; NEWMAN, S. J.; BERGMAN, P. J.; HOTTINGER, H. A.; PATNAIK, A. K. Evaluation of surgical margins required for complete excision of cutaneous mast cell tumors in dogs. Journal of the American Veterinary Medical Association, v. 224, n. 2, p. 236-240, jan. 2004.
SLATTER, D. Manual de cirurgia de pequenos animais. v. 1. 3
ŚMIECH, A.; ŚLASKA, B.; ŁOPUSZYŃSKI, W.; JASIK, A.; BOCHYŃSKA, D.; DĄBROWSKI, R. Epidemiological assessment of the risk of canine mast cell tumours based on the Kiupel two-grade malignancy classification. Acta Veterinaria Scandinavica, v. 60, n. 70, p. 1-9, fev. 2018.
SABATTINI, S.; SCARPA, F.; BERLATO, D.; BETTINI, G. Histologic grading of canine mast cell tumor: is 2 better than 3? Veterinary Pathology, v. 52, n. 1, p. 70-73, jan. 2015.
THAMM, D. H.; WITHROW, S. J.; DE LORIMIER, L. P.; FAN, T. M.; GARRETT, L. D.; KISSEBERTH, W. C. et al. Miscellaneous Tumors. In: WITHROW, S. J.; MACEWEN, E. G. Withrow and MacEwen’s Small Animal Clinical Oncology. Missouri: Elsevier, 2006. p. 785-823.
TAYLOR, F.; GEAR, R.; HOATHER, T.; DOBSON, J. Chlorambucil and prednisolone chemotherapy for dogs with inoperable mast cell tumours: 21 cases. Journal of Small Animal Practice, v. 50, n. 6, p. 284–289, jun. 2009.
THAMM, D.; VAIL, D. M. Mast cell tumors. In: WITHROW, S. J.; VAIL, D. M. Small Animal Clinical Oncology. 4. ed. Missouri: Saunders Elsevier, 2007. p. 402-424.
THAMM, D. H.; TUREK, M. M.; VAIL, D. M. Outcome and prognostic factors following adjuvant prednisone/vinblastine chemotherapy for high-risk canine mast cell tumour: 61 cases. The Journal of Veterinary Medical Science, v. 68, p. 581-587, 2006.
WILLMANN, M.; YUZBASIYAN-GURKAN, V.; MARCONATO, L.; DACASTO, M.; HADZIJUSUFOVIC, E.; HERMINE, O.; SADOVNIK, I.; GAMPERL, S.;
WEISSE, C.; SHOFER, F. S.; SORENMO, K. Recurrence rates and sites for grade II canine cutaneous mast cell tumors following complete surgical excision. Journal of the American Animal Hospital Association, v. 38, n. 1, p. 71-73, jan./fev. 2002.
ZAMBOM, D. A.; LUKARSEWSKI, R.; BECK, C.; DA ROSA FRAGA, D.; INKELMANN, M. A. Mastocitoma em cão – Relato de caso. Salão Do Conhecimento, v. 1, n. 1, ago. 2015.
1Discente do Curso de Pós-Graduação de Cirurgia de tecidos moles em Cães e Gatos na Associação Anclivepa SP e-mail: queziia@me.com
2Médico Veterinário Mestre em Anatomia dos animais domésticos e silvestres. e-mail: lucas.cirurgia@anclivepa-sp.com.br
