EVALUATION OF THE CULTIVATION OF THE MICROALGAE CHLORELLA VULGARIS IN DM AND BBM MEDIA RELATED TO THE PRODUCTIVITY OF BIOMASS AND REDUCING SUGARS.
REGISTRO DOI: 10.69849/revistaft/ch10202410141213
Kaique Eduardo Arcari Silva;
Orientador: Profa. Dra. Daniela Helena P. Guimarães
Resumo
A crescente busca por alternativas energéticas têm destacado as microalgas, especialmente a Chlorella vulgaris, devido ao seu elevado teor de carboidratos, que podem ser convertidos em fontes de energia, como o etanol, por meio de reações químicas. O desenvolvimento satisfatório dessa microalga depende de condições adequadas de cultivo, em que fósforo e nitrogênio influenciam diretamente a produtividade de biomassa. O objetivo deste trabalho é analisar empiricamente os efeitos nutritivos dos meios DM e BBM, com diferentes concentrações de nitrogênio (120 e 480 mg.L⁻¹) e fósforo (60 a 240 mg.L⁻¹), nas produtividades de biomassa seca e açúcares redutores. Os resultados mostraram que o meio BBM apresentou maior quantidade de açúcares redutores, enquanto o meio BG-11 teve melhor desempenho em termos de absorbância, indicando maior eficiência no crescimento celular. Essas observações sugerem que a escolha adequada do meio de cultivo pode otimizar a produção de biomassa e de açúcares, contribuindo para o desenvolvimento de alternativas energéticas baseadas em microalgas.
Palavras-chave: Microalgas. Chlorella vulgaris. Biomassa. Açúcares redutores. Cultivo.
1 INTRODUÇÃO
O aumento global do consumo de combustíveis fósseis tem gerado preocupações significativas devido aos impactos ambientais associados, desde a extração até o uso final desses recursos. Combustíveis fósseis, como o petróleo, são constituídos majoritariamente por hidrocarbonetos formados ao longo de milhões de anos sob condições específicas de temperatura e pressão (Silva et al., 2015). A exploração contínua desses recursos finitos não apenas contribui para o esgotamento de reservas naturais, como também agrava problemas ambientais, como a emissão de gases de efeito estufa, mudanças climáticas e poluição (Lucchesi, 2012). Diante dessa realidade, torna-se urgente a busca por fontes energéticas renováveis que possam minimizar esses impactos e atender à crescente demanda por energia.
Entre as alternativas promissoras para substituir os combustíveis fósseis, destaca-se a utilização de biocombustíveis, com destaque para o cultivo de microalgas, como a Chlorella vulgaris (Azeredo et al., 2012). As microalgas apresentam várias vantagens sobre os cultivos terrestres tradicionais, como a alta eficiência na produção de biomassa em ambientes controlados e a possibilidade de cultivo em áreas não aptas para a agricultura convencional. Além disso, essas microalgas têm a capacidade de converter luz solar em biomassa e açúcares redutores, que podem ser utilizados na produção de etanol, uma fonte de energia renovável com potencial para substituir parte do consumo de combustíveis fósseis (Azeredo et al., 2012).
No entanto, o desenvolvimento adequado das microalgas, especialmente em termos de produtividade de biomassa e de açúcares redutores, depende de condições ótimas de cultivo, nas quais nutrientes como fósforo e nitrogênio desempenham papeis cruciais. Estudos anteriores indicam que a variação nas concentrações desses nutrientes pode afetar diretamente a eficiência do crescimento e a produtividade das microalgas (Azeredo et al., 2012). Assim, há a necessidade de explorar de forma mais aprofundada os efeitos dessas variações, visando identificar as melhores condições para o cultivo da Chlorella vulgaris com o objetivo de maximizar a produção de biomassa e açúcares redutores.
O objetivo deste trabalho é analisar empiricamente os efeitos das concentrações de nitrogênio e fósforo em diferentes meios de cultivo sobre a produtividade de biomassa e açúcares redutores da Chlorella vulgaris. A pesquisa visa contribuir para o desenvolvimento de processos mais eficientes de produção de biocombustíveis a partir de microalgas, oferecendo alternativas mais sustentáveis ao uso de combustíveis fósseis. Dessa forma, os resultados obtidos poderão ser aplicados tanto no contexto industrial quanto no acadêmico, auxiliando na compreensão dos fatores que influenciam o crescimento e a produtividade dessa microalga, e na implementação de soluções energéticas mais sustentáveis.
2 FUNDAMENTAÇÃO TEÓRICA OU REVISÃO DA LITERATURA
Explora-se o potencial das microalgas, especificamente a Chlorella vulgaris, na produção de biocombustíveis, uma alternativa promissora aos combustíveis fósseis. Este tema surge diante da crescente demanda por fontes de energia renovável, aliada à urgência de mitigar os impactos ambientais causados pelo uso de combustíveis fósseis, como ressaltado por Silva et al. (2015). A literatura destaca as microalgas como uma opção viável, devido à sua alta capacidade de produção de biomassa, que pode ser convertida em açúcares redutores, usados para a produção de bioetanol (Azeredo et al., 2012).
O uso de Chlorella vulgaris é relevante principalmente por seu alto teor de carboidratos, variando entre 37% e 55% de sua biomassa seca, o que a torna especialmente atrativa para a produção de bioetanol, como descrito por Dragone et al. (2011), Guimarães et al. (2019) e Santana (2020). Estudos indicam que, para maximizar a produtividade, é essencial garantir condições adequadas de cultivo, especialmente no que se refere à disponibilidade de nitrogênio e fósforo, componentes essenciais para o crescimento das microalgas e a produção de biomassa (Trevisan, Branco & Arroyo, 2019).
Além disso, o processo fotossintético, fundamental para o crescimento das microalgas, é amplamente estudado na literatura. Chen et al. (2009) e Miranda, Passarinho e Gouveia (2012) descrevem as etapas claras e escuras da fotossíntese, que convertem a energia luminosa em energia química, culminando na produção de carboidratos. O uso de biorreatores, como o modelo Airlift, também é mencionado como uma solução eficiente para otimizar o cultivo de microalgas, facilitando a mistura de gases e líquidos e, assim, melhorando a produtividade (Chisti, 1989).
Portanto, a revisão da literatura aponta que a utilização de Chlorella vulgaris na produção de bioetanol é uma área promissora, mas que requer mais estudos para otimizar as condições de cultivo e aprimorar os processos tecnológicos envolvidos. A presente pesquisa busca contribuir para o entendimento desses fatores, analisando empiricamente o impacto das variações de nitrogênio e fósforo em meios de cultivo específicos, como DM e BBM (Watanabe, 1960; Lourenço, 2006), no aumento da produtividade de biomassa e açúcares redutores.
3 METODOLOGIA
3.1 Cultivo de Microalga
O projeto foi desenvolvido no Laboratório de Engenharia de Microalgas (LEM) da Escola de Engenharia de Lorena (EEL) – USP. A cepa de Chlorella vulgaris foi doada pelo Departamento de Oceanografia Biológica do Instituto Oceanográfico da USP e mantida em um cepário, controlado por um fotoperíodo e uma intensidade luminosa de 15 W. A cultura foi mantida em Erlenmeyer de 125 ml em meio BBM, repicada a cada 10 a 15 dias, na proporção de 10 ml de cultura antecessora para 90 ml de novo meio de cultivo.
As soluções de estoque, utilizadas para preparar o meio de cultivo, foram filtradas através de filtros de 0,22 μm. Os cultivos foram realizados em fotobiorreatores de coluna de bolhas com volume útil de 40 L, com aeração de 1,33 vvm e iluminação de 62 µmol.m⁻².s⁻¹, 24 horas por dia durante sete dias. O crescimento das microalgas foi monitorado por análise de absorbância em um espectrofotômetro (UV Vis, Bel Photonics), utilizando um comprimento de onda de 680 nm, conforme Zhao et al. (2015). 3.2 Preparo dos Meios de Cultivo
As concentrações de nitrogênio e fósforo nos meios de cultivo foram obtidas pela adição dos sais Ca(NO₃)₂·4H₂O, NaNO₃, K₂HPO₄ e KH₂PO₄ em diferentes proporções, conforme a Tabela 04.
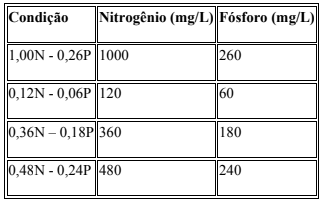
Fonte: TREVISAN; BRANCO; ARROYO (2019); WATANABE (1960).
3.3 Pré-Tratamento da Biomassa
Após o cultivo, o óleo da biomassa foi extraído por floculação, utilizando Sulfato de Alumínio a 0,15 mol.L⁻¹. A biomassa foi seca em liofilizador (LT1000, Terroni) e quantificada em relação ao teor de umidade (estufa a 105°C, A.O.A.C. método 96811) e lipídios (BLIGH; DYER, 1959). O óleo foi extraído das células quebradas por filtração à vácuo. A produtividade em biomassa seca (PBS) foi calculada pela equação (1):
PBS(mg⋅d−1⋅L−1)=massa total da biomassa(volume do reator)⋅Δt diaP_{BS} (mg \cdot d^{-1} \cdot L^{-1}) = \frac{massa \ total \ da \ biomassa}{(volume \ do \ reator) \cdot \Delta t \ dia}PBS (mg⋅d−1⋅L−1)=(volume do reator)⋅Δt diamassa total da biomassa.
A biomassa remanescente será analisada quanto ao teor proteico (A.O.A.C., 1980, 38012), cinzas (A.O.A.C., 1980) e carboidratos (diferença entre 100 e a soma das porcentagens de água, proteína, lipídios totais e cinzas).
3.4 Determinação da Produtividade em Açúcares Redutores
A quantidade de açúcares redutores será obtida pelo método do reagente 3,5-dinitrosalicílico (DNS) (MILLER, 1959). Neste método, os açúcares redutores reagem com o DNS, reduzindo sua coloração amarelada a um ácido de coloração avermelhada. A concentração óptica será determinada com um espectrofotômetro a 540 nm, utilizando uma curva de calibração.
3.4.1 Processo de Hidrólise
A sacarificação será realizada por hidrólise ácida com H₂SO₄ 2N. Uma solução 7% de H₂SO₄ será preparada, adicionando 16 mL à biomassa filtrada, que será autoclave a 121°C (1 atm) por 70 minutos e centrifugada a 6000 rpm por 5 minutos.
3.4.2 Reação com o DNS
A reação colorimétrica começará com a adição de 1 mL do sobrenadante e 3 mL do reagente DNS em tubos de ensaio. Os tubos serão aquecidos a 100°C por 5 minutos. Após resfriar, 16 mL de água destilada serão adicionados para medir a absorbância.
3.5 Análise dos Resultados
Os resultados dos experimentos serão analisados com softwares estatísticos para verificar os efeitos dos fatores sobre as variáveis de resposta.
4 RESULTADOS E DISCUSSÕES OU ANÁLISE DOS DADOS
Foram analisadas as seguintes concentrações no meio DM: Experimento 1 (Ca(NO3)2.4H2O (1g/L) – KH2PO4(0,26 g/L); Experimento 2 (Ca(NO3)2.4H2O (0,12g/L) – KH2PO4(0,6 g/L)); Experimento 3 (Ca(NO3)2.4H2O (0,36g/L) – KH2PO4(0,18 g/L)); Experimento 4 (Ca(NO3)2.4H2O (0,48g/L) – KH2PO4(0,24 g/L)). Contudo, nos meios BBM foram analisadas as seguintes concentrações: Experimento 1 (Ca(NO3)2.4H2O (0,75g/L) – K2HPO4(0,075 g/L)- KH2PO4 (0,175 g/L)); Experimento 2 (Ca(NO3)2.4H2O (0,12g/L) –
K2HPO4(0,6 g/L)); Experimento 3 (Ca(NO3)2.4H2O (0,36g/L) – K2HPO4(0,18 g/L)); Experimento 4 (Ca(NO3)2.4H2O (0,48g/L) – KH2PO4(0,24 g/L)).. Ademais, vale ressaltar que todos os cultivos foram deixados quinze dias seguidos antes de serem recolhidos.
1 Meio de Cultivo DM
Experimento 1
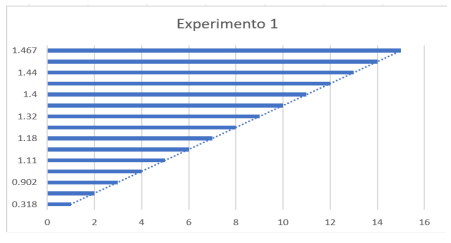
Gráfico referente ao Experimento 1

Tabela – Experimento 1
Experimento 2
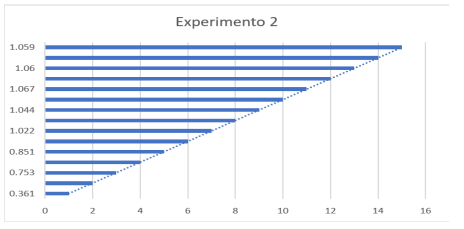
Gráfico referente ao Experimento 2

Tabela – Experimento 2
Experimento 3
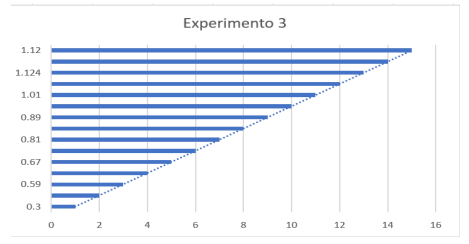
Gráfico referente ao Experimento 3

Tabela – Experimento 3
Experimento 4
Gráfico referente ao Experimento 4

Tabela – Experimento 4
2 Meio de Cultivo BBM
Experimento 1
Gráfico referente ao Experimento 1

Tabela – Experimento 1
Experimento 2
Gráfico referente ao Experimento 2

Tabela – Experimento 2
Experimento 3
Gráfico referente ao Experimento 3

Tabela – Experimento 3
Experimento 4
Gráfico referente ao Experimento 4

Tabela – Experimento 4
De modo geral, em relação ao metabolismo de lipídios sob considerável estresse ambiental, como a deficiência de nitrogênio, alguns estudos afirmam que o carbono fixado é alocado em compostos altamente energéticos, resultando em uma competição entre a síntese de carboidratos e lipídios (Siaut, Cuine et al., 2011). Além disso, a deficiência de nitrogênio leva a uma diminuição no conteúdo proteico, enquanto há um aumento em compostos ricos em energia, como lipídios e carboidratos (Barbosa, 2012).
No experimento 1, observa-se que a alta quantidade de nitrogênio fornecida como nutriente para as algas ocasiona uma perda na produção de biomassa, devido à competição entre os nu trientes, como descrito anteriormente. O fósforo, por sua vez, é utilizado na formação de ácidos nucleicos, membranas lipídicas e moléculas de ATP nas células (Peccia et al., 2013), de modo que mesmo em condições de baixa concentração de nitrogênio, o fósforo se torna um limitante para a produção de biomassa.
Conforme os experimentos 3 e 4, ao aumentar a concentração de nitrogênio, também se observa um aumento na concentração de fósforo no meio de cultivo, resultando em uma equivalência na produção de biomassa e facilitando a replicação das microalgas.
A análise dos dados apresenta disparidades, uma vez que a relação entre o peso e os valores calculados pelo método DNS não se mostra proporcional. Em alguns casos, amostras com pesos semelhantes obtiveram resultados distintos no DNS, dificultando a previsão do rendimento das amostras. A qualidade do que é fornecido pela microalga depende das condições de cultivo, resultando em variações únicas e diferenciadas de acordo com o tratamento aplicado.
Além disso, a determinação da concentração de açúcares redutores em todos os cultivos reve lou-se inviável, dada a extensa demanda dos cultivos, que requerem no mínimo 15 dias no reator, sem considerar o tempo necessário para a replicação das microalgas e seu crescimento até o ponto adequado para análise. Devido ao grande número de experimentos realizados, a caracterização de todas as espécies cultivadas não foi possível, podendo ser objeto de futuras investigações.
Quando se compara a curva de crescimento de todos os meios, é evidente que houve variação nos índices de crescimento, que influenciam as considerações sobre a eficiência dos meios de cultivo. No entanto, para as espécies analisadas neste estudo, observou-se um baixo índice de açúcares redutores, o que pode ser considerado inviável para a produção de biodiesel, mas popotencialmente atrativo para outras finalidades, como a extração de bio pigmentos.
5 CONCLUSÃO/CONSIDERAÇÕES FINAIS
Ambos os meios analisados demonstram elevado potencial para o cultivo de microalgas. No entanto, o desenvolvimento dos experimentos no meio DM foi prejudicado pela fragilidade do laboratório, resultando em contaminação e subsequente mortalidade de alguns cultivos. Os dados indicam que, apesar dessas adversidades, o crescimento em biomassa no meio DM, após 15 dias de cultivo, foi satisfatório, corroborando a viabilidade deste meio.
O meio BBM, por sua vez, apresentou absorbância superior ao meio DM nos experimentos iniciais, com características morfológicas indicativas de saúde, como uma coloração mais intensa e esverdeada. Isso sugere que o meio BBM pode ser uma alternativa promissora para otimização do cultivo de microalgas.
As análises evidenciam que os objetivos da pesquisa foram parcialmente atingidos. As hipóteses sobre a viabilidade dos meios para cultivo foram corroboradas, com ênfase nas condições que favorecem a produção de biomassa. As principais contribuições do estudo incluem a identificação de fatores que influenciam a eficiência do cultivo e a apresentação de resultados que podem orientar futuras pesquisas.
As limitações do estudo incluem a contaminação observada nos cultivos do meio DM, que pode comprometer a reprodutibilidade dos resultados. Recomenda-se a implementação de práticas rigorosas de controle ambiental e de esterilização em estudos futuros para mitigar esses problemas. Além disso, o questionamento inicial sobre a eficácia dos meios cultivados foi esclarecido, indicando que ambos os meios têm potencial para produção de biomassa, com o meio BBM apresentando-se como uma opção mais promissora. .
REFERÊNCIAS
1. ALAM, F. et al. Biofuel from Algae- Is It a Viable Alternative? Procedia Engineering, v. 49, p. 221–227, 2012.
2. ANDRADE, D. S.; COLOZZI FILHO, A. Microalgas de águas continentais: Potencialidades e desafios do cultivo. [s.l: s.n.]. v. 1
3. BLIGH, E. G.; DYER, W. J. A RAPID METHOD OF TOTAL LIPID EXTRACTION AND PURIFICATION. Canadian Journal of Biochemistry and Physiology, v. 37, n. 8, p. 911–917, 1 ago. 1959.
4. CHENG, J. J.; TIMILSINA, G. R. Status and barriers of advanced biofuel technologies: A review. Renewable Energy, v. 36, n. 12, p. 3541–3549, dez. 2011.
5. CORONADO-REYES, J. A. et al. Chlorella vulgaris, a microalgae important to be used in Biotechnology: a review. Food Science and Technology, v. 42, 2022.
6. DOS SANTOS, W. R. et al. Semi-continuous Cultivation of Chlorella minutissima in Landfill Leachate: Effect of Process Variables on Biomass Composition. Waste and Biomass Valorization, v. 13, n. 3, p. 1627–1638, 26 mar. 2022.
7. DRAGONE, G. et al. Nutrient limitation as a strategy for increasing starch accumulation in microalgae. Applied Energy, v. 88, n. 10, p. 3331–3335, out. 2011.
8. GUIMARÃES, D. H. P. et al. Viability of the Uses of Effluent for Cultivation of Chlorella vulgaris in Order to Integrate the Generation of Biofuels with the Treatment of Water. [s.l.] Springer International Publishing, 2019. v. 140
9. JACINAVICIUS FERNANDA, JÚNIOR WATSON, AZEVEDO MARIA E SANT’ANNA CÉLIA ; MANUAL PARA CULTIVO DE CIANOBACTÉRIAS: (file:///C:/Users/kaiqu/Downloads/virtuais_4cianobact%C3%A9rias.pdf) 10. LOURENÇO, S. O. Cultivo de microalgas marinhas. São Carlos: RiMa. 2006
11. MILANO, J. et al. Microalgae biofuels as an alternative to fossil fuel for power generation. Renewable and Sustainable Energy Reviews, v. 58, p. 180– 197, maio 2016.
12. MILLER, G. L. Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar. Analytical Chemistry, v. 31, n. 3, p. 426–428, 1 mar. 1959.
13. PATIL, V.; TRAN, K.-Q.; GISELRØD, H. R. Towards Sustainable Production of Biofuels from Microalgae. International Journal of Molecular Sciences, v. 9, n.
14, p. 1188–1195, 9 jul. 2008. 13. PAULINO, R. et al. SÉCULO XXI o mundo em convulsão. [s.l: s.n.]. 16
15. Salles de Azeredo, Vinicius Barboza. PRODUÇÃO DE BIODIESEL A PARTIR DO CULTIVO DE MICROALGAS: ESTIMATIVA DE CUSTOS E PERSPECTIVAS PARA O BRASIL;
16. SANTANA, H. Potencial biotecnológico de microalgas verdes (Chlorophyta) cultiváveis em sistemas a base de vinhaça e gás carbônico. 2020.
17. SIQUEIRA, S. F. et al. THIRD GENERATION BIODIESEL PRODUCTION FROM MICROALGAE Phormidium autumnale. Brazilian Journal of Chemical Engineering, v. 33, n. 3, p. 427–433, set. 2016.
18 SIRAJUNNISA, A. R.; SURENDHIRAN, D. Algae – A quintessential and positive resource of bioethanol production: A comprehensive review. Renewable and Sustainable Energy Reviews, v. 66, p. 248–267, dez. 2016.
19. TREVISAN, E.; BRANCO, K. B. Z. F.; ARROYO, P. A. Avaliação termogravimétrica da biomassa de Chlorella vulgaris cultivada em diferentes condições nutricionais Thermogravimetric evaluation of the biomass of Chlorella vulgaris cultivated in different nutritional conditions. Engevista, p. 242–255, 2019.
20. WATANABE, A. List of algal strains in collection at the institute of applied microbiology. The Journal of General and Applied Microbiology, v.6, n.4, p. 283- 292. Tokyo, 1960.
21. ZHAO, B.; SU, Y.; ZHANG, Y.; CUI, G. Carbon dioxide fixation and biomass production from combustion flue gas using energy microalgae. Energy, v. 89, p. 347-357, 2015
