USE OF PLANT EXTRACTS TO ASSESS ALLELOPATHIC ACTIVITY
REGISTRO DOI: 10.69849/revistaft/th10249261514
Maria Eduarda Seixas Dourado 1
Welerson Souza Silva1
Lucas Barbosa dos Santos 2
Torquato Martins de Andrade Neto 3
Tarso Moreno Alves de Souza 3
Edeilton Borges dos Santos 4
Matheus Sousa do Nascimento 1
Cassio Oliveira dos Santos 1
Maria da Conceição Araújo Correia 5
Resumo
A alelopatia é o processo pelo qual algumas espécies vegetais liberam compostos químicos ao ambiente, afetando o desenvolvimento de outras. Esse fenômeno está diretamente relacionado com a capacidade competitiva entre plantas, por recursos como água, nutrientes e luz. Nesse sentido, o objetivo do presente trabalho é avaliar os efeitos alelopáticos do extrato etanólico de espécies vegetais sobre a germinação e crescimento inicial de alface. Para produção dos extratos etanólicos, foram coletados e triturados 1kg de folhas e ramos de Ruta graveolens L. e Plectranthus barbatus A., imersos em 10L de etanol 99%. Transcorrido 48h, foi realizada a filtragem do material para separação das fases liquidas e solidas. Descartando-se a parte solida, foi feita a evaporação do solvente da solução, resultando em 100g do extrato. Os ensaios seguiram um delineamento em blocos casualizados com seis tratamentos e quatro repetições, para cada espécie vegetal. Foram testadas concentrações de 500, 2000, 3500 e 5000 mg/L, adotando água destilada como testemunha. Foram semeadas 50 sementes de alface desinfestadas em solução de hipoclorito de sódio a 2%. No experimento foram obtidos resultados satisfatórios que variaram a depender do extrato utilizado, mas que cada um demostrou resultados positivos em algum fator determinante, seja ele, por tamanho do hipocótilo e radícula ou velocidade de germinação ou maior porcentagem de plantas germinadas ao fim do experimento, gerando assim resultados que mostraram como cada uma interferiu no desenvolvimento inicial da alface.
Palavras-chave: Alelopatia; Lactuca sativa L.; Plantas Daninha; Metabólitos secundários.
1. INTRODUÇÃO
O termo alelopatia surgiu em 1937, caracterizado pelo botânico austríaco Hans Molish, tendo sua origem descrita do grego alellon (mútuo) e páthos (prejuízo). A literatura aponta inúmeros relatos do efeito alelopático de plantas ao longo do tempo, destacando-se o relato de Theophrastus (300 a.C), no qual observou que o grão de bico além da exaurir o solo possuía a capacidade de eliminar plantas invasoras próximas ao seu local de cultivo. O mesmo foi constatado por Culpeper, demonstrando a incompatibilidade entre plantas de manjericão e arruda, em que uma espécie prejudicava o desenvolvimento da outra (Filho, 2023).
A interação entre diferentes espécies vegetais através da liberação de substâncias químicas bioativas pode influenciar significativamente a dinâmica e a composição das comunidades vegetais em diversos ambientes (Lindamir Hernandez, 2023). O processo denominado de alelopatia ocorre quando substâncias fitotóxicas são liberadas por lixiviação, volatilização, exsudação das raízes e a decomposição de resíduos de algum tipo de planta, afetando a germinação das sementes e o crescimento de plantas vizinhas (Vasconselos, 2012).
A demonstração dos seus efeitos tem sido realizada a partir de pesquisas utilizando extratos obtidos a partir dos órgãos de determinadas espécies vegetais, aplicados diretamente sobre espécies de interesse agrícola por aplicações foliares ou nas sementes. Inúmeras são as técnicas para fazer a extração dos aleloquímicos, geralmente estas substâncias são extraídas de partes vegetais trituradas e misturadas com água, etanol ou outros solventes que extrair do interior celular essas substâncias (Pires; Oliveira, 2011).
A alelopatia é a capacidade que algumas espécies possuem de liberar substâncias químicas que afetam o crescimento de outras plantas. A cultura da alface apresenta alta sensibilidade a estes compostos, que por sua vez podem inibir o seu crescimento, prejudicando seu desenvolvimento resultando em menor rendimento produtivo (Moura; Rodrigues, 2011).
De acordo com Furini et al. (2020), ao analisarem o efeito alelopático de erva-de-santa-maria sobre a alface, notaram que com o aumento da concentração do extrato da espécie daninha, menores foram as respostas da alface para os parâmetros porcentagem de germinação, causando uma redução de aproximadamente 82% a germinação das sementes. Resultados semelhantes foram encontrados por Bitencourt et al. (2021), que observaram uma relação entre o aumento da concentração de extrato de aroeira-vermelha com a redução no potencial de germinação da alface.
O presente trabalho objetiva-se avaliar os efeitos do extrato etanólico de espécies vegetais sobre a germinação e o crescimento inicial da alface. Para isso, foram realizados experimentos em laboratório com diferentes concentrações do extrato, a fim de verificar se há a sensibilidade da cultura da alface em relação aos compostos produzidos pelas espécies testadas. Com base nos resultados obtidos, espera-se contribuir para o aumento no conhecimento e informações em torno da alelopatia, possibilitando o uso de plantas daninhas e medicinais como matéria prima para o desenvolvimento de novos produtos capazes de melhorar o manejo do campo de culturas de interesse agrícola.
2. METODOLOGIA
2.1. CONDUÇÃO DO EXPERIMENTO
A pesquisa foi realizada na Faculdade Irecê (FAI), localizada na cidade de Irecê, Bahia. O laboratório onde o trabalho foi acompanhado dispunha dos materiais necessários para o desenvolvimento da pesquisa de forma satisfatória, possibilitando a obtenção de resultados sólidos e conclusivos.
O material vegetal utilizado para produção dos extratos etanólicos foram 1kg de folhas e ramos de arruda (R. graveolens L.) e 1kg de folhas e ramos de boldo (P. barbatus Andrews.), que foram coletados, triturados e imersos em 10L de etanol 99,0%. Após 48h foi realizada a filtragem, separando o material em duas fases (liquida e sólida) descartando-se os materiais sólidos, a solução resultante foi colocada em um ebulidor elétrico a uma temperatura de 90 ºC para total evaporação do solvente, obtendo ao final do processo 100g, respectivamente, de extratos etanólicos brutos de consistência liquida, das espécies anteriormente mencionadas. Em seguida foi realizado o preparo das concentrações do extrato em 500, 2000, 3500 e 5000 mg/L, sendo a maior concentração obtida por pesagem e as demais por diluição. Como controle utilizou-se água (testemunha absoluta) e etanol 99,0% (testemunha solubilizante).
Nos bioensaios foram utilizou-se como espécie alvo a alface (Lactuca Sativa L.). As sementes foram desinfestadas por meio de imersão em solução de hipoclorito de sódio 2%, por 2 minutos, enxaguadas com água destilada e secas em papel filtro.
Em placas de Petri (9cm de diâmetro), previamente autoclavadas, colocou-se discos de papel filtro que foram impregnados com 2,5mL das concentrações obtidas do extrato etanólico.
Após evaporação do solvente, adicionou-se 2,5mL de água destilada. Em seguida, 50 sementes de alface foram distribuídas em cada placa, que serão mantidas em ambiente climatizado com temperatura controlada (25ºC) e fotoperíodo constante.
Os discos de papel filtro foram mantidos úmidos e, quando necessário, adicionou-se água destilada. Procedimento similar foi realizado com a testemunha absoluta e testemunha solubilizante, na ausência do extrato. O experimento seguiu um delineamento em blocos casualizados, com 6 tratamentos e 4 repetições, para cada espécie vegetal.
Nos bioensaios foram analisados os parâmetros: porcentagem de germinação, índice de velocidade de germinação (IVG) e comprimento de hipocótilo e radícula.
Para avaliar o percentual de germinação, a contagem das sementes será realizada diariamente, constatada a partir da protusão radicular de 2mm. O IVG será calculado por meio da seguinte fórmula pré-estabelecida:
IVG = G1/N1 + G2/N2 + …+ GN/NN, em que:
G1, G2 e Gn representam o número de sementes normais germinadas até o enésimo dia e, N1, N2 e Nn representam o número de dias em que se avaliarão as germinações.
Para o parâmetro de crescimento inicial, utilizou-se as medidas da radícula e do hipocótilo de 15 plântulas por placa, sendo feitas três dias após a germinação, utilizando-se papel milimetrado. O experimento foi considerado concluído após três dias consecutivos sem germinação.
O experimento foi realizado utilizando-se delineamento em blocos casualizados, com 4 repetições, sendo a unidade experimental para os bioensaios de germinação e crescimento composta de 50 sementes e 15 plântulas de alface, respectivamente.
A análise estatística foi realizada com o programa computacional sistema para análise de variância SISVAR (Ferreira, 2000) e as médias dos tratamentos comparadas pelo teste de Tukey à 5% de probabilidade.
RESULTADOS E DISCUSSÕES OU ANÁLISE DOS DADOS
6.1.1 VARIAVEIS
ARRUDA (Ruta graveolens)
No tratamento com concentrações de extrato de arruda observou-se que as plântulas submetidas as concentrações de 350 e 500mg/L apresentaram os menores valores médios para a variável comprimento de hipocótilo, com cerca de 13,50mm.
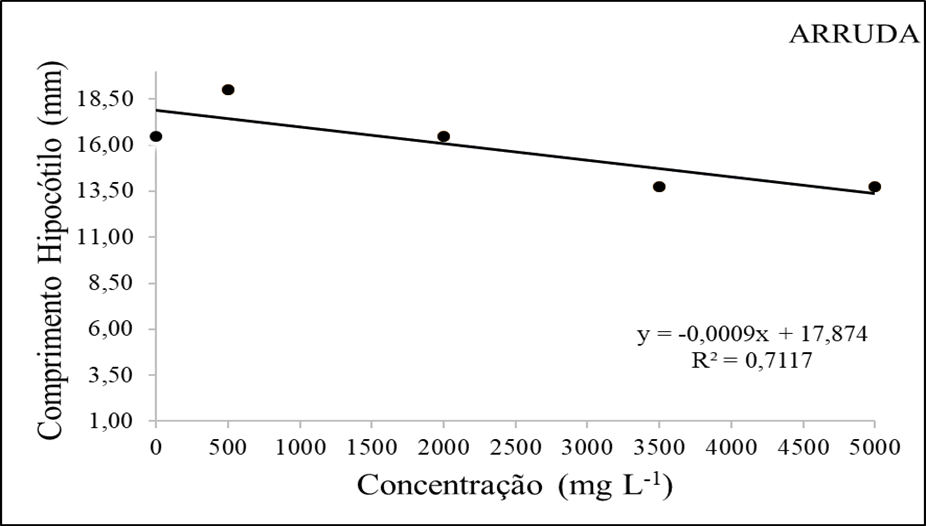
Figura 1 – Comprimento de hipocótilo (mm) em função da interação das doses do extrato etanolico de Arruda.
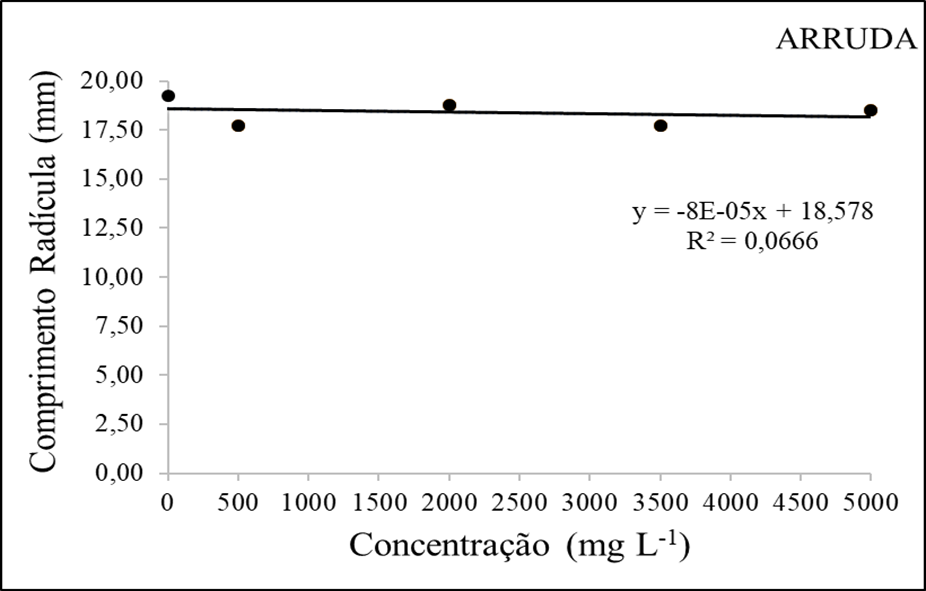
Figura 2 – Comprimento da radícula (mm) em função da interação das doses do extrato etanolico de Arruda.
Em relação ao comprimento da radícula, foi observado que as doses obtiveram resultados de variações médias. A testemunha atingiu o melhor resultado com 19,25mm, mas em relação aos tratamentos com o extrato da arruda, a dosagem de 2000mg/L mostrou-se mais eficaz (18,75mm).
Os quatros tratamentos não tiveram um impacto significativo no comprimento da radícula, ao contrário do que foi citado por Zobel & Brown (1991) avaliando folhas frescas e secas de arruda, descobriram que estes apresentam componentes ingredientes ativos tóxicos para o crescimento e desenvolvimento radicular da alface (furanocumarinas, xantocianinas, bergapten).
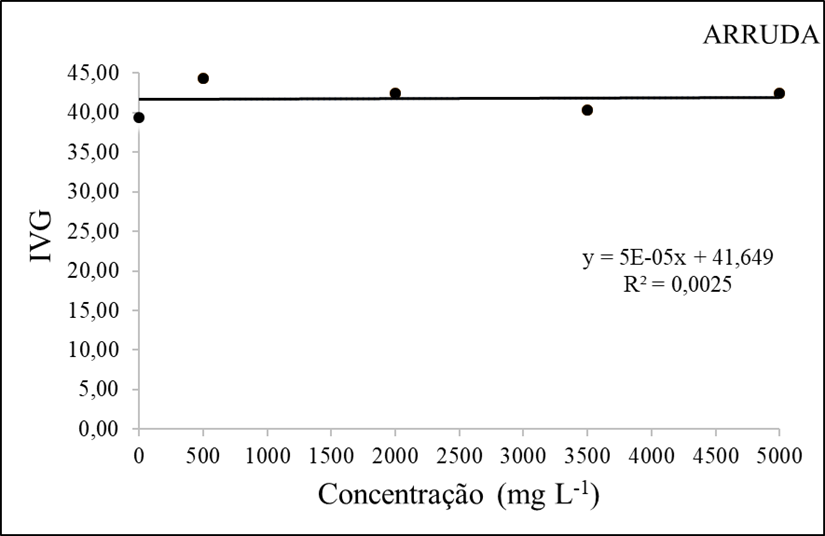
Figura 3 – O índice de velocidade de germinação (mm) em função da interação das doses do extrato etanolico de Arruda.
Ao observar o Indice de velocidade de germinação (figura 3), percebeu-se que a concentração de 500mg/L obteve o melhor resultado. Outro ponto importante que a figura fornece é que a medida que a concentração aumenta, o IVG diminui, indicando que algumas doses podem ter estimulado um maior vigor em comparação as outras doses. O processo de germinação da semente é marcado pela reativação do metabolismo, que fica dormente após a maturação fisiológica, podendo ser influenciado por fatores internos, externos ou ambientais (Carvalho & Nakagawa, 2000).
A arruda possui um flavonóide isolado, chamado rutina, e destaca-se por apresentar propriedades antibacterianas e alelopáticas, conforme apontado por Basile et al. (2000). Além disso, o óleo essencial da arruda também apresenta atividade alelopática, como constatado por De Feo et al. (2002).
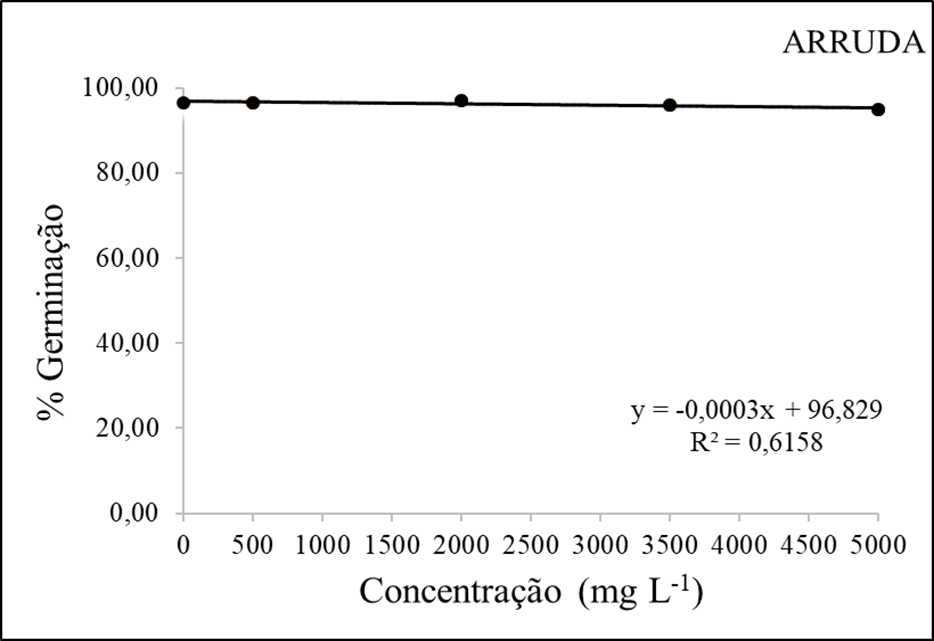
Figura 4 – Porcentagem de germinação (mm) em função da interação das doses do extrato etanolico de Arruda.
Em relação ao percentual de germinação, a figura 4 mostra que os valores permaneceram altos independentemente das dosagens, indicando que as sementes germinaram em todos os tratamentos, no entanto há uma pequena variação na porcentagem de germinação destacando a concentração de 2000mg/L que atingiu cerca de 97% de plantas germinadas.
Segundo Ferreira (2000) os avanços recentes na química de produtos naturais têm sido notáveis com o uso de métodos modernos de extração, isolamento, purificação e identificação. Isso tem proporcionado um maior conhecimento dos compostos secundários, que podem ser classificados de várias maneiras. Esses avanços têm contribuído significativamente para a compreensão desses compostos e suas aplicações na indústria e medicina.
5.2 BOLDO (Plectranthus barbatus)
O hipocótilo é uma parte responsável pelo crescimento inicial da raiz e do caule. Ao analisar os dados obtidos a partir dos resultados do experimento, constatou-se que os extratos de boldo (Plectranthus barbatus) não apresentaram diferenças significativas entre os quatros tratamentos de acordo com o teste de Tukey (5% de probabilidade).
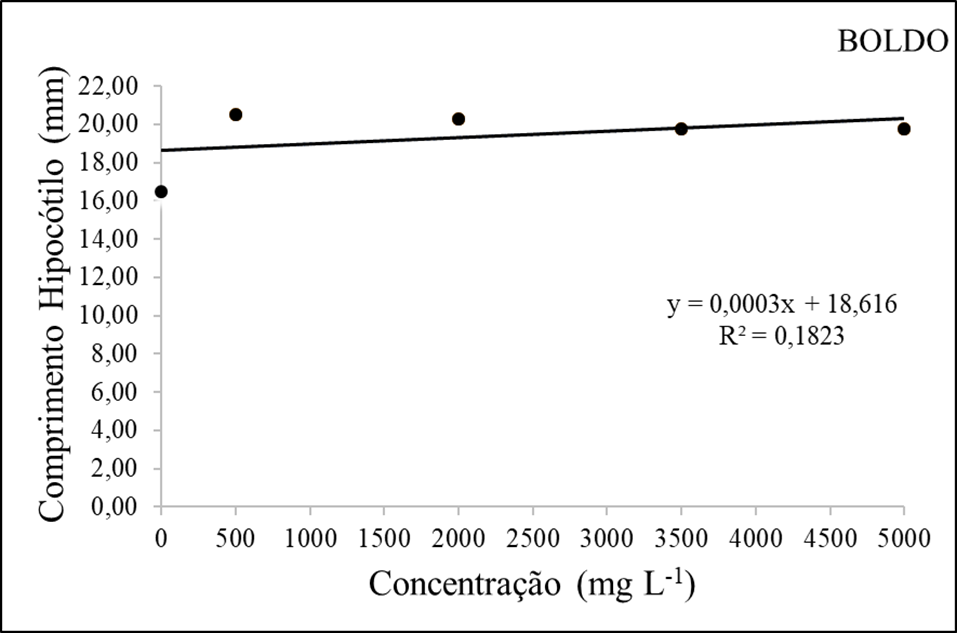
Figura 5 – Comprimento de hipocótilo (mm) em função da interação das doses do extrato etanolico de Boldo.
Porém, foi observado um desempenho superior na concentração de 500mg/L com cerca de 20,5mm no hipocótilo como mostra a figura 1. Essa estabilização do valor do hipocótilo em doses mais altas pode indicar uma saturação na resposta da planta ao aumento da dose.
Além disso, a consistência do valor do hipocótilo em doses mais altas sugere que uma dose maior pode não necessariamente resultar em um benefício adicional para o crescimento dessa parte da planta.
Em relação ao comprimento da radícula (figura 2) quando utilizado o extrato aquoso de boldo o mesmo não apresentou diferença significativa a nível de 5% de significância.
A testemunha apresentou um desenvolvimento superior atingindo cerca de 19,25mm, mas com o uso dos extratos a dosagem de 2000mg/L atingiu cerca de 18,75mm. A extensão da raiz é um indicador confiável para avaliar o efeito alelopático de várias concentrações dos extratos na fase inicial de desenvolvimento das sementes (Gorla & Perez 1977).
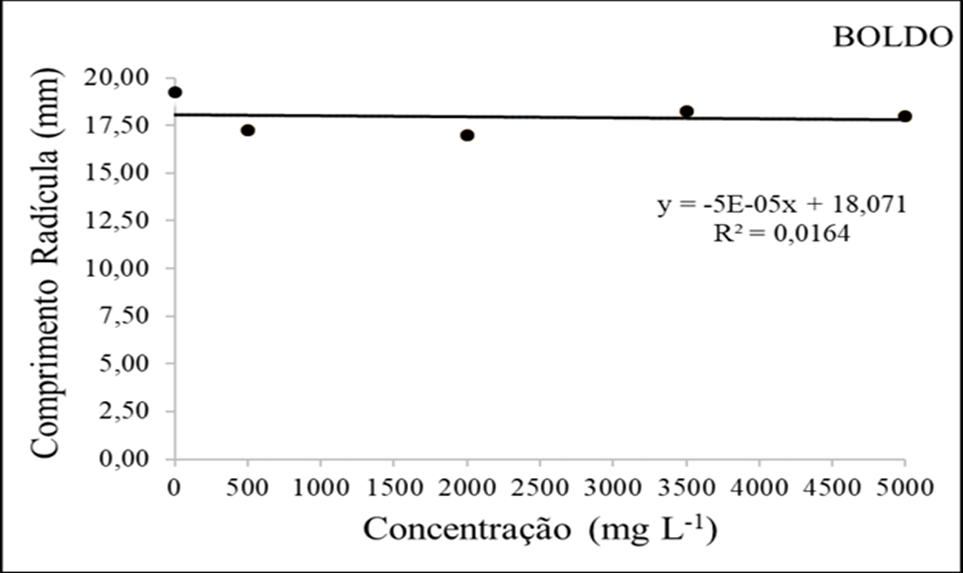
Figura 6 – Comprimento da radícula (mm) em função da interação das doses do extrato etanolico de Boldo.
Com relação aos resultados obtidos sobre o índice de velocidade de germinação (IVG), foi demostrado que a concentração de 5000mg/L se sobressaiu sobre os outros tratamentos atingindo cerca de 47,04mm. Entretando observa-se que todas as dosagens apresentaram resultados satisfatórios em qualquer das variáveis avaliadas.
O extrato de boldo não evidenciou inibição da germinação, nem tampouco demonstrou atraso na germinação, resultados esses que contrastam com os encontrados por Sales et al. (2005), os quais relatam que a germinação foi fortemente inibida pelo uso de soluções com boldo, mesmo em sua menor concentração.
Segundo Morais et al. (2009) o boldo-do-chile contém uma variedade de componentes químicos interessantes, como alcaloides (boldina), taninos, esteroides, ácidos graxos, terpenos, flavonoides (quercetina e canferol), derivados flavônicos (boldosídio, peumosídio), eugenol e ascaridol. Metabólitos secundários que podem afetar o crescimento e desenvolvimento de outras plantas ao seu redor.
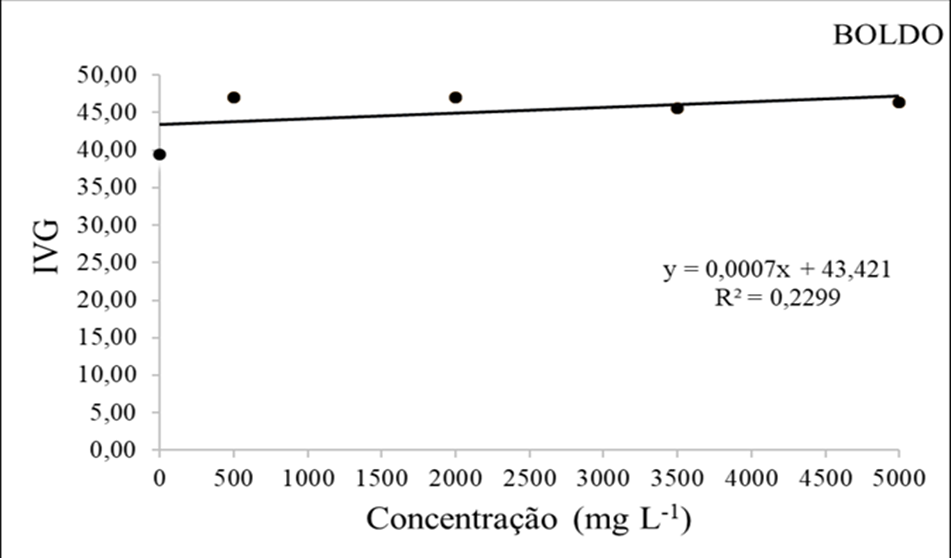
Figura 7 – O índice de velocidade de germinação (mm) em função da interação das doses do extrato etanolico de Boldo.
Na figura 8 mostra que não houve variação no percentual de germinação com o aumento do extrato de boldo, ou seja, o mesmo não afetou a germinação. Entretando percebe-se que a concentração de 2000mg/L teve um maior índice atingindo 98% de sementes germinadas.
De acordo com Ferreira e Borghetti (2004) a velocidade de germinação é um bom índice para avaliar a ocupação de uma espécie em um determinado ambiente, pois a germinação rápida é característica de espécies cuja estratégia é de se estabelecer no ambiente o mais rápido possível aproveitando condições ambientais favoráveis.
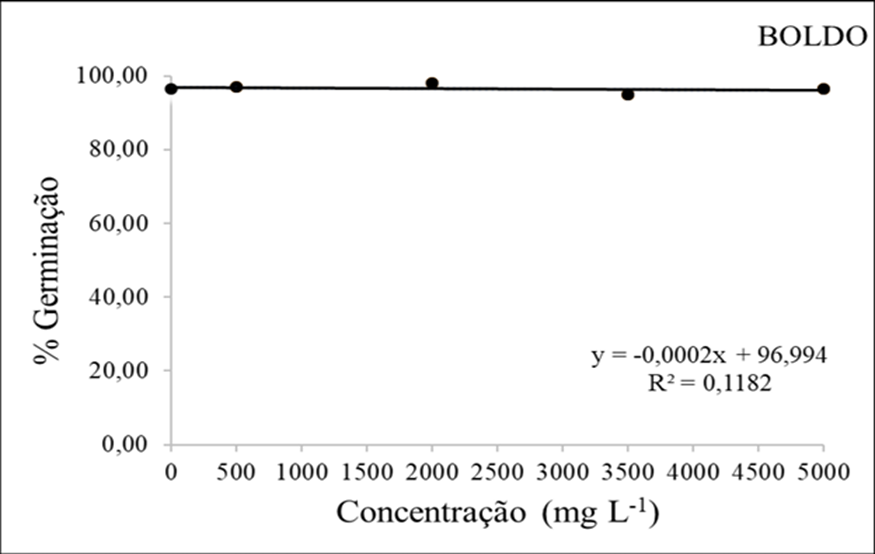
Figura 8 – Porcentagem de germinação (mm) em função da interação das doses do extrato etanolico de Boldo.
CONCLUSÃO/CONSIDERAÇÕES FINAIS
O estudo demonstrou o potencial das plantas espontâneas e medicinais como ferramentas para controle de plantas daninhas, redução de pragas e doenças, e promoção do crescimento agrícola via propriedades alelopáticas. A pesquisa revelou que extratos de arruda e boldo tiveram pouca interferência no desenvolvimento inicial da alface. Esses resultados sugerem implicações potenciais dessas plantas em outras culturas, destacando a importância de estudos adicionais para a implementação de práticas agrícolas mais sustentáveis e econômicas.
REFERÊNCIAS
ABREU, M. L. C.; Avaliação nutricional da cunhã (Clitoria ternatea L.) em diferentes idades de corte. Tese (Mestrado em Ciência Animal) – Universidade Estadual do Norte Fluminense Darcy Ribeiro.Campos dos Goytacazes, p.78 2012.
AIRES, S. S.; Potencial alelopático de espécies nativas do Cerrado na germinação e desenvolvimento inicial de invasoras. 61p. Dissertação (Mestrado em Botânica) – Universidade de Brasília-DF, 2007.
AL-SNAFI, A. E.; Pharmacological importance of Clitoria ternatea. Volume 6, Issue 3, PP. 68-83, 2016.
ALVADI, A.; Manejo das plantas daninhas pela alelopatia. Agropec. Catarin., v.17, n.1, março, 2004.
ANDRÉ, E. ALELOPATIA: LEVANTAMENTO DA PRODUÇÃO ACADÊMICA. UNIVERSIDADE FEDERAL DA FRONTEIRA SUL – UFFS CAMPUS- CHAPECÓ- SC, 2021.
APARECIDA, G.; GONZALO, M. ESTUDO DO POTENCIAL ALELOPATICO DO EXTRATO METANOLICO DE RAIZ E CAULE DE Caryocar brasiliense (PEQUI). Biosci. J., Uberlândia, v. 27, n. 3, p. 460-472, junho, 2011.
BASILE A. U.; SORBOA, S.; GIORDANOA, S.; Antibacterial and allelopathic activity of extract from Castanea sati¨a leaves/Fitoterapia, 2000.
BERTIN, C.; YANG, X.; WESTON, L. A.; The role of root exudates and allelochemicals in the rhizosphere. Plant and soil, 2003.
BINOTTO, E.; ORIKA, E.; Fisiologia Vegetal: Reguladores Vegetais. Edição: Andrey. Piracicaba-SP, I5 de maio de 2015.
BITENCOURT, G. A.; GONÇALVES, C. C. M.; ROSA, A. G.; ZANELLA, D. F. P.; MATIAS, R.; Fitoquímica e alelopatia da aroeira-vermelha (Schinus terebinthifolius Raddi) na germinação de sementes. Ensaios e Ciência, v. 25, n. 1, p. 02-08, 2021.
BRAGA, C. M.; Histórico da utilização de plantas medicinais. Monografia (Licenciatura em Biologia) − Universidade de Brasília/Universidade Estadual de Goiás, 2011.
BRAGUETO, G.; Flores de Centaurea cyanus e Clitoria ternatea: Caracterização química, estabilidade das antocianinas e propriedades funcionais in vitro. Ponta Grossa-PR, 2019.
BURIL, M. T.; THOMAS, W. W.; ALVES, M.; Flora da Usina São José, Igarassu-PE: Rutaceae, Simaroubaceae e Picramniaceae. Rodriguésia, v.65, n.3, p.701-710, 2014.
CAMPANA, J.; LINS, C.; Potencial alelopático e identificação dos metabólitos secundários em extratos de Canavalia ensiformis L. Rev. Ceres, v. 65, n.3, p. 243-252, Viçosa-MG, 2018.
CARVALHO, H.; MARIANA, N.; ALLAN, C.; ANÁLISE DO DESENVOLVIMENTO E DA PRODUÇÃO DA CUNHÃ EM FUNÇÃO DE DIFERENTES TIPOS DE ADUBAÇÃO ORGÂNICA. Ciência Agrícola, Rio Largo, v. 19, n. 1, p. 25-36. Paripiranga-BA, 2021.
CARVALHO, N. M.; NAKAGAWA, J.; Sementes: ciência, tecnologia e produção. 4.ed. Jaboticabal: Funep, 2000.
CÉZARI, N.; Alelopatia no manejo de plantas daninhas. UNIVERSIDADE FEDERAL DE SÃO JOÃO DEL-REI, Sete Lagoas-MG, 2016.
CORDEIRO, J. M. P.; FÉLIX, L. P.; Conhecimento botânico medicinal sobre espécies vegetais nativas da caatinga e plantas espontâneas no agreste da Paraíba, Brasil. Rev. Bras. Pl. Med., v.16, n.3, supl. I, p.685-692, Campinas-SP, 2014.
CORDEIRO, S. Z.;Plectranthus barbatus Andrews.Universidade Federal do Rio de Janeiro. Publicado em 2020. Disponível em: https://www.unirio.br/ccbs/ibio/herbariohuni/plectranthus-barbatus-andrews. Acessado em 28/03/2024.
CRISTIANI, M. C.; ROBERTO, José; DE JESUS, T.; 1054 FERREIRA, M. C. et al. POTENCIAÇÃO ALELOPÁTICA DE EXTRATOS VEGETAIS NA GERMINAÇÃO E NO CRESCIMENTO INICIAL DE PICÃO-PRETO E ALFACE. Ciênc. agrotec., v. 31, n. 4, p. 1054-1060, Lavras-MG, 2007.
DA CONCEIÇÃO, M.; MEDEIROS, S.; Alelopatia de extratos voláteis na germinação de sementes e no comprimento da raiz de alface. Pesq. agropec. bras., v.39, n.11, p.1083-1086, Brasília-DF, 2004.
DANILO, C.; Conservação e meio ambiente. ALELOPATIA: CONSIDERAÇÕES GENÉTICAS, QUÍMICAS E FISIOLÓGICAS. Cap.21. – Ponta Grossa – PR: Atena, 2021.
DE FEO, V.; DE SIMONE, F.; SENATORE, F.; Potential allelochemicals from the essential oil of Ruta graveolens. Phytochemistry, 2002.
DELBONE, C. A. C.; LANDO, R. L; Importância ecológica e evolutiva dos principais grupos de metabólitos secundários nas espécies vegetais. Congresso de Educação do Norte Pioneiro. 10ª edição. UENP-CCNE-CLA. Campus Jacarezinho, 2010.
DOS SANTOS, J. L.; Potencial alelopático de flores de Clitoria fairchildiana. R.A. Howard (Fabaceae). Recife-PE, 2023.
ELIAZAR, F.; ANDRÉ, P.; PASUCH, M.; Principais plantas com potencial alelopático encontradas nos sistemas agrícolas brasileiros. Acta Iguazu, v.2, Suplemento, p. 70-88. Cascavel-PR, 2013.
ENDARA, M. J.; FORRISTER, D.; COLEY, P.; The Evolutionary Ecology of Plant Chemical Defenses: From Molecules to Communities. Annual Review of Ecology, Evolution, and Systematics, 2023.
FERNANDA, N.; EXTRAÇÃO DE COMPOSTOS BIOATIVOS DE FLOR DE Clitoria ternatea. UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ, Londrina-PR, 2022.
FERNANDES, F.; DOS SANTOS, L.; IDENTIFICAÇÃO DE PLANTAS ESPONTÂNEAS COM PROPRIEDADES TERAPÊUTICAS EM ÁREA CULTIVADA COM jatropha Sp. Revista Verde, v.6, n.4, p. 258 – 262, Mossoró-RN, 2011.
FERNANDEZ, C.; “EFECTO ALELOPÁTICO DE Ruta graveolens, Baccharis alnifolia y Caesalpinia spinosa EN LA GERMINACIÓN DE SEMILLAS DE Chenopodium album, Amaranthus hybridus, Brassica rapa subsp. campestris y Brassica oleracea var. italica EN LA REGIÓN DE AREQUIPA – PERÚ”, 2018.
FERREIRA, A. G.; AQUILA, M. E. A. Alelopatia: Uma área emergente da ecofisiologia. Revista Brasileira de Fisiologia Vegetal, v. 12 (edição especial), p.175-204, 2000.
FERREIRA, A. G.; BORGHETTI, F. Germinação: do básico ao aplicado. Porto Alegre: Artmed, 2004.
FERREIRA, A. G.; AQUILA, M. E. A.; ALELOPATIA: UMA ÁREA EMERGENTE DA ECOFISIOLOGIA. R. Bras.Fisiol.Veg. 12(Edição Especial):175-204. Brasília-DF, 2000.
FERREIRA, D. F. S.; a computer analysis system to fixed effects split plottype designs. Revista Braileira de Biometria, v. 37, n. 4, p. 529-535, 2019.
FILHO, S.; Da SILVA, A. P.; A história das pesquisas em alelopatia no Brasil. – Brasília, DF: Embrapa, 2023.
FILHO, S.; DA SILVA, A. P.; Alelopatia: princípios básicos e aspectos gerais. Belém: Embrapa Amazônia Oriental, 2023.
FILHO, S.; SANTOS, G.; METODOLOGIAS EMPREGADAS EM ESTUDOS DE AVALIAÇÃO DA ATIVIDADE ALELOPÁTICA EM CONDIÇÕES DE LABORATÓRIO REVISÃO CRÍTICA. Planta Daninha, v. 28, n. 3, p. 689-697, Viçosa-MG, 2010.
FURINI, T.; FURINI, S. C. S.; BARROS, J. O.; Alelopatia e genotoxicidade da erva de santa maria sobre sementes Lactuca Sativa L. e raízes Allium Cepa L. SAJEBTT, Rio Branco, UFAC. v. 7 n. 2, 2020.
GERSHENZON, J.; CROTEAU, R. Terpenoids, In Herbivores: Their Interactions witch Secondary Plant Metabolites, Vol. 1: The Chemicai Participants, 2nd ed., G. A. Rosenthal and M. R. Berenbaum, eds., Academic Press, San Diego, CA, pp, 1992.
GOIS, F.; DA SILVA, A.; Flor de Clitoria ternatea: desidratação e caracterização; REVISTA OBSERVATORIO DE LA ECONOMIA LATINOAMERICANA, Curitiba, v.21, n.8, 2023.
GORETE, V.; SILVA, D.; EMBRAPA Rondônia. Folder 05- Série “Plantas Medicinais”. Editoração e layout: Marly de Souza Medeiros. Porto Velho, RO, dezembro de 2001.
GORLA C.M.; PEREZ S. C. J. G. A.; Influência de extratos aquosos de folhas de Miconia albicans Triana, Lantana camara L., Leucaena leucocephala (Lam) de Wit e Drimys winteri Forst, na germinação e crescimento inicial de sementes de tomate e pepino. Revista Brasileira de Sementes, 1977.
HERZOG-SOARES, J.D. et al. Atividade tripanocida in vivo de Stryphnodendron adstringens (barbatimão verdadeiro) e Caryocar brasiliensis (pequi). Revista Brasileira de Farmacognosia, v.12, p.01-02, 2002.
IBGE, Censo Agropecuário 2017. Disponível em: https://cidades.ibge.gov.br/brasil/ba/irece/pesquisa/24/27745. Acessado em: 12/05/2024.
INDERJIT & DEL MORAL, R. Is separating resource competition from allelopathy realistic. The Botanical Review, 63:221- 227, 1997.
JUNIOR, C. V. C.; Desempenho da Agricultura Baiana – 1992. Bahia Análise e Dados. Salvador, CEI, v.2, n.3, p.49-56, dez./92.
KATO-NOGUCHI, H.; Allelopathic Substances in Pueraria thunbergiana. Phytochemistry, 63, 577-580, 2003.
KOUL, O.; Phytochemicals and insect control: An antifeedant approach. Crit. Rev. Plant Sci., 27, 2018.
KRUSE, M.; STRANDBERG, M.; STRANDBERG, B.; Ecological Effects of Allelopathic Plants– a Review. NERI Technical Report, No. 315, 2000.
KUNZE, A.; AREGULLIN, M.; RODRÍGUEZ, E.; PROKSCH, P. Fate of chromene encecalin in the interaction of Encelia farinosa and its specialized herbivore Trirhabda geminata. Journal Chemical of Ecology, Heildenberg, v. 22, p. 491-498, 1996.
LÁZARO, E. P. P.; METABOLISMO SECUNDÁRIO. Escola Superior de Agricultura Luiz de Queiroz. Piracicaba-SP, 2013.
LOBO V.; PATIL A.; PHATAK A.; CHANDRA N.; Free radicals, antioxidants and functional foods: impact on human health. Pharmacogn Ver, 2010.
LOGEMANN, E.; PAMISKE, M.; HAHLBROCK, K. Modesof expression and common structural features of the complete phenylalaniane ammonialyase gene famyli in parsley, Proc. Natl. Acad. Sci., v.92, p. 5905-5909, 1995.
MACHADO, A. W.; Entenda a alelopatia entre culturas e plantas daninhas. AgroLink. Publicado em 2023. Disponível em: https://www.agrolink.com.br/agrolinkfito/manejo-integrado/manejo-integrado-de-plantas-daninhas/entenda-a-alelopatia-entre-culturas-e-plantas-daninhas_482863.html. Acessado em 04/05/2024.
MARASCHIN, F.; ESTEFÂNIA, M.; Potencial alelopático de espécies nativas na germinação e crescimento inicial de Lactuca sativa L. (Asteraceae). Acta bot. bras. 20(1): 61-69. Porto Alegre-RS, 2006.
MARCELINO, D.; Feijão-borboleta ou Cunhã, curiosidades e propriedades medicinais. Natureza e Conservação. Publicado em 2017. Disponível em: https://www.naturezaeconservacao.eco.br/2017/11/feijao-borboleta-ou-cunha-curiosidades.html. Acessado em 06/04/2024.
MAY, P. H. et al. Compilación y analisis sobre los productos florestales no madereros (PFNM) en el Brasil. Santiago: FAO, 2001. 88 p. MISSOURI BOTANICAL GARDE. ANUAL REPORT, 2009.
MORAIS, S. M.; CAVALCANTI, E. S. B.; MARIA, S.; COSTA, L. A.; Ação antioxidante de chás e condimentos de grande consumo no Brasil. Rev. Bras. Farmacogn. Braz, 2009.
MOURA, A. M.; O impacto da agricultura no crescimento do comércio na cidade de Irecê: análise da década de oitenta aos dias atuais. Salvador-BA, 1997.
MOURA, C. P. B.; CONSTANT, P. B. L.; Corante natural de flor comestível (Clitória ternatea). São Paulo, SP: Dialética, 2022.
NASIR H.; IQBAL Z.; HIRADATE S.; Fujii Y..Allelopathic potential of Robinia pseudo-acacia L. J Chem Ecol 31: 2179-2192, 2005.
NOGUEIRA, L.; Atividade alelopática de extratos triturados de folhas de Caryocar brasiliense sobre o crescimento inicial de espécies alvo e identificação de frações ativas através de fracionamento em coluna cromatográfica. Universidade de Brasília-DF: Instituto de ciências Biológicas Departamento de Botânica, 2010.
OLIVEIRA, Y. R.; SILVA, P. H.; Potencial Alelopático de Espécies da Família Fabaceae Lindl. Ensaios e Ciênc., v. 24, n. 1, p. 65-74, 2020.
PACHECO, L.; ALVES, V.; METABÓLITOS SECUNDÁRIOS DE PLANTAS. Revista Agrotecnologia, Ipameri, v.11, n.1, p.54-67, Ipameri-GO, 2020.
PANDEY A. K.; SINGH P.; TRIPATHI N. N; Chemistry and bioactivities of essential oils of some Ocimum species: an overview. Asian Pacific Journal of Tropical Biomedicine, 2018.
PASTORINI, L. H.; Interação e Competição entre Plantas. Publicado em 2023. Disponível em: https://cienciahoje.org.br/artigo/interacao-e-competicao-entre-plantas/. Acessado em 08/05/2024.
PEDRO, A.; MARIA, M.; MARIA, A.; PADRÃO DE ATIVIDADE ALELOPÁTICA EM POÁCEAS E FABÁCEAS. Revista Varia Scientia Agrárias. v. 03, n.02, p. 115-134. EMBRAPA AMAZÔNIA ORIENTAL, Belém-PA, 2013.
PIRES, N. M.; OLIVEIRA, V. R.; Alelopatia: Biologia e Manejo de Plantas Daninhas, Cap;5, 2011.
POULTON, J. E.; Cyanogenesis in plants. Plant Phisiol. 94: 401-405, 1990.
RIBEIRO, J.; UBIRATAN, J.; SIMONE, E.; Estudos com plantas espontâneas no Brasil: uma revisão. Research, Society and Development, v. 11, n. 7, e14111729700, 2000.
ROBERTO, P.; Bioeletrografias em plantas de Ruta graveolens tratadas com duas homeopatias. Viçosa-MG, 2007.
SALES, S.C.M.; SANTOS, G.C.; SOUZA, P.R.S. Efeito Alelopático De Boldo, Capim Cidreira E Hortelã Sobre Germinação E Crescimento De Plântulas De Alface. In: IV Congresso de ecologia do Brasil. Anais… Congresso de ecologia do Brasil – Caxambu. 2005.
SANDBERG, S. L.; BERNBAUM, M. R.; Leaf-tying by tortricid larvae as an adaptation for feeding on phototoxic Hipericum perforatum. Chem. Ecol. 15: 875-886, 1989.
SANTOS, M.; CARVALHO, M.; Caracterização fitoquímica de Clitoria ternatea Linn biodirecionada pelo seu potencial contra micro-organismos multirresistentes. Santana do Ipanema/AL. vol 3, n. 2, p.429-441, 2018.
SHARIFI-RAD, J.; SUREDA, A.; TENORE, G. C.; Biological Activities of Essential Oils: From Plant Chemoecology to Traditional Healing Systems. Molecules, 2017.
TAIZ, L.; ZEIGER, E.; Fisiologia Vegetal. Metabolitos secundários e defesa vegetal, CAP.13, 4º Edição. Porto Alegre-RS, 2009.
TOKURA, L. K.; NÓBREGA, Lúcia Helena Pereira; Alelopatia de cultivos de cobertura vegetal sobre plantas infestantes. Acta Scientiarum. Agronomy, vol. 28, núm. 3, pp. 379-384 Universidade Estadual de Maringá Maringá, Brasil, 2006.
TORIANI, A.L.T; OLIVEIRA, L. Ruta graveolens L. (Arruda). O conhecimento e suas particularidades. Curitiba, 2006.
TRINDADE, G. P.; OLIVEIRA, G. R.; BOLDO-DE-JARDIM Plectranthus barbatus Andrews. UNIVERSIDADE ESTADUAL DE CAMPINAS. Faculdade de Ciências Farmacêuticas, 2023.
VASCONCELOS, M. C. C.; SILVA, A. F. A.; LIMA, R.S. Interferência de Plantas Daninhas sobre Plantas Cultivadas. ACSA – Agropecuária Científica no Semi-Árido, v.8, n.1, p.01-06, 2012.
WEAVER, L. M.; HERRMANN, K. M. Dynamics of the shikimate pathway. Trends in Plant Science, Oxford, v. 2, n. 9, p. 346-351, 1997.
YAMASHITA, O. M.; FERNANDES NETO, E.; CAMPOS, O.R.; GUIMARÃES, S.C; Fatores que afetam a germinação de sementes e emergência de plântulas de arruda (Ruta graveolens L.). Rev. Bras. Pl. Med., Botucatu, v.11, n.2, p.202-208, 2009.
ZOBEL, A.M.; BROWN, S.A. Furanocoumarins on the surface of callus cultures from species of the Rutaceae and Umbelliferae. Can. J. Bot. Submitted, 1991.
1 Discente do Curso Superior de Engenharia Agronômica da Faculdade de Irecê – Campus Recanto das Arvores. e-mail: leow8964@gmail.com; duda.dseixas@gmail.com; cassiohf@icloud.com; matheustdb2900@gmail.com.
2 Docente do Curso Superior de engenharia agronômica da Faculdade de Irecê – Campus Recanto das Arvores. Orientador. Mestre em Defesa Agropecuária (MPDA/UFRB). e-mail: lucas.barbosa@faifaculdade.com.br
3 Docente do Curso Superior de Engenharia Agronômica da Faculdade de Irecê – Campus Recanto das Arvores. Doutor em Ciências Agrarias (CCAAB/UFRB). e-mail: torquato.coordenacao@faifaculdade.com.br;
3 Docente do Curso Superior de Engenharia Agronômica da Faculdade de Irecê – Campus Recanto das Arvores. Mestre em fitotecnia (PPGFITO/ UFERSA). e-mail: tarso.moreno@faifaculdade.com.br.
4 Eng. Agrônomo (UFOB). Mestrando no Programa de Pós-Graduação em Produção Vegetal no Semiárido Universidade Estadual de Montes Claros. e-mail: edeilton17@gmail.com.
5 Doutoranda no Programa de Pós-Graduação em Agroecologia e desenvolvimento territorial (PPGAD/UNIVASF/UFRP/UNEB). e-mail: conceicao.direcao@faifaculdade.com.br.

