TEMPORAL ANALYSIS OF THE INCIDENCE OF REPORTED CASES OF CHAGAS DISEASE IN BRAZIL, IN THE PERIOD OF 2010-2019
ANÁLISIS TEMPORAL DE LA INCIDENCIA DE CASOS NOTIFICADOS DE ENFERMEDAD DE CHAGAS EN BRASIL, EN EL PERIODO 2010-2019
REGISTRO DOI: 10.69849/revistaft/ch10202409171901
Bárbara Maria Santana Costa1;
Reynan Pereira Santos Junior2;
Cynthia Silva Santos3;
Luciana Marques da Silva4;
Omar Ariel Espinosa Dominguez5
RESUMO
A Doença de Chagas é causada pelo Trypanosoma cruzi e permanece uma importante preocupação de saúde pública no Brasil, apesar das medidas de controle adotadas ao longo das últimas décadas. O objetivo deste estudo é realizar uma análise temporal da incidência de casos notificados de Doença de Chagas no Brasil no período de 2010 a 2019, identificando tendências e possíveis fatores associados. Foram utilizados dados secundários do Sistema de Informação de Agravos de Notificação (SINAN) para calcular as taxas de incidência por região e por ano. A análise estatística incluiu modelos de regressão linear para avaliar a variação temporal das notificações. Os resultados indicam uma redução global das notificações no país durante o período analisado, com variações regionais significativas. A região Norte apresentou aumento de notificações, sugerindo a necessidade de maior vigilância e estratégias de controle. Em contraste, as regiões Sudeste e Sul mantiveram uma tendência de queda estável, resultado das medidas contínuas de controle vetorial. Conclui-se que, embora os casos de Doença de Chagas estejam em declínio em grande parte do Brasil, a doença ainda representa um desafio para a saúde pública em algumas regiões, especialmente em áreas onde a transmissão oral e a sinantropia com vetores estão em ascensão.
Palavras-chave: Doença de Chagas, análise temporal, incidência, saúde pública, Brasil, Trypanosoma cruzi.
ABSTRACT
Chagas disease is caused by Trypanosoma cruzi and remains an important public health concern in Brazil, despite control measures adopted over the last few decades. The objective of this study is to carry out a temporal analysis of the incidence of reported cases of Chagas Disease in Brazil from 2010 to 2019, identifying trends and possible associated factors. Secondary data from the Notifiable Diseases Information System (SINAN) were used to calculate incidence rates by region and year. The statistical analysis included linear regression models to evaluate the temporal variation of notifications. The results indicate an overall reduction in notifications in the country during the period analyzed, with significant regional variations. The North region showed an increase in notifications, suggesting the need for greater surveillance and control strategies. In contrast, the Southeast and South regions maintained a stable downward trend, as a result of continued vector control measures. It is concluded that, although cases of Chagas disease are declining in much of Brazil, the disease still represents a public health challenge in some regions, especially in areas where oral transmission and vector synanthropy are on the rise.
Keywords: Chagas disease, temporal analysis, incidence, public health, Brazil, Trypanosoma cruzi.
RESUMEN
La enfermedad de Chagas es causada por Trypanosoma cruzi y sigue siendo un importante problema de salud pública en Brasil, a pesar de las medidas de control adoptadas en las últimas décadas. El objetivo de este estudio es realizar un análisis temporal de la incidencia de casos notificados de Enfermedad de Chagas en Brasil de 2010 a 2019, identificando tendencias y posibles factores asociados. Se utilizaron datos secundarios del Sistema de Información de Enfermedades de Declaración Obligatoria (SINAN) para calcular las tasas de incidencia por región y año. El análisis estadístico incluyó modelos de regresión lineal para evaluar la variación temporal de las notificaciones. Los resultados indican una reducción general de las notificaciones en el país durante el período analizado, con importantes variaciones regionales. La región Norte mostró un aumento en las notificaciones, lo que sugiere la necesidad de mayores estrategias de vigilancia y control. En contraste, las regiones Sudeste y Sur mantuvieron una tendencia estable a la baja, como resultado de las continuas medidas de control de vectores. Se concluye que, aunque los casos de enfermedad de Chagas están disminuyendo en gran parte de Brasil, la enfermedad todavía representa un desafío de salud pública en algunas regiones, especialmente en áreas donde la transmisión oral y la sinantropía vectorial están en aumento.
Palabras clave: Enfermedad de Chagas, análisis temporal, incidencia, salud pública, Brasil, Trypanosoma cruzi.
INTRODUÇÃO
A Doença de Chagas (DC) foi descrita em 1909 por Carlos Ribeiro Justiniano das Chagas, que fez a descrição da doença em uma criança de 2 anos (Dias, 2011; Brasil,2015). Essa doença é considerada uma zoonose presente no continente americano com alta incidência na América Latina e no Brasil. O agente etiológico é o parasita protozoário Trypanosoma cruzi, transmitido por insetos hematófagos da ordem Hemíptera, família Reduviidae e subfamília Triatominae. Estes insetos são chamados comumente como “barbeiros” ou “chupões” e seu nome popular varia dependendo da região do país (Brasil, 2015).
O ciclo biológico da T. cruzi inicia durante o processo de alimentação do hospedeiro invertebrado sadio, através da ingesta do parasita em estágio de tripomastigota, que ao chegar no estômago do inseto se diferenciam em esferomastigotas e, posteriormente, em epimastigotas. Os epimastigotas migram para o intestino, onde sofrerão divisão binária e, após migrarem para o reto, se diferenciam finalmente na forma infectante, as tripomastigotas metacíclicos. Desta maneira são capazes de infectar o hospedeiro vertebrado saudável durante o processo de alimentação (Esch; Petersen, 2013).
Quando os triatomíneos se alimentam dos mamíferos através da probóscide, simultaneamente defecam liberando as tripomastigotas metacíclicos do T. cruzi. Estas formas infectivas podem penetrar os mamíferos através das lesões causadas pela fricção do próprio hospedeiro no local. A nível celular o protozoário adere à membrana da célula, o parasito é fagocitado pelos macrófagos e começa a se diferenciar na forma amastigota simultaneamente, e destrói a membrana do fagócito (Souza, 1999).
Dentro do citoplasma, a forma amastigota inicia a divisão celular binária e continua nesse processo por vários dias. Em aproximadamente cinco dias, as formas amastigotas iniciam o processo de transformação na forma tripomastigota. Nesse estágio, o parasita movimenta seu flagelo de maneira intensa, levando ao rompimento da célula e libera os parasitos no meio extracelular. Tanto as formas amastigotas quanto as formas em transição e tripomastigotas têm a capacidade de infectar outros tipos celulares ou atingir a corrente sanguínea e distribuir-se por todo o organismo (Souza, 1999).
O modo de transmissão pode ser de maneira vetorial, que ocorre pela passagem do protozoário das excretas do triatomíneo, por meio da mucosa humana ou da pele lesionada, por meio oral após ingestão de alimentos contaminados com T. cruzi, transfusional, por meio de transplante de órgãos, vertical, quando mulheres infectadas pelo T.cruzi transmite através da gestação ou no parto e acidental através do contato com sangue dos pacientes infectados ou excretas de triatomíneos com a pele lesada ou durante a manipulação sem uso de Equipamentos de Proteção Individual (EPI’s) em laboratório (Brasil, 2010).
Em mais de um século da descoberta da Doença de Chagas, a doença traz consigo o caráter de acometer populações negligenciadas, com alta incidência na América Latina, especialmente em países em desenvolvimento. De acordo com dados da Organização Pan Americana de Saúde (Opas, 2017), a DC é endêmica em 21 países das Américas, com aproximadamente 6 milhões de pessoas afetadas, com incidência anual de 30 mil casos novos, ocasionando em média 14.000 mortes/ano e 8.000 recém-nascidos são infectados durante a gestação. Estima-se que cerca de 70 milhões de pessoas vivam em áreas de exposição e corram o risco de contrair a doença (Opas,2017).
No Brasil, com o aprimoramento das ações de controle químico vetorial, realizadas pelo país a partir de 1975, combinado com a intensificação da vigilância na triagem de indivíduos no momento da doação de sangue, tecidos e órgãos, houve redução substancial do número de casos da DC na fase aguda no país (Dias et al., 2016).
A doença apresenta curso clínico bifásico, composto por uma fase aguda, por vezes não identificada, evoluindo para a fase crônica. Pode ocorrer pericardite, derrame pericárdico, tamponamento cardíaco, cardiomegalia, insuficiência cardíaca congestiva e derrame pleural. As manifestações clínicas mais comuns são febre prolongada e recorrente, cefaleia, mialgias, astenia, edema de face ou membros inferiores, rash cutâneo, hipertrofia de linfonodos, hepatomegalia, esplenomegalia, ascite. Em casos de transmissão vetorial, podem ocorrer sinais de porta de entrada que são sinal de Romaña (edema bipalpebral unilateral) ou chagoma de inoculação (lesão a furúnculo que não supura) (Brasil, 2013).
Passando a fase aguda da doença, o indivíduo inicia a fase crônica da DC podendo ser aparente ou inaparente. A maioria das pessoas infectadas (cerca de 60-70%) permanece na forma crônica inaparente, ou seja, não apresenta sintomas evidentes. Nesta forma, o parasita está presente no corpo, mas em níveis muito baixos. A infecção não causa sintomas clínicos significativos, e o paciente pode levar uma vida normal sem saber que está infectado. O diagnóstico geralmente é feito por meio de testes sorológicos, como a detecção de anticorpos contra o Trypanosoma cruzi. O paciente não mostra sinais visíveis da doença, e a função dos órgãos geralmente permanece intacta. Apesar de ser assintomática, existe o risco de progressão para a forma crônica aparente, especialmente se o sistema imunológico do paciente for comprometido ou com o avanço da idade.
Cerca de 30-40% dos infectados podem desenvolver complicações clínicas na fase crônica, que é a forma aparente. Os sintomas geralmente se desenvolvem anos ou décadas após a infecção inicial. As complicações podem afetar principalmente o coração, que inclui insuficiência cardíaca, arritmias, cardiomegalia, sendo um das principais causa de morte na DC. O sistema digestivo pode ser afetado, quando o parasita causa danos aos nervos do esôfago ou do cólon, levando a disfagia ou constipação crônica severa, respectivamente. Além de testes sorológicos, exames de imagem (como ecocardiogramas e raios-X) e exames específicos para o sistema digestivo (como manometria e estudos de trânsito esofágico) são usados para avaliar a extensão do dano (Brasil, 2013).
Segundo o Boletim epidemiológico da DC (Brasil, 2021), no ano de 2020, foram confirmados 146 casos no Brasil, com uma letalidade de 2% (3/146), sendo os óbitos apenas no Estado do Pará. No mesmo ano, a região Norte teve 138 casos notificados, sendo a maior incidência da doença no país, com a taxa de incidência de 0,74 por 100 mil/habitantes. Desses casos, a maior prevalência foi no sexo masculino com 93 casos e 53 do sexo feminino, sendo que destas últimas cerca de 6% estavam gestantes. No ano de 2019, foram confirmados 387 casos e, em 2020, 146 casos, ou seja, um decréscimo de 62,27%.
Na América latina, desde 1980 as taxas de infecção pelo T. cruzi em áreas endêmicas diminuíram de 16 a 18 milhões de casos segundo a Organização Mundial da Saúde para 11 milhões no início e 1990 e para 7,6 milhões em 2006. A mortalidade atribuída à infecção pelo T. cruzi teve queda neste mesmo período, cerca de 45.000 por ano para 14.000 em 2001 (Schmunis, 2007).
Uma vez que a DC é considerada uma doença negligenciada e acomete grande parte da América Latina, incluindo o Brasil, é relevante estudar sua soroprevalência em crianças, antes que a sua cronicidade possa se desenvolver. Se não diagnosticada e tratada adequadamente pode interferir diretamente na qualidade de vida destes indivíduos (Teles et al., 2014; Negrete et al., 2017).
Este estudo teve como objetivo realizar uma análise temporal da incidência de casos notificados da Doença de Chagas no Brasil, no período de 2010-2019 a partir de dados do Sistema de Informação de Agravos de Notificação (SINAN).
METODOLOGIA
Este estudo foi de natureza ecológica e descritiva, com enfoque temporal, que incluiu todos os casos notificados de Doença de Chagas em todas as 27 unidades federativas do Brasil, no período de 2010 a 2019.
Os dados foram obtidos a partir do Sistema de Informação de Agravos de Notificação (SINAN), disponível no Departamento de Informática do Sistema Único de Saúde (DATASUS). O SINAN é a base de dados que reúne informações sobre doenças de notificação compulsória, como a Doença de Chagas. Como critério de inclusão forma todos os casos notificados de Doença de Chagas aguda e crônica, registrados no SINAN, entre 1º de janeiro de 2010 e 31 de dezembro de 2019 e os casos sem informações completas ou duplicadas foram excluídos.
As variáveis coletadas incluíram: Ano de notificação (2010, 2011, 2012, 2013, 2014, 2015, 2016, 2017, 2018 e 2019), Unidade Federativa de residência (Acre (AC), Alagoas (AL), Amapá (AP), Amazonas (AM), Bahia (BA), Ceará (CE), Distrito Federal (DF), Espírito Santo (ES), Goiás (GO), Maranhão (MA), Mato Grosso (MT), Mato Grosso do Sul (MS), Minas Gerais (MG), Pará (PA), Paraíba (PB), Paraná (PR), Pernambuco (PE), Piauí (PI), Rio de Janeiro (RJ), Rio Grande do Norte (RN), Rio Grande do Sul (RS), Rondônia (RO), Roraima (RR), Santa Catarina (SC), São Paulo (SP), Sergipe (SE), Tocantins (TO), Idade (0-4, 5-9, 10-14, 15-19, 20-39, 40-59, 60-69, 70-79, 80 anos) e Sexo (masculino/feminino).
Para a análise dos dados a taxa de incidência foi calculada através do número de casos novos confirmados, dividido pela população residente, multiplicado por 10 milhões. Segue a fórmula: Taxa de incidência=(Número total de casos notificados/População do total)×10n. A variação percentual relativa (VPR) foi definida subtraindo a taxa de 2019 pela taxa de 2010, dividido pela taxa de 2010, multiplicado por 100.
Para a realização deste estudo, não foi necessário a utilização do Termo de Consentimento Livre Esclarecido (Res. CNS 466\2 em seu capítulo IV.8), por se tratar de análises de banco de dados público e com acesso livre sem exposição de dados pessoais. Segundo a resolução 510\2016, Lei 12.527\2011, não foi necessária a submissão do trabalho para o Sistema CEP-CONEP.
RESULTADOS
Nos anos 2010 a 2019 foram registrados 2.597 novos casos da DC no Brasil, com taxa de incidência de 12,23 casos novos por 10 milhões de habitantes.
Entre o início e o final do período analisado, houve aumento na taxa de incidência no Brasil, de 6,98 casos novos/10 milhões hab. em 2010, para 17,23 casos novos/10 milhões hab. em 2019, com VPR de 146,85%. O Pará foi o estado responsável por 78,50% dos casos do Brasil, com 2.055 novos casos no período estudado apresentando aumento da taxa de incidência de 97,90 casos novos/10 milhões hab. em 2010, para 274,33 casos novos/10 milhões hab. em 2019, com VPR de 180,21%. Os estados de Mato Grosso do Sul, Paraná, Santa Catarina, Minas Gerais, Alagoas e Ceará não tiveram nenhum novo caso registrado no período de análise.
No Brasil, há maior prevalência de casos no sexo masculino com 14,07 casos novos/10 milhões hab (n=1395) comparado ao sexo feminino com 11,62 casos novos/10 milhões hab (n= 1202), conforme a Tabela 1.
Em relação à faixa etária observou-se maiores taxas entre a faixa etária 10 a 14 anos com 13,97/10 milhões hab e menores taxas nas crianças menores de 5 anos com 9,86/10 milhões hab e 80 anos ou mais com 8,41/10 milhões hab., conforme a Figura 1.
Figura 1. Distribuição dos novos casos de Doença de Chagas Aguda por faixa etária, 2010 a 2019.
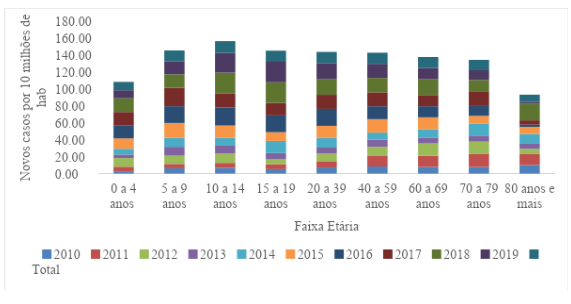
Fonte: SINAN, 2023.
DISCUSSÃO
Em relação ao número de casos de DC ao longo dos anos, percebe-se uma tendência ao aumento de notificações. Tal fato pode significar tanto um aumento da transmissão quanto uma maior efetividade diagnóstica das instituições de saúde em conjunto com a vigilância epidemiológica com o passar do tempo, visto a importância do diagnóstico da doença devido ao seu caráter crônico e à possibilidade de desenvolvimento de formas graves com maior risco de evolução para óbito.
O achado epidemiológico do presente estudo também vai de encontro com os resultados encontrados por Macedo et al. (2021), uma vez que a maior incidência de pacientes infectados nos últimos anos ocorreu igualmente no estado de Pará. Por outro lado, nos resultados de uma revisão sistemática podemos observar que não foram achados estudos de diagnóstico sorológico neste estado. Da região norte do país apenas foi achado um estudo realizado no estado de Amazonas, enquanto que da região nordeste três em Ceará e um em Sergipe. Sendo os estados da região norte, nordeste e centro oeste do país, zonas endêmicas da doença de Chagas, resulta de grande importa o desenvolvimento de pesquisas sorológicas afim de conferir a prevalência da doença nestas regiões (Cunha et al., 2021; Felipe et al., 2020; Oliveira et al., 2020).
Quando analisamos os dados da serie temporal, percebe-se uma predominância na faixa etária de 10-14 anos, divergindo dos resultados encontrados por Bittencourt e seus colaboradores (2020) e de Macedo e seus colaboradores (2021) onde seus respectivos estudos mostraram prevalência entre a faixa etária 20-59 anos sendo justificado por ser um grupo composto por pessoas em idade economicamente ativa.
No que concerne à distribuição da doença conforme o sexo foi observado uma maior ocorrência no sexo masculino do que no sexo feminino, corroborando com outros estudos realizados no Brasil (Bittencourt et al., 2020; Macedo et al., 2021).
Devido ao estado de Pará apresentar uma elevada prevalência e com evidências de associação entre o perfil sociodemográfico, a maioria dos indivíduos infectados do sexo masculino, isto poderia sugerir uma relação entre infecção chagásica e atividade de extrativismo do açaí, predominante na região, desempenhada prioritariamente por indivíduos do sexo masculino, configurando maior exposição ao T. cruzi que aqueles que trabalham no extrativismo de outros produtos (Cardoso et al., 2017).
A incidência da Doença de Chagas no Brasil tem apresentado um comportamento complexo nos últimos anos. Tradicionalmente, a transmissão vetorial, principalmente por meio do Triatoma infestans (barbeiro), foi amplamente controlada, resultando em uma redução significativa dos casos desde a década de 1980, graças a campanhas de controle vetorial. Entretanto, ainda ocorrem novos casos de transmissão, embora agora estejam mais frequentemente associados a outras formas de contágio, como demonstra um estudo prévio realizado no estado de Mato Grosso que encontrou possíveis evidencias de sinantropia em espécies de Triatoma willami infectados com T. cruzi (Silva, 2019). A presença de indicadores ambientais nas comunidades do estudo revelou que existe a associação da presença do vetor com estes, e que alguns como o tipo de parede, tipo de telhado e o acúmulo de matéria orgânica podem ser considerados como fatores de risco para a manutenção da doença na área (Sousa, et al., 2024).
Entretanto, existem outras formas de transmissão T. cruzi como: a transmissão oral com a ingestão de alimentos contaminados, como açaí ou caldo de cana, a transmissão congênita que ocorre de mãe para filho durante a gestação e/ou a transfusão de sangue ou transplante de órgãos (Yasuda et al., 2022, Choque et al., 2024).
Nos últimos anos, a transmissão oral tem sido a principal forma de infecção registrada, principalmente em regiões da Amazônia e áreas rurais. No período entre 2010 e 2020, foram relatados surtos associados a alimentos contaminados, sendo o açaí uma das principais fontes de transmissão (Sobral et al., 2024).
A compreensão da maneira pela qual os seres humanos, vetores e indicadores ambientais interagem para promover a transmissão de T. cruzi na área e a identificação de fatores de risco em nível domiciliar e peridomiciliar é necessária e útil para direcionar o desenvolvimento de estratégias eficazes na prevenção e controle do vetor e consequentemente na redução da infecção humana nessas áreas (Sousa, et al., 2024).
CONCLUSÕES
A análise temporal demonstrou que a taxa de incidência de casos notificados da doença de chagas no brasil entre os anos 2010-2019 obteve aumento de casos durante o período de analisado, reforçando a necessidade de políticas públicas principalmente no estado do Pará, onde foi detectado as maiores taxas de incidência dos casos do Brasil. Atualmente há uma baixa incidência e prevalência da doença no mundo, assim como no Brasil, especialmente nas regiões Sudeste e Sul, a transmissão vetorial está sob controle, sendo raros os novos casos.
Porém a Amazônia tem registrado casos esporádicos, muitas vezes em surtos devido à ingestão de alimentos contaminados e o Brasil ainda abriga um grande número de pessoas que vivem com a forma crônica da doença, resultado de infecções adquiridas décadas atrás.
Em virtude da grande devastação das matas ocorrido nas últimas décadas, pode haver a possibilidade de mudança de hábitos do T. cruzi reafirmando a necessidade de se manter uma vigilância sobre a situação epidemiológica dessa doença.
Diante disso, e com a relevância do assunto para a comunidade científica e para a saúde pública, deve-se fomentar pesquisas que possam incentivar novas investigações epidemiológicas correlacionadas ao tema nos próximos anos em todas as regiões do país.
REFERÊNCIAS
BITTENCOURT, Luiz Felipe Santiago, et al. Análise temporal e espacial da prevalência de doença de chagas aguda no estado do Pará no período de 2010 a 2014. Brazilian Journal of Health Review, , v. 3, n. 4, p. 7874–7892, 2020. Disponível em: https://ojs.brazilianjournals.com.br/ojs/index.php/BJHR/article/view/12980
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Doença de Chagas aguda no Brasil: série histórica de 2000 a 2013. Bol Epidemiol. v. 46, n. 21, p. 1-9, 2015. Disponível em: https://www.gov.br/saude/pt-br/assuntos/saude-de-a-a-z/d/doenca-de-chagas/arquivos/boletim-epidemiologico-volume-46-no-21-2015-doenca-de-chagas-aguda-no-brasil-serie-historica-de-2000-a-2013.pdf/view
BRASIL. Ministério da saúde. Secretaria de vigilância em saúde. Departamento de vigilância epidemiológica. Doenças infecciosas e parasitárias: guia de bolso. Departamento de Vigilância Epidemiológica. Secretaria de Vigilância em Saúde. Ministério da Saúde, 2010. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/svsa/doencas-diarreicas-agudas/doencas-infecciosas-e-parasitarias_-guia-de-bolso.pdf
BRASIL. Secretaria de Vigilância em Saúde Ministério da Saúde. Boletim Epidemiológico, ano 2, 2021. Disponível em: https://www.saude.ce.gov.br/download/boletins/
CARDOSO Elline Jahne de Souza, et al. Perfil epidemiológico dos portadores de doença de Chagas: dos indicadores de risco ao processo de enfrentamento da doença. Arq. Ciênc. Saúde, v. 24, n. 1, p. 41-46, 2017. Disponível em: https://ahs.famerp.br/racs_ol/Vol-24-1/perfil-epidemiologico-dos-portadores-de-doenca-de-chagas-dos-indicadores-de-risco-ao-processo-de-enfrentamento-da-doenca.pdf
CHOQUE, Ana Gabriela Herrera, et al. Parasitic Effects on the Congenital Transmission of Trypanosoma cruzi in Mother–Newborn Pairs. Microorganisms v.12, p.1243, 2024. https://doi.org/10.3390/microorganisms12061243
CUNHA, Giovanna dos Santos, et al. PREVALÊNCIA DA DOENÇA DE CHAGAS NO NORTE DO BRASIL. Revista Multidisciplinar em Saúde, v. 2, n. 1, p. 97, 2021. Disponível em: https://editoraime.com.br/revistas/index.php/rems/article/view/913
DIAS, João Carlos Pinto. Os primórdios do controle da doença de Chagas (em homenagem a Emmanuel Dias, pioneiro do controle, no centenário de seu nascimento). Rev. Soc. Bras. Med. Trop., 2011. Disponível em: https://www.scielo.br/j/rsbmt/a/gkDYJcKYz8CR9FNDLTmD9Hd/?format=pdf&lang=pt
DIAS, João Carlos Pinto, et al. Mudanças no paradigma da conduta clínica e terapêutica da doença de Chagas: avanços e perspectivas na busca da integralidade da saúde. Epidemiol. e Serviços Saúde, 25 (núm. esp.): 87 – 90, 2016. Disponível em: https://www.scielo.br/j/ress/a/jBwFdrNhQjcpKJSc5StyScB/?format=pdf&lang=pt
FELIPE, Alberto Gabriel Borges, et al. Doença de chagas: Análise de mortalidade na região Centro-Oeste do Brasil (2008 a 2017). Brazilian Journal of Health Review, v. 3, n. 6, p. 16102–16107, 2020. Disponível em: https://ojs.brazilianjournals.com.br/ojs/index.php/BJHR/article/view/19658/15752
MACEDO, Thaís Lemos de Souza, et al. Análise do perfil epidemiológico da Doença de Chagas no Brasil. Período entre 2001 e 2018. Revista de Saúde, v. 12, n. 3, p. 42–49, 2021. Disponível em: http://editora.universidadedevassouras.edu.br/index.php/RS/article/view/2514.
NEGRETTE, Olga Sánchez, et al. Prevalencia de infección por Trypanosoma cruzi en escolares de Salta y Chaco, Argentina. Acta bioquímica clínica latinoamericana, v. 51, n. 4, p. 687-694, 2017. Disponível em: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-29572017000400016
OLIVEIRA, Evaldo Hipólito, et al. Acute Chagas Disease in northeastern Brazil: epidemiology and temporal evolution. Research, Society and Development, v. 9, n. 8, p. e878986645, 2020. Disponível em: https://rsdjournal.org/index.php/rsd/article/view/6645
OPAS. Pan American Health Organization. Chagas disease (American trypanosomiasis), 2017. Disponível em : www.paho.org/hq/index.php?option=com_topics&view=article&id=10&Itemid=40743&l.
SCHMUNIS, Gabriel A. Epidemiology of Chagas disease in non endemic countries: the role of international migration. Memórias do Instituto Oswaldo Cruz, v. 102, p. 75-86, 2007. Disponível em: https://www.scielo.br/j/mioc/a/9vpy7ZcByRrwS3HtVDv4mqB/?format=pdf&lang=en
SILVA, Arivonaldo Vaniel da. Ocorrência de triatomíneos infectados por Trypanosoma cruzi registrados na V- Geres/Sespe/Brasil. 2019. 42 f. Trabalho de Conclusão de Curso (Bacharelado em Medicina Veterinária) – Unidade Acadêmica de Garanhuns, Universidade Federal Rural de Pernambuco, Garanhuns, 2019.
SOBRAL, Marcus Aurelio Farias, et al. Uma ameaça silenciosa, o crescimento das infecções orais por Trypanossoma Cruzi: Uma revisão integrativa Research, Society and Development, v. 13, n. 2, e11213245108, 2024. DOI: http://dx.doi.org/10.33448/rsd-v13i2.45108
SOUSA, Maressa Laíse Reginaldo, et al. Indicadores ambientais e captura de triatomíneos em área rural com histórico recente de captura do vetor. Brazilian Journal of Health Review, v. 7, n. 1, p. 2369-2388, 2024. DOI: https://doi.org/10.34119/bjhrv7n1-190
SOUZA, Wanderley. O parasita e sua interação com os hospesdeiros. In: BRENER, Z. et al. Trypanosoma cruzi e doença de Chagas. Rio de Janeiro: Guanabara Koogan, 1999.
TELES, Weber de Santana, et al. Doença de Chagas infantil em área rural do Nordeste brasileiro: risco de transmissão e reflexões sociais. Interfaces Científicas – Humanas e Sociais, v. 3, n. 1, p. 9–18, 2014. Disponível em: https://periodicos.set.edu.br/humanas/article/view/1509/987
YASUDA, Maria Aparecida Shikanai, et al. Emerging and reemerging forms of Trypanosoma cruzi transmission. Memórias do Instituto Oswaldo Cruz. v.117, p.1-8, 2022. DOI: 10.1590/0074-02760210033
1Mestranda do Programa de Pós-Graduação em Ciências da Saúde, Faculdade de Medicina da Universidade Federal de Mato Grosso (UFMT);
2Especialista em Imagenologia. Docente da Faculdade Educare-MT e da União das Faculdades Católicas de Mato Grosso (UNIFACC);
3Mestranda em Enfermagem pela Universidade Federal de Mato Grosso (UFMT);
4Doutora em Ciências. Docente do Curso de Medicina da Universidade de Cuiabá (UNIC)
5Doutor em Ciências. Docente do Programa de Pós-Graduação em Ciências da Saúde, Faculdade de Medicina da Universidade Federal de Mato Grosso (UFMT).
