REGISTRO DOI: 10.69849/revistaft/ni10202409081007
Joaquim Felipe Junior1; Vitória Ribeiro Barbosa de Menezes2; Júlia Veríssimo Delgado de Souza3; Emilene Correia Gomes de Santana4; Islla Beatriz Jardim Priston5; Elayne Feitosa dos Santos6; Belmiro Vasconcelos7; Thyago Morais Vicente da Silva8; Ricardo José de Holanda Vasconcellos9; Emanuel Dias de Oliveira e Silva10
RESUMO
Introdução: O ameloblastoma é um tumor de crescimento lento, com expansão óssea e altas taxas de recidiva. Origina-se do esmalte, folículo dental, ligamento periodontal ou revestimento de cistos odontogênicos e epitélio odontogênico. Recentemente, em 2022, a OMS reclassificou os ameloblastomas em convencional, unicístico, periférico e metastático devido visões prospectivas baseadas em atualizações de estudos genéticos, o que vem gerando um dilema na literatura sobre qual a abordagem terapêutica ideal do ameloblastoma convencional, para proporcionar menor risco cirúrgico e morbidade ao paciente. Objetivo: Realizar uma revisão integrativa da literatura, descrevendo 02 ressecções de ameloblastomas convencionais após tratamento conservador e 01 relato de transformação periférica fornecendo informações valiosas sobre seu manejo. Metodologia: O presente estudo foi dividido em duas etapas. A primeira etapa consiste em uma série descritiva de três casos de ameloblastomas convencionais tratados de maneira conservadora onde dois foram submetidos a uma posterior ressecção parcial e o terceiro caso apresentou evolução para ameloblastoma periférico. Na segunda etapa, foi realizada uma revisão integrativa e sistemática, conduzida de acordo com as recomendações do PRISMA, acerca da ressecção e exérese no tratamento dos ameloblastomas convencionais. Resultados: A classificação e opções de tratamento do ameloblastoma são baseadas nas características histopatológicas e podem variar desde a enucleação até a ressecção com reconstrução. Este estudo concentra-se em três relatos de casos em pacientes com ameloblastoma convencional. O tratamento envolveu duas ressecções parciais com reconstrução primária e uma enucleação associada à osteotomia periferica após tratamentos conservadores sem acompanhamento prolongado. O tratamento de escolha e a recidiva foram avaliados, e os pacientes obtiveram resultados satisfatórios. Conclusão: Não existe consenso sobre o tratamento de ameloblastomas. Tanto cirurgias conservadoras quanto intervenções radicais são utilizadas. A escolha deve tratamento deve levar em conta a localização, tamanho, idade, condição de saúde geral e cooperação do paciente, possibilidade de acompanhamento a longo prazo, padrão histopatológico e experiência profissional.
Palavras-chave: Ameloblastoma; Reconstrução Mandibular; Tumores Odontogênicos.
ABSTRACT
Introduction: Ameloblastoma is a slow-growing tumor, presenting bone expansion and high recurrence rates. It originates from the tooth enamel, dental follicle, periodontal ligament or lining of odontogenic cysts and odontogenic epithelium. Recently, in 2022, the WHO reclassified ameloblastomas into conventional, unicystic, peripheral and metastatic due to prospective views based on updates to genetic studies, which has generated a dilemma in the literature regarding the ideal therapeutic approach for conventional ameloblastoma, to provide a lower surgical risk and morbidity to patients. Purpose: Carry out an integrative review of the literature, describing 02 resections of conventional ameloblastomas after conservative treatment and 01 report of peripheral transformation, providing valuable information on management. Methodology: The current study was divided into two stages. The first step consists in a descriptive series of three cases of conventional ameloblastomas treated by conservative methods, where two of them were subsequently submitted to partial resection and the third one turned into a peripheral ameloblastoma. In the second step, an integrative and systematic review was carried out in accordance with the PRISMA recommendations on resection and excision for treating conventional ameloblastomas. Results: Classification and treatment methods in cases of ameloblastoma are based on histopathological characteristics and can range from enucleation to resection with reconstruction. This study focuses on three case reports of patients with conventional ameloblastoma. The treatment consisted in two partial resections with primary reconstructions and one enucleation combined with a peripheral osteotomy after conservative treatments without prolonged follow-up. The treatment of choice and recurrence were evaluated, and the patients had satisfactory results. Conclusion: There is no consensus on the treatment of ameloblastomas. Both conservative surgeries and radical interventions are used. The chosen treatment must take into account the location of the tumor, size, age, general health condition and cooperation of the patient, possibility of long-term delivery, histopathological pattern and professional experience.
Keywords: Ameloblastoma; Mandibular Reconstruction; Odontogenic Tumors.
1 INTRODUÇÃO
O ameloblastoma (AM) é o segundo tumor odontogênico benigno mais comum, seguido do odontoma (SLOOTWEG; BAUMHOER, 2019). Este tumor foi descrito pela primeira vez por Cusack em 1827 e é o tumor odontogênico de ocorrência mais frequente na mandíbula (GHAI, 2022). Nessa conjuntura, AM é uma neoplasia benigna de origem epitelial, e seu surgimento relaciona-se ao esmalte, folículo dental, ligamento periodontal ou revestimento de cistos odontogênicos que não progride para a formação do esmalte (ADEEL et al., 2018).
Os ameloblastomas foram classificados pela Organização Mundial da Saúde (OMS) de 2017 em sólidos/multicísticos, periféricos, desmoplásicos e unicísticos com implicações para o tratamento, das quais cerca de 13% a 21% de todos os casos são unicísticos. (SARGOLZAEI; ATARBASHI-MOGHADAM; ROOHI, 2019). Entretanto, na mais recente classificação da OMS de 2022, os ameloblastomas foram abreviados às variantes de ameloblastoma (convencional), unicística, periférica e metastática devido à introdução de visões prospectivas baseadas em atualizações de estudos genéticos (SOLUK-TEKKESIN; WRIGHT, 2022).
AM se apresenta com semelhante frequência em homens e mulheres, acometendo a mandíbula em 84% dos casos com prevalência entre a quarta e quinta décadas de vida (MASTHAN et al., 2015). O ameloblastoma clinicamente apresenta crescimento lento e altas taxas de recidiva (KREPPEL; ZÖLLER, 2018), podendo apresentar expansão óssea em especial na região de molares e ramo mandibular, sendo inicialmente um quadro indolente, enquanto o progresso da lesão leva a queixa álgica, aumento de volume e desconforto (PETROVIC et al., 2018). Radiograficamente se apresentam radiolúcidos, sendo multiloculares ou uniloculares. Possuem bordas bem definidas, e frequentemente podem gerar deslocamentos, reabsorções radiculares de dentes associados à lesão e relação com terceiros molares inferiores inclusos (BROWN; BETZ, 2015). O diagnóstico diferencial inclui displasia fibrosa em sua fase radiolúcida, lesão central de células girantes, mixoma, cisto dentígero, tumor odontogênico queratocístico e cisto ósseo simples (KITISUBKANCHANA et al., 2021) e que condiciona a necessidade de confirmação do diagnóstico pelo exame histológico (RANCHOD et al., 2021).
A recorrência do ameloblastoma convencional é alta, ainda mais nos casos tratados de forma conservadora (RUSLIN et al., 2018), não obstante a abordagem radical envolve maiores complicações pós-operatórias, além de diminuição da qualidade de vida, ao componente estético e função (DANDRIYAL et al., 2022).
A variante unicística apresenta comportamento biológico menos agressivo, respondendo bem ao tratamento conservador (HSU; CHIANG; CHEN, 2014), apesar disso, alguns casos requerem tratamentos mais agressivos (MCCLARY, 2016). A variante periférica tem outra origem e responde bem a excisão local (MASTHAN et al., 2015). Em virtude de seu comportamento biológico, crescimento lento, caráter localmente invasivo e com altas taxas de recidiva, não existe consenso sobre o tratamento do ameloblastoma (NAKAMURA et al., 2002).
O tratamento pode ser conservador (marsupialização, enucleação, curetagem), geralmente utilizado nos casos de ameloblastoma unicístico; ou radical, que corresponde à ressecção marginal, também chamada de segmentar, e à ressecção parcial, ambas utilizadas nos casos de ameloblastoma convencional (HENDRA et al., 2019). Individualmente o tratamento apresenta vantagens e desvantagens, gerando dilema na literatura sobre qual a abordagem terapêutica ideal do ameloblastoma, considerando que o padrão histopatológico para alguns autores é um considerável ponto a ser observado (SAMUEL et al., 2014). Por outro lado, porém, a escolha do tratamento depende não apenas do padrão histopatológico, mas também da sua localização, tamanho, idade e condicionamento do paciente para um acompanhamento a longo prazo (BORRELLO et al., 2016).
O presente estudo tem como objetivo realizar uma revisão integrativa descrevendo a ressecção de ameloblastomas convencionais após tratamento conservador e relato de transformação periférica fornecendo informações valiosas sobre o manejo.
2 REVISÃO DA LITERATURA
2.1 Conceito
AM é um tumor que se caracteriza por ser localmente invasivo e apresentar crescimento lento do epitélio odontogênico, originando-se predominantemente do tecido do esmalte que não passou por diferenciação, como remanescentes epiteliais do órgão do esmalte, da lâmina dentária, de cistos odontogênicos ou células basais da mucosa bucal. (MASTHAN et al., 2015). Sua identificação inicial remonta a 1827, quando Cusack o reconheceu pela primeira vez (CUSACK, 1827). Posteriormente, em 1885, o médico francês Louis-Charles Malassez o designou como ‘adamantinoma’ (MALASSEZ, 1910) e em 1930, Ivey e Churchill renomearam o tumor como ‘ameloblastoma’ (IVEY; CHURCHILL, 1930). Em 2017, a OMS classificou o ameloblastoma como um dos tumores odontogênicos epiteliais benignos (VERED; MULLER; HEIKINHEIMO, 2017). Mutações em genes associados à via MAPK são frequentemente identificadas em ameloblastomas, sendo a mutação BRAFV600E a mais prevalente (SWEENEY et al., 2014).
2.2 Classificação
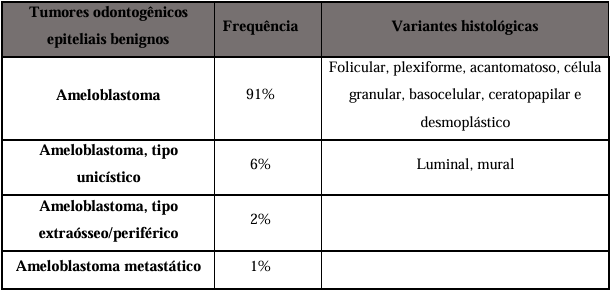
Em 1971, a OMS incluiu os tumores odontogênicos em sua primeira classificação histológica, estabelecendo critérios clinicopatológicos para o diagnóstico. Para enfatizar a terminologia padrão internacionalmente, que posteriormente foi modificada em 1992 nasegunda edição (KRAMER; PINDBORG; SHEAR, 1992). Com o advento de técnicas auxiliares avançadas, uma terceira edição atualizada foi proposta por Philipsen e Reichart em 2005 (WRIGHT et al., 2014). A quarta edição da Classificação de Tumores de Cabeça e Pescoço da OMS, publicada em 2017, simplifica as versões anteriores e categoriza os ameloblastomas em quatro tipos: ameloblastoma convencional, ameloblastoma unicístico, ameloblastoma extraósseo/periférico e ameloblastoma metastático (Quadro 1) (VERED; MULLER; HEIKINHEIMO, 2017). Na atual classificação da OMS de 2022, os ameloblastomas foram abreviados em ameloblastoma (convencional), unicístico, periférico e metastático devido à introdução de visões prospectivas baseadas em atualizações de estudos genéticos (SOLUK-TEKKESIN; WRIGHT, 2022). O termo “sólido/multicístico” para o ameloblastoma convencional foi eliminado devido à falta de significado prognóstico e ao risco de confusão com o ameloblastoma unicístico. O ameloblastoma desmoplásico, que havia sido subcategorizado como AM na classificação anterior da OMS de 2005, também foi retirado por ser considerada apenas uma variante histológica do ameloblastoma convencional, apesar de suas características clínicas e às vezes radiográficas únicas (WRIGHT; VERED, 2017). Da mesma forma, o odontoameloblastoma, mencionado na classificação de 2005, foi excluído e é agora precisamente descrito como um ameloblastoma originado em um odontoma, não sendo mais denominado odontoameloblastoma. O ameloblastoma metastático foi reclassificado como benigno, afastando-se da categorização anterior como um tumor odontogênico maligno, pois exibe histopatologia benigna, embora apresente potencial metastático, tornando difícil a distinção histopatológica do ameloblastoma convencional (VERED; MULLER; HEIKINHEIMO, 2017).
Recentemente, houve esforços para incluir o ameloblastoma adenóide como um subtipo na próxima revisão da classificação de tumores odontogênicos da OMS (JAYASOORIYA et al., 2022). O ameloblastoma adenóide é um tumor odontogênico híbrido que compartilha características histopatológicas com o ameloblastoma e com o tumor odontogênico adenomatóide. Embora demograficamente semelhante ao ameloblastoma convencional, o ameloblastoma adenóide apresenta diferenças histopatológicas e uma maior taxa/múltiplas recorrências, indicando sua natureza biologicamente agressiva (JAYASOORIYA et al., 2022)
Quadro 1 – Classificação do ameloblastoma de acordo com a Classificação de Cabeça e Tumores no pescoço, publicado em 2017.
2.3 Epidemiologia do ameloblastoma
O ameloblastoma apresenta uma prevalência geográfica variável, com uma incidência global de 0,92 casos por milhão de pessoas/ano (HENDRA et al., 2020). A maioria dos estudos epidemiológicos indica que este tumor é o mais comum entre os tumores odontogênicos benignos ou o segundo mais comum. Um estudo brasileiro, abrangendo 6.231 lesões orais, revelou que, dos 185 (3%) tumores odontogênicos benignas identificados, os ameloblastomas eram os mais frequentes, constituindo 29% do total, seguidos pelos tumores odontogênicos ceratocísticos (28%) e odontomas (19%) (OSTERNE et al., 2011). Da mesma forma, na China, duas extensas séries de tumores odontogênicos, uma compreendendo 759 casos e baseada na classificação da OMS de 1992 (LU et al., 1998) e outra compreendendo 1.642 casos e baseada na classificação da OMS de 2005 (JING et al., 2007), mostraram que AM era o tumor odontogênico mais prevalente, representando 59% e 40%, respectivamente. Entretanto, em outra série chinesa de 1.309 tumores odontogênicos, o tumor odontogênico ceratocístico foi o mais frequente (39%), seguido pelo ameloblastoma (37%) e odontomas (6%) (LUO; LI, 2009). Nos Estados Unidos e Canadá, AM é o segundo tumor odontogênico mais comum, sendo superado apenas pelo odontoma (DALEY et al., 1978).
Entre os estudos indianos, um extenso levantamento na região de Marathwada, em Maharashtra, analisando registros histopatológicos de 1992 a 2012, indicou que, dos 125 tumores odontogênicos benignos, o tumor odontogênico ceratocístico foi o mais prevalente (45%), seguido pelo ameloblastoma (35%), odontoma (7%) e tumor odontogênico adenomatóide (5%) (BHAGWAT et al., 2017).
AM geralmente se apresenta na faixa etária de 30 a 60 anos, com uma ligeira predominância no sexo masculino e localização mais comum na mandíbula (LARSSON; ALMERÉN, 1978). Em um estudo chinês realizado por Lu et al. (1998), a idade média de apresentação do AM foi de cerca de 31 anos, com 91% dos tumores localizados na mandíbula (LU et al., 1998). A proporção homem:mulher foi de 1,5:1. Hatada et al (2001), do Japão, documentou uma idade média de 35 anos com uma proporção homem: mulher de 1,6:1, com cerca de 93% dos tumores localizados também mandíbula (HATADA et al., 2001). Uma pesquisa envolvendo 52 casos de ameloblastomas na Índia revelou uma idade predominante de apresentação nas terceira e quarta décadas, com uma predominância masculina, sendo a mandíbula, especialmente a face posterior, o local mais comum tanto para casos novos quanto recorrentes (CARVALHO et al., 2017). Na região de Marathwada, na Índia, a distribuição etária indicou um pico de ocorrência na quarta década (31%) (BHAGWAT et al., 2017). Embora AM em crianças seja considerado raro, uma série indiana de 256 casos diagnosticados mostrou que apenas 15% ocorreram na faixa etária pediátrica, com uma proporção homem:mulher de 2:1 (BANSAL et al., 2015).
Uma revisão sistemática destacou uma diferenciação racial na prevalência relativa do AM, observando uma frequência significativamente maior em países asiáticos e hospitais africanos em comparação com hospitais europeus e americanos (MACDONALD-JANKOWSKI et al., 2004).
2.4 Apresentação clínica
A manifestação mais prevalente do AM é um aumento de volume indolor e de crescimento lento na mandíbula ou maxila. Em algumas situações, esse tumor é identificado por meio de achados radiográficos realizadas por razões diversas (KREPPEL; ZÖLLER, 2018).
A predominância de casos de ameloblastoma convencional (80%) ocorre na mandíbula, especialmente na região posterior, enquanto os ameloblastomas tende também a se manifestar predominantemente na região do corpo, ramo e ângulo da mandíbula (SINGH et al., 2015). A presença de terceiros molares não erupcionados também pode estar associada ao AM. Este tumor não apresenta predileção por sexo e é mais comumente diagnosticada em adultos entre 30 e 60 anos (GHAI, 2022).
A variante desmoplásica desse tumor é frequentemente encontrada na parte anterior da maxila ou mandíbula, com seu crescimento direcionado no sentido vestíbulo-lingual, resultando em notável expansão. Em média, os ameloblastomas apresentam um tamanho inicial de cerca de 4 cm (BOFFANO et al., 2021). Embora a dor seja incomum, pode ocorrer devido à hemorragia dentro ou adjacente ao tumor. Outros sinais desse tumor incluem má oclusão, deformidade facial, invasão de tecidos moles e mobilidade dos dentes (SOLUK-TEKKESIN; WRIGHT, 2017). A variante unicística do AM é mais comum em indivíduos na faixa etária pediátrica e possivelmente se origina de um cisto dentígero pré-existente ou de um folículo dentário, devido à sua frequente relação dentígera com um dente não erupcionado. Dessa forma, a região do terceiro molar é a localização mais comum para o ameloblastoma unicístico (GHATTAMANENI et al., 2017; MASTHAN et al., 2015). Já a variante periférica do ameloblastoma geralmente se apresenta como um aumento de volume gengival indolor e de crescimento lento em adultos. A média de idade para o ameloblastoma metastático é de 43±16 anos, com uma leve predileção pelo sexo masculino.
AM, caracterizado por seu crescimento lento, foi objeto de uma revisão sistemática composta por 16 estudos, que calculou uma taxa média de crescimento específico em 87,84% ao ano. A maior taxa de crescimento foi associada à variante sólida e multicística do ameloblastoma, enquanto os ameloblastomas periféricos apresentaram a menor taxa de crescimento CHAE et al., 2015).
2.5 Diagnóstico
O diagnóstico do AM exige a realização de exames de imagem, geralmente utilizando tomografia computadorizada (TC), além de uma biópsia. A TC é eficaz para identificar uma lesão expansiva radiotransparente, comumente bem definida e uni ou multilocular. Este método também é útil para avaliar a destruição cortical ou a extensão de tecidos moles (MCCLARY et al., 2016). Embora os ameloblastomas originados no osso muitas vezes sejam frequentemente identificados em radiografias panorâmicas ou filmes periapicais, a extensão dos tecidos moles ou a invasão óssea frequentemente não são precisamente documentadas. Na radiografia, o ameloblastoma se apresenta como uma lesão lítica com margens recortadas, exibindo também molares impactados e reabsorção das raízes dentárias.
O ameloblastoma multilocular mais comum se manifesta como a típica aparência de “bolha de sabão” em radiografias. Quando originário da maxila, a ressonância magnética é preferível à tomografia computadorizada, pois oferece uma caracterização mais detalhada da possível extensão à base do crânio, órbita ou seios paranasais. A ressonância magnética também é a modalidade de imagem preferida para o ameloblastoma desmoplásico, devido às suas margens de tecidos moles menos definidas, que podem ser erroneamente diagnosticadas como uma lesão fibro-óssea (MCCLARY et al., 2016). O ameloblastoma unicístico geralmente é diagnosticado somente após exame histopatológico, já que se assemelha a um cisto odontogênico tanto clinicamente quanto radiograficamente. Em imagens de tomografia computadorizada ou ressonância magnética, o ameloblastoma unicístico apresenta uma radiolucência unilocular finamente corticada, geralmente associada a um dente não erupcionado e muitas vezes levando a uma expansão da mandíbula (MASTHAN et al., 2015; SAGHRAVANIAN et al., 2015). No caso do ameloblastoma metastático, uma tomografia por emissão de pósitrons (PET) é geralmente preferida para detectar metástases à distância (GHAI, 2022).
Dado que nenhuma característica radiológica é patognomônica, o diagnóstico definitivo do ameloblastoma só é alcançado por meio de biópsia. A histopatologia desempenha um papel crucial na diferenciação do ameloblastoma de outras lesões como fibroma ossificante, osteomielite, tumor de células gigantes, displasia fibrosa cística, mieloma e sarcoma. O estadiamento pré-operatório em casos de ameloblastoma maligno também é determinado por biópsia (MCCLARY et al., 2016). A biópsia por agulha Trucut pode ser realizada sob orientação de TC através de um alvéolo dentário ou uma janela de erosão cortical. No caso de biópsia incisional, é necessária a ruptura da mucosa, que eventualmente precisará ser removida durante a cirurgia. O ameloblastoma periférico, por não ser coberto por osso, pode ser facilmente submetido à biópsia (MCCLARY et al., 2016).
2.6 Achados radiográficos
Radiologicamente, os ameloblastomas geralmente exibem uma imagem osteolítica unilocular ou multilocular bem definida, circundada por uma margem radiopaca, muitas vezes com expansão do córtex ósseo, com possibilidade de reabsorção radicular e eventual associação com dente impactado (ALMEIDA et al., 2016; RUSLIN et al., 2018).
A radiografia panorâmica de rotina faz parte da investigação diagnóstica para rastreamento de patologias. No entanto, a radiografia panorâmica não pode excluir outros diagnósticos cujas características radiológicas possam ser semelhantes às dos ameloblastomas (KITISUBKANCHANA et al., 2021; RANCHOD et al., 2021).
As características típicas dos radiogramas convencionais de ameloblastomas são lesões radiolúcidas multiloculares ou uniloculares com extenso adelgaçamento e expansão da cortical sobrejacente, o que é uma característica importante para o diagnóstico diferencial. Além disso, eles estão ocasionalmente associados com dentes inclusos. Esses achados não são patognomônicos para ameloblastomas e também podem indicar outros tumores e cistos odontogênicos, estes incluem ceratocisto odontogênico, fibromixoma, fibrossarcoma, hemangioma, cisto ósseo aneurismático e tumor de células gigantes (KITISUBKANCHANA et al., 2021; RANCHOD et al., 2021).
Portanto, o diagnóstico diferencial por radiografia convencional é difícil. Vários investigadores tentaram diferenciar o ameloblastoma do tumor odontogênico ceratocístico com o uso de tomografia computadorizada e ressonância magnética. Os fluidos císticos dos tumores odontogênicos ceratocísticos têm baixa concentração de proteínas solúveis, enquanto aqueles dos ameloblastomas geralmente contêm fluidos levemente proteicos, ocasionalmente associados a materiais coloidais. Portanto, os tumores odontogênicos ceratocísticos apresentam menor densidade da tomografia computadorizada do que os ameloblastomas (KITISUBKANCHANA et al., 2021).
2.7 Achados histopatológicos
Do ponto de vista histológico, AM é composto por dois tipos distintos de células: as “células basais”, localizadas na periferia e semelhantes a ameloblastos, e as “células epiteliais” suprabasais, posicionadas centralmente e assemelhando-se ao retículo estrelado. As células basais exibem características hipercromáticas, formato colunar, organização em paliçada, citoplasma vacuolizado e núcleos deslocados da membrana basal (inversão de polaridade). Por outro lado, as células epiteliais apresentam uma morfologia citológica mais suave, com figuras mitóticas esparsas, refletindo sua taxa de crescimento lento (CHANDAVARKAR et al., 2014).
No ameloblastoma clássico, anteriormente designado como ameloblastoma sólido/multicístico, as células basais e epiteliais organizam-se em dois padrões característicos: folicular e plexiforme. O padrão folicular revela células epiteliais agrupadas em ilhas ou folículos, circundadas por tecido conjuntivo, enquanto o padrão plexiforme mostra as células epiteliais entrelaçadas em uma rede plexiforme envolvendo o tecido conjuntivo. Em alguns casos, os ameloblastomas podem exibir ambos os padrões em diferentes proporções dentro do mesmo tumor. Diversas variantes histológicas adicionais de ameloblastomas multicísticos foram identificadas, como ameloblastomas desmoplásicos, acantomatosos, de células basais, de células granulares e queratopapilares. Estas variantes frequentemente se sobrepõem a um dos dois padrões principais característicos, sendo que apenas o ameloblastoma desmoplásico pode exibir um comportamento mais agressivo (NARIAI et al., 2019).
A identificação histológica do ameloblastoma unicístico representa, muitas vezes, um desafio para o patologista, pois as características diagnósticas clássicas podem não ser facilmente observáveis. O tecido sólido geralmente está ausente, sendo recuperados apenas fragmentos membranosos da parede do cisto. As células basais na parede do cisto podem apresentar alongamento limitado, e a característica paliçada nuclear muitas vezes é restrita a um pequeno grupo celular. Embora as células suprabasais possam estratificar-se na forma de retículo estrelado, elas podem apresentar inflamação sobreposta. O ameloblastoma unicístico possui duas variantes histológicas: luminal e mural. Na variante luminal, a parede do cisto se apresenta como um saco uniforme revestido pelo epitélio do AM, e, ocasionalmente, espessamentos da parede composta por células de ameloblastoma podem invaginar o lúmen. Na variante mural, as ilhas tumorais infiltramse na parede fibrosa de maneira semelhante ao ameloblastoma convencional (SARGOLZAEI; ATARBASHI-MOGHADAM; ROOHI, 2019).
No ameloblastoma periférico, o retículo estrelado raramente é evidente, e a maioria das ilhas epiteliais exibe paliçadas de células basais colunares. Não há envolvimento de osso ou periósteo, embora o tumor possa causar uma impressão superficial no osso subjacente.
O ameloblastoma metastático apresenta uma histologia benigna e bem diferenciada semelhante ao tipo sólido/multicístico no sítio primário. Além disso, focos semelhantes de histologia benigna também são observados em locais remotos do sítio primário, considerados metástases (MCCLARY et al., 2016). Como a diferenciação histológica entre o ameloblastoma não metastático e metastático não é possível, o diagnóstico de ameloblastoma metastático só pode ser feito retrospectivamente, após a ocorrência de metástase. O ameloblastoma folicular foi mais frequentemente encontrado no sítio secundário, seguido pelo tipo plexiforme, sendo os pulmões os locais secundários mais comumente afetados (PANDIAR et al., 2021).
2.8 Tratamento
O objetivo do tratamento cirúrgico para AM é minimizar as recorrências e restaurar a função e estética, com mínima morbidade na área doadora. Atualmente, a abordagem cirúrgica recomendada para o ameloblastoma clássico (tipo sólido/multicístico) é a ressecção completa em bloco (cirurgia radical) com margem de segurança adequada, classificada como osteotomia segmentar ou marginal para a mandíbula, e maxilectomia parcial ou total para a maxila. A ressecção ampla, com uma margem óssea de 1 a 1,5 cm, é recomendada devido à alta taxa de recorrência após cirurgia conservadora, especialmente para ameloblastomas sólidos/multicísticos (MCCLARY et al., 2016).
Contudo, uma recente meta-análise não conseguiu estabelecer a superioridade da cirurgia radical em comparação com a conservadora (SLUSARENKO DA SILVA et al., 2018). A recorrência é atribuída à infiltração de células tumorais no osso esponjoso além da periferia das margens radiográficas (COVELLO; BUCHBINDER 2016). É essencial garantir a reconstrução óssea imediata ou tardia e a reabilitação dentária para ajudar na fala, deglutição e melhorar os resultados gerais dos pacientes (MCCLARY et al., 2016).
Entretanto, a cirurgia radical pode resultar em deformidades estéticas, prejuízos funcionais e impacto psicológico. Buscando evitar essas complicações, têm sido exploradas abordagens conservadoras, incluindo marsupialização, enucleação, curetagem, enucleação combinada com solução de Carnoy, enucleação combinada com curetagem e curetagem combinada com crioterapia (TITINCHI; BRENNAN, 2022). No entanto, essas estratégias conservadoras estão associadas a uma alta taxa de recidiva, relatada como sendo de 40% em uma recente meta-análise (ALMEIDA et al., 2016). Em casos de ameloblastoma primário sólido/multicístico tratado de forma conservadora, o risco relativo de recorrência é três vezes maior em comparação com o tratamento radical (ALMEIDA et al., 2016). Outra meta-análise, englobando quatro estudos sobre a abordagem radical versus conservadora para AM, documentou uma maior taxa de recorrência após a abordagem conservadora (TROIANO et al., 2017). Portanto, justifica-se a ressecção óssea no tratamento do ameloblastoma multicístico primário.
Para reconstrução mandibular, enxertos ósseos livres vascularizados, como os da fíbula, ílio, escápula ou rádio, são considerados padrão, sendo o retalho livre de fíbula a opção de escolha, oferecendo a vantagem adicional de reconstruir defeitos mandibulares de segmento longo (KALWAGADDA et al., 2020). O retalho livre oblíquo interno da crista ilíaca é particularmente indicado para reconstrução mandibular, aproveitando a utilidade do músculo oblíquo interno para formar um fechamento de tecido mole sobre o osso. Para defeitos do ângulo mandibular, a crista ilíaca é preferida, eliminando a necessidade de múltiplas osteotomias, como observado na fíbula (MCCLARY et al., 2016). Pacientes submetidos à reconstrução com retalho livre osteomiocutâneo podem ser considerados para implantes dentários osteointegrados (GAO et al., 2021), promovendo uma função mastigatória melhorada, menos consequências psicológicas e uma qualidade de vida aprimorada, de acordo com Pappalardo et al. (2018). A técnica de osteogênese por distração também está ganhando destaque na reconstrução mandibular após ressecção cirúrgica do tumor, e o uso de planejamento cirúrgico virtual 3D tem aprimorado ainda mais a precisão e previsibilidade da cirurgia reconstrutiva (GHAI, 2018).
A recorrência do ameloblastoma convencional é alta, principalmente nos casos tratados de forma conservadora (RUSLIN et al., 2018). Porém, o tratamento radical ao AM convencional envolve maior número de complicações pós-operatórias, além de diminuição da qualidade de vida, pois atinge regiões fundamentais para a estética e função do sistema estomatognático (DANDRIYAL et al., 2022; DE CAMPOS et al., 2022).
Na reconstrução do defeito maxilar, utiliza-se enxerto de pele para revestir a cavidade, e um obturador é instalado para facilitar o acesso durante a vigilância. Devido à menor resistência do osso cortical da maxila à invasão tumoral, em comparação com a mandíbula, o ameloblastoma da maxila apresenta uma taxa maior de recorrência local após procedimento cirúrgico. Portanto, retalhos livres não são empregados para defeitos maxilares, a fim de evitar cobrir potenciais locais de recorrência (MCCLARY et al., 2016).
Para ameloblastomas unicísticos, tanto a abordagem cirúrgica radical quanto a conservadora, incluindo excisão, marsupialização, eletrocautério químico, curetagem, radioterapia ou cirurgia combinada e radiação, são opções viáveis (MASTHAN et al., 2015; (MCCLARY et al., 2016; ZHENG, 2019). O ameloblastoma extraósseo/periférico é predominantemente tratado com ampla excisão local, apresentando uma taxa de recorrência relatada entre 9% e 20% após o tratamento (MASTHAN et al., 2015).
2.9 Prognóstico
O prognóstico do ameloblastoma é influenciado pela idade do paciente, localização e dimensão do tumor, tipo histológico, extensão e estágio da doença (MCCLARY et al., 2016). Este tumor, caracterizado por crescimento lento, apresenta uma taxa média de crescimento específico calculada em 87,8% ao ano, conforme uma meta-análise (CHAE et al., 2015). No entanto, quando não tratado, AM pode atingir proporções enormes, representando um risco para as vias aéreas (HENDRA et al., 2019).
Após tratamento, AM pode recidivar, com uma taxa global de recorrência de 9,8%, segundo um estudo chinês (YANG et al., 2017), e 19,3% de acordo com uma pesquisa multicêntrica europeia (BOFFANO et al., 2021). As taxas de recorrência estão diretamente relacionadas ao tipo de procedimento cirúrgico realizado (radical versus conservador), à adequação das margens cirúrgicas e, nos casos de extensão maxilar do AM para estruturas vitais, como órbita, seios paranasais ou base do crânio. A recorrência após cirurgia conservadora geralmente decorre da persistência da doença residual, que cresce lentamente na cavidade removida, enquanto a ressecção cirúrgica radical exibe taxas de recorrência significativamente inferiores. Mais de 50% das recorrências manifestam-se nos cinco anos subsequentes à intervenção cirúrgica primária (REICHART; PHILIPSEN; SONNER, 1995). Tumores com dimensões superiores a 6 cm ou que envolvem estruturas anatômicas adjacentes, incluindo tecidos moles, estão associados a uma taxa de recorrência mais elevada, independentemente do tipo de cirurgia empregado (YANG et al., 2017). Subtipos histológicos granulares e foliculares também estão correlacionados com uma maior incidência de recorrência (REICHART; PHILIPSEN; SONNER, 1995). Vigilância tumoral em assintomáticos os pacientes devem incluir exames clínicos e ortopantomografia a cada 6 meses durante o primeiro ano, depois, uma vez por ano durante no mínimo 10 anos (PETROVIC et al., 2018).
Em geral, os ameloblastomas maxilares tendem a ser mais agressivos e apresentam maior propensão à recorrência em comparação aos mandibulares, principalmente devido à fragilidade do osso cortical maxilar, que oferece uma barreira menos eficaz à disseminação local do tumor. Em situações não tratadas, pacientes com ameloblastoma maxilar que se estende até o sistema nervoso central ou aqueles com múltiplas recorrências enfrentam risco de mortalidade. (REICHART; PHILIPSEN; SONNER, 1995).
2.10 Avanços recentes
Recentemente, com o esclarecimento dos marcadores moleculares do ameloblastoma, têm sido realizadas abordagens para o tratamento dessa condição por meio de terapia molecular direcionada. Esses tumores apresentam mutações somáticas altamente recorrentes nas vias de sinalização da proteína quinase ativada por mitógeno (MAPK) e do ouriço sônico (SHH), conhecidas por serem ativadas durante o desenvolvimento dentário. No contexto da via MAPK, a mutação BRAFV600E é identificada em 57% dos casos de AM, enquanto na via SHH, a presença de mutações Smoothened (SMO) é observada em 24% dos casos (SWEENEY et al., 2014; MCCLARY et al., 2016). Notavelmente, os ameloblastomas com mutações BRAFV600E são predominantemente (96%) localizados na mandíbula, enquanto os ameloblastomas com mutações SMO são mais frequentes na maxila (85%). Os medicamentos direcionados à terapia molecular que inibem as funções de BRAF e MEK mutados têm potencial para serem utilizados no tratamento do AM. Três terapias moleculares direcionadas para a mutação BRAF V600E foram aprovadas pela Food and Drug Administration (FDA) dos Estados Unidos da América: vemurafenib e dabrafenib para a mutação BRAF, e trametinib para a mutação MEK (SHI et al., 2021). Em um estudo recente, observou-se uma resposta dramática à terapia de inibição dupla de BRAF/MEK com dabrafenibe/trametinibe em casos de ameloblastomas recorrentes na mandíbula com massas metastáticas em ambos os pulmões (KAYE et al., 2015). Da mesma forma, outro relatório demonstrou uma redução notável no volume de tumor em um ameloblastoma recorrente múltiplo da mandíbula em resposta à terapia única de inibição do BRAF com dabrafenibe (FADEN; ALGAZI, 2017).
3 OBJETIVOS
3.1 Objetivo Geral
Relatar uma série de três casos de ameloblastomas convencionais tratados anteriormente de forma conservadora com posterior ressecção parcial, tendo um dos relatos evoluído para um ameloblastoma periférico, bem como realizar uma revisão integrativa da literatura científica.
3.2 Objetivos específicos
Descrever o processo de diagnóstico clínico de ameloblastomas convencionais em região mandibular;
Descrever de forma sistematizada, na literatura científica, aspectos radiográficos de ameloblastomas convencionais;
Descrever as evidências atualmente disponíveis sobre o tratamento e acompanhamento na ressecção para ameloblastomas convencionais.
4 METODOLOGIA
4.1 Desenho do estudo
O presente estudo foi dividido em duas etapas. A primeira etapa consiste em uma série descritiva de três casos de ameloblastomas convencionais tratados de maneira conservadora com posterior ressecção parcial, tendo um destes casos evoluído para um caso de ameloblastoma periférico.
Na segunda etapa, foi realizada uma revisão integrativa da literatura acerca do tratamento de ressecção de ameloblastomas convencionais. O processo de revisão foi conduzido de acordo com as recomendações do PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-analyses) (PAGE et al., 2022) questionando se existe consenso sobre o tratamento conservador ou radical do ameloblastoma convencional.
4.2 Materiais e métodos para revisão integrativa da literatura
4.2.1 Estratégia de busca
Foi realizada uma busca, de forma independente, pelos pesquisadores (JFJ) e (VRBM) nas bases de dados PubMed, Scopus e Web of Science por artigos referentes ao tratamento de ressecção para ameloblastomas, publicados no corte temporal entre os anos de 2014 e 2024, em língua inglesa.
A estratégia de busca utilizou a seguinte combinação de descritores DeCS/MeSH e termos livres: (“ameloblastoma” OR “odontogenic tumors” AND “tumor resection”) e (“ameloblastoma” AND “tumor resection”).
Após a remoção das referências duplicadas os artigos foram listados e selecionados de acordo com a leitura do título e resumo e, em seguida, foram avaliados quanto à elegibilidade. Ademais, também foi feita uma busca manual de estudos adicionais que poderiam não ter sido listados na busca inicial.
4.2.2 Critérios de inclusão e exclusão
Critérios de inclusão: artigos completos sobre o tratamento do AM convencional, realizado nos últimos 10 anos, em inglês e português, e relatos de casos, ou estudos consagrados na área publicados anteriormente a este período.
Critérios de exclusão: artigos sem análise estatística, artigos que não apresentam a classificação dos tumores.
4.2.3 Seleção dos estudos
Ensaios clínicos, estudos transversais, estudos de coorte, estudos de caso-controle e estudos de séries de caso com ao menos 10 casos puderam ser selecionados para esta revisão. Estudos em animais, relatos de casos isolados, revisões da literatura e estudos que não relataram dados relevantes para o propósito deste estudo foram excluídos.
O coeficiente Kappa de Cohen foi utilizado para calcular a concordância interexaminadora durante a seleção das publicações, mostrando um nível de concordância quase perfeito entre os examinadores (JFJ) e (VRBM) (kappa = 0.92).
4.2.4 Extração dos dados
Os seguintes dados foram extraídos de cada um dos estudos selecionados: autoria; ano de publicação; desenho do estudo; tamanho da amostra; grupo de comparação; tipo histopatológico do tumor; duração da cirurgia; frequência de lesões nervosas; outras complicações relatadas; taxa de recorrência do tumor; tempo de acompanhamento. Estes dados foram classificados como quantitativos ou qualitativos e tabulados para comparação. Todos os pesquisadores verificaram a consistência dos dados e quaisquer divergências foram resolvidas por discussão até que um consenso fosse alcançado.
4.2.5 Avaliação da qualidade metodológica dos estudos
A ferramenta RoB (Risk-of-Bias) 2.0 da Cochrane32 foi utilizada para avaliar a qualidade metodológica e o risco de viés nos estudos incluídos na revisão. Esta ferramenta afere o risco de viés em cinco domínios: viés no processo de randomização, viés por desvios da intervenção pretendida, viés por dados ausentes, viés na aferição dos desfechos e viés no relato dos desfechos. Cada domínio é classificado em baixo risco de viés, algum risco de viés ou alto risco de viés e, ao final, o risco de viés global é obtido com base no maior risco apresentado pelos domínios. A avaliação da qualidade metodológica e do risco de viés foi conduzida de forma independente pelos dois pesquisadores (JFJ) e (VRBM), com um nível de concordância satisfatório entre eles (kappa =
0.92).
4.3 Considerações éticas
Adotando as diretrizes e normas estabelecidas pela Resolução de n° 466/2012 do CNS (Conselho Nacional de Saúde), os participantes cujo casos foram relatados foi informado dos riscos e benefícios do estudo, e concordou em fornecer seus dados clínicos, laboratoriais e de imagens contidos nos seus registros hospitalares para publicação, mediante assinatura de Termo de Consentimento Livre e Esclarecido (TCLE) (Anexo I-II-III). Aos participantes, ficam garantidas o anonimato, a confidencialidade e privacidade quanto ao uso da sua imagem e informações pessoais.
5 RESULTADOS
5.1 Relato do caso I
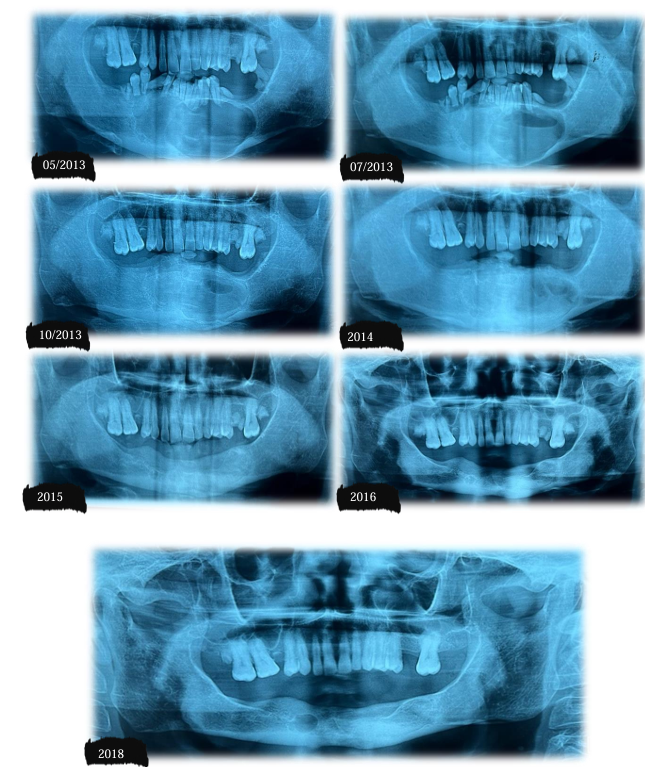
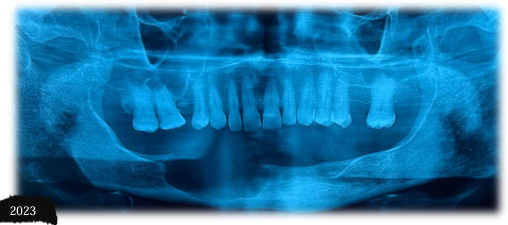
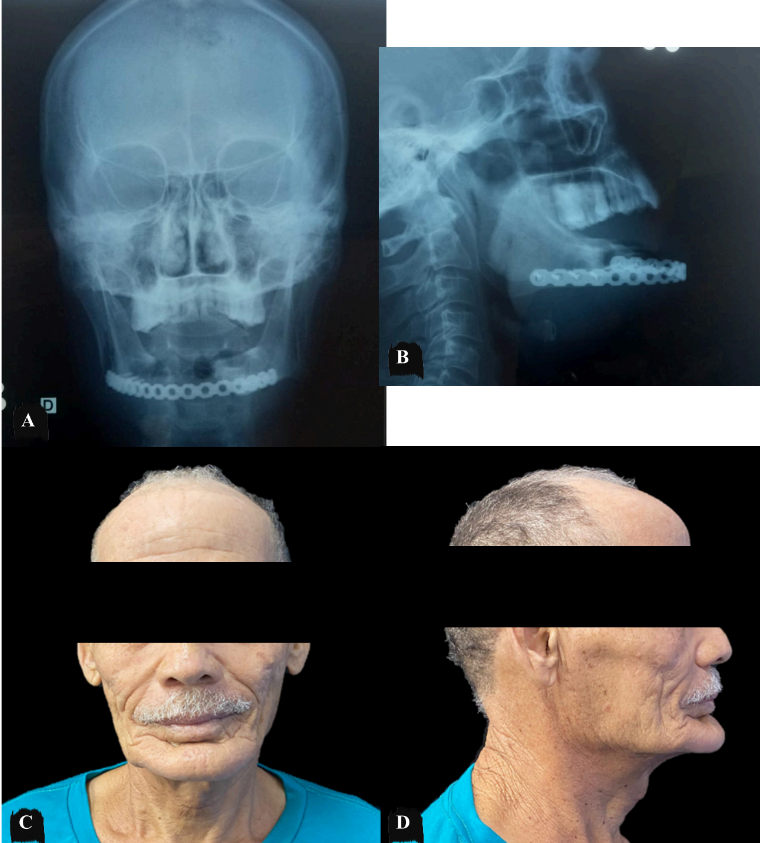
Paciente agricultor, 63 anos de idade, leucoderma, sexo masculino, sem comorbidades sistêmicas, acompanhado no serviço de Cirurgia e Traumatologia Buco-Maxilo-Facial do Hospital Universitário Oswaldo Cruz – HUOC (Figura 1), desde 2013, com laudo histopatológico prévio de ameloblastoma sólido/convencional. O paciente realizou neste marco temporal de 2013, biópsia incisional para laudo histopatológico, seguido de instalação de dreno, orientações pós-operatórias sob o toilette lesional e acompanhamento radiográfico (Figura 2). Em 2014 foi realizada curetagem associado à osteotomia periférica (Figura 3 – 4) obtendo laudo histopatológico (ANEXO IV). A última consulta foi realizada no ano de 2018, o paciente retorna ao serviço após 05 (cinco) anos com queixa de aumento de volume em região submandibular direita, assintomático e de crescimento lento. Ao exame físico, o paciente apresentou discreto aumento de volume de caráter intraósseo em região submandibular à direita, medindo aproximadamente 3,7 cm em seu maior diâmetro, de consistência firme à palpação. A pele sobrejacente à lesão era de coloração normal. Linfadenopatia regional e sinais flogísticos locais não foram observados. No exame físico intra-bucal foi evidenciado aumento de volume de implantação séssil em rebordo alveolar com apagamento do sulco vestibular e mucosa íntegra. No histórico radiográfico OPG observa-se regressão tumoral após tratamento conservador por descompressão até o ano de 2018 (Figura 5), momento em que houve ausência de acompanhamento e recrudescimento da lesão. Os exames laboratoriais hematológicos e bioquímicos apresentavam valores dentro dos padrões de normalidade.
Figura 1 – Aspectos clínicos pré-operatórios do aumento de volume de mandíbula direita (2023).
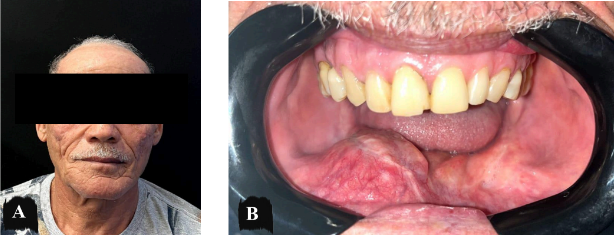
Figura 2 – Aspectos clínicos pré-operatórios do aumento de volume de mandíbula direita (2013).
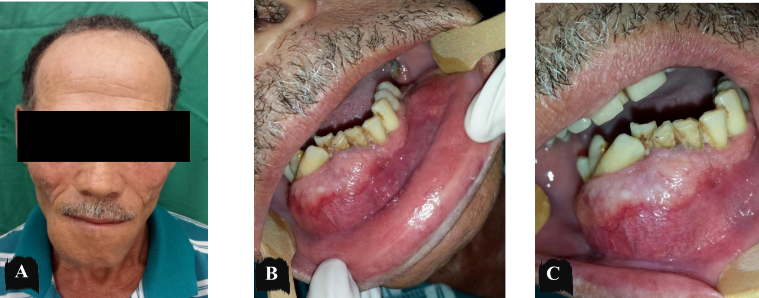
Figura 3 – Aspectos clínico e tomográfico pré-operatórios para curetagem em 2014.
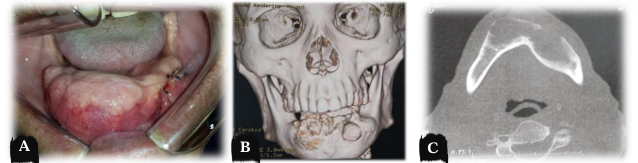
Figura 4 – Curetagem associada à osteotomia periférica realizado em 2014.
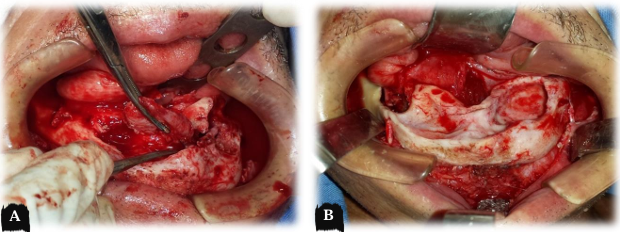
Figura 5 – Aspectos radiográficos prévios em radiografia panorâmica, onde se observa o histórico da lesão osteolítica em mandíbula em mês/ano.
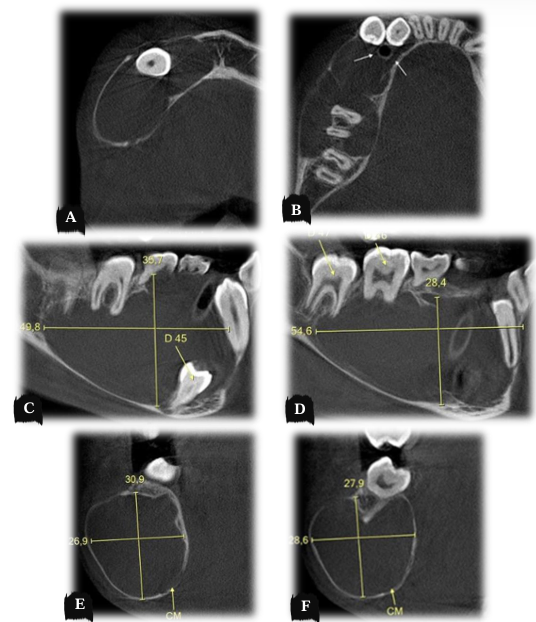
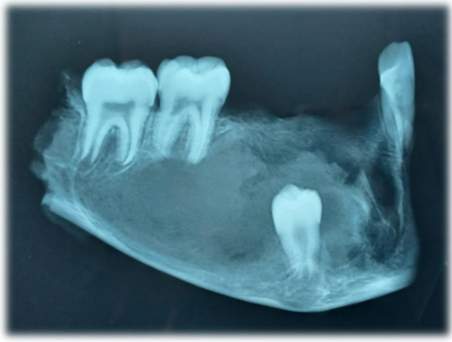
No exame de imagem panorâmico pré-operatório observa-se lesão osteolítica circunscrita bem delimitada com extensão de linha média ao corpo mandibular direito (Figura 6).
Figura 6 – Aspectos radiográficos pré-operatórios em radiografia panorâmica onde se observa a presença de lesão osteolítica em mandíbula direita.
Considerando a localização, as dimensões da lesão, a idade avançada, padrão histopatológico de caráter sólido/convencional, menor nível de cooperação e acompanhamento a longo prazo pelo paciente, o tratamento de escolha foi à ressecção parcial seguida de fixação por placa de reconstrução do sistema 2.4 mm.
Figura 7 – Dobra da placa em biomodelo. Caráter unilocular do AM em corte axial tomográfico.
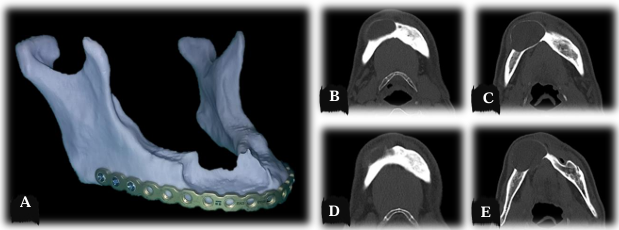
Previamente ao procedimento de ressecção parcial mandibular, foi realizada a dobradura da placa de reconstrução do sistema de fixação 2.4 mm sob o biomodelo, tendo como base a imagem tomográfica em proporção 1:1 (Figura 7).
Inicialmente foi realizado um acesso submentoniano semilunar através de incisão na pele e tecidos subcutâneos até o músculo platisma, que por sua vez foi dividido na linha média, seguido de descolamento subperiosteal expondo a borda anterior da sínfise mandibular.
Em seguida foi realizado o acesso submandibular (Risdon) iniciando a incisão na pele, utilizando como referência uma prega cutânea do pescoço, localizada cerca de 2 cm inferior à borda inferior da mandíbula, seguida de dissecção dos planos cutâneo e subcutâneo até o músculo platisma, que foi dissecado e incisado de uma extremidade a outra da incisão inicial até sua liberação e exposição da camada superficial da fáscia cervical profunda. O nível da incisão e da divulsão da fáscia foi no mínimo 1,5 cm inferior à mandíbula para ajudar a proteger a veia e artéria facial, e o ramo mandibular marginal do nervo facial. A cápsula da glândula submandibular foi visualizada e devidamente protegida. Os acessos submentoniano e submandibular foram unidos através de tunelização subperiosteal, respeitando a topografia do nervo mentoniano (Figura 8[a-b]). Em seguida, a placa de reconstrução do sistema 2.4 foi adaptada pela tunelização (Figura 8.a) onde posteriormente foi fixada utilizando 04 (quatro) parafusos locking 10 mm bicorticais no coto proximal e 03 (três) parafusos locking 10 mm bicorticais no coto distal (Figura 8.b).
Figura 8 – Resseção parcial da mandíbula. a) acesso submandibular com adaptação da placa de reconstrução 2.4 mm por tunelização; b) acesso submentoniano após exérese do tumor com margem de segurança.
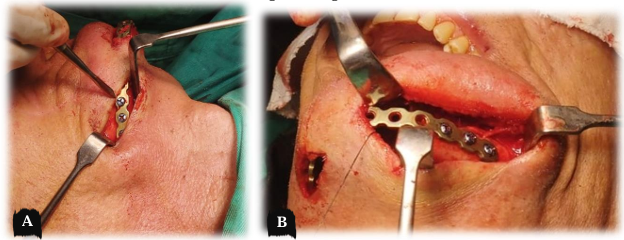
O tumor foi identificado e isolado, e a exérese parcial da mandíbula foi realizada com auxílio de serra e cinzeis envolvendo a área comprometida pela lesão com margens de segurança de 01 cm em cada coto ósseo (Figura 9). A linha de corte da resseção parcial envolveu o longo eixo imaginário do canino inferior esquerdo a distal do corpo mandibular direito. Após hemostasia adequada, foi feita síntese por planos da ferida cirúrgica, onde os músculos masseter e pterigóide medial foram suturados juntos com suturas interrompidas reabsorvíeis com Monocryl® 3-0; o músculo platisma foi fechado com pontos contínuos simples com Monocryl® 3-0; e a pele e o tecido subcutâneo foram fechados com pontos contínuos simples com fio de Nylon® 4-0. No pósoperatório imediato foram observadas macroscopicamente e radiograficamente as margens de seguranças livres (Figura 9 [a-b]). A peça cirúrgica foi enviada para estudo anatomopatológico para emissão de laudo histopatológico (ANEXO V).
Figura 9 – Controle pós-operatório sem sinais clínicos ou radiográficos de recidiva da lesão.
O paciente evoluiu sem complicações pós-operatórias. Nenhum sinal de danos às estruturas adjacentes, como a glândula submandibular e glândulas sublinguais, ducto sublingual e nervos facial e lingual, nem alterações do fluxo salivar foram observados no período pós-operatório imediato ou tardio. Após 03 meses de acompanhamento, o paciente não apresenta sinais clínicos e radiográficos de recidiva do tumor (Figura 10).
Figura 10 – Controle pós-operatório sem sinais clínicos ou radiográficos de recidiva da lesão.
5.2 Relato do caso II
Paciente estudante, 13 anos de idade, leucoderma, sexo masculino, sem comorbidades sistêmicas, compareceu ao serviço de Cirurgia e Traumatologia Buco-Maxilo-Facial do Hospital Universitário Oswaldo Cruz – HUOC após ser acompanhado por 01 (um) ano em outro serviço de Cirurgia e Traumatologia Buco-Maxilo-Facial com laudo histopatológico prévio de ameloblastoma convencional (Anexo VI), ao qual foi empregado tratamento conservador por descompressão intrabucal em região posterior de mandíbula direita por 08 (oito) meses.
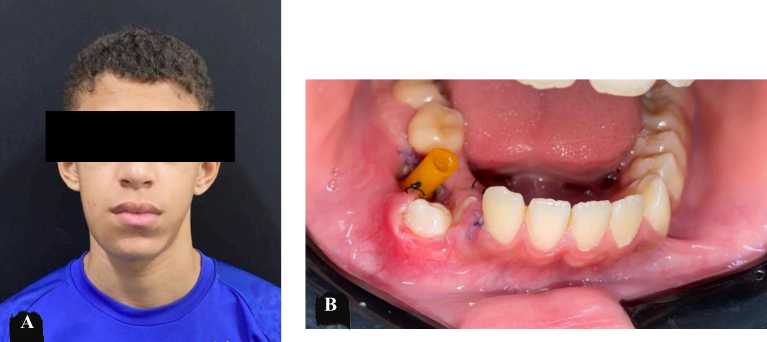
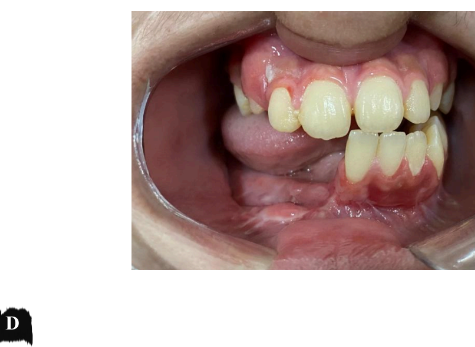
O paciente procura o serviço com queixa de aumento de volume em região submandibular direita, assintomático e de crescimento lento. Ao exame físico, o paciente apresentou aumento de volume de caráter intraósseo em região submandibular à direita, medindo aproximadamente 5,4 cm em seu maior diâmetro, de consistência firme à palpação (Figura 11.a). A pele sobrejacente à lesão era de coloração normal. Linfadenopatia regional e sinais flogísticos locais não foram observados. No exame físico intra-bucal foi evidenciado aumento de volume de implantação séssil em rebordo alveolar com apagamento do sulco vestibular e mucosa presença de dreno associado à lesão (Figura 11.b). Os exames laboratoriais hematológicos e bioquímicos apresentavam valores dentro dos padrões de normalidade.
Figura 11 – Aspectos clínicos pré-operatórios do aumento de volume de mandíbula direita. a) Aspectos extra-bucais. b) Aspectos intra-bucais revelando aumento de volume em rebordo alveolar com presença de dreno.
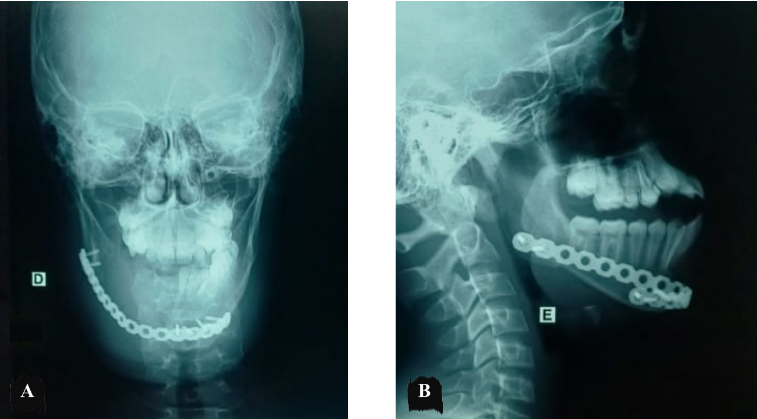
No exame de imagem tomográfico pré-operatório observa-se lesão osteolítica, circunscrita, com bordas bem definidas, deslocamento e reabsorções radiculares de dentes associados à lesão, dentes inclusos/impactados com extensão da lesão da linha média ao corpo mandibular direito (Figura 12). Como medida de segurança foi realizada revisão das lâminas histopatológicas neste serviço, confirmando o laudo de ameloblastoma (ANEXO VII).
Figura 12 – Aspectos tomográficos prévios em tomografia computadorizada, onde se observa lesão osteolítica em mandíbula.
Considerando o fato da lesão não ter respondido favoravelmente ao tratamento conservador por descompressão e levando também em consideração aspectos como a localização, as dimensões da lesão, a idade, padrão histopatológico, menor nível de cooperação e acompanhamento a longo prazo pelo paciente, o tratamento de escolha foi a ressecção parcial seguida de fixação por placa de reconstrução do sistema 2.4 mm.
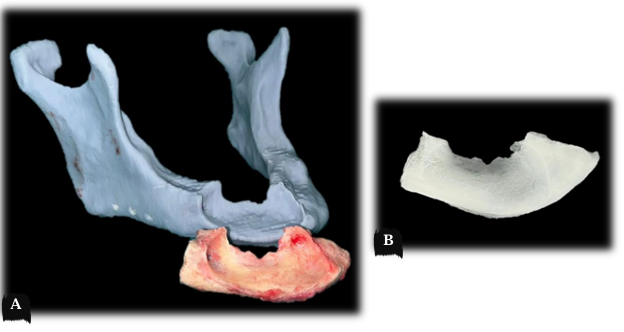
Previamente ao procedimento de ressecção parcial mandibular, foi confeccionado biomodelo em resina, através do software Meshmixer 3.5 ® foi espelhado a hemi-mandíbula esquerda saudável na hemi-mandíbula patológica (Figura 13), em seguida foi realizada a dobradura da placa de reconstrução do sistema de fixação 2.4 mm sob o biomodelo, tendo como base a imagem tomográfica em proporção 1:1 (Figura 14).
Figura 13 – Espelhamento da hemi-mandíbula esquerda saudável na hemi-mandíbula patológica.
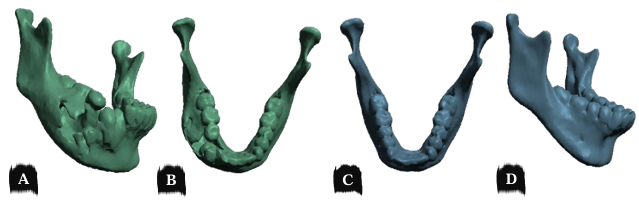
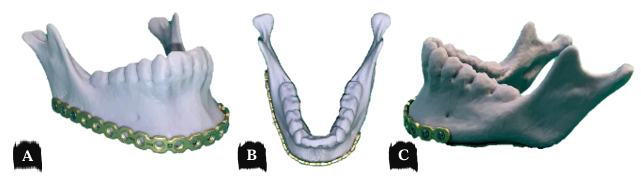
Figura 14 – Dobradura da placa de reconstrução 2.4 mm sob o biomodelo.
A cirurgia de ressecção parcial iniciou pelo acesso submentoniano semilunar através de incisão na pele e tecidos subcutâneos até o músculo platisma, que por sua vez foi dividido na linha média, seguido de descolamento subperiosteal expondo a borda anterior da sínfise mandibular.
Em seguida foi realizado o acesso submandibular (Risdon) iniciando a incisão na pele, utilizando como referência uma prega cutânea do pescoço, localizada cerca de 2 cm inferior à borda inferior da mandíbula, seguida de dissecção dos planos cutâneo e subcutâneo até o músculo platisma, que foi dissecado e incisado de uma extremidade a outra da incisão inicial até sua liberação e exposição da camada superficial da fáscia cervical profunda. O nível da incisão e da divulsão da fáscia foi no mínimo 1,5 cm inferior à mandíbula para ajudar a proteger a veia e artéria facial, e o ramo mandibular marginal do nervo facial. A cápsula da glândula submandibular foi visualizada e devidamente protegida. Os acessos submentoniano e submandibular foram unidos através de tunelização subperiosteal, respeitando a topografia do nervo mentoniano. Posteriormente foi realizada incisão intrasulcular nas faces vestibular e lingual em toda extensão do tumor, seguido de descolamento mucoperiosteal. Em seguida, a placa de reconstrução do sistema 2.4 foi adaptada pela tunelização onde posteriormente foi fixada utilizando 02 (dois) parafusos locking 10 mm bicorticais no coto proximal e 03 (três) parafusos locking 10 mm bicorticais no coto distal.
Figura 15 – Exérese parcial da mandíbula envolvendo a área comprometida pela lesão com margens de segurança de 01 cm em cada coto ósseo.
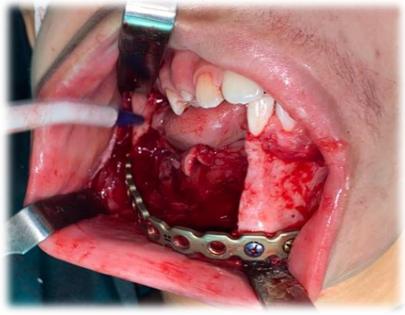
O tumor foi identificado e isolado, e a exérese parcial da mandíbula foi realizada com auxílio de serra e cinzeis envolvendo a área comprometida pela lesão com margens de segurança de 01 cm em cada coto ósseo (Figura 15). A linha de corte da resseção parcial envolveu a distal do incisivo medial inferior direito a distal do terceiro molar inferior direito. Após hemostasia adequada, foi feita síntese por planos da ferida cirúrgica, onde os músculos masseter e pterigóide medial foram suturados juntos com suturas interrompidas reabsorvíeis com Monocryl® 3-0; o músculo platisma foi fechado com pontos contínuos simples com Monocryl® 3-0; e a pele e o tecido subcutâneo foram fechados com pontos contínuos simples com fio de Nylon® 4-0. No pósoperatório imediato foram observadas radiograficamente as margens de seguranças livres (Figura 16). A peça cirúrgica foi enviada para estudo anatomopatológico para emissão de laudo histopatológico (ANEXO VIII).
Figura 16 – Imagem radiográfica da peça cirúrgica após ressecção com margem de segurança.
O paciente evoluiu sem complicações pós-operatórias. Nenhum sinal de danos às estruturas adjacentes, como a glândula submandibular e glândulas sublinguais, ducto sublingual e nervos facial e lingual, nem alterações do fluxo salivar foram observados no período pós-operatório imediato ou tardio. Após 03 meses de acompanhamento, o paciente não apresenta sinais clínicos e radiográficos de recidiva do tumor (Figura 17).
Figura 17 – Controle pós-operatório sem sinais clínicos ou radiográficos de recidiva da lesão.
5.3 Relato do caso III
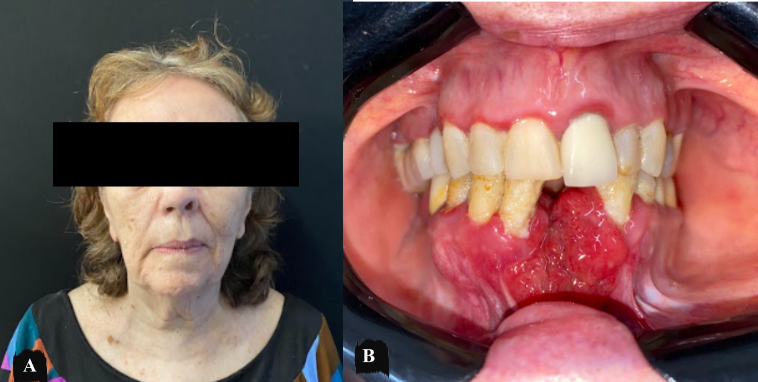
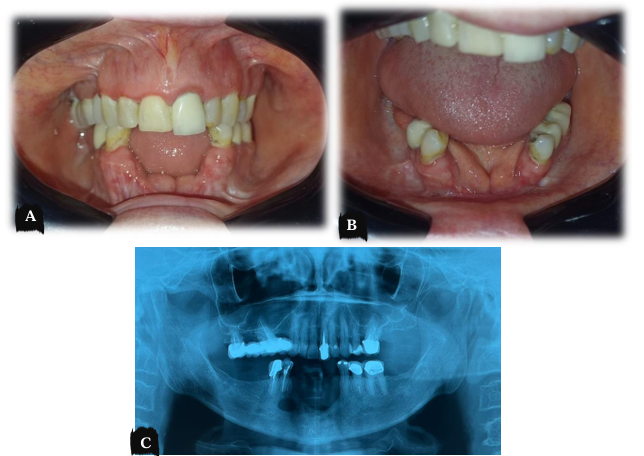
Paciente professora, 78 anos de idade, leucoderma, sexo feminino, com hipertensão arterial sistêmica sem demais comorbidades, acompanhada no serviço de Cirurgia e Traumatologia BucoMaxilo-Facial do Hospital Universitário Oswaldo Cruz – HUOC desde 1990 onde recebeu laudo histopatológico de ameloblastoma sólido/convencional. A paciente realizou neste marco temporal 04 (quatro) intervenções cirúrgicas conservadoras sob anestesia geral. A última consulta foi realizada no ano de 2014. A paciente retorna ao serviço após 08 (oito) anos com queixa de aumento de volume em região de rebordo alveolar anterior de mandíbula, assintomático, sangrante ao toque e de crescimento lento. Ao exame físico, não foi observado aumento de volume aparente na vista extrabucal. Linfadenopatia regional e sinais flogísticos locais não foram observados (Figura 18.a).
No exame físico intra-bucal foi evidenciado lesão granulomatosa, circunscrita, bem delimitada, exofítica, de implantação séssil, hiperemiado, com dor a palpação em rebordo alveolar anterior de mandíbula edêntula com extensão aos caninos com mobilidade (Figura 18.b). Os exames laboratoriais hematológicos e bioquímicos apresentavam valores dentro dos padrões de normalidade.
Figura 18 – a) Aspecto clínico pré-operatório extrabucal sem repercussão clínica; b) Imagem intrabucal com tecido de granulação em região anterior de mandíbula.
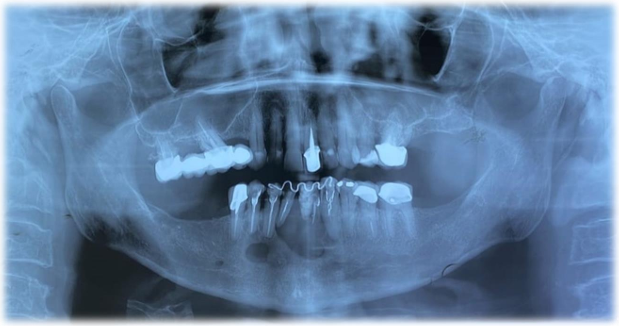
No exame de imagem panorâmico pré-operatório observam-se duas lesões radiolúcidas uniloculares, circunscritas e bem delimitadas, sendo a principal lesão em sua maior extensão medindo 3,7 cm localizada entre os caninos inferiores e a segunda lesão localizada inferiormente aos pré-molares em mandíbula direita medindo 1,2 cm (Figura 19). Observa-se contenção lingual para manter estabilidade entre os dentes associados à lesão.
Figura 19 – Aspectos radiográficos pré-operatórios em radiografia panorâmica onde observa-se 02 (duas) imagens osteolíticas em mandíbula.
Foi realizado biópsia incisional da lesão em rebordo alveolar, tendo como laudo histopatológico, lesão sugestiva de granuloma piogênico (Anexo IX). Durante a biópsia incisional também foi removido à contensão lingual, os dentes incisivos, medial inferior esquerdo e lateral inferior direito.
Considerando a localização, as dimensões da lesão, a idade avançada, o histórico histopatológico de ameloblastoma sólido/convencional, menor nível de cooperação e acompanhamento a longo prazo pela paciente, o tratamento de escolha foi a exérese total da lesão seguida da exodontia dos dentes associados à lesão.
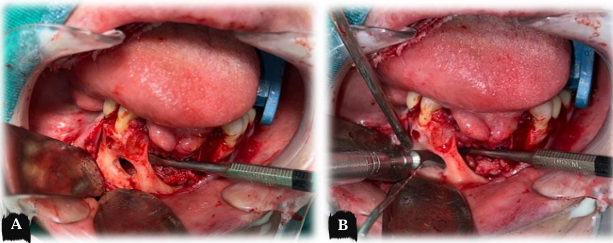
Inicialmente foi realizado um retalho de Newmann através de uma incisão intrasulcular e duas relaxantes na altura dos segundos pré-molares inferiores com margem de segurança do tecido mole saudável ao tecido lesional de 0,5 cm. Em seguida foi realizado o descolamento mucoperiosteal e elevação do retalho. Em seguida foi realizado a exodontia dos dentes remanescentes com mobilidade associados à lesão (caninos inferiores direito e esquerdo) com intuito de visualizar a verdadeira extensão da lesão, evitando retenção de tecido lesional entre os dentes. A carúncula e o nervo mentoniano foram visualizados e devidamente protegidos respeitando suas topografias. Posteriormente foi realizada exérese total da lesão se estendendo até o segundo leito cirúrgico de menor diâmetro, ao qual não foi observado tecido lesional, compatível com fenestração por remodelação óssea (Figura 20.a). Por precaução foi realizado osteotomia periférica utilizando brocas de desgaste (Figura 20.b). Após hemostasia adequada, foi feita síntese por planos da ferida cirúrgica, onde foram suturados por suturas interrompidas reabsorvíeis com Monocryl® 30. A peça cirúrgica foi enviada para estudo anatomopatológico para emissão de laudo histopatológico (ANEXO X), ao qual revelou o diagnóstico de ameloblastoma. Diante disso, despertou-se a necessidade de revisão das lâminas histopatológicas, bem como do bloco em parafina do laudo anterior, compatível com granuloma piogênico, ao qual obtiveram lâminas (Figura 21) como diagnóstico confirmado de ameloblastoma (ANEXO XI).
Figura 20 – a) Ausência de acometimento intraósseo; b) Osteotomia periférica em fenestração.
A paciente evoluiu sem complicações pós-operatórias. Nenhum sinal de danos às estruturas adjacentes, como a glândula e ducto sublingual, nem alterações do fluxo salivar foram observados no período pós-operatório imediato ou tardio. Após 04 meses de acompanhamento, a paciente não apresenta sinais clínicos e radiográficos de recidiva do tumor (Figura 22).
Figura 21 – Revisão de lâmina histopatológica revelando neoplasia odontogênica benigna de origem epitelial com arranjadas frouxamente lembrando o retículo estrelado do órgão do esmalte.
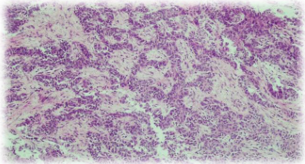
Figura 22 – Controle pós-operatório sem sinais clínicos ou radiográficos de recidiva da lesão.
5.4 Resultados da busca na literatura científica
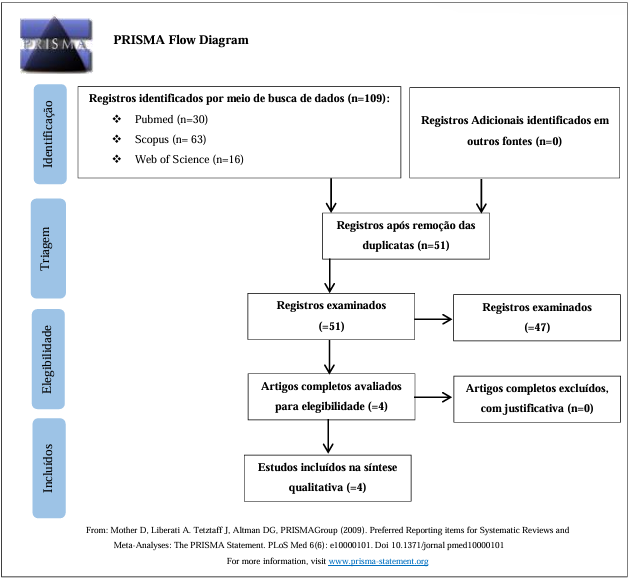
A busca inicial nas bases de dados identificou 109 artigos, sendo 30 na PubMed, 63 na Scopus e 16 na Web of Science. Após remoção das publicações duplicadas e análise de título e resumos, quatro artigos foram selecionados para leitura completa. Todos atenderam os critérios desta revisão e foram incluídos na análise. O diagrama PRISMA mostrando o fluxograma completo do processo de seleção dos estudos está disposto na Figura 23.
Figura 23 – Diagrama PRISMA com fluxograma da busca e seleção dos dados incluídos da revisão.
5.5 Qualidade metodológica dos estudos
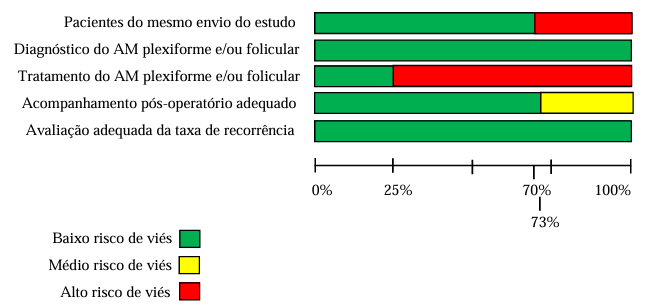
Baseado no RoB 2.0, três dos quatro estudos incluídos na revisão apresentaram um alto risco global de viés. A falta de randomização e de cegamento dos participantes e avaliadores foram as principais fontes de viés nos estudos. Três foram estudos retrospectivos, um era apenas revisão sistemática. Totalizando quatro estudos incluídos na síntese qualitativa segundo aos nossos critérios de elegibilidade. As características desses estudos estão expressas no Quadro 2 e o risco de o viés entre eles é expresso na Figura 24.
Figura 24 – Avaliação da qualidade metodológica e do risco de viés dos estudos selecionados com base na ferramenta rob 2.0.
5.6 Descrição dos estudos e síntese dos dados
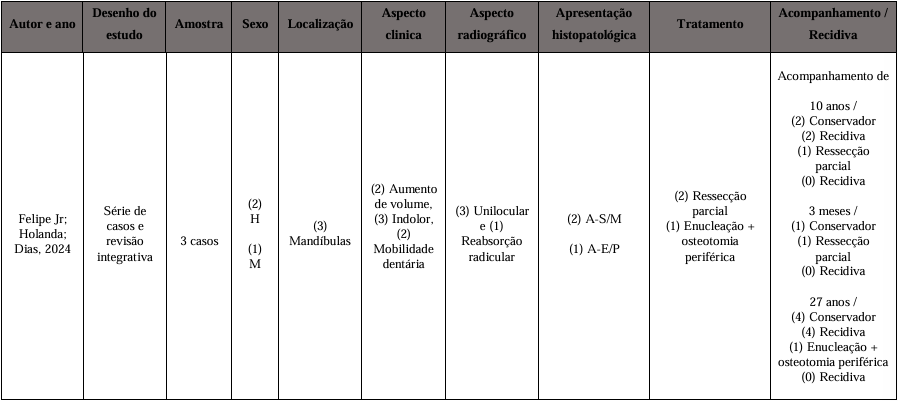
Uma descrição detalhada dos estudos incluídos na revisão é apresentada no Quadro 2. Quatro artigos publicados entre 1995 e 2022 foram analisados, sendo três estudos retrospectivos e uma revisão sistemática, que utilizaram pacientes submetidos a tratamentos conservadores e radicais do AM. Nas características detalhadas dos descritores incluídos na revisão, foi considerado como tratamento conservador a excisão periférica, curetagem, enucleação associada à ostectomia periférica e o tratamento sem reconstrução. Como tratamento radical foi considerado aos estudos incluídos a ressecção segmentar, ressecção parcial, hemi-mandibulectomia e enxerto ósseo/placa, e ressecção total. No total, 3.848 pacientes foram incluídos na revisão, 3.766 realizaram tratamento cirúrgico, pois 38 pacientes não realizaram qualquer tratamento cirúrgico, considerando ainda que 44 pacientes realizaram radioterapia no estudo de Reichart et a., 1995. No estudo 784 casos foram submetidos ao tratamento conservador e 945 casos submetidos ao tratamento radical. Expressamente 18 casos foram realizados enucleação associado à ostectomia periférica Bansal et al., 2015 e a ressecção parcial expressa em 10 casos por Petrovic et al., 2018. Na maioria dos casos, o AM foi diagnosticado como folicular, exceto um caso que recebeu diagnóstico de AM plexiforme, acantomatoso, unicistico, histologia mista e carcinoma ameloblástico, não especificado e outros. Durante o estudo apenas Petrovic et al., 2018 relatou um ameloblastoma periférico. Dos 3.677 casos relatados por Reichart et al., 1995 apenas 327 casos foram acompanhados no períodos de 4 anos, o que reflete momento periclitante ao tratamento, observando as características indolentes e a alta taxa de recidiva do AM. Apenas Reichart et al., 1995 discrimina o tratamento conservador e radical da recidiva o que indica menor taxa de recidiva diante do tratamento radical. O tempo médio de acompanhamento foi de 8,5 anos. A descrição do presente estudo pode ser observada no Quadro 3.
Quadro 2 – Características detalhada dos descritores incluídos na revisão.
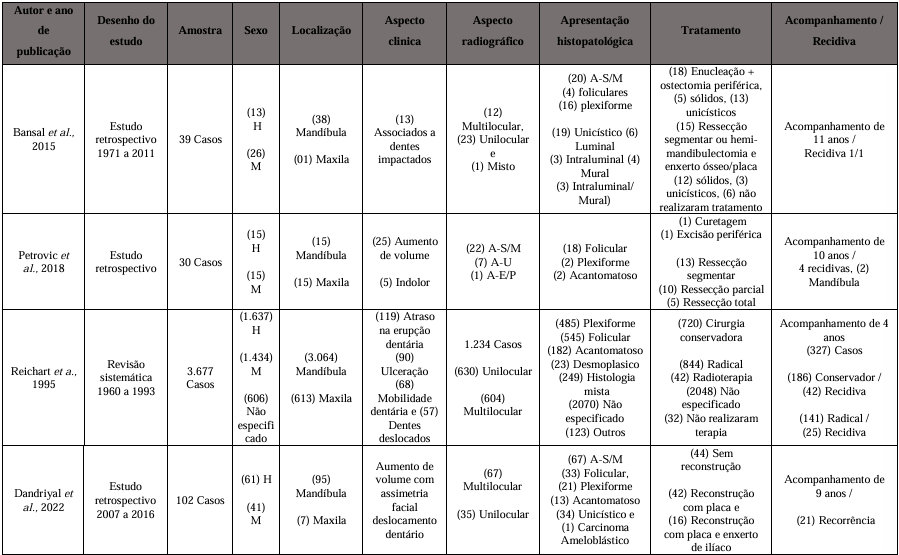
Quadro 3 – Descrição detalhada do presente estudo.
Autor e ano Desenho do estudo Amostra Sexo Localização Aspecto clinica Aspecto radiográfico Apresentação histopatológica Tratamento Acompanhamento /
Recidiva
6 DISCUSSÃO
AM é uma neoplasia classificada como tumor odontogênico epitelial benigno dos maxilares. Os ameloblastomas crescem lentamente e são localmente invasivos. Ele pode se originar de remanescentes epiteliais do órgão do esmalte, da lâmina dentária, de cistos odontogênicos ou células basais da mucosa bucal. No entanto, não tem sido demonstrado cientificamente o fator desencadeante na sua etiopatogenia (MASTHAN et al., 2015).
Os pacientes muitas vezes recuam por receio na procura de atendimento médico até que sua vida seja significativamente afetada pelo tumor (RUSLIN et al., 2018). Pelo ameloblastoma ser um tumor de crescimento lento, pode levar muitos anos até que o paciente busque atendimento médico, momento em que o tratamento fica muito mais complexo devido às dimensões do tumor. O que foi observado em 2 dos 3 relatos do nosso estudo, em que o tratamento conservador surtir resultados desejados, a ausência de acompanhamento prolongado culminou em abordagem cirúrgicas agressivas.
Sua incidência maior se dá na terceira e quarta décadas de vida, sem preferência por gênero ou raça. Em nosso estudo envolveu a 2ª, 4ª e 5ª década de vida com 2/3 do gênero masculino. Pode ocorrer em qualquer região dos maxilares, mas a região de corpo e ramo de mandíbula são as localizações anatômicas mais prevalentes (85%). A maioria dos tumores está localizada na mandíbula (80-93%). A grande maioria dos ameloblastomas é unilateral (95%). Foi observado em nosso estudo prevalência do corpo e ramo de mandíbula (66%), com total acometimento da mandíbula (100%) e comprometimento unilateral (66%).
Em um estudo multicêntrico europeu descrito por Boffano et al. 2021, apresentaram idade média de 47,4 anos, distinto à idade principal da Indonésia Oriental (39,7 anos), segundo Ruslin et al 2018. No relatório da Holanda descrito por Oomens et al. 2014, também foi encontrada idade média de 44,1 anos. Neste estudo, a idade média do diagnóstico foi de 37,0 anos, considerando o retorno após acompanhamento tardio à idade média foi de 51,3 anos.
De acordo com a mais recente classificação dos tumores odontogênicos pela OMS em 2017, é classificado como tumor odontogênico benigno de origem epitelial, sendo: ameloblastoma (anteriormente descrito como ameloblastoma solido/multicístico), ameloblastoma unicístico e ameloblastoma periférico/ extraósseo (WRIGHT; VERED, 2017). O presente estudo descreve três casos de AM tratados anteriormente de forma conservadora, sendo um destes casos evoluindo com caráter periférico.
O ameloblastoma é uma lesão óssea expansiva que pode atingir grandes dimensões, provocando assimetria facial e/ou intrabucal, principalmente o tipo sólido/multicístico. O que foi observado expansão facial, em dois dos três casos do presente estudo. Também pode-se apresentar como uma lesão bem circunscrita com margens definidas, o que é mais comum nos casos de ameloblastomas unicísticos. Estes fazem diagnóstico diferencial principalmente com outros tumores e cistos odontogênicos, em razão das características clínicas e radiográficas (KITISUBKANCHANA et al., 2021; SANTANA et al., 2019). Não obstante, os três casos de ameloblastomas (ameloblastoma sólido/multicístico) descritos no estudo apresentaram imagens bem circunscrita com margens definidas.
O ameloblastoma periférico/extraósseo é uma variante incomum que se apresenta nos tecidos gengivais com as mesmas características histológicas do ameloblastoma (ameloblastoma sólido/multicístico), porém sem envolvimento ósseo observado radiograficamente, exceto em casos de lesões avançadas que causam a destruição do osso adjacente (GHATTAMANENI et al., 2017). No presente estudo, um caso de ameloblastoma (ameloblastoma sólido/multicístico) após quatro intervenções cirúrgicas conservadoras, a paciente apresentou envolvimento ao tecido periférico o que denota o caráter agressivo do ameloblastoma, o que requer um acompanhamento fidedigno e prolongado.
A distribuição histológica neste estudo foi de 100% de AM (ameloblastoma sólido/multicístico). Ruslin et al. 2018, em seu estudo retrospectivo (2011 a 2016) de 84 pacientes diagnosticados com ameloblastoma em um centro de referência da Indonésia Oriental foi de 25% de ameloblastoma unicístico, cerca de 57% de ameloblastoma multicístico e ameloblastoma multicístico não especificado de 18%. Esses achados são semelhantes aos de Saghravanian et al. 2015, ao qual realizou um estudo retrospectivo de 40 anos (1971 a 2010) com 88 pacientes na Faculdade de Odontologia, Mashhad, Irã que encontrou 24% com ameloblastoma unicístico, cerca de 73% com ameloblastoma multicístico e 3% com ameloblastoma extraósseo.
Radiologicamente, AM geralmente exibem uma imagem osteolítica unilocular ou multilocular bem definida, circundada por uma margem radiopaca, muitas vezes com expansão do córtex ósseo, com possibilidade de reabsorção radicular e eventual associação com dente impactado (ALMEIDA et al., 2016; RUSLIN et al., 2018). Dos 84 pacientes estudados por Ruslin et al. em 2018, dezenove radiolucências (34%) foram classificadas como uniloculadas e 37 radiolucências (66%) como multiloculadas. De forma semelhante um estudo retrospectivo e descritivo realizado por Ranchod et al., 2021 foram incluídas 148 lesões observadas durante um período de 45 anos, de 1972 a 2017 em um centro colaborador da OMS, na Cidade do Cabo, África do Sul. A região posterior foi o local mais acometido, com a maioria das lesões apresentando aspecto multilocular (68,24%) e reabsorção radicular (66,38%). Em nosso estudo a região posterior de mandíbula foi envolvida de dois dos três casos relatados (66,66%) e a reabsorção radicular (66,38%).
Nosso estudo traz o relato envolvendo uma criança com mais radiolucências uniloculadas e menos multiloculadas o que também foi o achado de Bansal et al. 2015. Este autor avaliou 39 casos de ameloblastoma em crianças indianas com menos de 18 anos, observadas durante um período de 41 anos (1971-2011) no Departamento de Patologia Oral, Nair Hospital Dental College, Índia. Radiograficamente, 23 casos apresentaram-se como radioluscência unilocular. Histologicamente, 20 casos apresentaram-se como sólido e 19 como ameloblastoma unicístico. Sugerindo que as crianças apresentam uma maior percentagem de radiolucências unilocular e uma menor percentagem de radiolucências multiloculadas, o que está de acordo com uma maior percentagem de ameloblastoma unicístico e uma menor percentagem de ameloblastoma multicístico. Mas deve-se enfatizar que tanto o ameloblastoma unicístico quanto o multicístico podem apresentar radiolucências uniloculadas e multiloculadas. Ou seja, o aspecto radiográfico independe do tipo histológico BANSAL et al., 2015).
O planejamento do tratamento do ameloblastoma deve levar em consideração a classificação do tumor, as características de crescimento, localização, grau de morbidade, idade do paciente e potencial de recorrência. Tratamentos conservadores envolvem procedimentos de descompressão da lesão seguida por enucleação e manobras coadjuvantes locais como cauterização química (Solução de carnoy), crioterapia, osteotomia periférica para prevenir a recidiva da lesão (TITINCHI; BRENNAN, 2022). O tratamento conservador foi o de escolha inicialmente aos três pacientes do estudo. O paciente do relato de caso I realizou biópsia incisional seguido instalação de dreno para descompressão no ano de 2013 por anestesia geral, posteriormente ao ano de 2014 foi realizada curetagem associado à osteotomia periférica. O relato de caso II foi realizado instalação de dreno para descompressão no ano de 2023 por sete meses, ao qual não foi observada regressão do tumor. A paciente do relato de caso III realizou quatro intervenções cirúrgicas por curetagem associado à osteotomia periférica.
As terapias radicais correspondem às ressecções ósseas que envolvem margem de tecido clinicamente ou radiograficamente normais e consequentemente resultam em sequelas ao paciente (GHAI, 2022). Devido a sua capacidade infiltrativa, o ameloblastoma (ameloblastoma sólido/multicístico) é considerado um tumor com comportamento agressivo. A terapia radical é a mais indicada neste caso, pois as células remanescentes infiltradas perifericamente à lesão resultam frequentemente na recorrência do tumor (GHAI, 2022). Após êxitos no tratamento conservador nos três casos do presente estudo, com a ausência de acompanhamento prolongado dos pacientes em ambiente ambulatorial, dois casos resultaram em ressecção parcial e um caso em enucleação após evolução periférica do ameloblastoma. Em contraste, o ameloblastoma unicístico é considerado menos agressivo do que as outras variantes, requerendo abordagens mais conservadoras (HSU; CHIANG; CHEN, 2014). As taxas de recorrência após tratamentos radicais é menor quando comparadas a tratamentos conservadores (HENDRA et al., 2019).
Em nosso estudo as reconstruções foram feitas em dois dos três relatos de casos descritos com placas metálicas de titânio, o que é notável na literatura moderna que discute e oferece principalmente estudos sobre enxerto ósseo. Não apenas nosso estudo, mas a literatura recente limita-se sobre placas de titânio principalmente a relatos de casos.
Estudos mostram altas taxas de complicações Ruslin et al. 2018, por sangramento pela ferida, exposição da placa após difícil fechamento durante a cirurgia, o que parece ser confirmado por este estudo onde um paciente apresentou complicações pós-operatórias por sangramento excessivo da ferida cirúrgica.
As reconstruções do AM são menos invasivas e menos dispendiosas para o paciente, uma vez que nenhum osso precisa ser enxertado, o que poderia explicar por que é usado com tanta frequência na Indonésia Oriental. (KILLAMPALLI et al., 2023). Em nosso estudo inicialmente os pacientes realizaram abordagens conservadoras (100%) por drenagem, curetagem associado ou não a osteotomia periférica. Na Indonésia Oriental, a maioria dos pacientes foi tratada de forma conservadora (62,5%), apesar da maioria dos pacientes ter sido diagnosticada com ameloblastoma multicístico (RUSLIN et al., 2018). Diferentemente, em estudo retrospectivo realizado em 42 pacientes no Royal Melbourne Hospital, Austrália o ameloblastoma multicístico (85,3%) foi tratada de forma radical (ressecção cirúrgica), sendo os demais 14,7% tratados de forma conservadora (SINGH et al., 2015). Não há explicação para isso, mas pode ser que o tratamento seja decidido pelo tamanho do tumor e não pelo tipo histológico. Os pacientes também podem negar o tratamento radical devido a fatores financeiros ou relutância em relação ao risco de deformidades, dormência labial, má oclusão e mastigação (SINGH et al., 2015; SHI et al., 2021). As razões para o tratamento conservador ou radicais devem ser essencialmente motivadas pelo paciente.
O presente estudo apresenta deficiências. Este estudo foi limitado a apenas três relatos de casos de uma revisão integrativa em um centro de referência em Cirurgia e Traumatologia Bucomaxilofacial de Recife/PE, o Hospital Universitário Oswaldo Cruz, Faculdade de Odontologia de Pernambuco. Mais estudos relacionados ao AM ainda são necessários em outros centros de saúde no Recife/PE. No entanto, o número de pacientes tratados não está distribuído igualmente entre os hospitais. Portanto, os nossos resultados podem não ser generalizáveis para toda a população do Recife/PE. Como este estudo se trata de uma revisão integrativa, a análise pode incluir viés de informação. No entanto, os resultados apresentados neste estudo são semelhantes aos relatos de outros estudos. Além disso, a análise deste relatório fornece dados importantes para melhorar os planos de tratamento para cirurgia de ameloblastoma.
Nesse estudo integrativo sobre AM, os achados majoritários do tipo histológico foram ameloblastoma multicístico e sua localização foi na mandíbula. A maioria dos ameloblastomas inicialmente foi tratada de forma conservadora, após casos de recidiva as reconstruções foram feitas em sua maioria apenas com placas de titânio e não com enxerto ósseo, que é uma técnica mais clássica e pouco utilizada na atualidade. Essas reconstruções às vezes apresentam complicações que exigem mais cirurgia ou dias mais longo de internação e um acompanhamento fidedigno.
LIMITAÇÕES DO ESTUDO
A principal limitação do estudo se refere à quantidade da amostra, uma vez que o ameloblastoma é o segundo tumor odontogênico benigno mais comum, acompanhado do odontoma (SLOOTWEG; BAUMHOER, 2019). Para reduzir os vieses, foram incluídos nos relatos de casos apenas AM com recidivas após tratamentos conservadores.
VANTAGENS DO ESTUDO
O presente estudo contribui para a literatura ao analisar o comportamento indolente e agressivo do AM trazendo a luz da ribalta, diante da escolha de um tratamento conservador, a necessidade de um acompanhamento a longo prazo minimizando assim, comorbidades futuras aos pacientes.
7 CONSIDERAÇÕES FINAIS
Não existe consenso sobre o tratamento de ameloblastomas, incluindo o convencional, tanto cirurgias conservadoras quanto intervenções radicais são utilizadas. A escolha de tratamento deve levar em conta a localização, tamanho, idade, condição de saúde geral e cooperação do paciente, possibilidade de acompanhamento à longo prazo, padrão histopatológico e experiência profissional.
É importante ressaltar que embora os ameloblastomas convencionais tenham sido tratados anteriormente de forma mais conservadora, o acompanhamento é fundamental e nem sempre as recidivas ocorrem, podendo ter sido a melhor opção terapêutica à época, nos casos clínicos descritos. As razões para o tratamento conservador ou radical devem ser essencialmente motivadas pelo paciente.
REFERÊNCIAS
ADEEL, M. et al. Ameloblastoma: management and outcome. Cureus, v. 10, n. 10, 2018.
AHMED, R.; PRADEEP D.; MUTHUSEKHAR M. R. Unicystic mural ameloblastoma: an case report and review of literature. Int J Dent Oral Sci, v. 8, n. 7, p. 3412-3415, 2021.
ALMEIDA, R. et al. Recurrence rate following treatment forprimary multicystic ameloblastoma: systematic review and meta-analysis. Int J Oral Maxillofac Surg, v. 45, n. 3 p. 359-367, 2016.
BANSAL, S. et al. The occurrence and pattern of ameloblastoma in children and adolescents: an Indian institutional study of 41 years and review of the literature. Int J Oral Maxillofac Surg, v. 44, n. 6, p. 725-731, 2015.
BHAGWAT, A. et al. Odontogenic tumors: Review of 127 cases in Marathwada region of Maharashtra. J Oral Maxillofac Pathol, v. 21, n. 3, p. 457-458, 2017.
BOFFANO, P. et al. The epidemiology and management of ameloblastomas: a European multicenter study. J Craniomaxillofac Surg, v. 49, n. 12, p. 1107-1112, 2021.
BORRELLO, R. et al. A conservative approach to a peripheral ameloblastoma. Case reports in dentistry. v. 2016, 2016.
BROWN, N.; BETZ, B. Ameloblastoma: a review of recent molecular pathogenetic discoveries. Biomarkers in cancer. v. 7, n. Suppl 2, p. 19-24, 2015.
CARVALHO, K. et al. Ameloblastoma: A 16-year clinicopathological study on Goan population.
Indian J Pathol Microbiol, v. 60, n. 2, p. 157-160, 2017.
CHAE, M. et al. Establishing the natural history and growth rate of ameloblastoma with implications for management: systematic review and meta-analysis. PLoS One, v. 10, n. 2, 2015.
CHANDAVARKAR, V. et al. Ameloblastoma: Cytopathologic profile of 12 cases and literature review. Journal of Cytology. v. 31, n. 3, p. 161-164, 2014.
COVELLO, P.; BUCHBINDER, D. Recent trends in the treatment of benign odontogenic tumors. Curr Opin Otolaryngol Head Neck Surg, v. 24, n. 4, p. 343-351, 2016.
CUSACK, J. Report of the amputations of the lower jaw. Dublin Hosp Rec, v. 4, p. 1-38, 1827.
DANDRIYAL, R. et al. Ameloblastoma: Retrospective Study and Analysis of 102 Cases Over 10 Years, Single Centre, Institutional Experience. J Maxillofac Oral Surg. v. 21, n. 2, p. 730-738, 2022.
DALEY, T.; WYSOCKI, G.; PRINGLE, G. Relative incidence of odontogenic tumors and oral and jaw cysts in a Canadian population. Oral Surg Oral Med Oral Pathol, v. 77, n 3, p. 276-80, 1994.
DE CAMPOS, W. et al. Surgical Treatment of Ameloblastoma: How Does It Impact the Oral Health-Related Quality of Life? A Systematic Review. J Oral Maxillofac Surg. v. 80, n. 6, p.11031114, 2022.
FADEN, D.; ALGAZI, A. Durable treatment of ameloblastoma with single agent BRAFi Re: clinical and radiographic response with combined BRAF-targeted therapy in stage 4 ameloblastoma. J Natl Cancer Inst, v. 109 n. 1, 2017.
GAO, N. et al. The role of folded fibular flap in patients’ reconstruction of mandibular defects: a retrospective clinical study. Scientific Reports. v. 11, n. 23853, 2021.
GHAI, S. Ameloblastoma: an updated narrative review of an enigmatic tumor. Cureus, v. 14, n. 8, 2022.
GHAI, S. et al. Use of 3-D printing technologies in craniomaxillofacial surgery: a review. Oral Maxillofac Surg, v. 22, n. 3, p. 249-259, 2018.
GHATTAMANENI, S. et al. Unicystic ameloblastoma in conjunction with peripheral ameloblastoma: A unique case report presenting with diverse histological patterns. J Oral Maxillofac Pathol. v.21, n.2, p. 267-272, 2017.
HATADA, K. et al. Clinicostatistical study of ameloblastoma treatment. Bull Tokyo Dent Coll, v. 42, n. 2, p.87-95, 2001.
HENDRA, F. et al. Global incidence and profile of ameloblastoma: a systematic review and metaanalysis. Oral Dis, v. 26, n. 1, p. 12-21, 2020.
HENDRA, F, et al. Radical vs conservative treatment of intraosseous ameloblastoma: Systematic review and meta-analysis. Oral Dis. v. 25, n. 7, p. 1683-1696, 2019.
HSU, M.; CHIANG, M.; CHEN, J. Unicystic ameloblastoma. Journal of Dental Sciences, v. 9, n. 4, p. 407-411, 2014.
IVEY, R.; CHURCHILL, H. The need of a standardized surgical and pathological classification of tumors and anomalies of dental origin. Am Assoc Dent Sch Trans, v. 7, p. 240-5, 1930.
JAYASOORIYA, P. et al. Diagnostic enigma of adenoid ameloblastoma: literature review based evidence to consider it as a new sub type of ameloblastoma. Head Neck Pathol, v. 16, n. 2, p. 344352, 2022.
JING, W. et al. Odontogenic tumours: a retrospective study of 1642 cases in a Chinese population.
Int J Oral Maxillofac Surg, v. 36, n. 1, p. 20-25, 2007.
KALWAGADDA, S. et al. Management of ameloblastoma with free tissue flap in comparison with other reconstructive options available. J Maxillofac Oral Surg, v. 19, n. 2, p. 283-288, 2020.
KAYE, F. et al. Clinical and radiographic response with combined BRAF-targeted therapy in stage 4 ameloblastoma. J Natl Cancer Inst, v. 107, n. 1, p. 378, 2015.
KILLAMPALLI, Y. et al. Segmental Resection With Primary Reconstruction Using a PatientSpecific Implant for Unicystic Ameloblastoma: A One-Year Follow-Up Case Report. Cureus. v.15, n. 6, 2023.
KITISUBKANCHANA, J. et al. Odontogenic keratocyst and ameloblastoma: radiographic evaluation. Oral Radiol. v. 37, n.1, p. 55-65, 2021.
KRAMER, I; PINDBORG, J; SHEAR, M. The WHO Histological Typing of Odontogenic Tumours. A commentary on the Second Edition. Cancer. v. 70, n.12, p. 2988-2994, 1992.
KREPPEL, M.; ZÖLLER, J. Ameloblastoma—clinical, radiological, and therapeutic findings. Oral Dis, v. 24, n. 1-2, p. 63-66, 2018.
LARSSON, A.; ALMERÉN, H. Ameloblastoma of the jaws. An analysis of a consecutive series of all cases reported to the Swedish Cancer Registry during 1958–1971. Acta Pathol Microbiol Scand, v. 86A, n. 5, p. 337-349, 1978.
LUO, H.; LI, T. Odontogenic tumors: a study of 1309 cases in a Chinese population. Oral Oncol, v. 45, n. 8, p. 706-711, 2009.
LU, Y. et al. Odontogenic tumors. A demographic study of 759 cases in a Chinese population. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. v. 86, n. 6, p. 707-714,1998.
MACDONALD-JANKOWSKI, D. et al. Ameloblastoma in the Hong Kong Chinese. Part 1: systematic review and clinical presentation. Dentomaxillofac Radiol, v. 33, n. 2, 71-82, 2004.
MALASSEZ, L. Sur l’existence d’amas épithéliaux autour de la racine des dents chez l’homme adulte et a l’état normal (débris épithéliaux paradentaires). Arch Physiol Norm Pathol, v. 3, p. 309-342, 1910.
MASTHAN, K. et al. Ameloblastoma. J Pharm Bioallied Sci, v. 7, n. 1, p.167-170, 2015.
MCCLARY, A. et al. Ameloblastoma: a clinical review and trends in management. Eur Arch Otorhinolaryngol, v. 273, n. 7, p. 1649-1661, 2016.
NAKAMURA, N. et al. Comparison of long-term results between different approaches to ameloblastoma. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology, v. 93, n. 1, p. 13-20, 2002
NARIAI, Y. et al. Clinical features of giant hybrid ameloblastoma of the mandible: A case report with long-term observation of natural growth before treatment. Oral and Maxillofacial Surgery Cases. v. 5, n. 3, 2019.
OOMENS M, VAN DER WAAL I. Epidemiology of ameloblastomas of the jaws; a report from the Netherlands. Med Oral Patol Oral Cir Bucal. v. 19, n. 6, p.581- 583, 2014.
OSTERNE, R. et al. Odontogenic tumors: a 5-year retrospective study in a Brazilian population and analysis of 3406 cases reported in the literature. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, v. 111, n. 4, p. 474-481, 2011.
PAGE, M. et al. A declaração PRISMA 2020: diretriz atualizada para relatar revisões sistemáticas.
Rev Panam Salud Publica, v. 46, s/n, p. 1-12, 2022.
PANDIAR, D. Metastasizing ameloblastoma: a 10 year clinicopathological review with an insight into pathogenesis. Head Neck Pathol, v. 15, n. 3, p. 967-974, 2021.
PAPPALARDO, M. et al. Long-term outcome of patients with or without osseointegrated implants after resection of mandibular ameloblastoma and reconstruction with vascularized bone graft: functional assessment and quality of life. J Plast Reconstr Aesthet Surg, v. 71, n. 7, p. 1076-1085, 2018.
PETROVIC, I. et al. Ameloblastomas of the mandible and maxilla. Ear, nose, & throat journal. v. 97, n. 7, p. 26-E32, 2018.
REICHART, P.; PHILIPSEN, H.; SONNER, S. Ameloblastoma: biological profile of 3677 cases. Eur J Cancer B Oral Oncol, v. 31, n. 2, p. 86-99, 1995.
RUSLIN, M. et al. The Epidemiology, treatment, and complication of ameloblastoma in EastIndonesia: 6 years retrospective study. Med Oral Patol Oral Cir Bucal. v. 23, n. 1, p. 54-58, 2018.
RANCHOD, S. et al. Ameloblastoma of the mandible: analysis of radiographic and histopathological features. J Oral Med Oral Surg. v. 27, n. 6, 2021.
SAGHRAVANIAN, N. et al. A 40-year retrospective clinicopathological study of ameloblastoma in Iran. Asian Pac J Cancer Prev. v. 17, n. 2, p. 619-623, 2015.
SAMUEL, S. et al. Unicystic ameloblastoma with mural proliferation: conservative or surgical approach? BMJ Case Rep. v. 2014, 2014.
SARGOLZAEI, S.; ATARBASHI-MOGHADAM, S.; ROOHI, A. Mandibular Mural Ameloblastoma with Unusual Histopathologic Features: a Rare Challenging Case. J Dent (Shiraz), v. 20, n. 4, p. 304–307, 2019.
SHI, H. et al. Ameloblastoma: a succinct review of the classification, genetic understanding and novel molecular targeted therapies. The Surgeon, v. 19, n. 4, p. 238-243, 2021.
SILVA, Y. et al. Is conservative surgery a better choice for the solid/multicystic ameloblastoma than radical surgery regarding recurrence? A systematic review. Oral Maxillofac Surg, v. 22, n. 4, p. 349-56, 2018.
SINGH, T. et al. Ameloblastoma: Demographic data and treatment outcomes from Melbourne, Australia. Australian Dental Journal, v. 1, n. 60, p. 24-29, 2015.
SLOOTWEG, P.; BAUMHOER, D. Jaws cancer: pathology and genetics. Encyc Can, v. 3, s/n, p. 313–324, 2019.
SLUSARENKO, Y. et al. Is conservative surgery a better choice for the solid/multicystic ameloblastoma than radical surgery regarding recurrence? A systematic review. Oral Maxillofac Surg. v. 22, n. 4, p. 349-356, 2018.
SOLUK-TEKKESIN, M.; WRIGHT, J. The World Health Organization classification of odontogenic lesions: a summary of the changes of the 2022 (5th) edition. Turk Patoloji Derg, v. 38, n. 2, p. 168–184, 2022.
SWEENEY, R. et al. Identification of recurrent SMO and BRAF mutations in ameloblastomas. Nat Genet, v. 46, n. 7, p. 722-755, 2014.
TITINCHI, F; BRENNAN, P. Unicystic ameloblastoma: analysis of surgical management and recurrence risk factors. British Journal of Oral and Maxillofacial Surgeons. v. 60, n. 3, p. 337342, 2022.
TROIANO, G. et al. Conservative vs radical approach for the treatment of solid/multicystic ameloblastoma: a systematic review and meta-analysis of the last decade. Oral Health Prev Dent, v. 15, n. 5, p. 421-426, 2017.
VERED, M; MULLER, S; HEIKINHEIMO, K. IARC WHO Classification of Tumours. IARC Press, v. 9, n. 4, p. 8, 2017.
WRIGHT, J; TEKKESIN, M. Odontogenic tumors: where are we in 2017? J Istanb Univ Fac Dent, v. 51, n. 3, p. 10-30, 2017.
WRIGHT, J. et al. Odontogenic tumors, WHO 2005: where do we go from here? Head Neck Pathol. v. 8, n. 4, p. 373-382, 2014.
WRIGHT, J; VERED, M. Update from the 4th Edition of the World Health Organization Classification of Head and Neck Tumours: Odontogenic and Maxillofacial Bone Tumors. Head Neck Pathol, v. 11, n. 1, p. 68-77, 2017.
YANG, R. et al. Recurrence and cancerization of ameloblastoma: multivariate analysis of 87 recurrent craniofacial ameloblastoma to assess risk factors associated with early recurrence and secondary ameloblastic carcinoma. Chin J Cancer Res, v. 29, n.3, p. 189-195, 2017.
ZHENG, C. et al. Marsupialisation for the treatment of unicystic ameloblastoma of the mandible: a long-term follow up of 116 cases. Br J Oral Maxillofac Surg, v. 57, n. 7, p. 655-662, 2019.
1Doutorando do Programa de Pós-Graduação em Cirurgia e Traumatologia Bucomaxilofacial Universidade de Pernambuco, Brasil.
ORCID: https://orcid.org/0000-0001-9653-3386
2Centro Universitário Maurício de Nassau, Pernambuco, Brasil
https://orcid.org/0000-0001-6750-4770
3Graduanda da Faculdade de Odontologia de Pernambuco da Universidade de Pernambuco, Pernambuco, Brasil
ORCID: https://orcid.org/0000-0002-8348-5677
4Graduanda da Faculdade de Odontologia de Pernambuco da Universidade de Pernambuco, Pernambuco, Brasil
ORCID: https://orcid.org/0000-0002-7766-7116
5Graduanda da Faculdade de Odontologia de Pernambuco da Universidade de Pernambuco, Pernambuco, Brasil
ORCID: https://orcid.org/0000-0002-0636-5401
6Graduanda do curso de Odontologia da Faculdade Pernambucana de Saúde, Pernambuco, Brasil
ORCID: https://orcid.org/0009-0001-0411-6946
7Cirurgião, Professor e Pesquisador em Cirurgia Bucomaxilofacial e Harmonização Orofacial. Universidade de Pernambuco, Pernambuco, Brasil
ORCID: https://orcid.org/0000-0002-6515-1489
8Cirurgião, Professor em Cirurgia e Traumatologia Bucomaxilofacial Hospital Universitário Oswaldo Cruz, Pernambuco, Brasil
ORCID: 0000-0002-1841-6560
9Cirurgião, Professor em Cirurgia e Traumatologia Bucomaxilofacial Universidade de Pernambuco, Pernambuco, Brasil.
ORCID: https://orcid.org/0000-0002-7934-5743
10Cirurgião, Professor em Cirurgia e Traumatologia Bucomaxilofacial Universidade de Pernambuco, Pernambuco, Brasil
ORCID: https://orcid.org/0000-0003-1010-704X

