TREATMENT METHODS FOR SMOKING CESSATION IN PEOPLE WITH SEVERE MENTAL DISORDERS: AN OVERVIEW OF SYSTEMATIC REVIEWS
REGISTRO DOI: 10.69849/revistaft/cs10202409071155
Luíza Maria Guimarães de Souza Leite1; Mauro Castro de Albuquerque Filho2; Tatiana Silva Ferreira de Almeida3; Deborah Rose Galvão Dantas4; Allana Renally Cavalcante Santos de Moraes5; Cristine Diniz Coutinho Cruz6; Cínthia Andrade de Espíndola7; Eclésio Cavalcante Santos8; Monalyza Myllenna Silva Monteiro Lima9; Edenilson Cavalcante Santos10
RESUMO
O tabagismo representa a principal causa de morte evitável no mundo, com portadores de transtornos mentais graves apresentando maior vulnerabilidade. Existem diferentes formas de tratamento para a cessação do tabagismo, porém com poucos estudos avaliando seus efeitos em doentes mentais graves. O objetivo deste estudo foi revisar na literatura vigente a eficácia dos tratamentos utilizados atualmente nos pacientes portadores de transtornos mentais graves visando a cessação do tabagismo. Trata-se de um estudo descritivo em overview da literatura, cuja pesquisa realizou-se entre abril e junho de 2020, empregando as bases de dados Cochrane library, Medline e PubMed, utilizando os termos de busca (mental disorders) AND (tobacco use disorders OR nicotine) AND (therapy), além de pesquisas em revistas e jornais científicos, sendo selecionadas 7 revisões sistemáticas. Encontraram-se 72 estudos que avaliaram a abstinência tabágica, utilizando principalmente antidepressivos, vareniclina e terapia de reposição de nicotina (TRN), além de terapias não farmacológicas. A bupropiona e a nortriptilina associaram-se à maior taxa de abstinência em curto prazo, demonstrando melhora parcial dos sintomas depressivos. A vareniclina levou ao aumento nas taxas de abstinência de forma sustentada. A TRN demonstrou melhores resultados quando associada ao tratamento não farmacológico. Verificou-se efeitos adversos em 54,2%, 81,8% e 12,5% dentre os estudos que usaram bupropiona, vareniclina e TRN respectivamente. Desta forma, conclui-se que: Bupropiona, vareniclina, nortriptilina e TRN demonstraram eficácia na cessação do tabagismo, principalmente se associada a abordagens comportamentais, com benefícios superiores aos riscos decorrentes do tratamento.
Palavras-chave: Transtornos mentais. Transtornos do uso de tabaco. Nicotina. Terapia.
ABSTRACT
Smoking represents the main cause of preventable death in the world, with people with serious mental disorders presenting greater vulnerability. There are different forms of treatment for smoking cessation, but few studies have evaluated their effects on seriously mentally ill patients. The objective of this study was to review the current literature on the effectiveness of treatments currently used in patients with severe mental disorders aimed at smoking cessation. This is a descriptive study in overview of the literature, whose research was carried out between April and June 2020, using the Cochrane library, Medline and PubMed databases, using the search terms (mental disorders) AND (tobacco use disorders OR nicotine) AND (therapy), in addition to research in scientific magazines and newspapers, 7 systematic reviews being selected. 72 studies were found that evaluated smoking abstinence, using mainly antidepressants, varenicline and nicotine replacement therapy (NRT), in addition to non-pharmacological therapies. Bupropion and nortriptyline were associated with a higher rate of short-term abstinence, demonstrating partial improvement in depressive symptoms. Varenicline led to increased abstinence rates on a sustained basis. NRT demonstrated better results when associated with non-pharmacological treatment. Adverse effects were found in 54.2%, 81.8% and 12.5% among the studies that used bupropion, varenicline and NRT respectively. Therefore, it is concluded that: Bupropion, varenicline, nortriptyline and NRT demonstrated efficacy in smoking cessation, especially when associated with behavioral approaches, with benefits greater than the risks arising from the treatment.
Keywords: Mental disorders. Tobacco use disorders. Nicotine. Therapy.
1. INTRODUÇÃO
O tabagismo, atualmente, representa o principal fator de risco modificável de doenças e de morte prematura no mundo, contabilizando 20% de mortes em homens acima de 30 anos de idade e 5% em mulheres a nível mundial (Wu et al., 2016; Da Silva et al., 2016). O tabaco mata mais da metade dos usuários nos dias atuais, com mortalidade que chega a mais de 8 milhões de pessoas por ano, sendo mais de 7 milhões de mortes resultantes do uso direto do tabaco e 1,2 milhão de óbitos decorrentes da exposição de não-fumantes ao fumo passivo de acordo com a Organização Mundial da Saúde (WHO, 2019).
Pessoas portadoras de doenças mentais graves, definidas como um grupo de doenças com sintomas psiquiátricos moderados a graves, incluindo transtorno depressivo maior, transtorno bipolar, esquizofrenia e outros transtornos psicóticos, representam uma população de risco aumentado para o tabagismo, apresentando taxas de prevalência de fumo de 70%, quando comparada a 20% da população em geral (Roberts et al., 2017; Brose et al., 2018; WHO, 2018).
Embora os números revelem maior prevalência e severidade do tabagismo nessa população de risco, o percentual de pessoas com transtorno mental severo que têm interesse em cessar ou reduzir a prática do tabagismo é semelhante à da população geral (Peckham et al., 2017). A maioria dos estudos relacionados ao tratamento visando à cessação do tabagismo nesse grupo de risco é baseada principalmente na farmacoterapia, em monoterapia ou em associação com terapias comportamentais (Roberts et al., 2017).
Desta forma, buscou-se na presente overview integrar e sintetizar as informações de revisões sistemáticas existentes acerca do arcabouço terapêutico utilizado atualmente nos pacientes portadores de transtornos mentais com o fim de cessação do tabagismo, considerados em monoterapia ou em combinação com tratamentos comportamentais, relacionando os possíveis efeitos adversos relacionados à terapia farmacológica vigente (Pollock et al., 2020).
2. METODOLOGIA
Trata-se de um estudo descritivo pautado em uma overview da literatura nacional e internacional. Baseamo-nos nas recomendações metodológicas do ReportingItems for Systematic Reviews and Meta-Analyses (PRISMA), conforme mostrado na figura 1 (Moher et al., 2009).
A pesquisa foi realizada durante o período de abril a junho de 2020 nas bases de dados LILACS, Periódicos CAPES, SciELO, Cochrane library, Medline e PubMed, empregando os seguintes termos de busca: (mental disorders) AND (tobacco use disorders OR nicotine) AND (therapy). Não foram encontradas pesquisas relevantes que atendessem ao propósito do trabalho na literatura cinzenta.
Como critérios de inclusão durante a filtragem dos estudos, fazia-se necessário que o estudo (1) fosse uma revisão sistemática; (2) tivesse sido publicado entre 2016 e 2020 e (3) se encontrasse nos idiomas inglês, português ou espanhol. Ao fim do processo de busca, foram encontrados 180 artigos que foram lidos primeiramente pelos títulos e resumos por dois revisores independentes, MCAF e LMSL, baseando-se nos critérios de inclusão do trabalho, e posteriormente os artigos selecionados foram confrontados entre os dois revisores e as divergências foram solucionadas sem a necessidade de um terceiro revisor, sendo selecionados 14 artigos.
Posteriormente, os estudos foram analisados quanto ao texto completo pelos mesmos revisores de forma independente, devendo atender, além dos critérios supracitados, (1) não ser uma overview; (2) apresentar mais de 5 estudos incluindo dependentes de nicotina; (3) apresentar métodos de tratamento como um dos focos da pesquisa; (4) não apresentar a dependência de nicotina ou de outras drogas como o único transtorno mental. Posteriormente, os estudos selecionados pelos revisores foram confrontados e as divergências foram esclarecidas sem a necessidade de um terceiro revisor. Ao final, 7 revisões sistemáticas foram selecionadas para esta overview.
Figura 1 – Fluxograma com esquema de representação dos critérios metodológicos de identificação, seleção, elegibilidade e inclusão, adaptados do método PRISMA (Moher et al., 2009).
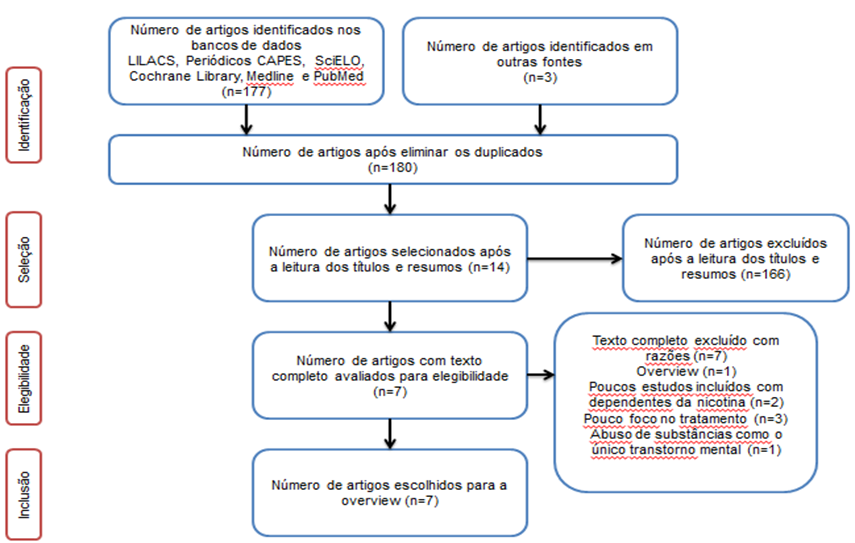
Fonte: Leite et al., 2023.
Foram incluídas somente revisões sistemáticas de ensaios clínicos randomizados com ou sem estudos open-label, que envolvessem métodos de tratamento farmacológico ou não farmacológico para a cessação do tabagismo em pacientes com transtornos mentais graves adicionais e que, de preferência, apresentassem estudos com critério de abstinência maior ou igual a 6 meses.
Foram empregadas intervenções farmacológicas e não farmacológicas a fim de avaliar suas eficiências na cessação do tabagismo em pacientes com transtornos mentais. Dentre as terapias farmacológicas, foram utilizadas (1) vareniclina; (2) bupropiona; (3) terapia de reposição de nicotina; (4) clozapina; (5) selegilina; (6) nortriptilina; (7) fluoxetina; (8) sertralina; (9) topiramato; e (10) naltrexona. Dentre as terapias não farmacológicas, foram aplicadas diferentes modalidades, desde intervenções em grupo, entrevistas motivacionais e terapia cognitivo-comportamental até a estimulação transcraniana por corrente contínua. Essas intervenções foram avaliadas como monoterapia ou em combinação entre elas.
O resultado principal procurado por esta overview foi o da cessação do tabagismo por 6 meses ou mais. De preferência, foi dada relevância para que o número de pacientes selecionados para o grupo de intervenção fosse o maior possível e que os resultados quanto à abstinência fossem por um período mais longo possível, bem como fossem bioquimicamente comprovados, a exemplo da dosagem de monóxido de carbono (CO) expirado com concentração maior que 10 ppm ou da concentração salivar, sérica e/ou urinária de cotinina, um metabólito da nicotina. Como resultados secundários esperados, encontravam-se (1) redução de sintomas de abstinência; (2) ausência de desestabilização do transtorno mental; e (3) poucos efeitos adversos leves a moderados e nenhum efeito adverso grave.
3. RESULTADOS
3.1 ANTIDEPRESSIVOS
Foram incluídas cinco revisões sistemáticas que avaliaram a eficácia do uso dos antidepressivos como estratégia de redução ou cessação do tabagismo, abrangendo 24 estudos, subdivididos dentre os seguintes medicamentos: bupropiona (dezesseis estudos), fluoxetina (quatro estudos), nortriptilina (dois estudos), selegilina (um estudo) e sertralina (um estudo).
Dentre os estudos que envolveram a aplicação da bupropiona como método de intervenção, a maioria utilizou 150 mg por dia nos primeiros 3 dias e 300 mg por dia a partir do quarto dia. Considerando as pesquisas que utilizaram a fluoxetina como estratégia de intervenção, essa droga foi utilizada em doses variadas, isoladas ou com associação à TRN e à terapia cognitivo-comportamental (TCC) (Blondal et al., 1999; Spring et al., 2007).
Dentre os estudos que utilizaram a nortriptilina como ferramenta de intervenção, Hall et al. (1998) associou essa droga à TCC. Já Hall et al. (2002) utilizou nortriptilina associada ao manejo médico ou a intervenção psicológica, comparando-a a bupropiona e ao placebo associados ao manejo médico ou a intervenção psicológica. O estudo com a selegilina utilizou esse medicamento em associação a aconselhamento breve (Weinberger et al., 2010). Por outro lado, o estudo que empregou a sertralina como intervenção utilizou-a em associação ao aconselhamento, em oposição ao placebo mas aconselhamento (Covey et al., 2002).
No geral, a bupropiona esteve associada a maiores taxas de abstinência em curto prazo após o período de intervenção, quando em comparação com o placebo. Em se tratando dos resultados secundários, a bupropiona demonstrou interferir na melhora dos sintomas depressivos em alguns estudos.
Dentre os estudos que empregaram a fluoxetina, a maioria dos estudos não observaram taxas de abstinência significativamente maiores a favor do grupo que fez uso da fluoxetina (Blondal et al., 1999; Saules et al., 2004).
Ambos os estudos utilizados com o uso da nortriptilina como ferramenta de intervenção constataram maiores taxas de abstinência de tabagismo quando em comparação ao placebo, no entanto um dos ensaios evidenciou que não houve diferenças significativas na abstinência contínua após 12 meses (Hall et al., 2002). Ademais, um dos estudos presenciou um alívio nos efeitos negativos ocorridos após a cessação do tabagismo (Hall et al., 2002).
O estudo que fez uso da selegilina como droga de intervenção evidenciou que as taxas de abstinência do tabagismo não diferiram das do placebo.20 Por outro lado, o estudo que utilizou a sertralina referiu melhora dos sintomas de abstinência em relação ao placebo, embora as taxas de abstinência não houvessem diferido significativamente (Covey et al., 2002).
O principal efeito adverso evidenciado pelas pesquisas que empregaram a bupropiona como droga de intervenção foi a insônia, relatada por seis dos artigos incluídos nas revisões sistemáticas utilizadas. Outros efeitos colaterais comumente encontrados nos estudos foram tontura, boca seca, dificuldade de concentração, agitação, náuseas e dor torácica. Entretanto, um estudo relatou rigidez muscular e despertar noturno como efeitos adversos encontrados (George et al., 2008). Outro artigo evidenciou sonhos vividos no grupo em uso da bupropiona (Brody et al., 2017). Dois estudos evidenciaram possíveis reações alérgicas relacionadas à bupropiona (Evins et al., 2005; Brown et al., 2007).
A fluoxetina foi bem tolerada nos estudos que a utilizaram, uma vez que somente um dos quatro artigos relatou efeitos adversos, que incluíam nervosismo e ansiedade (Blondal et al., 1999). Dentre os estudos que utilizaram a nortriptilina como estratégia de intervenção, ambos relataram boca seca como principal sintoma (Hall et al, 1998; Hall et al, 2002).
O estudo que envolveu a selegilina como droga principal relatou boca seca, sintomas gripais e irregularidade nos batimentos cardíacos, assim como maior frequência cardíaca, de forma significativamente maior em relação ao placebo. Foram encontrados também cefaleia, sonolência e aumento do apetite, porém de forma menos significativa (Weinberger et al., 2010). Por outro lado, a pesquisa que utilizou a sertralina evidenciou que sete pacientes, três do grupo placebo e quatro do grupo de intervenção, apresentaram tontura, agitação e diarreia (Covey et al., 2002).
3.2 VARENICLINA
Foram incluídas seis revisões sistemáticas que avaliaram a eficácia do uso da vareniclina como estratégia de redução ou cessação do tabagismo, representando oito estudos com um total de 496 participantes portadores de esquizofrenia ou transtorno esquizoafetivo, dois estudos com 60 pacientes diagnosticados com transtorno bipolar e um estudo com 525 pacientes portadores de depressão maior unipolar sem sintomas psicóticos.
A maioria dos estudos utilizou 2 mg de vareniclina durante a maior parte do período de tratamento, empregando 0,5 mg por dia nos primeiros 3 dias, 1 mg por dia do quarto ao sétimo dia e 2 mg por dia a partir da segunda semana. Um estudo utilizou 2 mg por dia desde o início do tratamento (Weiner et al., 2011). Nos estudos incluídos nas revisões sistemáticas abrangidas por esta overview, o método de comparação predominante foi o placebo.
O estudo de Fatemi et al. (2013), ao comparar a vareniclina e a bupropiona de liberação prolongada com o placebo, não constatou diminuição significativa na quantidade de cigarros fumados por dia, nicotina urinária ou sérica ou nível de CO exalado no ar. Weiner et al. (2011) constatou que 75% dos pacientes que utilizaram vareniclina alcançaram abstinência sustentada ao fim do período de intervenção, enquanto 0% dos participantes que receberam o placebo alcançaram a abstinência. Um estudo evidenciou que, após 12 semanas de tratamento, 19% dos pacientes que usaram vareniclina atenderam aos critérios de cessação do tabagismo, em comparação a 4,7% do grupo placebo (p = 0,046). Já após 24 semanas, 11,9% pacientes tratados com vareniclina e 2,3% dos pacientes tratados com placebo, respectivamente, apresentaram os critérios de abstinência (p = 0,090) (Williams et al., 2012). Outro estudo constatou que a vareniclina, em comparação com o placebo, reduziu significativamente os níveis de cotinina (p < 0,001), e outras medidas referentes ao tabagismo (p < 0,01), assim como nas respostas de uma escala de estímulos para fumar (p = 0,02) (Smith et al., 2016).
O único estudo open-label utilizando a vareniclina como estratégia de intervenção, em uma amostra de 53 pacientes sem grupo comparador, evidenciou que na 12ª semana do estudo, 32 participantes apresentaram os critérios de abstinência, tendo sido constatado que pacientes com sintomas mais baixos de achatamento afetivo (efeito mais típico) apresentaram probabilidade mais alta de atingir a abstinência do tabagismo e possuíram maiores aumentos na sensibilidade à recompensa durante o tratamento (Dutra et al., 2012).
Um ensaio clínico envolvendo pacientes com transtorno bipolar tipo I ou tipo II evidenciou que, após 3 meses de tratamento, mais indivíduos deixaram de fumar com vareniclina em comparação ao placebo (48,4% vs. 10,3%, OR = 8,1; IC 95%, 2,03–32,5; p < 0,002). Após 6 meses, 19,4% dos pacientes continuaram abstinentes em comparação a 6,9% dos pacientes que utilizaram placebo (OR = 3,2; IC95%, 0,60-17,6; P = 0,17) (Chengappa et al., 2014). Em um ensaio clínico direcionado para uma amostra de 5 pacientes portadores de transtorno bipolar tipo I ou II, um indivíduo apresentou abstinência ao tabagismo (Wu et al., 2012). No estudo que utilizou pacientes com transtorno depressivo maior, o grupo tratado com vareniclina apresentou maior índice de abstinência contínua quando comparado ao placebo nas semanas 9 a 12 (Anthenelli et al., 2013).
Por outro lado, um estudo evidenciou que a vareniclina, em comparação ao placebo, não gerou melhora nas pontuações em uma bateria cognitiva projetada para testar o efeito de drogas no desempenho cognitivo na esquizofrenia (a bateria MATRICS), tanto na pontuação geral quanto nos compostos individuais quanto no domínio. Além disso, não ocorreram diferenças significativas entre os efeitos da vareniclina contra o placebo nos escores de sintomas utilizados (Smith et al., 2016). Outro ensaio clínico não notou diferença entre os grupos nos sintomas positivos da escala BPRS (BriefPsychiatric Rating Scale) (t = 1,7, df = 5,1, p = 0,29) ou nos escores de ansiedade/depressão (t = 0,005, df = 4,9, p = 0,99) (Hong et al., 2011).
No estudo de Meszaros et al. (2013), não houve melhora significativa da cognição até o fim do estudo em ambos os grupos. Além disso, não houve mudanças significativas nos sintomas positivos, negativos e gerais de acordo com a escala PANSS (Positive and Negative Syndrome Scale). Entretanto, Shim et al. (2012) constatou que ocorreram efeitos positivos da vareniclina como adjuvante para os sintomas cognitivos em pacientes portadores de esquizofrenia.
A maioria dos estudos incluídos relatou efeitos adversos significativamente maiores no grupo da vareniclina quando comparado ao placebo. Os principais sintomas relatados foram náusea, insônia, cefaléia, constipação e irritabilidade. No entanto, três dentre os onze estudos que trouxeram a vareniclina como método de intervenção não notaram diferenças significativas entre os efeitos adversos do grupo da vareniclina quando em comparação ao grupo placebo (Fatemi et al., 2013; Smith et al., 2016).
Em um ensaio clínico envolvendo pacientes com transtorno bipolar, ocorreram dez eventos adversos graves, além do desenvolvimento de sonhos anormais, sobretudo no grupo de intervenção (61,3% vs. 31% no grupo placebo) (Chengappa et al, 2014). Outro estudo, realizado em pacientes com depressão maior, também evidenciou sonhos anormais (11,3% vs. 8,2%), além de náuseas (27,0% vs. 10,4%), cefaleia (16,8% vs. 11,2%), insônia (10,9% vs. 4,8%) e irritabilidade (10,9% vs. 8,2%) (Anthenelli et al., 2013).
Um estudo constatou um aumento de baixa significância na taxa no índice de vômitos (15,6% contra 3,1% no grupo placebo, p = 0,20), boca seca (34,4% contra 18,8% do grupo placebo, p = 0,26) e aumento do apetite (31,3% versus 18,8%, p = 0,39) no grupo em uso da vareniclina (Hong et al., 2011).
3.3 TERAPIA DE REPOSIÇÃO DE NICOTINA (TRN)
Foram incluídas quatro revisões sistemáticas que avaliaram a eficácia da terapia de reposição de nicotina (TRN) na redução ou cessação do tabagismo, perfazendo seis estudos com um total de 777 pacientes portadores de esquizofrenia, e dois estudos com 646 participantes com sintomas depressivos ou diagnóstico de depressão maior (Chen; Lan; Wu, 2013).
Na maioria dos estudos a TRN foi utilizada sob a forma de adesivos de nicotina, com doses variáveis de 14 a 31,2 mg por dia, com exceção de um estudo, em que foram utilizadas gomas de mascar de nicotina, com doses de 2 ou 4 mg por dia (Kinnunen; Korhonen; Garvey, 2008).
A TRN foi comparada ao placebo ou a doses baixas e altas de nicotina, associada a reforços positivos monetários ou a terapias comportamentais. Apenas três estudos compararam o uso de adesivos de nicotina isolado em relação ao placebo (Dalack; James; Meador-Woodruff, 1999; Thorsteinsson et al., 2001).
No estudo que avaliou a abstinência do fumo em pacientes em uso goma de mascar de nicotina, foi verificado que os participantes depressivos em uso de placebo tiveram taxas de abstinência mais baixas (5,7%), do que os grupos em uso de TRN (não depressivos 20,1%, p = 0.004; em comparação aos depressivos 15,1%, p = 0,05), não havendo diferença significativa na cessação do fumo entre os grupos (Kinnunen; Korhonen; Garvey, 2008).
Não foi verificada diferença significativa da taxa geral de CO expirado nos três estudos que avaliaram a TRN em relação ao placebo, sendo de 15% num dos estudos realizados com pacientes esquizofrênicos sem intenção de cessar o fumo (Dalack; James; Meador-Woodruff, 1999). Um dos estudos verificou que 100% dos pacientes em uso de placebo retornaram o fumo antes de completar o período de seis meses, em comparação com o grupo em uso de TRN (3 de 9 pacientes) (Horst et al, 2005). Outro ensaio demonstrou que metade dos pacientes sob o grupo placebo retomaram o fumo e desistiram do estudo em comparação a 22% dos pacientes com depressão maior que fizeram uso de TRN. A proporção dos que não retomaram o tabagismo foi maior no grupo de TRN do que no grupo placebo, mas sem diferenças estatísticas significativas (Thorsteinsson et al., 2001).
Na comparação de doses altas a baixas doses de TRN, o ponto de prevalência de abstinência de 7 dias foi de 2,7% (5/184), sendo 4 pacientes em uso de baixas doses (4,3%) e 1 paciente em uso de alta dose (1,1%). Os participantes sob uso de baixas doses de TRN tiveram redução de mais 3,1 cigarros em média em relação ao grupo em uso de altas doses de TRN (p = 0,005), sem diferença significativa entre os grupos após análise estatística. Na avaliação quanto à dependência de nicotina, níveis de CO expirado, sintomas extrapiramidais e sintomas psiquiátricos, não houve diferença entre os grupos (Chen; Lan; Wu, 2013).
A TRN, quando associada a terapias comportamentais, demonstrou melhores resultados quanto à abstinência do fumo e na permanência dos participantes no estudo. Um dos ensaios que comparou TRN associada com métodos comportamentais à terapia de rotina constatou que, embora não houvesse diferenças entre os grupos em relação à abstinência de modo geral, houve proporções mais altas de fumantes que completaram todas as sessões de tratamento nos momentos de avaliação nos grupos sob terapias comportamentais (30% x 6% aos 3 meses; 18,6% x 4% aos 6 meses; e 18,6% x 6,6% aos 12 meses) (Baker et al., 2006).
No estudo que comparou reforço de contingência (RC) isolado ou associado à TRN, foi demonstrado na 20ª semana de estudo que os grupos de intervenção (RC e RC+TRN) alcançaram maior redução dos valores de CO expirado e de cotinina do que o grupo controle de mínima intervenção (32%, 12%, 4%, respectivamente, p= 0,02). O grupo com RC isolado obteve melhores resultados de percentual de cessação do fumo, considerando os critérios de valor de cotinina e de CO expirado, do que o grupo que usou RC associada à TRN (23% versus 10%). Neste estudo, apenas 16 (27%) dos 60 participantes em uso de TRN permaneceram no estudo, por motivos não relatados. Não houve diferença estatística significativa quanto aos relatos de sintomas psiquiátricos nos três grupos avaliados (Gallagher et al., 2007).
Na comparação de tratamento intensivo com o tratamento de gerenciamento de medicações, 21% dos participantes obtiveram abstinência contínua por 12 semanas após a data prevista para a cessação do fumo, não havendo diferenças significativas entre os tratamentos, sendo 15,6% sob o tratamento de dependência de nicotina versus 26,2% sob o tratamento de gerenciamento de medicação (Williams et al., 2010).
3.4 ANTIPSICÓTICOS
Em uma revisão sistemática, foram identificados cinco estudos que utilizaram a clozapina para cessação ou redução de tabagismo em pacientes esquizofrênicos, sendo três ensaios clínicos randomizados, realizados nos EUA, e 2 estudos open-label, realizados em Taiwan, perfazendo o total de 727 participantes com diagnóstico de esquizofrenia.
Nos três estudos randomizados revisados, foram comparadas doses variadas de clozapina, com dose baixa (até 150 mg/dia), doses médias (200 a 450 mg/dia), e um dos estudos comparou com doses altas (até 600 mg/dia) (De Leon et al., 2005). Os dois estudos open-label compararam a clozapina com antipsicóticos típicos (ou de primeira geração) e com outros antipsicóticos atípicos (ou de segunda geração). Em um dos estudos, houve a administração prévia de haloperidol 120 mg/dia por 2 semanas (McEvoy et al., 1995). Nenhum dos cinco estudos utilizou placebo como comparador.
A clozapina administrada em doses médias a altas foi associada à melhora da pontuação na escala de avaliação psiquiátrica BPRS e na escala de avaliação clínica CGI (Clinical Global Impressionscale), com maior redução do número de cigarros fumados por dia (McEvoy et al., 1995; McEvoy; Freudenreich; Wilson, 1999). Um dos estudos não verificou efeito significativo na redução dessas escalas, demonstrando que não há evidências de que a clozapina reduza os níveis de cotinina séricos em pacientes com esquizofrenia (De Leon et al., 2005).
O tipo de antipsicótico não foi significativamente associado à cessação do tabagismo, mas foi significativamente preditivo de redução do tabagismo, com a redução no número de cigarros fumados por dia, bem como nos valores do FTND (Wu; Chen; Lee, 2013). Em outro estudo, os pacientes que fizeram uso de antipsicóticos de primeira geração ou clozapina reduziram mais o tabagismo em comparação com os que usaram outros antipsicóticos de segunda geração (Wu; Lan, 2017).
3.5 ANTICONVULSIVANTES
Dentre os estudos incluídos nesta overview, apenas uma das revisões sistemáticas incluiu o papel do anticonvulsivante na redução do tabagismo, com a inclusão de um ensaio clínico randomizado duplo-cego que avaliou, de forma secundária, o papel do topiramato para aquele desfecho em comparação com o placebo em portadores de trastorno esquizoafetivo (Weinberger et al., 2008).
No estudo, os participantes foram randomicamente designados para receber topiramato em doses de 100 a 400mg/dia (n = 13) e placebo (n = 11) durante 8 semanas, sem nenhuma outra intervenção farmacológica ou comportamental complementar (Weinberger et al., 2008).
Na avaliação entre os níveis de monóxido de carbono na quarta semana (Topiramato = 21,6, número de cigarros relatado = 11,3; placebo = 25,6, número de cigarros relatado = 9,7; p = 0,44) e na oitava semana (Topiramato = 23,7, número de cigarros relatado = 8,2; Placebo = 21,4, número de cigarros relatado = 10,39; p = 0,62), não foram detectadas diferenças significativas entre o uso de topiramato e placebo, exercendo fraca influência nos sintomas do humor e psicóticos e na redução do fumo. Não foram reportados efeitos adversos no estudo (Weinberger et al., 2008).
3.6 NALTREXONA
Foram incluídas duas revisões sistemáticas, perfazendo três ensaios clínicos randomizados que avaliaram a eficácia da naltrexona na cessação do tabagismo, sendo dois estudos realizados com a participação de portadores de sintomas depressivos ou histórico de depressão maior, e um estudo realizado com pacientes portadores de esquizofrenia.
Nos estudos em pacientes depressivos ou com histórico de depressão, foram comparadas doses de até 50 mg/dia de naltrexona em relação ao placebo, com um dos estudos associando terapia de reposição de nicotina através de adesivos, sob doses decrescentes, e outro ensaio associando sessões de aconselhamento individual ao tratamento, tendo durado de 4 a 8 semanas (Covey; Glassman; Stetner, 1999; Walsh et al., 2008). Ambos os estudos avaliaram de forma secundária a influência do sexo e do histórico de depressão nas taxas de cessação do tabagismo. Todos os estudos compararam a naltrexona em relação ao placebo. Não foram descritas as doses de naltrexona utilizadas no estudo realizado com pacientes portadores de esquizofrenia (Meszaros et al., 2010).
Pacientes tratados com naltrexona apresentaram, ao final do tratamento de 4 semanas, taxas de cessação do tabagismo de 46,7%, contra os 26,3% que fizeram uso de placebo (OR = 2,5, p <0,10). Nesse estudo, a naltrexona exerceu maior efeito em fumantes mulheres do que em homens (OR: 3,5 x 1,4) e entre os pacientes com histórico de depressão maior em relação aos que não tinham histórico desse transtorno (OR: 8,4 x 0,8). Numa análise tripla (sexo, depressão e tratamento), os efeitos foram ainda mais significativos em relação às fumantes mulheres (OR = 4.4 vs. 2.7) (Covey; Glassman; Stetner, 1999).
Em outro estudo, a taxa geral de cessação do tabagismo ao final do tratamento foi maior nos participantes que usaram a naltrexona (60%) em comparação ao grupo que fez uso de placebo (53%), embora que a diferença dos escores do BDI (de 0 a 19 pontos) nas duas intervenções não fosse significativa, correspondendo a 4.35 e 3.31, pelo uso de naltrexona e placebo respectivamente. Em relação à abstinência prolongada durante todo o período do estudo, verificou-se que a naltrexona demonstrou ser uma melhor opção em sintomas depressivos mais intensos (OR = 1,31, p = 0,07). Devido ao número reduzido da amostra, foi impossibilitada análise da influência do sexo nos desfechos (Walsh et al., 2008). Dentre os efeitos adversos reportados, destacaram-se sonolência, desorientação espacial, náusea, dor abdominal, problemas de concentração em oito usuários de naltrexona é um dos participantes que utilizou placebo relatou ataque de pânico (Covey; Glassman; Stetner, 1999). Foram relatados ainda tontura e sensação de rubor e calor nos usuários de naltrexona em relação ao placebo (Walsh et al., 2008).
3.7 NÃO FARMACOLÓGICO
Foram incluídas três revisões sistemáticas que abordaram terapias comportamentais para redução do tabagismo, sendo quatro estudos com 363 pacientes com sintomas depressivos, seis estudos com o total de 1.701 indivíduos com depressão maior (DM) ou histórico de depressão maior (HDM) e dez estudos com o total de 844 portadores de esquizofrenia ou transtorno psicótico.
Os estudos com indivíduos depressivos avaliaram o efeito de terapias comportamentais isoladas ou em associação a tratamento medicamentoso, em comparação a outras estratégias como sessões de educação em saúde, psicoterapia ou utilizando técnicas de relaxamento (Batra et al., 2010; Schleicher et al. 2012).
Nos estudos com pacientes com DM ou HDM houve destaque para a Terapia cognitivo comportamental (TCC), que foi comparada ao tratamento para depressão e a sessões de educação (Brown et al., 2001; Haas et al., 2004). Outras metodologias foram avaliadas como estratégia de manejo do humor e de habilidades para prevenção de recaídas e de aconselhamento psicológico em associação com medicação (Hall; Muñoz; Reus, 1994; Killen et al., 2008).
Dentre as intervenções utilizadas nos pacientes com esquizofrenia, desordem esquizoafetiva ou desordem bipolar destacam-se terapias comportamentais (dois estudos), estimulação transcraniana por corrente contínua isolada ou em associação com medicação (três estudos), entrevistas motivacionais (dois estudos) (Bennett et al., 2015; Steinberg et al., 2015). Foram avaliadas ainda intervenções com foco em estilo de vida saudável, reforço positivo através de reforço monetário denominado reforço de contingência e programa estruturado e personalizado de cessação do tabagismo (Baker et al., 2017; Tidey et al, 2011).
Indivíduos com sintomas depressivos quando submetidos a terapias comportamentais associadas a sessões de educação em saúde e psicoterapia não demonstraram aumento significativo das taxas de abstinência em relação aos grupos não submetidos a essas estratégias (Batra et al., 2010; Bernard et al., 2015; Schleicher et al. 2012). Quando terapia ativação comportamental foi associada ao tratamento padrão, baseado em estratégias para cessar o fumo e TRN, os desfechos de abstinência demonstraram melhores resultados (MacPherson et al., 2010).
Quanto aos pacientes com DM ou HDM, a TCC, quando utilizada em associação ao tratamento para depressão, não resultou em desfechos mais favoráveis do que quando utilizada isoladamente. Um dos estudos verificou taxas de abstinência de 30,1% no grupo submetido a TCC isolada e de 39,5% no grupo sob TCC associado a tratamento para depressão, embora esse grupo tenha apresentado melhores resultados na população de HDM recorrente (Brown et al., 2001). Outro estudo também demonstrou que a TCC acarretou maiores taxas de abstinência em indivíduos com histórico de vários episódios de DM (OR= 2,93; IC 95%; 1,13 – 7,67) (Haas et al., 2004).
Estratégias de manejo de humor foram mais eficazes do que o tratamento padrão durante o seguimento dos indivíduos esquizofrênicos, embora esses resultados não tenham sido confirmados em outro estudo similar, que demonstrou discreta diferença entre os pacientes com e sem HDM (Hall; Muñoz; Reus, 1994; Hall et al., 1996). Pacientes com HDM sob o programa de stagecare, constituído a partir de sessões de aconselhamento psicológico em associação a TRN e bupropiona, demonstraram maiores taxas de abstinência no seguimento de 18 meses do que quando submetidos a sessões de briefcontact (OR = 4,549) (Hall et al, 2006). Outro estudo que avaliou TCC com foco em habilidades para prevenção de recaídas em comparação a sessões de ligações telefônicas não obteve resultados de abstinência significativa entre os grupos (Killen et al, 2008).
A terapia de estimulação transcraniana por corrente contínua (ETCC) em pacientes esquizofrênicos demonstrou resultados favoráveis em relação à redução dos sintomas de desejo de fumar e melhora dos sintomas cognitivos em pacientes esquizofrênicos, mas sem diferenças significativas nas taxas de abstinência do fumo quando comparada ao tratamento simulado (Smith et al., 2015; Wing et al., 2012).
Entrevistas motivacionais não resultaram em diferença significativa das taxas de abstinência do fumo quando comparada a intervenção psicossocial ou intervenções mínimas, embora tenha havido diminuição geral do número dos cigarros fumados por dia (Steinberg, 2003). Quando as entrevistas motivacionais foram associadas a sessões personalizadas, não resultaram em melhores desfechos de redução do fumo em comparação a sessões de educação interativa (Steinberg et al., 2015).
No estudo que avaliou a eficácia da associação de bupropiona ou de placebo ao método comportamental de reforço de contingência (RC), isto é, reforço positivo através de recompensa monetária aos participantes que conseguissem obter abstinência do fumo validada através da medição da redução de cigarros fumados por dia, da concentração urinária de cotinina e de CO expirado, foi verificado maior grau de abstinência no grupo sob RC durante os 22 dias de intervenção, em comparação ao grupo sem RC (Tidey et al., 2011). No estudo que verificou a eficácia da utilização de uma estratégia comportamental multifacetada, também baseada em reforço monetário e social, não houve diferenças significativas de abstinência em relação ao grupo de suporte baseado em terapias de grupo e educação em saúde (Bennett et al., 2015).
Quando terapia comportamental foi associada a sessões de aprimoramento motivacional, psicoeducação, treinamento de habilidades e prevenção de recaídas em pacientes esquizofrênicos, houve maior taxa de abstinência contínua nas últimas quatro semanas de tratamento quando comparada a terapia comportamental em grupo com base no Programa da ALA, mas não houve diferença significativa de abstinência ao final do tratamento e após seguimento dos participantes por 6 meses (George et al., 2000). Pacientes esquizofrênicos sob tratamento com foco em estilo de vida saudável e sob acompanhamento através de ligações telefônicas tiveram redução do número de cigarros e aumento das taxas de abstinência, mas sem diferenças significativas entre os grupos (Baker et al., 2017).
Num estudo que comparou a taxa de abstinência entre um grupo de pacientes esquizofrênicos que foi submetido a um programa estruturado e personalizado de cessação do tabagismo a um grupo sob tratamento comportamental usual, observou-se que o primeiro grupo obteve 36% de abstinência do fumo ao final de 12 meses de estudo, em comparação com o 23% do grupo controle (OR=2,9, IC 95% 0,8–10,5) (Gilbody et al., 2015).
Num dos estudos com pacientes com e sem HDM, 5% dos participantes relataram efeitos adversos com o uso de TRN ou bupropiona na fase open-label, com o relato de sintoma mais comum de distúrbios do sono, com 58% referindo insônia e 14% relatando sonhos vívidos (Killen et al., 2008).
4. DISCUSSÃO
Esta overview incluiu sete revisões sistemáticas, com o total de 72 estudos incluídos após a exclusão dos duplicados, com a maioria dos estudos correspondendo a ensaios clínicos randomizados, com apenas cinco estudos open-label (6,94%). Os resultados evidenciaram que a maioria dos ensaios baseou-se em tratamentos farmacológicos, com destaque para bupropiona (22%), vareniclina (15,3%) e terapia de reposição de nicotina (11%) e outras terapias farmacológicas (23,7%). Além disso, as terapias não farmacológicas associadas ou não ao tratamento medicamentoso foram bastante encontradas em nossa pesquisa (28%) (Tabela 1).
Quanto ao perfil dos participantes, verificou-se destaque para a população portadora transtornos esquizofrênicos (57%) e de depressão maior ou história patológica pregressa de episódio depressivo (39%), com apenas 4% dos ensaios com participantes acometidos de transtorno bipolar.
Tabela 1 – Resumo dos estudos incluídos.
Terapias Estudos incluídos Esquizofrenia Sintomas depressivos / DM / HDM Transtorno Bipolar Antidepressivos 24 (33,3%) 10 13 1 Vareniclina 11 (15,2%) 8 1 2 TRN 8 (11,1%) 6 2 0 Antipsicóticos 5 (6,94%) 5 0 0 Anticonvulsivantes 1 (1,39%) 1 0 0 Naltrexona 3 (4,17%) 1 2 0 Terapias não farmacológicas 20 (27,78%) 10 10 0 Total 72 (100%) 41 (57%) 28(39%) 3(4%)
DM (depressão maior); HDM (histórico de depressão maior).
Fonte: Leite et al., 2023.
No geral, a bupropiona associou-se à maior taxa de abstinência em curto prazo após o período de intervenção quando em comparação ao placebo, entretanto, essa taxa apresentou redução 6 meses ou 12 meses após a suspensão da droga durante o período de intervenção.
Além disso, a bupropiona não esteve associada a mudanças importantes nos sintomas psiquiátricos, embora tenha demonstrado melhora parcial dos sintomas depressivos. Apesar disso, alguns dos efeitos adversos comumente encontrados com o uso da bupropiona foram insônia, tontura, boca seca, dificuldade de concentração, agitação, náuseas e dor torácica.
A fluoxetina, na maior parte dos estudos, não proporcionou taxas de abstinência significativamente maiores a favor do grupo de intervenção em relação ao placebo. Contudo, nos artigos em que esteve associada ao aumento na taxa de abstinência, sobretudo naqueles com menos sintomas psiquiátricos, essa correspondeu a no máximo 6 meses de abstinência após a suspensão da droga. Além disso, em geral, a fluoxetina não apresentou efeitos adversos prevalentes.
Os estudos que introduziram a nortriptilina como ferramenta de intervenção não demonstraram diferenças significativas na abstinência contínua após os 12 meses, embora tenha sido observado alívio dos efeitos negativos do transtorno psiquiátrico. Por outro lado, o principal efeito adverso encontrado com o uso da nortriptilina foi a boca seca, bem como foram relatados sintomas de cefaleia, tremores nas mãos, visão turva e constipação.
A selegilina não esteve relacionada com alterações da taxa de abstinência quando comparada ao placebo, sendo encontrado, como efeitos adversos principais, boca seca, sintomas gripais, taquicardia e irregularidade nos batimentos cardíacos.
A sertralina também não proporcionou aumento das taxas de abstinência em relação ao placebo, embora tenha contribuído para a diminuição na irritabilidade, ansiedade e inquietação. Entretanto, como efeitos adversos encontrados, merecem destaque a tontura, agitação e diarreia.
A vareniclina, em geral, esteve associada ao aumento nas taxas de abstinência de forma sustentada, como também o proporcionou menor consumo de cigarros por dia e aumento do desejo em parar de fumar ao fim do período de intervenção quando relacionada ao placebo. Conquanto, na maioria dos estudos que a compararam a bupropiona, não ocorreram mudanças significativas no que tange ao índice de abstinência.
Somando-se a isso, embora em alguns ensaios tenha sido observada uma tendência de redução dos sintomas psicóticos em pacientes com esquizofrenia ou outros transtornos esquizoafetivos com o uso desse medicamento, grande parte dos estudos constataram a não ocorrência de mudanças significativas nos sintomas psicóticos, depressivos ou outros sintomas psiquiátricos. Entretanto, a vareniclina esteve associada a ocorrência de náusea, insônia, cefaleia, constipação e irritabilidade como efeitos adversos principais.
A terapia de reposição de nicotina (TRN), sob a forma de adesivos de nicotina, representou a maior parte das intervenções (88%), com apenas um estudo utilizando goma de mascar de nicotina, havendo ainda heterogeneidade entre os estudos quanto aos grupos comparativos, com 37,5% dos ensaios comparando TRN em relação ao placebo e a maioria dos estudos utilizando terapias comportamentais associadas.
A abstinência do fumo em participantes em uso de TRN não apresentou diferença significativa na comparação com o placebo, havendo, entretanto, maior redução do número de cigarros fumados por dia nos grupos em uso de TRN em baixas doses quando comparadas a altas doses, embora não tenham sido identificadas diferenças quanto aos sintomas extrapiramidais e sintomas psiquiátricos entre os grupos.
Os resultados relacionados à abstinência e a permanência dos participantes nos estudos foram melhores quando a TRN foi associada a terapias comportamentais, com destaque para a adoção de técnicas de reforço de contingência. A TRN demonstrou a ocorrência de movimentos anormais involuntários como efeito adverso.
Quanto ao uso de antipsicóticos para o fim de cessação ou redução de tabagismo em pacientes esquizofrênicos, a clozapina foi avaliada em uma revisão sistemática que demonstrou que, embora esse antipsicótico possa oferecer melhora das pontuações nas escalas de sintomas psiquiátricos, sobretudo em comparação aos fármacos de primeira geração, o efeito desejado de redução ou cessação do fumo não foi verificado em todos os estudos, cujos resultados também apresentaram limitações, considerando que os participantes dos estudos encontravam-se internados e sob controle de horário permitido para o fumo.
Na avaliação do efeito de redução ou cessação do fumo a partir do uso de terapia farmacológica à base de anticonvulsivantes, apenas o topiramato foi incluído nesta overview, com a inclusão de apenas uma revisão sistemática que abordou o papel dessa classe de medicamentos na redução do tabagismo, que foi avaliada através de um ensaio clínico randomizado duplo-cego que avaliou esse efeito de forma secundária em pacientes portadores de esquizofrenia. Nesse estudo não foi demonstrada diferença significativa na comparação do topiramato em relação ao placebo em relação aos sintomas psicóticos e do humor, quanto à redução do fumo, bem como quanto aos efeitos adversos.
Na avaliação da eficácia da naltrexona na cessação do tabagismo em pacientes com transtornos mentais graves, verificou-se que quando comparada ao uso do placebo, a naltrexona, em pacientes depressivos ou com histórico de depressão, demonstrou maior taxa de abstinência do fumo, com resultados mais significativos em pacientes do sexo feminino e com histórico de depressão maior.
Quanto aos efeitos adversos pelo uso da naltrexona foi relatada a ocorrência de sonolência, desorientação espacial, náusea, dor abdominal, problemas de concentração, tontura e sensação de rubor e calor.
Embora sem significativa diferença na abstinência do fumo em relação ao tratamento padrão, os estudos que utilizaram terapias comportamentais em associação com sessões de educação em saúde, psicoterapia, TCC ou ao tratamento farmacológico a base de TRN ou bupropiona, demonstraram resultados melhores quanto à redução dos sintomas de desejo de fumar e melhora dos sintomas cognitivos, o que também foi observado nos estudos que utilizaram terapia a base de estimulação transcraniana de corrente contínua em pacientes esquizofrênicos.
O presente estudo apresenta como limitações: (1) a inclusão de revisões sistemáticas de baixa ou muito baixa evidência científica devido à escassez de estudos de maior evidência envolvendo a temática, o que pode comprometer no julgamento final do trabalho; (2) o predomínio da avaliação do risco de viés como alto risco/incerto em detrimento do baixo risco de viés; (3) a presença de estudos open-label incluídos em algumas revisões sistemáticas inseridas neste trabalho, o que reduz o nível de evidência científico desta overview.
Somando-se a isso, deve-se atentar para a maior dificuldade de projeção prática envolvendo a utilização dos tratamentos manejados pelos estudos incluídos nas revisões sistemáticas, uma vez que a maioria incluiu participantes com desejo de parar de fumar, em uso diário de quantidades parecidas de nicotina e com outras características semelhantes, o que limita a reprodutibilidade prática e põe em dúvida alguns resultados encontrados.
Outra limitação evidenciada foi a heterogeneidade encontrada dentre os estudos no que se refere aos participantes incluídos, sobretudo, no grupo em uso de antidepressivos como droga de intervenção, em que poderiam ser encontrados pacientes com depressão maior, com episódio depressivo prévio ou mesmo sem sintomas depressivos, o que pode dificultar a avaliação comparativa dentre esses trabalhos.
5. CONCLUSÃO
O tabagismo representa uma importante causa de aumento de morbidade e mortalidade, que acarreta gastos em saúde pública, onerando sistemas de saúde em nível mundial e no âmbito brasileiro, sendo de suma relevância a adoção de estratégias multidisciplinares e esforços conjuntos das nações para a redução e cessação dessa prática na população geral e, sobretudo, dos portadores de doenças mentais graves, que correspondem a grupo com alto fator de risco para o fumo.
Nesta overview, verificou-se que o arcabouço terapêutico disponível para a redução do tabagismo na população demonstrou ser aplicável aos fumantes com transtornos mentais graves, tendo sido demonstrado que os benefícios decorrentes da redução ou cessação do fumo superam os possíveis efeitos adversos verificados com o uso de medicações.
Bupropiona, vareniclina, nortriptilina e terapia de reposição de nicotina demonstraram eficácia na redução do tabagismo, bem como a associação de tratamento medicamentoso a abordagens comportamentais evidenciaram ser mais eficazes na manutenção do tratamento, na abstinência do fumo e na diminuição dos sintomas de necessidade de fumar e de abstinência.
Este trabalho buscou elencar as formas de tratamento para cessação do fumo em portadores de doenças mentais, sendo necessários novos estudos para avaliar a comparação estatística da eficácia dos fármacos utilizados nos estudos.
REFERÊNCIAS
ANTHENELLI, R.M. et al. Effects of varenicline on smoking cessation in adults with stably treated current or past major depression: A randomized trial. Ann Intern Med. 2013; 159(6):390–400.
BAKER, A. et al. A Randomized Controlled Trial of a Smoking Cessation Intervention Among People With a Psychotic Disorder. Am J Psychiatry. 2006; 163(11):1934.
BAKER, A.L. et al. Randomized controlled trial of a healthy lifestyle intervention among smokers with psychotic disorders: outcomes to 36 months. Aust N Z J Psychiatry. 2017. 52(3): 239-252.
BATRA, A. et al. A cluster-randomized effectiveness Trial of smoking cessation modified for at-risk smoker subgroups. J Subst Abuse Treat. 2010; 38(2):128-40.
BENNETT, M.E. et al. Smoking Cessation in Individuals With Serious Mental Illness: a randomized controlled Trial of two psychosocial interventions. J. Dual Diagn. 2015; 11(3-4):161-73.
BERNARD, P. et al. Exercise and Counseling for Smoking Cessation in Smokers With Depressive Symptoms: a randomized controlled pilot trial. J. Dual Diagn. 2015; 11 (3-4): 205-16.
BLONDAL, T. et al.The effects of fluoxetine combined with nicotine inhalers in smoking cessation – A randomized trial. Addiction. 1999; 94(7):1007–15.
BRODY, A.L. et al. Combination extended smoking cessation treatment plus home visits for smokers with schizophrenia: A randomized controlled trial. Nicotine Tob Res. 2017; 19(1):68–76.
BROSE, L.S. et al. Maintaining abstinence from smoking after a period of enforced abstinence – Systematic review, meta-analysis and analysis of behavior change techniques with a focus on mental health. Psychol Med. 2018; 48(4):669–78.
BROWN, R.A. et al. Bupropion and cognitive–behavioral treatment for depression in smoking cessation Richard. NicotineTob Res. 2007; 9(7):721–30.
BROWN, R.A. et al. Cognitive–behavioral treatment for depression in smoking cessation. J Consult Clin Psychol. 2001; 69(3): 471-80.
BROWN, R.A. et al. Efficacy of sequential use of fluoxetine for smoking cessation in elevated depressive symptom smokers. Nicotine Tob Res. 2014; 16(2):197–207.
CARVALHO, A.P.V. et al. Avaliação do risco de viés de ensaios clínicos randomizados pela ferramenta da colaboração Cochrane. Diagnóstico Trat [Internet]. 2013; 18(1):38–44. Disponível em:http://pesquisa.bvsalud.org/portal/resource/pt/lil-670595#
CHEN, H.K.; LAN, T.H.; WU, B.J. A double-blind randomized clinical Trial of different doses of transdermal nicotine patch for smoking reduction and cessation in long-term hospitalized schizophrenic patients. Eur Arch Psychiatry Clin Neurosci. 2013; 263(1):75–82.
CHENGAPPA, K.N.R. et al. Varenicline for smoking cessation in bipolar disorder: a randomized, double-blind, placebo-controlled study. J Clin Psychiatry. 2014; 75(7): 765-72.
COVEY, L.S. et al. A randomized Trial of sertraline as a cessation aid for smokers with a history of major depression. Am J Psychiatry. 2002; 159(10):1731–7.
COVEY, L.S.; GLASSMAN, A.H., STETNER, F. Naltrexone effects on short-term and long-term smoking cessation. J Addict Dis. 1999; 18(1):31-40. doi: 10.1300/J069v18n01_04. PMID: 10234561.
DA SILVA, L.C.C. et al. Smoking control: Challenges and achievements. J Bras Pneumol. 2016; 42(4):290–8.
DALACK, G.W.; JAMES, H; MEADOR-WOODRUFF; M.D. Acute feasibility and safety of a smoking reduction strategy for smokers with schizophrenia, NicotineTob Res. 1999; 1 (1): 53–57, https://doi.org/10.1080/14622299050011151
DE LEON, J. et al. Does clozapine decrease smoking? Prog Neuro-Psychopharmacology Biol Psychiatry. 2005; 29(5):757–62.
DUTRA, S.J. et al. Varenicline as a Smoking Cessation Aid in Schizophrenia: Effects on Smoking Behavior and Reward Sensitivity Sunny. Psychopharmacol. 2012; 219(1):25–34.
EVINS, A.E. et al. A double-blind placebo-controlled Trial of bupropion sustained-release for smoking cessation in schizophrenia. J Clin Psychopharmacol. 2005; 25(3):218–25.
FATEMI, S.H. et al. Antismoking and potential antipsychotic effects of varenicline in subjects with schizophrenia or schizoaffective disorder: A double-blind placebo and bupropion-controlled study. Schizophr Res. 2013; 146(1–3):376–8.
GALLAGHER, S.M. et al. A Comparison of Smoking CessationTreatments for Persons with Schizophrenia and Other Serious Mental Illnesses. J Psychoactive Drugs. 2007; 39(4):487-97.
GEORGE, T.P. et al. A Placebo-ControlledTrial of Bupropion Combined with Nicotine Patch for Smoking Cessation in Schizophrenia. Biol Psychiatry. 2008; 63(11):1092–6.
GEORGE, T.P. et al. Nicotine transdermal patch and atypical antipsychotic medications for smoking cessation in schizophrenia. Am J Psychiatry. 2000; 157(11):1835-42.
GILBODY, S. et al. Be spoke smoking cessation for people with severe mental ill health (SCIMITAR): a pilot randomized controlled trial. Lancet Psychiatry. 2015; 2(5): 395-402.
HAAS, A.L. et al. Influences of mood, depression history, and treatment modality on outcomes in smoking cessation. J Consult Clin Psychol. 2004; 72(4): 563-70.
HALL, S.M. et al. Mood management and nicotine gum in smoking treatment: a therapeutic contact and placebo-controlled study. J Consult Clin Psychol. 1996; 64(5):1003-9.
HALL, S.M. et al. Nortriptyline and cognitive-behavioral therapy in the treatment of cigarette smoking. Arch Gen Psychiatry. 1998; 55(8):683–90.
HALL, S.M. et al. Psychological intervention and antidepressant treatment in smoking cessation. PrimCare Companion J Clin Psychiatry. 2002; 4(5):206.
HALL, S.M. et al. Treatment for cigarette smoking among depressed mental health out patients: a randomized clinical trial. Am. J. Public Health. 2006; 96(10): 1808-14.
HALL, S.M.; MUÑOZ, R.F.; REUS, V.I. Cognitive-behavioral intervention increases abstinence rates for depressive-history smokers. J Consult Clin Psychol. 1994; 62(1):141-6.
HONG, L.E. et al. Effects of moderate-dose treatment with varenicline on neurobiological and cognitive biomarkers in smokers and non smokers with schizophrenia or schizoaffective disorder. Arch Gen Psychiatry. 2011; 68(12):1195–206.
HORST, D.W. et al. Extended use of nicotine replacement therapy to maintain smoking cessation in persons with schizophrenia. Neuropsychiatr Dis Treat. 2005; 1(4):349–55.
KILLEN, J.D. et al. Extended cognitive behavior therapy for cigarette smoking cessation. Addiction. 2008; 103(8): 1381-90.
KINNUNEN, T.; KORHONEN, T.; GARVEY, A.J. Role of Nicotine GUM and Pretreatment Depressive Symptoms in Smoking Cessation: Twelve-Month Results of a Randomized Placebo Controlled Trial. The International Journal of Psychiatry in Medicine. 2008;38(3):373-389. doi:10.2190/PM.38.3.k
MacPHERSON, L. et al. Randomized controlled Trial of behavioral activation smoking cessation treatment for smokers with elevated depressive symptoms. J Consult Clin Psychol. 2010; 78(1): 55-61.
McEVOY, J.P. et al. Clozapine decreases smoking in patients with chronic schizophrenia. Biol Psychiatry. 1995; 37(8):550-2. doi: 10.1016/0006-3223(94)00365-A. PMID: 7619979.
McEVOY, J.P.; FREUDENREICH, O.; WILSON, W.H. Smoking and therapeutic response to clozapine in patients with schizophrenia. Biol Psychiatry. 1999; 46(1):125-9. doi: 10.1016/s0006-3223(98)00377-1. PMID: 10394482.
MESZAROS, Z.S. et al. Oral naltrexone treatment for alcohol dependence in schizophrenia is not effective for smoking cessation. Alcohol. Clin. Exp. Res. 2010; 34: 176A.
MESZAROS, Z.S. et al. Varenicline treatment of concurrent alcohol and nicotine dependence in schizophrenia: A randomized, placebo-controlled pilot trial. J Clin Psychopharmacol. 2013; 33(2):243–7.
MOHER, D. et al. The PRISMA Group (2009) Preferred Reporting Items for Systematic Reviews and Meta-Analyses: The PRISMA Statement. PLoS Med 6(7): e1000097. Disponível emhttps://doi.org/10.1371/journal.pmed.1000097.
PEARSALL, R. et al. Pharmacological and behavioural interventions to promote smoking cessation in adults with schizophrenia and bipolar disorders: a systematic review and meta-analysis of randomized trials. BMJ Open. 2019 Nov; 9(11):e027389.
PECKHAM, E. et al. Smoking cessation in severe mental ill health: whatworks? Na updated systematic review and meta-analysis. BMC Psychiatry. 2017 Jul; 17(1):252.
POLLOCK, M. et al. Manual Cochrane para revisões sistemáticas de intervenções versão 6.1 (atualizado em setembro de 2020). Cochrane, 2020. Disponível em www.training.cochrane.org/handbook.
ROBERTS, E. et al. Efficacy and tolerability of pharmacotherapy for smoking cessation in adults with serious mental illness: a systematic review and network meta‐analysis. HHS Public Access. Addiction. 2017; 111(4):599–612.
SAULES, K.K. et al. Double-blind placebo-controlled Trial of fluoxetine in smoking cessation treatment including nicotine patch and cognitive-behavioral group therapy. Am J Addict. 2004; 13(5):438–46.
SCHLEICHER, H.E. et al. Mood Management intervention for college smokers with elevated depressive symptoms: a pilot study. J Am Coll Health. 2012; 60(1): 37-45.
SHEA, B.J. et al. AMSTAR 2: uma ferramenta de avaliação crítica para revisões sistemáticas que incluem estudos randomizados ou não randomizados de intervenções em saúde, ou ambos. BMJ Open. 2017; 358:1–9.
SHIM, J.C. et al. Adjunctive varenicline treatment with antipsychotic medications for cognitive impairments in people with schizophrenia: A randomized double-blind placebo-controlled trial. Neuropsychopharmacology. 2012; 37(3):660–8.
SMITH, R.C. et al. Effects of transcranial direct current stimulation (tDCS) on cognition, symptoms, and smoking in schizophrenia: a randomized controlled study. Schizophr. Res. 2015; 168(1-2): 260-6.
SMITH, R.C. et al. Varenicline effects on smoking, cognition, and psychiatric symptoms in schizophrenia: A double-blind randomized trial. PLoS One. 2016; 11(1):1–20.
SPRING, B. et al. Fluoxetine, smoking, and history of major depression: A randomized controlled trial. J Consult Clin Psychol. 2007; 75(1):85–94.
STEINBERG, M.L. Engaging smokers with schizophrenia in treatment for tobacco dependence: A brief motivational interviewing intervention [dissertação]. Florida: College of Arts and Sciences, University of South Florida; 2003. 104 p.
STEINBERG, M.L. et al. An adaptation of motivational interviewing increases quit attempts in smokers with serious mental illness. NicotineTob Res. 2015; 18(3):243-50.
THORSTEINSSON, H.S. et al. The effects of transdermal nicotine therapy for smoking cessation on depressive symptoms in patients with major depression. Neuropsychopharmacology. 2001; 24(4):350-8. doi: 10.1016/S0893-133X(00)00217-7. PMID: 11182530.
TIDEY, J.W. et al. Effects of contingency management and bupropion on cigarette smoking in smokers with schizophrenia. Psychopharmacology. 2011; 217(2): 279–87.
WALSH, Z. et al. The impact of depressive symptoms on the efficacy of naltrexone in smoking cessation. J Addict Dis. 2008; 27(1):65-72. doi: 10.1300/J069v27n01_07. PMID: 18551889.
WEINBERGER, A.H. et al. A Double-Blind, Placebo-Controlled, Randomized Clinical Trial of Oral Selegiline Hydrochloride for Smoking Cessation in Nicotine Dependent Cigarette Smokers. Drug Alcohol Depend. 2010; 107(2–3):188.
WEINBERGER, A.H. et al. Effects of topiramate on smoking in patients with schizoaffective disorder, bipolar type. J Clin Psychopharmacol. 2008a; 28(2): 247-8.
WEINER, E. et al. Varenicline for smoking cessation in people with schizophrenia: A double blind randomized pilot study. Schizophr Res. 2011;129(1):94–5.
WELLS, G.A. et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of non randomised studies in meta-analyses [Internet]. 2019 [citado 2020 ago 21]. Disponível em:http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp
WHO. World Health Organization. Tobacco [Internet]. Geneva: WHO, 2019 [citado em 2020 Jun 22]. Disponível em:https://www.who.int/es/news-room/fact-sheets/detail/tobacco.
WHO. World Health Organization. WHO guidelines: Management of physical health conditions in adults with severe mental disorders. WHO [Internet]. 2018; 34–7. Disponívelem:https://www.who.int/mental_health/evidence/guidelines_severe_mental_disorders_web_note_2018/en/%0Ahttp://apps.who.int/iris/bitstream/handle/10665/275718/9789241550383-eng.pdf
WILLIAMS, J.M. et al. A randomized, double-blind, placebo-controlled study evaluating the safety and efficacy of varenicline for smoking cessation in patients with schizophrenia or schizoaffective disorder. J Clin Psychiatry. 2012; 73(5):654-60;
WILLIAMS, J.M. et al. Comparison of Two Intensities of Tobacco Dependence Counseling in Schizophrenia and Schizoaffective Disorder Jill. J Subst AbusTreat. 2010; 38(4):384–93.
WING, V.C. et al. High frequency repetitive transcranial magnetic stimulation reduces tobacco craving in schizophrenia. Schizophr. Res. 2012; 139 (1-3): 264-6.
WU, B.; CHEN, H.; LEE, S. Do atypical antipsychotics really enhance smoking reduction more than typical ones?: the effects of antipsychotics on smoking reduction in patients with schizophrenia. J Clin Psychopharmacol. 2013; 33(3):319-28.
WU, B.J.; LAN, T.H. Predictors of smoking reduction outcomes in a sample of 287 patients with schizophrenia spectrum disorders. Eur Arch Psychiatry Clin Neurosci. 2017; 267(1):63–72.
WU, B.S. et al. A Preliminary Feasibility Study of Varenicline for Smoking Cessation in Bipolar Disorder. J Dual Diagn. 2012; 8(2):131–2.
WU, Q. et al. Varenicline for smoking cessation and reduction in people with severe mental illnesses: systematic review and meta-analysis. Addiction. 2016; 111(9):1554–67.
1Especialista em Medicina de Família e Comunidade. Secretaria Municipal de Saúde de Campina Grande-PB. e-mail: luizamgsl@gmail.com
2Especialista em Medicina de Família e Comunidade. Secretaria Municipal de Saúde de Campina Grande-PB. e-mail: maurocastro1996@gmail.com
3Mestre em Ciência da Saúde e Biomedicina. Universidade Federal de Campina Grande (UFCG). e-mail: tsfalmeida@gmail.com
4Doutora em Medicina e Saúde. Universidade Federal de Campina Grande (UFCG). e-mail: deborahdantas4@hotmail.com
5Graduada em Enfermagem. Secretaria Municipal de Saúde de Campina Grande-PB. e-mail: allanarenally@gmail.com
6Graduada em Medicina. Secretaria Municipal de Saúde de Campina Grande-PB. e-mail: crisinhadcc@hotmail.com
7Graduada em Medicina. Secretaria Municipal de Saúde de Campina Grande-PB. e-mail: ciinthia.cae@gmail.com
8Mestre em Ciência e Tecnologia Ambiental. Secretaria Municipal de Saúde de Campina Grande-PB. e-mail: eclesiocavalcante@gmail.com
9Mestre em Odontologia. Secretaria Municipal de Saúde de Campina Grande-PB. e-mail: monalyza.healthy@hotmail.com
10Mestre em Saúde da Família e Comunidade. Secretaria Municipal de Saúde de Campina Grande-PB. e-mail: edenilsoncavalcante@gmail.com
