ORAL AND MAXILLOFACIAL LYMPHOPROLIFERATIVE MANIFESTATIONS OF EPSTEIN-BARR VIRUS (EBV)
REGISTRO DOI: 10.69849/revistaft/ni10202409042123
Paulo Ricardo Aguiar de Arruda1
Gabriel Campos Emídio2
Professores:
Leopoldo Luiz Rocha Fujii3
Fernanda Vieira Heimlich4
Chimene Kuhn Nobre5
RESUMO
O Herpesvírus humano-4 (HHV-4) é um dos vírus que mais acomete a cavidade oral, podendo ser transmitido principalmente pela saliva. Uma das suas características mais relevantes dentro da odontologia é a ocorrência das linfoproliferativas, dentre elas podemos citar o linfoma de Burkitt, hodgkin, não Hodgkin de células NK/T, vale ressaltar que cabe aos profissionais da saúde observar e se atentar às manifestações do vírus, para prevenção de problemas futuros. No fim, o cirurgião dentista (CD) é importante tanto na identificação quanto no acompanhamento de pacientes portadores de doenças linfoproliferativas, por conta do reconhecimento da lesão e pelo tratamento oral pós-terapia antineoplásica. O presente trabalho visa mostrar a relação do Epstein-Barr com manifestações linfoproliferativas orais e maxilofaciais e expor a importância do (CD) como agente do diagnóstico precoce.
Palavras chave: Epstein-barr Vírus, Linfomas, Cavidade oral, Doenças linfoproliferativas.
ABSTRACT
Human Herpesvirus-4 (HHV-4) is one of the viruses that most affects the oral cavity and can be transmitted mainly through saliva. One of its most relevant characteristics within dentistry is the occurrence of lymphoproliferative diseases, among which we can mention Burkitt’s, Hodgkin’s and non-Hodgkin’s NK/T cell lymphoma. It is worth highlighting that it is up to health professionals to observe and pay attention to the manifestations of the virus. , to prevent future problems. Ultimately, the dental surgeon (CD) is important both in identifying and monitoring patients with lymphoproliferative diseases, due to the recognition of the lesion and oral treatment after antineoplastic therapy. The present work aims to show the relationship of Epstein-Barr with oral and maxillofacial lymphoproliferative manifestations and expose the importance of (CD) as an agent for early diagnosis.
Key words: Epstein-Barr Virus, Lymphomas, Oral Cavity, Lymphoproliferative Diseases.
INTRODUÇÃO
A flora microbiana é a segunda comunidade mais diversificada de microrganismos no corpo humano, incluindo uma variedade de fungos e bactérias. (Kilian, 2016). O mero contraste entre saúde e doença se dá pela interação complexa entre os microrganismos, resposta imunológica do hospedeiro e fatores baseados no ecossistema oral (Slots, 2010). Dentro desse microcosmo que é a cavidade oral, o centro por muita das vezes tem sido as bactérias, no entanto, os vírus compõem uma complexa flora viral, onde as principais famílias eucarióticas contribuem para as doenças bucais em indivíduos as quais incluem herpesvírus, papillomavirus, picornavírus, enterovírus, retrovírus (Slots, 2010).
Este artigo de revisão, cujo objetivo é evidenciar a força bélica do Epstein Barr Vírus (EBV) para com sua capacidade de manifestar e desenvolver doenças linfoproliferativas em cavidade oral e região maxilofacial, procura dá primazia ao Cirurgião dentista, o qual é linha de frente na identificação de lesões virais derivadas de doenças malignas linfoproliferativas.
REVISÃO DE LITERATURA
1. EPSTEIN-BARR VÍRUS (EBV)
O vírus Epstein-Barr (EBV), também conhecido como herpesvírus humano 4 (HHV-4), é um membro da família dos gamaherpesvírus (Damania et al., 2022). Já se passaram mais de 50 anos desde que o EBV, o primeiro vírus oncogênico humano, foi descoberto em 1964 associado a doenças linfoproliferativas (Damania et al., 2022; Young et al., 2016;) e também, como membro da família HHV, possui maior prevalência na cavidade oral (Tonoyan et al., 2019).
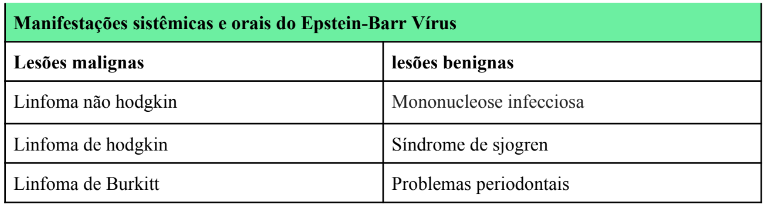
O EBV, é considerado como a infecção mais comum e persistente em humanos, sendo que cerca de 95% das populações mundiais sustentam uma infecção assintomática ao longo da vida, infectando principalmente linfócitos B, tornando-os imortalizados, e células epiteliais da orofaringe. (Abdelwahed hussey, 2018; Yin et al., 2018). Descobriu-se, também, que o EBV está associado a uma ampla gama de neoplasias, como linfoma de Burkitt (LB), linfoma de Hodgkin (LH), linfoma não-Hodgkin (LNH), distúrbios linfoproliferativos pós-transplante (DLPT), linfoma difuso de grandes células B (LCBLD), linfoma de células NK / T (LCNKT) (Yin et al., 2018). Além da sua associação com diferentes formas de cancro humano, o EBV também está associado às doenças não malignas, incluindo mononucleose infecciosa, leucoplasia pilosa oral, lúpus eritematoso sistêmico e esclerose múltipla. (Damania et al., 2022)
A transmissão do (HHV-4) ocorre principalmente através da saliva. No entanto, o leite materno, os fluidos corporais e o transplante de órgãos também podem espalhar o vírus de um hospedeiro para outro. (Damania et al., 2022) O que fica bastante claro é que a cavidade oral, como instrumento primário de contaminação, coloca a lume o relacionamento viral sistêmico com a cabeça e o pescoço. É lidando com esses fatos que a infecção primária por (EBV) ocorre durante a infância, a chamada mononucleose infecciosa (Vedham et al., 2015). Também ocorrendo em adultos jovens, conhecida como “Doença do beijo”, sendo a infecção aguda sintomática que acomete até 80% dos primeiros contatos de indivíduos ingênuos ao vírus. (Tonoyan et al., 2019). Após isso, a latência lítica, período de replicação do antígeno, ocorre por toda a vida do hospedeiro, apresentando variáveis de ciclos líticos, infectando células B e residindo em células linfócitas de memória (Damania et al., 2022). Além da infecção por perdigotas, ainda em cavidade oral, o vírus pode infectar diretamente células B após a transcitose epitelial (Neville, 2016).
Demais, essa disposição epitelial do vírus pode ser associada com lesões: carcinoma nasofaríngeo e carcinoma gastrointestinal (Yin et al., 2018) Analisar um pouco melhor as reproduções líticas do vírus é de suma importância para o controle do mesmo quando o assunto é inibir clinicamente a replicação viral com uso de medicamentos (Pagano et al., 2018).
2. PROPULSOR ONCOGÊNICO
O câncer possui como marca registrada a proliferação celular descontrolada, dessa forma, seguranças fisiológicos existem durante o processo de replicação celular, sendo tarefa fundamental deste ciclo garantir que o DNA seja fielmente replicado durante a fase S e que essas cópias cromossômicas sejam distribuídas para as duas novas células durante a fase M. As disfunções nesse ciclo celular dão acesso às células para obter características de crescimento descontrolado, principalmente hiperproliferação, baixa taxa de apoptose (Hanahan et al., 2011).
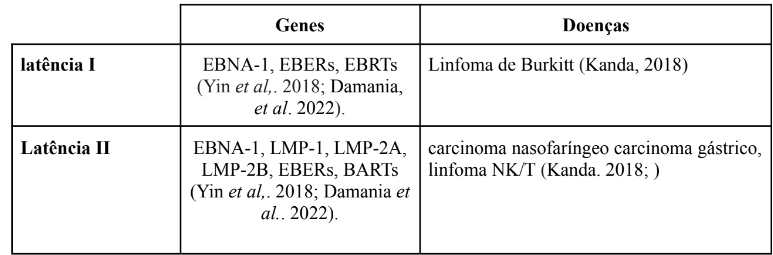
O EBV, como fora dito anteriormente, associa-se com uma gama de neoplasias humanas, principalmente aquelas relacionadas aos linfócitos B (Yin et al., 2018) e então, o período de latência do Vírus, i.e, a presente produção de genes virais, ao longo prazo nos linfócitos, possibilita a multiplicação do material genético, o que, dependendo da latência viral, originam-se tumores conforme o estágio em que se encontram. A latência 0, por exemplo, exibe a expressão de EBERs e BARTs e geralmente ocorre em células B de memória quiescentes (Damania et al., 2022). Latência I, que etiologicamente produz o linfoma de burkitt, como também a latência II, onde manifestam os linfomas de células carcinoma nasofaríngeo (CNF), linfoma de hodgkin (HL), EBV-câncer gastrointestinal (EBV-GC), (NK/T). Latência III, produzindo Linfoma não hodgkin relacionados a AIDS, LB parcial, distúrbios linfoproliferativos pós-transplante (PTLD) e linfoma difuso de grandes células B (DLBCL) (Yin et al., 2018).
Os antígenos do EBV gerados dentro desses “steps” de latência são; EBNAs 1, 2, 3A, 3B, 3C e EBNA-LP, além de serem geradas proteínas virais, como; LMPs 1, 2A e 2B. Também, RNAs EBER não codificantes e microRNAs. (Kanda, 2018). A importância de lidar com a análise microbiológica viral é compreender que antígenos como EBNA3A e EBNA3C neutralizam proteínas de supressão tumoral, como a p16 (Maruo et al., 2011), o que impossibilita a proliferação contínua da proteína supressora. Esses mesmos antígenos suprimem epigeneticamente proteínas supressoras de tumor pró apoptótico Bim, proteína essa crítica no curso da linfogênese. (Kanda, 2018).

São esses genes, como o EBNA1, que são necessários para a manutenção viral durante a latência, eles que permitem a replicação do EBV, através do maquinário do hospedeiro, na fase S do ciclo de replicação celular. (Damania et al., 2022) Alguns mecanismos biológicos, já analisados em testes clínicos, inibem a proliferação de EBNA1 e a latência do vírus, prevenindo a proliferação tumoral. (Messick et al., 2019). Uma das proteínas de membrana latente listadas anteriormente, a exemplo da LMP1 que foi a primeira oncoproteína viral identificada em linhas celulares cultivadas, foi detectada em muitos cancros associados ao EBV, demonstradas anteriormente por possuírem alta interação com receptores tumorais (Messick et al., 2019).
3. MANIFESTAÇÕES NA CAVIDADE ORAL DE DOENÇAS LINFOPROLIFERATIVAS
A cavidade oral e o sistema estomatognático atuam como interfaces e displays essenciais para a saúde sistêmica. É por meio desses dispositivos biológicos que podemos identificar o estado atual e antecipar possíveis cenários futuros, permitindo a detecção precoce e a prevenção de doenças. Nesse contexto, cabe ao cirurgião-dentista a responsabilidade primordial de monitorar e intervir diante de manifestações primárias de qualquer patologia oral, inclusive neoplasias, desempenhando um papel crucial na promoção da saúde integral do paciente. Embora tenha sido citado muitas lesões associadas ao EBV, As doenças linfoproliferativas desenvolvem-se em pessoas com imunodeficiências congênitas ou adquiridas, incluindo doença linfoproliferativa iatrogênica ou pós-transplante (PTLD), doenças relacionadas à imunodeficiência. (Toner et al., 2022) Ou seja, associados ao manejo desses pacientes imunocompetentes, o CD poderá analisar o de forma precoce o “display” e definir melhor prognóstico.
3.1 LINFOMA DE NÃO HODGKIN
O Linfoma não Hodgkin (LNH) é o tipo de Linfoma com maior frequência, abrangendo 85% dos casos de linfomas. (Gante et al., 2022) A classificação do LNH é complexa e está em constante evolução, com mais de 50 subtipos diferentes listados na última classificação da Organização Mundial da Saúde (Barone et al., 2022). As diversas classificações incluem linfoma de células B maduras de alto grau linfoma de Burkitt (BL), linfoma difuso de grandes células B (DLBCL) e linfoma primário de células B grandes do mediastino (PMLBCL), linfoma anaplásico de grandes células (ALCL) e linfoma linfoblástico (LL). (Sandlund, 2015), sendo, dentre os citados, o DLBCL o mais comum, acometendo cerca de 66% de todos os linfomas na idade média de 66 anos. Sendo que seu acometimento em boca inclui um crescimento nodular acelerado, com características intactas ou ulceradas (Abdelwahed Hussein, 2018).
Figura 1: Linfoma de não hodgkin intraósseo
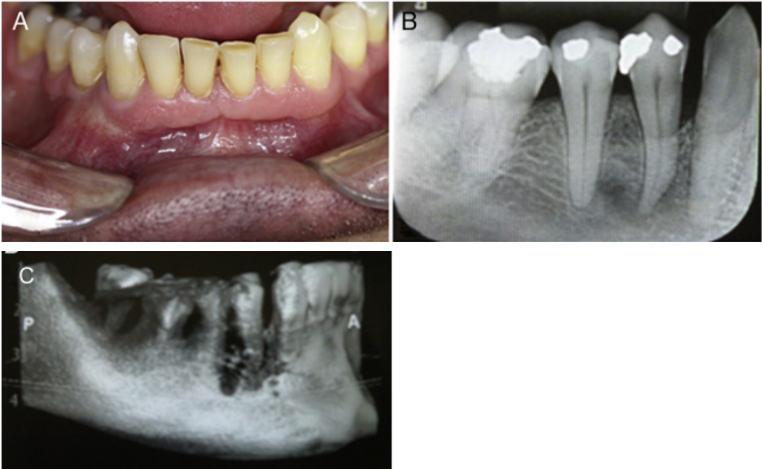
As áreas de maior acometimento são o anel tonsilar de Waldeyer, as glândulas salivares maiores e os seios paranasais. Intraoralmente pode acometer os ossos da mandíbula (Figura 1) e várias áreas da mucosa oral; palato, gengiva, língua, bochecha, assoalho da boca e lábios. As manifestações podem aparecer como abscesso dentário, tumor epitelial, osteonecrose dos maxilares relacionados à medicina (Barone et al., 2022). As interações entre o vírus Epstein-Barr (EBV) e o vírus HIV foram identificadas na patogênese do LB o qual é um tipo de LNH (Khan et al., 2017; Al-Naaeb, 2018) mostrando a correlação entre as duas casuísticas. Os envolvimentos consuetudinários ilustram exaustivamente o papel do cirurgião oral no diagnóstico precoce deste tumor maligno. A biópsia e o encaminhamento rápido do paciente ao departamento de onco hematologia são essenciais para evitar atraso no manejo desta doença desafiadora, que deve ser multidisciplinar. (Gante et al., 2022).
3.2 LINFOMA DE BURKITT
O linfoma de Burkitt (LB) é um linfoma não-Hodgkin agressivo (LNH) de células B com a maior taxa de proliferação celular que qualquer malignidade conhecida, excluindo pacientes com imunodeficiência, BL compreende cerca de 30% a 50% dos casos de LNH (Casulo et al., 2018) e possui prevalência maior em crianças em relação a adultos como outras demais malignidades linfóides, como; leucemia linfoblástica aguda de células precursoras B (LACP) e linfoma anaplásico de grandes células (LAGC), algumas características epidemiológicas; o EBV é um fator oncogênico de LB endêmica que está associado à infecção na primeira infância, particularmente em áreas do mundo onde a malária é endêmica, tornando esta forma de LB a doença pediátrica mais comum. (Casulo et al., 2018).
Foi em 1961, que Denis Burkitt conheceu Epstein, um patologista experimental, e compartilhou com ele amostras dos linfomas (LF). Dentro desses LF, Epstein e colegas identificaram o vírus que passou a ser conhecido como EBV (Epstein-Barr vírus) (Burkitt, 1983). Na classificação da organização mundial da saúde (OMS), são descritas três variantes clínicas do linfoma de Burkitt: tipos endêmicos, esporádicos e associados à imunodeficiência. Os linfomas endêmicos são recorrentes em crianças africanas e quase sempre estão associados ao EBV. (Quimby et al, 2017).
No tocante a pacientes imunocomprometidos, cerca de 25%–40% dos linfomas não-Hodgkin (LNH) estão associados ao HIV antes da era da terapia antirretroviral altamente ativa (Khan et al., 2017).
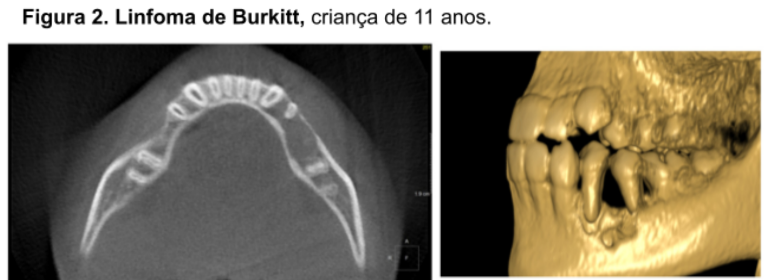
Cerca de 50% a 70% dos casos de linfoma de Burkitt estão nos ossos gnáticos, embora o tipo “esporádico” afete primariamente a região abdominal. Lesão em ossos gnáticos têm sido relatadas. Geralmente há um crescimento neoplásico que pode produzir aumento de volume facial concomitante à reabsorção óssea (Fig. 2), proptose, por vezes pode causar minimamente dor e sensibilidade. As características radiográficas consistem em um processo maligno e incluem destruição radiolúcida do osso, com margens irregulares e mal definidas. (Neville, 2016)
3.3 – LINFOMA DE CÉLULAS NK/T EXTRANODAL
O LFC NKT é a forma patológica mais frequente e foi designado linfoma do tipo nasal, no entanto, a comunicação buco sinusal é possível, logo, a cavidade oral e a região maxilofacial tornam-se presente como acometimento secundário da doença, e sim, meio para o CD. Isso é tão evidente que o LFC NKT é considerado, depois do carcinoma espinocelular e do adenocarcinoma, o terceiro cancro nasossinusal mais comum, representando de 12% a 15% das neoplasias malignas de cabeça e pescoço (El-Naggar, 2017). Os aparecimentos são: secreção e epistaxe, além de apresentar alguns outros sinais com sua evolução, como inchaço facial e distúrbio visual. Frequentemente, essas lesões envolvem a cavidade oral, como boca, mucosa jugal, lábio superior, palato e faringe. As manifestações orais incluem ulcerações palatinas, úlceras gengivais maxilares (Sánchez-romero et al, 2021). Além disso, outras manifestações como: doença periodontal ou mesmo a granulomatose de wegener. (Park et al., 2016)
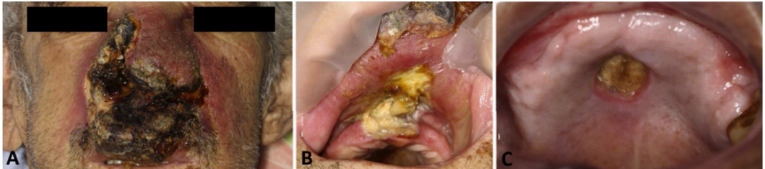
Figura 3. Apresentação clínica do ENKTCL-NT. A, B: Homem, 60 anos, apresentando extensa lesão necrótica na linha média, circundada por edema e eritema, causando destruição severa do terço médio da face (A) e de estruturas orais, como rebordo alveolar, mucosa vestibular e labial (B). C: Paciente do sexo masculino, 54 anos, com úlceras necróticas em palato e rebordo alveolar póstero-superior, como único sinal da doença. (Sánchez-romero et al., 2021).
Na latência II a III de replicação genética do EBV, onde genes específicos são produzidos que afetam, diferentemente das outras doenças linfoproliferativas outrora citadas, células do tipo T e “NK cells” sendo responsável pelo surgimento de desordens linfoproliferativas das células envolvidas predominante na ásia e américa latina (Hue et al. 2020).
3.4 LINFOMA DE HODGKIN
O linfoma de hodgkin (LH), tendo apenas 9.000 casos anualmente relatados, é considerado raro. (Ansell, 2015), apresenta variados subtipos, assim como o LNH, entre eles, pode-se citar; Linfoma de Hodgkin clássico da esclerose nodular (LHCEN), linfoma de Hodgkin com predominância de linfócitos nodulares (LHPFN), linfomas que possuem celularidade mista (LHMC) e deplatada de linfócitos (LHDL) (Wang et al, 2018).
Utilizando o (LHCEN) como referência, temos que ele representa 85% de todos os LH, tendo prevalência de incidência entre a 1º e a 3º décadas de vida, afetando principalmente mulheres. Muito frequentemente, as diversas formas de (LH) relacionam-se com o (HHV-4), em especial as formas (LHMC) e (LHDL), os quais são positivos para o vírus cerca de 70% a 80% dos exames histoquímicos. (Wang, 2018). Nos casos gerais, cerca de 30 a 40% dos (LH) podem estar relacionados causalmente com o Epstein-Barr Vírus. (Brice et al., 2021)
O envolvimento extranodal da doença apresenta-se mais comumente em região pulmonar, óssea e de tecidos moles, sendo a manifestação nodular de aproximadamente 10 cm mais comum em estágios avançados da doença. acometimentos de linfadenopatia supradiafragmática é comum, linfonodos cervicais, mediastinais anteriores, supraclaviculares e axilares, enquanto as áreas inguinais são menos frequentemente envolvidas (Brice et al., 2021).
METODOLOGIA
A identificação para os artigos para esta revisão foi feita pela inserção de termos de forma individual ou combinados na plataforma PubMed, como: “Epstein-barr Vírus”, “Burkitt’s lymphoma”, “NK/T cell lymphoma”, “non-Hodgkin lymphoma”, “hodgkin’s lymphoma”, “oral disease, EBV”. Alguns critérios para inclusão foram; (I) Artigos de referência internacional, (II) ser publicado com no mínimo 10 anos para artigos referentes a lesões orais e 14 anos de publicação de artigos com especificações gerais a respeito da microbiota e de processos de replicação celular, salvo aqueles que possuem caráter histórico (III) O estudo deve apresentar relação entre as doenças linfoproliferativas e os mecanismos oncogênicos do EBV. (IV) Relato de casos que procuram expor a manifestação primária em cavidade oral e região maxilofacial. Esses requisitos eliminaram vários estudos focados apenas em expor lesões sem qualquer relação com a cavidade oral e a região maxilofacial, expondo a característica oncológica sem apresentar o papel do CD na identificação dessas lesões. No entanto, este requisito foi fundamental para garantir que os dados resumidos fossem relevantes para o objetivo geral de fornecer dados para informar a triagem e a detecção.
Termos utilizados Todos Selecionados Citados Epstein-Barr Vírus 13.668 20 11 Burkitt’s lymphoma 3.113 10 05 NK/T cell lymphoma 2.088 10 04 Non-Hodgkin lymphoma 39.008 15 06 hodgkin’s lymphoma 21,245 10 03 Oral disease, EBV 508 20 05 total 79.550 85 40
DISCUSSÃO
Em todo o mundo, o linfoma é a terceira doença maligna mais comum, representando 3% de todos os tumores malignos. Na região de cabeça e pescoço, os linfomas são responsáveis por 12% de todos os tumores malignos, tornando-se a terceira malignidade mais frequente, seguindo o carcinoma espinocelular (46%) e o carcinoma da tireoide (33%) (Storck, 2019). É a proliferação neoplásica maligna do sistema imunológico que representa a segunda malignidade primária mais comum na cabeça e no pescoço (Barone et al., 2022).
Guevara-Canales, junto a colaboradores, em 2011, revisaram 215 artigos, contando 714 pacientes e, em outra oportunidade, investigaram 151 pacientes e os sítios mais acometidos foram os anéis de waldeyer’s e a gengiva. Região analisada por CDs e áreas de trabalho de diversos periodontistas.
Segundo E Zapater, conforme seu estudo a linfomas malignos de cabeça e pescoço feito em 2010, em praticamente todos os casos de linfoma de células NK/T, as células neoplásicas continham o vírus Epstein-Barr. Pois é dentro dessa correlação que Denis Bukit, um cirurgião, trabalhava na África Central, em Kampala, notou crianças com faces grosseiramente distorcidas, com lesões que envolviam um ou ambos os lados da face e os maxilares superiores e inferiores, acompanhada por vezes de proptose e outras distorções. Mais tarde, Burkitt ao juntar-se com Epstein, um patologista experimental, compartilharam amostras de linfomas que possuíam amostras virais, os quais passaram a ser conhecidos como Epstein-Barr vírus. (Ferry, 2006). O fato existente de correlação viral neoplásica é clara, apoiado em contexto histórico-científico, o qual nos abre o entendimento para compreendermos o papel do CD no diagnóstico precoce de doenças linfoproliferativas sistêmicas decorrente de um agente viral presente em cerca de 90% da população mundial (Yin et al., 2018).
O diagnóstico do linfoma depende do exame anatomopatológico. Lesões extranodais requerem biópsia profunda, similar a tumores de carcinoma espinocelular, muitas vezes com anestesia local, exceto em áreas específicas como seios paranasais. Aspiração com agulha fina é útil, mas pode gerar resultados falsos. O citodiagnóstico de LH é mais simples que o de LNH. O papel inicial de diagnóstico é de otorrinolaringologistas e cirurgiões bucomaxilofaciais, enquanto o tratamento é conduzido por hematologistas, estomatologistas e oncologistas. É vital suspeitar da doença e obter biópsia rapidamente, com amostra clínica adequada.
CONCLUSÃO
O vírus Epstein-Barr (EBV) torna-se claramente manifesto nas manifestações observadas na cavidade oral e região maxilofacial, não apenas como infecção, mas malignização linfoproliferativa. Salienta-se, portanto, a imprescindível atuação do cirurgião dentista na identificação precoce no tocante a essas lesões, uma vez que são podem ser sinais de imunocomprometimento. A colaboração interdisciplinar entre profissionais de saúde oral, hematologistas e oncologistas emerge como um pilar fundamental para assegurar um manejo integral e eficaz dessas manifestações. O aprofundamento do entendimento acerca dessa interação entre o vírus e o hospedeiro pode conduzir a estratégias mais assertivas de prevenção e tratamento, culminando em melhores desfechos clínicos e qualidade de vida para os indivíduos afetados.
REFERÊNCIAS
ANSELL, S. M., Hodgkin Lymphoma: Diagnosis and Treatment. Mayo Clinic Proceedings, v. 90, n. 11, p. 1574–1583, 2015. Disponível em: <https://www.mayoclinicproceedings.org/article/S0025-6196(15)00550-9/fulltext>.
AL-NAEEB, Anna Bowzyk; AJITHKUMAR, Thankamma; BEHAN, Sarah; et al. Non-Hodgkin lymphoma. BMJ, v. 362, 2018. Disponível em: <https://www.bmj.com/content/362/bmj.k3204>.
ABDELWAHED HUSSEIN, M. R. Non-Hodgkin’s lymphoma of the oral cavity and maxillofacial region: a pathologist viewpoint. Expert Review of Hematology, v. 11, n. 9, p. 737–748, 2018. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/30058399/>.
BARONE,S.; BUFFONE, C.; FERRILLO, M.; et al. Oral Malignant Non-Hodgkin Lymphoma: A Retrospective Single-Center Study. International Journal of Environmental Research and Public Health, v. 19, n. 5, p. 2605, 2022. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/35270301/>.
BURKITT, D. P.; Charles S. Mott Award. The discovery of Burkitt’s lymphoma. Cancer, v. 51, n. 10, p. 1777–1786, 1983. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/6299496/>.
BRICE, P.; DE KERVILER, E. ; FRIEDBERG, J. W. Classical Hodgkin lymphoma. The Lancet, v. 398, n. 10310, p. 1518–1527, 2021. Disponível em: <https://www.thelancet.com/article/S0140-6736(20)32207-8/abstract>.
CASULO, C.; FRIEDBERG, J. W. Burkitt lymphoma- a rare but challenging lymphoma. Best Practice & Research Clinical Haematology, v. 31, n. 3, p. 279–284, 2018. Disponível em: <https://www.sciencedirect.com/science/article/abs/pii/S1521692618300525?via%3Dihub>.
DAMANIA, B.; KENNEY, S. C. ; RAAB-TRAUB, N. Epstein-Barr virus: Biology and clinical disease. Cell, v. 185, n. 20, p. 3652–3670, 2022. Disponível em: <https://www.cell.com/cell/fulltext/S0092-8674(22)01121-7?_returnURL=https%3A%2F%2Flinking hub.elsevier.com%2Fretrieve%2Fpii%2FS0092867422011217%3Fshowall%3Dtrue>.
EL-NAGGAR, A. K; CHAN, J. K C; GRANDIS, J. R; et al. WHO classification of head and neck tumours. Lyon: International Agency For Research On Cancer (Iarc, 2017.)
FERRY, J. A. Burkitt’s Lymphoma: Clinicopathologic Features and Differential Diagnosis. The Oncologist, v. 11, n. 4, p. 375–383, 2006. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/16614233/>.
GANTE, J.; GEORG, S.; ROBEZ, J. G.; et al. Primary extra-nodal non-Hodgkin’s lymphoma affecting mandibular bone: a case report. The Pan African medical journal, v. 41, 2022. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9167483/>.
GUEVARA-CANALES, J. O.; MORALES-VADILLO, .; DE FARIA, P. E. A.; et al. Systematic review of lymphoma in oral cavity and maxillofacial region. Acta odontologica latinoamericana: AOL, v. 24, n. 3, p. 245–250, 2011. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/22550817/>.
HANAHAN, D.; WEINBERG, R. A. Hallmarks of cancer: the next Generation. Cell, v. 144, n. 5, p. 646–674, 2011. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/21376230/>.
HART, S.; HORSMAN, J.M.; RADSTONE, C.R.; et al. Localised Extranodal Lymphoma of the Head and Neck: The Sheffield Lymphoma Group Experience (1971–2000). Clinical Oncology, v. 16, n. 3, p. 186–192, 2004. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/15191005/>.
HUE, S. S.; OON, M. L.; WANG, S.; et al. Epstein–Barr virus-associated T- and NK-cell lymphoproliferative diseases: an update and diagnostic approach. Pathology, v. 52, n. 1, p. 111–127, 2020. Disponível em: <https://www.sciencedirect.com/science/article/abs/pii/S0031302519304210>.
IVONE CUADRA-GARCIA, G. M.; PROULX, C. L.; CHIN LEE WU, C. C.; et al. Sinonasal Lymphoma. The American Journal of Surgical Pathology, v. 23, n. 11, p. 1356–1356, 1999. Disponível em: <https://oa.mg/work/10.1097/00000478-199911000-00006>.
KHAN, Alina; BRAHIM, Amanda; RUIZ, Marco; et al. Relapsed/refractory Burkitt lymphoma and HIV infection. International Journal of Std & Aids, v. 29, n. 7, p. 695–703, 2017. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/29264956/>.
KILIAN, M.; CHAPPLE, I. L. C.; HANNIG, M.; et al. The oral microbiome – an update for oral healthcare professionals. British Dental Journal, v. 221, n. 10, p. 657–666, 2016. Disponível em: <https://www.nature.com/articles/sj.bdj.2016.865>.
KULCZYK, T.; DAKTERA-MICKER, A.; BIEDZIAK, B.; et al. The Primary Outbreaks of Burkitt Lymphoma in the Oral Cavity. A Report of Two Cases, Review of the Literature and Dental Implications. Diagnostics, v. 11, n. 12, p. 2358–2358, 2021. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8700466/>.
LYONS, S. F. ; LIEBOWITZ, D. N. The roles of human viruses in the pathogenesis of lymphoma. Seminars in Oncology, v. 25, n. 4, p. 461–475, 1998. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/9728596/>.
TONOYAN, L.; VINCENT-BUGNAS, S.; OLIVIERI, Charles-Vivien; et al. New Viral Facets in Oral Diseases: The EBV Paradox. International Journal of Molecular Sciences, v. 20, n. 23, p. 5861, 2019. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6929135/>.
KANDA, T. EBV-Encoded Latent Genes. Advances in Experimental Medicine and Biology, v. 1045, p. 377–394, 2018. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/29896676/>.
KILIAN, M.; CHAPPLE, I. L. C.; HANNIG, M.; et al. The oral microbiome – an update for oral healthcare professionals. British Dental Journal, v. 221, n. 10, p. 657–666, 2016. Disponível em: <https://www.nature.com/articles/sj.bdj.2016.865>.
MARUO, S.; ZHAO, B.; JOHANNSEN, E.; et al. Epstein-Barr virus nuclear antigens 3C and 3A maintain lymphoblastoid cell growth by repressing p16 INK4A and p14 ARF expression. Proceedings of the National Academy of Sciences, v. 108, n. 5, p. 1919–1924, 2011. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3033265/>.
MESSICK, T. E.; SMITH, G. R.; SOLDAN, S. S.; et al. Structure-based design of small-molecule inhibitors of EBNA1 DNA binding blocks Epstein-Barr virus latent infection and tumor growth. Science Translational Medicine, v. 11, n. 482, 2019. Disponível em: <https://stm.sciencemag.org/content/11/482/eaau5612.full>.
NEVILLE, Brad W ; AL, Et. Oral and maxillofacial pathology. St. Louis: Elsevier, Cop, 2016.
PAGANO, J.; WHITEHURST, C. ; ANDREI, G. Antiviral Drugs for EBV. Cancers, v. 10, n. 6, p. 197, 2018. Disponível em:<https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6025560/>
PARK, K. G.; DHONG, E. S.; NAMGOONG, S.; et al. Recurrent Extranodal NK/T-Cell Lymphoma
Presenting as a Perforating Palatal Ulcer and Oro-Nasal Fistula. Archives of Craniofacial Surgery, v. 17, n. 3, p. 165–168, 2016. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5556807/#:~:text=Presenting%20symptoms%20 of%20ENKTL%20are,misdiagnosed%20as%20sinusitis%20%5B6%5D.>.
PEREIRA, D. L.; FERNANDES, D. T.; SANTOS-SILVA, A. R.; et al. Intraosseous Non-Hodgkin Lymphoma Mimicking a Periapical Lesion. Journal of Endodontics, v. 41, n. 10, p. 1738–1742, 2015. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/26234541/>. Acesso em: 25 mar. 2022.
QUIMBY, A. E; CAULLEY, L.; RODIN, D.; et al. Primary Burkitt lymphoma of the supraglottic larynx: a case report and review of the literature. Journal of Medical Case Reports, v. 11, n. 1, 2017. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5345263/>.
SLOTS, J.. Human viruses in periodontitis. Periodontology 2000, v. 53, n. 1, p. 89–110, 2010. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/20403107/>.
SÁNCHEZ-ROMERO, C.; BOLOGNA-MOLINA, R.; PAES DE ALMEIDA, O.; et al. Extranodal NK/T cell lymphoma, nasal type: An updated overview. Critical Reviews in Oncology/Hematology, v. 159, p. 103237, 2021. Disponível em: <https://www.sciencedirect.com/science/article/pii/S1040842821000251?casa_token=m8slHWz3 6rwAAAAA:bTnOg257Yx3ZwbNy66mShyh-e1GH1UldE-mvqYbK0lmrK7enk19piTrO6UxROJuvWuJEj MVh_UQ>.
SANDLUND, J. T. Non-Hodgkin Lymphoma in Children. Current Hematologic Malignancy Reports, v. 10, n. 3, p. 237–243, 2015. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/26174528/>.
ETEMAD-MOGHADAM, S.; TIRGARY, F.; KESHAVARZ, S.; et al. Head and neck non-Hodgkin’s lymphoma: a 20-year demographic study of 381 cases. International journal of oral and maxillofacial surgery/International journal of oral & maxillofacial surgery, v. 39, n. 9, p. 869–872, 2010. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/20538427/>.
STORCK, K.; BRANDSTETTER, M.; KELLER, U.; et al. Clinical presentation and characteristics of lymphoma in the head and neck region. Head & Face Medicine, v. 15, n. 1, 2019. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/30606206/>.
TONOYAN, L.; VINCENT-BUGNAS, S.; OLIVIERI, C.; et al. New Viral Facets in Oral Diseases: The EBV Paradox. International Journal of Molecular Sciences, v. 20, n. 23, p. 5861, 2019. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/31766729/>.
TONER, K. ; BOLLARD, C. M. EBV+ lymphoproliferative diseases: opportunities for leveraging EBV as a therapeutic target. Blood, v. 139, n. 7, p. 983–994, 2022. Disponível em: </>.
VEDHAM, V.; VERMA, M. ; MAHABIR, S. Early-life exposures to infectious agents and later cancer development. Cancer Medicine, v. 4, n. 12, p. 1908–1922, 2015. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/26377256/>.
WANG, H.; BALAKRISHNA, Jayalakshmi P.; PITTALUGA, Stefania; et al. Diagnosis of Hodgkin lymphoma in the modern era. British Journal of Haematology, v. 184, n. 1, p. 45–59, 2018. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6310079/>.
YIN, H.; QU, J.; PENG, Q.; et al. Molecular mechanisms of EBV-driven cell cycle progression and oncogenesis. Medical Microbiology and Immunology, v. 208, n. 5, p. 573–583, 2018. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/30386928/>.
YOUNG, L. S.; YAP, L. F. ; MURRAY, P. G. Epstein–Barr virus: more than 50 years old and still providing surprises. Nature Reviews Cancer, v. 16, n. 12, p. 789–802, 2016. Disponível em: <https://www.nature.com/articles/nrc.2016.92>.
ZAPATER, E; BAGÁN, JV; CARBONELL, F; et al. Malignant lymphoma of the head and neck. Oral Diseases, v. 16, n. 2, p. 119–128, 2010. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/20374502/>.
1Acadêmico do curso de Graduação em Odontologia pela Faculdade De Educação de Porto Velho – FIMCA
E-mail; pauloricardoaguiardearruda@gmail.com
http://lattes.cnpq.br/5577407735036052
2Acadêmico do curso de Graduação em Odontologia pela Faculdade De Educação de Porto Velho – FIMCA
E-mail; gabrielcamposemidio@gmail.com
http://lattes.cnpq.br/5577407735036052
3Especialista em Estomatologia e Mestre em Patologia Bucal e Estomatologia, Coordenador da Clínica Escola de Odontologia do Centro Universitário Aparício Carvalho – FIMCA
e-mail: fujii.llr@uol.com.br
http://lattes.cnpq.br/2871647880940855
4Mestre em Estomatologia, Especialista em Oncologia, Professora da Clínica Escola de Odontologia do Centro Universitário Aparício Carvalho – FIMCA
email: fernanda.vieira@fimca.com.br
http://lattes.cnpq.br/2798238940276700
5Mestre em Patrimônio Cultural, professora do Centro Universitário Aparício Carvalho – FIMCA
e-mail: chimenekn@gmail.com
