REGISTRO DOI:10.69849/revistaft/th10248301426
Patrick Alayn Miranda Cardoso1
Tárcio Peixoto Roca2
RESUMO
A doença de Chagas, uma enfermidade endêmica que representa um significativo problema de saúde pública na região Norte do Brasil, é o foco deste estudo. A pesquisa justifica-se pela necessidade urgente de dados atualizados e detalhados que orientem ações e políticas mais eficientes para o controle da doença, que continua a ameaçar a saúde das populações locais. Este trabalho analisa o perfil clínico e epidemiológico da doença de Chagas, enfocando prevalência, incidência e características demográficas dos pacientes afetados. Com base em dados epidemiológicos e registros médicos disponíveis, identificamos padrões de sintomas, métodos diagnósticos e tratamentos predominantes, além de comorbidades associadas e fatores de risco relevantes. A pesquisa também destaca as diferenças de saúde entre áreas urbanas e rurais, assim como as implicações para políticas de saúde pública direcionadas à prevenção, diagnóstico e tratamento da doença de Chagas na região Norte. Os resultados desta pesquisa contribuem para uma melhor compreensão do impacto da doença de Chagas e a formulação de estratégias eficazes de saúde pública na região.
Palavras-chave: perfil clínico, doença de Chagas, região Norte, saúde pública
ABSTRACT
Chagas disease, an endemic illness that represents a significant public health problem in the Northern region of Brazil, is the focus of this study. The research is justified by the urgent need for updated and detailed data to guide more efficient actions and policies for controlling the disease, which continues to threaten the health of local populations. This work analyzes the clinical profile of Chagas disease, focusing on prevalence, incidence, and the demographic and clinical characteristics of affected patients. Based on available epidemiological data and medical records, we identified patterns of symptoms, predominant diagnostic methods and treatments, as well as associated comorbidities and relevant risk factors. The research also highlights health disparities between urban and rural areas, as well as the implications for public health policies aimed at preventing, diagnosing, and treating Chagas disease in the Northern region. The results of this research contribute to a better understanding of the impact of Chagas disease and the formulation of effective public health strategies in the region.
Keywords: clinical profile, Chagas disease, Northern region, public health.
INTRODUÇÃO
A doença de Chagas (DC), também conhecida como tripanossomíase americana, foi descoberta em 1909 pelo pesquisador Carlos Chagas. Causada pelo protozoário Trypanosoma cruzi (NUNES et al.; 2013), é considerada uma das principais doenças tropicais negligenciadas no mundo, sendo endêmica na região norte do Brasil e em outras áreas do continente americano, de acordo com a Organização Mundial da Saúde (OMS).
A transmissão ocorre principalmente pela picada de triatomíneos, insetos da família Reduviidae, que deixam fezes contendo a forma infecciosa do parasita (tripomastigota metacíclica) após se alimentarem de sangue humano (MORAES, 2021). Além disso, a contaminação pode ocorrer pela ingestão de alimentos ou água contaminada com insetos ou fezes infectadas. O consumo de açaí também está associado à ocorrência da doença. (GERES LF, et al., 2022; MENDONÇA, RM et al., 2020; RODRIGUES ADDPS, et al., 2021).
A DC é dividida em duas etapas: a fase aguda e a crônica ( a fase crônica se desenvolve de forma lenta e com baixa parasitemia) e a aguda (que se desenvolve de forma rápida, com alta parasitemia e, geralmente, com autolimitação). A patologia é caracterizada, sobretudo, pela dilatação cardíaca e pelo derrame pericárdico. A miocardite é de natureza intensa e difusa, com necrose miocitolítica, edema, vasculite e infiltrado inflamatório, de natureza mononuclear e polinuclear. A maioria dos casos agudos é indeterminada. É estimado que os pacientes com a forma descrita sejam a maioria dos infectados em áreas endêmicas, com um percentual de aproximadamente 40% de casos dessa natureza. O estágio é caracterizado pela presença de uma infecção, confirmada por testes parasitológicos e sorológicos, sem manifestações clínicas, radiológicos (coração, esôfago e cólon) e eletrocardiográficas (OLIVEIRA SF, et al., 2021; RODRIGUES ADDPS, et al., 2021; CUNHA LNA, et al., 2021; BRASIL, 2023).
A evolução para as formas de patologia mais sugestivas, em geral, ocorrerá entre 10-20 anos após a primeira fase aguda. Tendo em vista a gravidade das manifestações que pode causar, o envolvimento cardíaco é, sem dúvida, o mais relevante sob a ótica médica e social (LIMA; TEXEIRA; LIMA, 2019). A apresentação clínica da forma cardíaca crônica pode variar significativamente, de acordo com o grau de acometimento da estrutura e função cardíacas, dentre outros fatores. Os principais achados nos corações de chagásicos referem-se à miocardite fibrosante progressiva e crônica. A perda de células cardiovasculares e a sua substituição por tecido fibroso parecem desorganizar a estrutura e a função do miocárdio, o que resulta em um mau funcionamento eletrofisiológico e, consequentemente, em uma maior incidência de insuficiência cardíaca (IC), bloqueios intra e extraventriculares, além de taquiarritmias ventriculares, o que tem um impacto prognóstico na DC. Os principais sintomas são a febre, a dor nos gânglios, a vermelhidão, o inchaço nos olhos (sinal de Romanã) e o aumento do fígado e baço, que são os principais sintomas. A febre, com frequência, desaparece após alguns dias e a pessoa não se dá conta do que aconteceu, apesar de o parasita já estar presente em alguns órgãos (LIMA; TEXEIRA; LIMA, 2019).
Dessa forma, o diagnóstico precoce da Doença de Chagas (DC) é crucial para garantir o tratamento adequado e evitar complicações a longo prazo. Durante a fase inicial da doença, que em muitos casos é assintomática ou apresenta apenas sinais leves, apenas uma pequena parcela dos pacientes desenvolve uma síndrome clínica distinta. Essa síndrome, que se manifesta gradualmente ao longo de várias semanas, é observada em aproximadamente 10% dos casos (SUAREZ et al., 2022). Para identificar a presença do parasito responsável pela DC, são utilizados métodos laboratoriais como testes de anticorpos, técnicas de biologia molecular, xenodiagnóstico e microscopia.
Os testes de anticorpos detectam a resposta imunológica do organismo ao parasito, enquanto as técnicas de biologia molecular permitem a detecção direta do DNA do parasito. O xenodiagnóstico envolve a utilização de insetos vetores, como barbeiros não infectados, que se alimentam do sangue do paciente. Após um período de incubação, esses insetos são dissecados e examinados para verificar a presença de tripomastigotas no trato intestinal dos insetos (IOC, 2009). A microscopia, por sua vez, permite a visualização direta do parasito no sangue periférico durante a fase aguda da doença (MARIE; PETRI Jr, 2022). A forma tripomastigota invasiva do parasito pode ser detectada no sangue periférico, atingindo um pico de parasitemia aproximadamente 30 dias após a infecção. No entanto, o acesso a esses testes eficazes ainda é um desafio em áreas remotas, o que frequentemente resulta em subnotificação e subdiagnóstico da doença. Essa detecção precoce do parasito é fundamental para iniciar o tratamento oportuno e adequado, visando interromper a progressão da doença e prevenir suas complicações (SUAREZ et al., 2022).O Ministério da Saúde preconiza o uso do benzonidazol como tratamento, reservado para pacientes diagnosticados com Doença de Chagas (DC) mediante confirmação da patologia por um profissional qualificado (GERES LF, et al., 2022; BRASIL, 2023; BRASIL, 2010). Disponibilizado gratuitamente pelas Secretarias Estaduais de Saúde, o medicamento é recomendado para indivíduos com a forma aguda da doença assim que esta é identificada. Já para portadores da forma crônica, o benzonidazol é indicado a pacientes assintomáticos com exames sem alterações (forma indeterminada) ou em estágios iniciais da doença, sendo a sua prescrição avaliada caso a caso. Em situações de intolerância ou falta de resposta ao tratamento inicial, especialmente em casos agudos ou de reativação da DC em pacientes imunossuprimidos, o Ministério da Saúde oferece o nifurtimox como uma alternativa terapêutica.
Quanto à prevenção da doença, as medidas variam de acordo com a forma de contaminação. Para evitar a multiplicação dos insetos vetores dentro de casa, recomenda-se o uso de inseticidas aplicados por profissionais em locais propícios à sua presença, além da utilização de mosquiteiros. No contexto da transmissão oral, a vigilância sanitária desempenha papel fundamental, aliada à educação contínua, controle rigoroso na liberação de alvarás e avaliação criteriosa nos processos de produção de alimentos. Ademais, métodos como a cocção acima de 45°C, pasteurização e liofilização representam estratégias eficazes na prevenção da transmissão oral por T. cruzi (SUAREZ et al., 2022).
Uma estratégia abrangente é essencial para interromper as cadeias de transmissão e mitigar a propagação da doença. As estratégias de controle devem incluir duas linhas de ação principais: prevenção da transmissão, visando evitar a ocorrência de novos casos (VASQUEZ et al.; 2009), e rápido diagnóstico e tratamento das pessoas infectadas. Isto não só ajuda a restaurar a saúde destes indivíduos sempre que possível, mas também proporciona conforto aos pacientes, às suas famílias e à comunidade, ao mesmo tempo que quebra a cadeia de transmissão sanguínea e reduz a carga parasitária no doador e na mãe (SOSA, 2012). Dessa forma, é relevante pontuar que a redução do impacto das doenças na sociedade levará a uma redução nos gastos com saúde (LEE BY; BACON KM; BOTTAZZI ME; HOTEZ PJ, 2013). Portanto, investir em estratégias eficazes de prevenção e controle não só beneficia a saúde pública, mas também tem implicações financeiras positivas para a sociedade como um todo.
Além disso, a DC enquadra-se na categoria de doenças negligenciadas, indicando que afeta principalmente comunidades marginalizadas e que vivem em um contexto de vulnerabilidade social, que enfrentam barreiras no acesso a cuidados de saúde e recursos. A Organização Mundial da Saúde (OMS) define as doenças tropicais negligenciadas (DTN) como um conjunto de 20 doenças que afetam mais de 1,7 mil milhões de indivíduos em todo o mundo, particularmente aqueles que residem em áreas tropicais e subtropicais (ZAIDEL et al., 2020). Além do mais, o financiamento insuficiente para a investigação, prevenção e tratamento agrava as consequências sociais e económicas da negligência desta doença ao longo da história. Embora a DC afete 6 a 7 milhões de pessoas em todo o mundo, é encontrada predominantemente nas regiões rurais da América Latina, com casos adicionais relatados nos Estados Unidos, Canadá, Europa e África (ZAIDEL et al., 2020).
Estudar esse tema é crucial não apenas para compreender a epidemiologia e os mecanismos de transmissão da doença, mas também para desenvolver estratégias eficazes de prevenção, diagnóstico e tratamento, contribuindo assim para a redução do impacto dessa enfermidade na saúde pública e na qualidade de vida das populações afetadas. Sendo assim, o objetivo desta pesquisa é analisar o perfil epidemiológico e as características clínicas da Doença de Chagas (DC) na região Norte, incluindo sua incidência, perfil social, etnia mais afetada, gênero mais afetado, faixa etária mais afetada e o modo de infecção. Também será avaliada a frequência da doença, os fatores que contribuem para sua ocorrência, os sintomas apresentados pelos pacientes e as áreas onde as iniciativas de controle são insuficientes. Ademais, pretende-se oferecer suporte para o desenvolvimento e implementação de medidas preventivas aprimoradas, técnicas de diagnóstico e abordagens de tratamento, com o propósito de reduzir o impacto da doença e melhorar o bem-estar das comunidades afetadas. Este estudo visa contribuir para uma compreensão mais ampla da DC e ressaltar a importância da implementação de estratégias integradas e esforços contínuos para combater eficazmente esta enfermidade negligenciada.
MATERIAL E MÉTODOS
Este estudo adota uma abordagem transversal, quantitativa e analítica, com o propósito de examinar os registros confirmados e delinear o perfil dos indivíduos acometidos pela doença de Chagas aguda na região Norte do Brasil. Os dados analisados foram obtidos por meio de uma pesquisa pública realizada em 09 de abril de 2024, utilizando informações disponibilizadas pelo Departamento de Informática do Sistema Único de Saúde do Brasil (DATASUS/RO), por intermédio do Sistema de Informação de Agravos de Notificação (SINAN), abrangendo o intervalo de tempo compreendido entre os anos de 2019 e 2020. Para acessar o banco de dados do DATASUS, o usuário deve primeiramente acessar o site oficial da plataforma através do endereço eletrônico http://www2.datasus.gov.br/DATASUS/. Em seguida, é necessário clicar no link denominado “Informações de Saúde (TABNET)” e, posteriormente, selecionar a opção “Estatísticas Vitais”. Na página de apresentação desta seção, o usuário deve optar por “Doença de Chagas”. Para acessar os dados específicos de um estado em particular, o usuário deve selecionar o estado desejado entre as opções disponíveis.
Este estudo abrangeu exclusivamente os dados provenientes de Rondônia, um dos estados que compõem a Região Norte do Brasil. As informações utilizadas incluíram variáveis como o ano do primeiro sintoma, UF de residência, região de saúde de residência, sexo, faixa etária, raça/cor, modo e local de infecção, zona de moradia da infecção, disponíveis no banco de dados do DATASUS.
Os dados que serão obtidos serão armazenados e processados de forma quantitativa em um banco de dados utilizando o software Microsoft Office Excel 2016. Nesse ambiente, as porcentagens das ocorrências serão calculadas, assim como as médias e desvios padrão do Índice de Desenvolvimento Humano (IDH) serão determinados para a realização do teste estatístico de Correlação de Pearson. A análise dos dados será conduzida através do software estatístico (Biostat 5.3), considerando um nível de significância estatística igual a p<0,05. Os resultados que forem encontrados serão apresentados na forma de tabelas e comparados com as literaturas encontradas para discussão. Tendo em vista que a presente pesquisa será realizada a partir da coleta e análise de dados secundários através de consulta pública, disponibilizados pelo sistema de informação referido anteriormente, e sendo este também de domínio público, ressaltar-se-á a dispensação da apreciação pelo Comitê de Ética em Pesquisa para a realização do estudo.
RESULTADOS E DISCUSSÃO
De acordo com os dados observados no presente estudo, nos anos de 2019 2020, a região norte do Brasil registrou 524 casos confirmados de Doença de Chagas Aguda (DCA), com a maioria desses casos ocorrendo no estado do Pará (Tabela 1). Este padrão de distribuição sugere que fatores regionais específicos, como condições ambientais e socioeconômicas, podem estar contribuindo para a alta incidência no Pará.
A concentração dos casos nesse estado destaca a importância de investigar mais a fundo os determinantes locais da doença e reforça a necessidade de estratégias de prevenção e controle direcionadas, bem como melhorias no acesso aos serviços de saúde para a população afetada.
TABELA 1: Número de casos e taxa de incidência de doença de Chagas aguda, segundo Região, Unidades Federadas de infecção e ano de início de sintomas. Brasil, 2019 – 2020.
Região/Unidade federada de Infecção Nº de casos confirmados 2019 Nº de casos confirmados 2020 Amapá 36 5 Acre 21 1 Amazonas 29 8 Pará 253 159 Roraima 1 Não fornecidos Rondônia 1 1 Tocantins 9 Não fornecidos NORTE 350 174
FONTE: Ministério da Saúde/SVS – Sistema de Informação de Agravos de Notificação – Sinan Net
Entre os 524 casos de Doença de Chagas Aguda (DCA) analisados no período, o sexo masculino predominou, representando 56,49% dos casos (Tabela 2). Embora essa prevalência sugira uma possível influência de fatores comportamentais, ocupacionais ou biológicos que possam predispor os homens a um risco maior de contrair a doença, a diferença observada não foi estatisticamente significativa. Portanto, não é possível afirmar com certeza que o sexo masculino está mais predisposto à DCA com base nesses dados.
TABELA 2: Perfil sociodemográfico de casos de doença de Chagas aguda, segundo ano de início de sintomas. Brasil, 2019 – 2020
SEXO 2019 2020 Masculino 191 105 Feminino 159 69 TOTAL 350 174 FONTE: Ministério da Saúde/SVS – Sistema de Informação de Agravos de Notificação – Sinan Net
Em relação à etnia, a cor parda foi a mais comumente declarada, representando 84,5% dos casos (Tabela 3).
TABELA 3: Casos confirmados por Ano 1º Sintoma(s) segundo Ano 1º Sintoma(s) 2019 – 2020
ETNIA
COR/RAÇA 2019 2020 IGN/BRANCO 11 1 BRANCO 30 14 PRETO 15 2 AMARELO 1 0 PARDO 292 150 INDIGENA 1 7 TOTAL 350 174 FONTE: Ministério da Saúde/SVS – Sistema de Informação de Agravos de Notificação – Sinan Net
A análise demográfica revelou que a maioria dos indivíduos afetados pela
DCA eram adultos jovens entre 20 e 39 anos (Tabela 4)
TABELA 4: Casos confirmados segundo Ano 1º Sintoma(s)
IDADE 2019 2020 ING/BRANCO 0 0 <1 4 1 1-4 11 9 5-9 23 11 10-14 37 9 15-19 38 10 20-39 117 65 40-59 87 60 60-64 11 0 65-69 11 2 70-79 10 5 80 e+ 1 2 TOTAL 350 174 FONTE: Ministério da Saúde/SVS – Sistema de Informação de Agravos de Notificação – Sinan Net
A transmissão oral foi a forma mais frequente de contágio (87,4%), seguida pela transmissão de origem desconhecida, onde não foi possível identificar a fonte de infecção. Houve uma queda significativa de 47% nos registros de casos suspeitos de fase aguda e de 63% nos casos confirmados de DCA em 2020 em comparação com 2019 (Tabela 3).
TABELA 5: Modo de Infecção
Modo Provável Infecção 2019 2020 IGN/Branco 17 16 Tranfusional 0 0 Vetorial 19 12 Vertical 0 0 Acidental 2 0 Oral 312 146 Outros 0 0
TOTAL 350 174
FONTE: Ministério da Saúde/SVS – Sistema de Informação de Agravos de Notificação – Sinan Net
Em 2020, houve uma significativa diminuição nas notificações e confirmações de casos relacionados à doença de Chagas aguda (DCA) em comparação com 2019. Especificamente, observou-se uma redução de 47% nas notificações de casos suspeitos de fase aguda da doença. Além do impacto direto causado pela COVID-19, a pandemia gerou consequências indiretas à saúde, incluindo o atraso no diagnóstico de diversas patologias e a negligência na prevenção e acompanhamento de doenças endêmicas. A emergência de saúde pública criada pela COVID-19 também impactou a notificação de doenças tropicais negligenciadas (DTN), que afetam cerca de 1 bilhão de pessoas globalmente, principalmente as populações que vivem em um contexto de vulnerabilidade social, que já enfrentam a falta de saneamento básico, moradias inadequadas e condições de saúde precárias (SBMT, 2021).
Além disso, a quantidade de casos confirmados de DCA caiu ainda mais drasticamente, apresentando uma redução de 63%. Esses dados podem ser conferidos na Tabela 6, que detalha a comparação anual dos números de casos suspeitos e confirmados.
TABELA 6: Subnotificação da suspeição e da confirmação de casos de doença de Chagas aguda.
Brasil, 2019-2020.
DCA 2019 2020 Decrescimo % Notificação de suspeitos 4169 2193 47,39%
Casos
Confirmados 387 146 62,27%
FONTE: Sistema de Informação de Agravos de Notificação (SINAN)/MS. Data de atualização dos dados: março/2021. Dados preliminares, sujeitos à alteração.
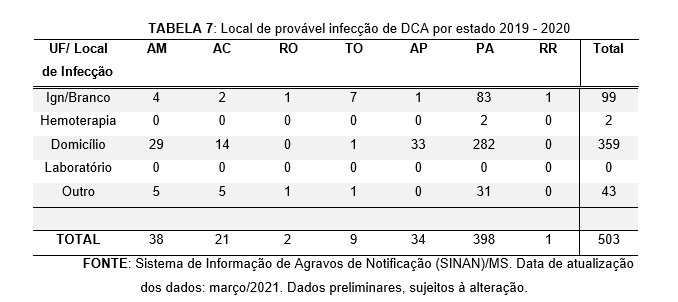
Na Tabela 7, é possível observar o local de provável infecção por DCA. Verifica-se que a infecção em domicílio foi a mais elevada, correspondendo a 359 casos notificados (71,37%), com a maioria dos casos registrados no estado do Pará.
TABELA 7: Local de provável infecção de DCA por estado 2019 – 2020
Avaliou-se a notificação por evolução clínica da DC, onde foi possível perceber que 2,29% dos pacientes chagásicos evoluíram para óbito, evidenciando a baixa relação da DC com a mortalidade, conforme demonstra a Tabela 8. Apesar do baixo índice, é de extrema relevância o cuidado com a patologia, já que a DC é predominantemente assintomática na fase aguda, o que dificulta o diagnóstico, e pode haver repercussões cardíacas decorrentes da progressão da doença (Dias et al.; 2016).
Tabela 8: Notificações por evolução clínica da doença de Chagas no Brasil entre os anos de 2019-2020.
Evolução Clínica 2019 2020 IGN/Branco 38 25 Vivo 303 146 Óbito pelo agravo notificado 7 3 Óbito por outra causa 2 0 TOTAL 350 174
Fonte: Ministério da Saúde/SVS – Sistema de Informação de Agravos de Notificação – Sinan Net.
Em 2019, houve uma maior quantidade de casos registrados nas regiões de saúde (CIR), totalizando 350 notificações, enquanto em 2020, esse número caiu para 174 casos confirmados. O estado do Pará liderou com o maior número de casos, contabilizando 412 notificações, o que representa 78,63% do total. As regiões de saúde do Tocantins registraram 9 casos (1,72%).
O Amapá ficou em segundo lugar com 41 casos (7,8%), seguido pelo Amazonas com 37 casos (7,06%). No Acre, foram notificados 22 casos (4,19%), dos quais 21 (4,0%) ocorreram nas regiões de saúde de Juruá e Tarauacá/Envira. Nos estados de Rondônia, Roraima e Tocantins, a incidência de DCA foi baixa entre 2019 e 2020 (Tabela 8).
TABELA 8: Comparativo entre as regiões de saúde (CIR) com ocorrência de infecção por DCA entre os anos de 2019 e 2020.
Região de Saúde de Residência 2019 2020 Nº Total % Acre 21 1 22 4,19% Juruá e Tarauacá/Envira 21 0 21 4,0% Baixo Acre e Purus 0 1 1 0,19% Amapá 36 5 41 7,8% Área Central 26 4 30 Área Sudoeste 10 1 1 Amazonas 29 8 37 7,06% Manaus, Entorno e Alto Rio Negro 16 7 23 Rio Negro e Solimões 1 0 1 Baixo Amazonas 7 0 7 Triangulo 4 0 4 Alto Solimões 1 0 1 Regional Juruá 0 1 1 Pará 253 159 412 78,63% Baixo Amazonas 2 3 5 Lago Tucuruí 5 2 7 Metropolitana I 70 33 103 Metropolitana II 0 1 1 Metropolitana III 5 3 8 Rio Caetés 1 1 2 Tocantins 95 49 144 Xingu 0 2 2 Marajó I 20 13 33 Marajó II 55 52 107 Rondônia 1 1 2 Madeira Mamoré 1 0 1 Vale do Jamari 0 1 1 Roraima 1 0 1 Sul 1 0 1
Tocantins 9 0 9 1,72%
Médio Norte Araguaia 8 0 8 Capim Dourado 1 0 1 Região Norte 350 174 524
FONTE: Ministério da Saúde/SVS – Sistema de Informação de Agravos de Notificação – Sinan Net.
Segundo a Organização Pan- Americana de Saúde – OPAS (2023), a doença de Chagas afeta mais de 6 milhões de pessoas em todo o mundo, a maioria delas na América Latina. No cenário brasileiro, especificamente na região norte do país, entre os anos de 2019 a 2020 foram registrados 524 casos da doença no pais (DATASUS, 2024), onde houve uma prevalencia em indidviduos na faixa etária de 20 a 39 anos, correspondendo a 182 casos (34,7%), similar ao encontrado por Souza SB, et al.
(2021).
Além disso, a incidência da enfermidade demonstrou ser mais presente entre os indivíduos do sexo masculino, um padrão que se alinha com descobertas em outros estudos. Por exemplo, em uma pesquisa conduzida por Gomes G. et al. (2020), observou-se que 54,78% dos casos notificados eram de homens. Cardoso LP. et al. (2020) também encontraram uma taxa de incidência mais elevada entre os homens, registrando 154,96 casos por 100 mil habitantes em comparação com 133,87 casos por 100 mil habitantes entre as mulheres. Da mesma forma, Santos FAC. et al. (2020) destacaram a predominância masculina, observando uma diferença de 100 casos em relação ao sexo feminino.
Entre 2019 e 2020, a principal via de infecção registrada nos estados da Região Norte foi a contaminação oral, com 458 casos notificados (87,40%), sendo a maioria deles ocorridos em domicílio (n=359). Esses resultados são comparáveis aos encontrados por Rodrigues ADDPS, et al. (2021), que, em sua pesquisa no norte do Brasil, revelou que entre 2007 e 2018, 82,80% dos casos de DCA resultaram de contaminação oral, com 70,81% das infecções ocorrendo em casa. Similarmente, Oliveira SF, et al. (2021) relataram um padrão de contaminação parecido na região nordeste entre 2010 e 2019. A associação desses resultados aos hábitos alimentares locais, como o consumo de açaí, caldo de cana, bacaba, entre outros, bem como à preparação artesanal de alimentos sem as devidas precauções higiênicas, também foi destacada por CUNHA LNA, et al. (2021).
No estado do Acre, foram registrados 22 casos de doença de Chagas no período analisado, com destaque para a região de saúde Juruá e Tarauacá/Envira, que notificou 20 desses casos. Isso confirma os achados de Oliveira GF, et al. (2018), que identificaram 41 casos na mesma região entre 2009 e 2016. A pesquisa de Oliveira correlacionou a alta incidência de infecção por DCA com a produção agrícola e o consumo de açaí na área, um padrão também observado no Pará, onde o açaí é apontado como o principal alimento responsável pela contaminação na região norte do Brasil.
No estado do Amapá, que foi o segundo com maior número de notificações no período analisado, com 41 casos, as ocorrências foram distribuídas entre as regiões de saúde da Área Central (n=30 casos) e Área Sudoeste (n=11 casos). Já no Amazonas, a maior concentração de notificações foi registrada na região de Manaus, Entorno e Alto Rio Negro, com 25 casos. O Tocantins foi o quinto estado com maior número de casos na região norte, registrando 9 notificações, das quais 8 foram na região de saúde Médio Norte Araguaia e 1 em Capim Dourado. Nos estados de Rondônia e Roraima, a prevalência da doença de Chagas aguda (DCA) é baixa. Contudo, apesar da incidência da doença nessas regiões, não foram encontradas literaturas recentes que permitissem comparar os resultados e estabelecer correlações com outras variáveis. doença nas regiões de saúde destes estados, não foram encontradas literaturas recentes para comparar os resultados e traçar correlações com outras variáveis.
Na análise da relação entre os casos notificados de Doença de Chagas e o Índice de Desenvolvimento Humano (IDH) utilizando a correlação de Pearson, não foi identificada uma significância estatística relevante. No entanto, observou-se uma tendência onde estados com menor IDH, como o Pará, apresentaram um maior número de casos. Durante o período estudado, o Pará teve o menor IDH da região norte e o maior número de notificações de DCA, conforme também relatado por Alves WEFM, et al. (2021).
Além disso, não foram encontradas outras pesquisas recentes que correlacionassem diretamente a incidência de DCA com o IDH dos estados. Dado que o IDH resume aspectos cruciais do desenvolvimento humano, como renda, educação e saúde, e considerando que fatores sociais, culturais e políticos influenciam a qualidade de vida (PNUD, 2023), pode-se deduzir que condições de vida desfavoráveis estão associadas a um maior risco de infecção por DCA. Isso indica que os determinantes sociais da saúde desempenham um papel significativo na prevalência da doença.
CONSIDERAÇÕES FINAIS
A análise do perfil epidemiológico dos indivíduos infectados pelo Trypanossoma cruzi revelou uma prevalência elevada em relação ao sexo masculino e à autoidentificação racial como parda. No entanto, essa diferença observada em indivíduos do sexo masculino não foi estatisticamente significativa. A faixa etária mais afetada abrangeu os adultos jovens, entre 20 e 39 anos, seguida pelos indivíduos de 40 a 59 anos. Além disso, constatou-se que o estado do Pará apresenta uma incidência mais elevada de casos em comparação aos demais estados da região em estudo. Essa investigação oferece contribuições substanciais para o entendimento e a detecção precoce de surtos e epidemias, fortalecendo as iniciativas de vigilância em saúde, bem como as ações de combate e as medidas preventivas. Espera-se que os resultados deste estudo forneçam uma base sólida para pesquisas futuras sobre o Trypanossoma cruzi, promovendo a coleta de dados atualizados e ampliando o conhecimento científico nessa área..
REFERÊNCIAS BIBLIOGRÁFICAS
COUNCIL ON CHAGAS DISEASE OF THE INTERAMERICAN SOCIETY OF CARDIOLOGY. Chagas disease: an overview of clinical and epidemiological aspects. Journal of the American College of Cardiology, v. 62, n. 9, p. 767-776, 2013. DOI:
10.1016/j.jacc.2013.05.046. PMID: 23770163.
CARDOSO LP, et al. Spatial distribution of Chagas disease and its correlation with health services. Revista da Escola de Enfermagem da USP, 2020; 54: e03565
Dias, J. C. P., Ramos Júnior, A. N., Gontijo, E. D., Luquetti, A., Shikanai-Yasuda, M. A., Coura, J. R., Torres, R. M., Melo, J. R. C., Almeida, E. A., & Oliveira Júnior, W. (2016). II Consenso Brasileiro em doença de Chagas, 2015. Epidemiologia e Serviços de Saúde, 25, 7–86..
GOMES G, et al. Perfil epidemiológico da Doença de Chagas aguda no Pará entre 2010 e 2017. Pará Research Medical Journal, 2020; 4: e29.
IOC – Instituto Oswaldo Cruz, 2009. Disponível em<: http://www.fiocruz.br/ioc/cgi/cgilua.exe/sys/start.htm?infoid=633&sid=32. Acessado em: 05 de junho 2024.
LEE BY, BACON KM, BOTTAZZI ME, HOTEZ PJ. Global economic burden of Chagas disease: a computational simulation model. Lancet Infect Dis 13: 342-348.
LIMA, R.S.; TEIXEIRA, A.B.; LIMA, V.L.S. Doença de chagas: uma atualização bibliográfica. Revista Brasileira de Análises Clínicas, v. 51, n. 2, p. 103-106, 2019.
MARIE, C; PETRI, W. A. Jr. Manual MSD Versão para profissionais – Doença de
Chagas. Disponível em<: https://www.msdmanuals.com/pt–
br/profissional/doen%C3%A7as–infecciosas/protozo%C3%A1riosextraintestinais/doen%C3%A7a–de–chagas. Acessado em 05 de junho de 2024.
MORAES, F. C. A. de, PASSOS, E. S. dos R., COSTA, P. M., PESSOA, F. R., & LOPES, L. de J. da S. (2021). Doença de Chagas na Região Norte do Brasil: Análise dos casos no período de 2010 a 2019 [Chagas Disease in the North Region of Brazil: Analysis of cases in the period from 2010 to 2019]. Research, Society and Development, 10(5), e48210514193. https://doi.org/10.33448/rsd–v10i5.14193.
NIELEBOCK MAP, MOREIRA OC, DAS CHAGAS XAVIER SC, et al. Association between Trypanosoma cruzi DTU TcII and chronic Chagas disease clinical presentation and outcome in an urban cohort in Brazil. PLoS One. 2020;15(12December):1–15. doi: 10.1371/journal.pone.0243008.
NUNES, M.C.; DONES, W.; MORILLO, C.A.; ENCINA, J.J.; RIBEIRO, A.L.; Council on Chagas Disease of the Interamerican Society of Cardiology. Chagas disease: an overview of clinical and epidemiological aspects. Journal of the American College of Cardiology, v. 62, n. 9, p. 767-776, 2013. DOI: 10.1016/j.jacc.2013.05.046. PMID: 23770163.
RODRIGUES A, et al. Cenário da doença de Chagas aguda na Região Geográfica Intermediária de Belém/PA. Brazilian Journal of Development, 2021;7(12): 111225111239.
RODRIGUES A, et al. Doença de chagas aguda: o impacto da transmissão oral no Estado do Pará. Brazilian Journal of Development, 2021; 7(8): 86187-86206.
SANTOS FAC, et al. Avaliação da prevalência e do perfil epidemiológico da doença de chagas aguda entre 2014 e 2017 no estado do Pará, Brasil. Brazilian Journal of Health Review, 2020; 3(4): 8974-8982.
SOUZA, S. B. de; OLIVEIRA, A. de; CAMPOS, E. de S.; GODINHO, G. A.; SARAIVA, A. F. F.; ARAUJO, B. M.; MENEZES, A. B. V. de; SILVA, L. A.; MEIRELES, R. de S.; GOMES, E. dos S. (2021). Perfil epidemiológico da doença de Chagas aguda na região norte do Brasil no ano de 2015-2019. Revista Eletrônica Acervo Saúde, 13(7), e8200. https://doi.org/10.25248/reas.e8200.2021.
SOSA-ESTANI S. El tratamiento etiológico de la enfermedad de Chagas como estrategia de salud pública. Rev Argent Salud Pública 11: 40-43.
SBMT – Sociedade Brasileira de Medicina Tropical, 2021. Disponível em <:
https://sbmt.org.br/impacto–da–covid–19–na–notificacao–de–doencas–tropicaisnegligenciadas/ Acessado em 05 de junho de 2024.
THE UK CHAGAS HUB, 2013. Disponível em <: http://www.thehtd.org/chagasuk.aspx. Acessado em 8 de março de 2024.
VAZQUEZ-PROKOPEC GM, SPILLMANN C, ZAIDENBERG M, KITRON U, GÜRTLER RE 2009. Cost-effectiveness of Chagas disease vector control strategies in northwestern Argentina. PLoS Negl Trop Dis 3: e363.
ZAIDEL, E.J.; FORSYTH, C.J.; NOVICK, G.; MARCUS, R.; RIBEIRO, A.L.P.; PINAZO, M.-J.; MORILLO, C.A.; ECHEVERRÍA, L.E.; SHIKANAI-YASUDA, M.A.; BUEKENS, P.; PEREL, P.; MEYMANDI, S.K.; RALSTON, K.; PINTO, F.; SOSA-ESTANI, S. COVID-19: Implications for People with Chagas Disease. Heart Global, v. 15, n. 1, p.
69, 2020. DOI: https://doi.org/10.5334/gh.891.
