REGISTRO DOI:10.69849/revistaft/th10248061619
Isabela Cintra Ribeiro
Mariá Milesi Ortiz
Natália Lima dos Santos
Gabrielle Moreno Lopes
Luísa Montanini Baptista Nunes
Thais Botelho Ramos Pedroso
Tiago Souza Macre Giovanna Sola Méa
INTRODUÇÃO:
Os alimentos são conduzidos pelo esôfago até o estômago por meio de movimentos peristálticos. As fibras musculares desse órgão, em formato tubular, recebem estímulos nervosos para se contraírem até o alimento chegar ao esfíncter esofágico inferior. Este esfíncter funciona como uma espécie de válvula que relaxa para permitir que os alimentos passem e, em seguida, se contrai mais uma vez para impedir que eles retornem para o esôfago (Pinheiro, 2022).
Quando essas movimentações sofrem algum tipo de prejuízo ocorre uma disfunção do esôfago, desencadeando o que chamamos de acalasia (Pinheiro, 2022). A acalasia foi descrita originalmente por Thomas Willis em 1674, em Londres. Esta alteração foi classificada como uma desordem motora primária do esôfago, sendo considerada a mais comum entre seus tipos (Camões, 2017).
A acalasia (grego: a-, não + calasia, relaxa) de esôfago é uma doença primária neurodegenerativa da motilidade, resultante da degeneração do plexo mioentérico inibido existente nas paredes do esôfago. É caracterizada por relaxamento incompleto do esfíncter esofágico inferior e aperistaltismo esofágico. Uma caracterização certeira é o relaxamento incompleto do esfíncter esofágico inferior devido às causas supracitadas (Araújo, 2020).
Essa perda neuronal não foi esclarecida ainda, mas acreditam que os mecanismos de iniciação possíveis são infecção viral, fatores genéticos, ambientais e destruição neuronal imunomediada. O evento trigger, da degeneração neuronal, ainda não está completamente elucidada na literatura, mas já foram consideradas causas auto-imunes, infecciosas ou genéticas (Araújo, 2020).
No Brasil, a causa é desconhecida e é uma doença rara, atingindo 1:100.000 da população geral que pode acometer igualmente homens e mulheres e é mais comumente diagnosticada entre os 20 e 40 anos de idade (Fernandez; Lucio; Pollachi, 2004; Pinheiro, 2022).Os sintomas mais comuns são disfagia e regurgitação, observa-se também dor torácica que precisa ser diferenciada de angina de origem cardíaca, além disso, cerca de 60% possuem algum grau de emagrecimento pelo esvaziamento o ineficaz do esôfago e ingestão de menor quantidade de alimentos, e as complicações respiratórias são as repercussões extra esofágicas mais comuns desse distúrbio, ocorrem em mais da metade dos pacientes (Fernandez; Lucio; Pollachi, 2004).
Não há um tratamento curativo para a acalasia, mas os pacientes podem utilizar opções farmacológicas e/ou cirúrgicas com o objetivo de reduzir os sintomas. Tratamentos recentes incluem a injeção de toxina botulínica, dilatação pneumática e cardiomiotomia de Heller com fundoplicatura parcial, considerada o padrão ouro na terapia. Ademais, outra opção inovadora é a miotomia endoscópica peroral (POEM), uma técnica minimamente invasiva e segura, com taxas de sucesso comparáveis às da cirurgia tradicional (França et al., 2023).
Diante do exposto, a relevância desse estudo se dá devido à baixa quantidade de estudos disponíveis na literatura em comparação com a importância dessa doença.
METODOLOGIA:
Trata-se de uma revisão sistemática que seguiu as recomendações do protocolo PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses). Os critérios de elegibilidade foram: artigos publicados nos últimos 5 anos, nos idiomas português, inglês e espanhol; artigos não pagos e disponíveis na íntegra, indexados nas seguintes bases de dados: MEDLINE/PubMed, Scielo, LILACS e Cochrane. Foi utilizado apenas o descritor DeCS/MeSH “Acalasia Esofágica”.
Inicialmente, foram encontrados 181 resultados. Os títulos e resumos desses artigos foram lidos e foram descartados aqueles cujo tema principal não correspondia ao descritor DeCS/MeSH selecionado, cujo foco era em outras doenças esofágicas, que abordavam intervenções, populações ou contextos não pertinentes, ou que não apresentavam resultados primários relevantes para a temática.
Os artigos sem resumo foram separados para leitura completa posteriormente. Após a seleção inicial, 45 artigos foram mantidos. Desses, foram excluídos os artigos duplicados e aqueles que não estavam disponíveis na íntegra. No total, 40 artigos foram lidos integralmente, resultando em 19 artigos utilizados nesta revisão.
Os resultados foram organizados em tópicos para facilitar a compreensão, abordando aspectos como epidemiologia, fatores de risco, fisiopatologia, diagnóstico, diagnóstico diferencial e tratamento.
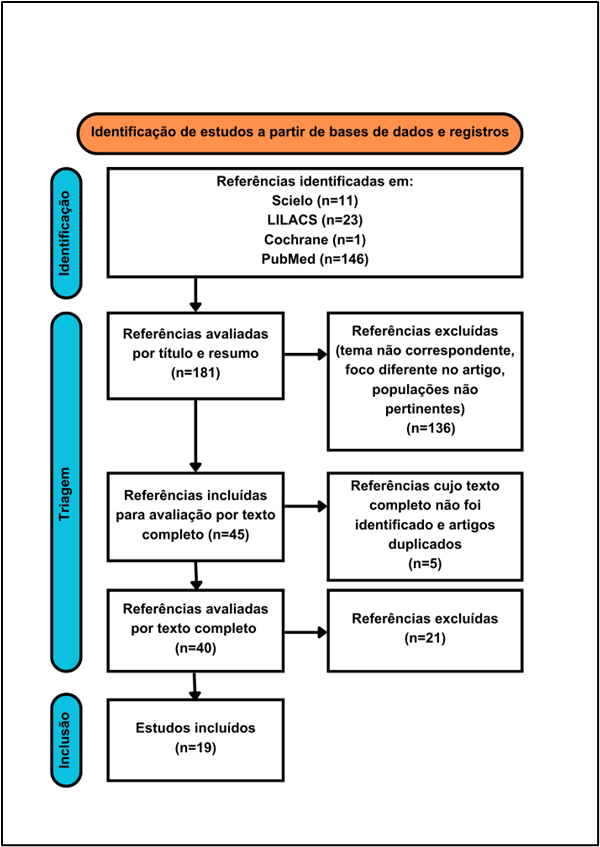
Fluxograma 1: Fluxo de identificação e seleção dos artigos
DISCUSSÃO/RESULTADOS:
- EPIDEMIOLOGIA
A acalasia é uma patologia rara que acomete com igual frequência homens e mulheres, sendo principalmente afetadas pessoas com idade entre 30 e 60 anos (Momodu & Wallen, 2023).
O real número de paciente com acalasia é indefinido, visto que até 42% dos pacientes não são diagnosticados por conterem sintomas inespecífico, uma pesquisa americana feita usando manometria de alta resolução identificou prevalência aproximadamente 3 vezes maior do que o estimado anualmente, comprovando a ineficiência da obtenção de dados (Jia et al., 2023).
- FATORES DE RISCO
Devido a incidência em irmãos e gêmeos idênticos, foi observada uma anormalidade genética que pode levar a suscetibilidade a infecção viral e neurodegeneração por consequência desse distúrbio (Jia et al., 2023).
Estudos de associação genética encontraram inserção de alelos na cauda citoplasmática do HLA-DQß1, conferindo um fator de risco para acalasia (Momodu & Wallen, 2023).
A acalasia também foi notada associada a doenças genéticas como a Síndrome de Allgrove, a Síndrome de Down e a Doença de Parkinson (Jia et al., 2023).
- QUADRO CLÍNICO
Essa patologia cursa com disfagia e regurgitação, refluxo, dor abdominal e retroesternal, perda de peso, tosse noturna e azia. Os sintomas são progressivos, e se não forem tratados, podem evoluir para broncoaspiração, esofagite e perfuração nos casos mais severos (Slim & Williamson, 2023).
Devido a dilatação e distorção do esôfago cervical pode ocorrer o sinal chamado “pescoço de rã-touro” levando à obstrução da traqueia e ao som de estridor (Momodu & Wallen, 2023).
- ETIOLOGIA
Acredita-se que a acalasia resulte da degeneração do plexo mioentérico e das fibras do nervo vago no esfíncter esofágico inferior (EEI). Observa-se uma perda de neurônios inibitórios contendo peptídeo intestinal vasoativo (VIP) e óxido nítrico sintase no plexo mioentérico esofágico, e nos casos mais graves, também ocorre envolvimento de neurônios colinérgicos. A etiologia exata dessa degeneração permanece indeterminada, embora várias teorias tenham sido propostas, incluindo mecanismos autoimunes, infecção viral e predisposição genética. A maioria dos casos observados nos Estados Unidos corresponde à acalasia idiopática primária; contudo, a acalasia secundária pode ser associada à Doença de Chagas causada por Trypanosoma cruzi, infiltração esofágica por carcinoma gástrico, gastroenterite eosinofílica, linfoma, certas infecções virais e distúrbios neurodegenerativos (Momodu & Wallen, 2023).
- FISIOPATOLOGIA/PATOGÊNESE
O esôfago desempenha um papel crucial no transporte do bolo alimentar da boca para o estômago, além de prevenir o refluxo do conteúdo gástrico. Este processo é facilitado por contrações peristálticas coordenadas na faringe e esôfago, juntamente com o relaxamento dos esfíncteres esofágicos superior e inferior. A inervação parassimpática das vias excitatórias e inibitórias regula os músculos lisos do EEI. Neurotransmissores excitatórios, como a substância P e a acetilcolina, e neurotransmissores inibitórios, como o peptídeo intestinal vasoativo (VIP) e o óxido nítrico, modulam a pressão e o relaxamento do EEI (Momodu & Wallen, 2023).
Indivíduos com acalasia apresentam perda de células ganglionares inibitórias não colinérgicas e não adrenérgicas, enquanto os neurônios excitatórios permanecem intactos. Essa deficiência de células ganglionares inibitórias resulta em um desequilíbrio entre neurotransmissão inibitória e excitatória, culminando em um EEI hipertensivo e não relaxado (Momodu & Wallen, 2023). A degeneração neural gradual resulta em contrações excessivas do EEI e perda de regulação, levando à obstrução funcional e subsequente dilatação, causando aperistalse irreversível e agravamento dos sintomas obstrutivos.
Estudos sugerem que a acalasia pode estar associada a polimorfismos genéticos nas três isoformas da óxido nítrico sintase e classes específicas de antígeno leucocitário humano (HLA) (Jia et al., 2023). Um estudo europeu apoia a hipótese de que a acalasia é um distúrbio autoimune, onde auto anticorpos interagem com DNA, semelhante ao diabetes tipo 1 e lúpus. A pesquisa genética identificou uma inserção de oito resíduos na posição 227-234 na cauda citoplasmática do HLA-DQß1 como o fator de risco mais potente para a acalasia, com variantes adicionais em HLA-DQß1 e HLA-DQa1 também associadas ao risco (Jia et al., 2023).
A neurodegeneração no EEI, caracterizada pela perda seletiva de neurônios inibitórios no plexo mioentérico do esôfago distal e pela redução de mediadores como óxido nítrico (NO), VIP e células intersticiais de Cajal (ICCs), desempenha um papel central na fisiopatologia da acalasia (Momodu & Wallen, 2023). A produção de NO é predominantemente mediada pela óxido nítrico sintase neuronal (nNOS), em pacientes com acalasia, a quantidade de células positivas para nNOS no EEI é significativamente menor, resultando em disfunção similar à acalasia. Além do mais, VIP, um neuropeptídeo essencial para o relaxamento esofágico, também é reduzido nos pacientes, e sua administração exógena melhora o relaxamento do EEI. E ao observar ICCs, envolvidas na transmissão de neurotransmissores e servindo como marcapassos, também estão reduzidas no EEI de pacientes com acalasia (Jia et al., 2023).
Os fatores precipitantes da neurodegeneração no EEI incluem anormalidades genéticas, infecções virais e respostas inflamatórias e imunes. A ocorrência de acalasia em gêmeos e associação com doenças genéticas como Síndrome de Down e Doença de Parkinson sugerem uma componente genética significativa. Polimorfismos nos genes relacionados ao sistema imunológico, como HLA-DQB1, PTPN22, e citocinas como IL-10, IL-23R e IL-33, têm sido implicados na acalasia (Jia et al., 2023). Infecções virais, como herpes simples tipo 1 (HSV-1), também têm sido associadas à acalasia, com alguns estudos demonstrando títulos elevados de anticorpos e DNA viral em pacientes (Jia et al., 2023).
A inflamação e a imunidade desempenham um papel importante na patogênese da acalasia. Infiltrações de mastócitos, eosinófilos e linfócitos T foram observadas no EEI de pacientes, correlacionando-se com a severidade da degeneração neural. Citocinas, quimiocinas e complementos são regulados positivamente na acalasia, contribuindo para a resposta inflamatória (Momodu & Wallen, 2023). A presença de autoanticorpos e enzimas proteolíticas extracelulares também sugere uma componente autoimune, com aumento de auto anticorpos como anti receptor ganglionar de acetilcolina e antineuronais (Jia et al., 2023).
Essas descobertas indicam a complexidade da patogênese da acalasia, envolvendo interações entre predisposição genética, infecções virais e respostas autoimunes, resultando em neurodegeneração do EEI. O aprofundamento do entendimento desses mecanismos pode fornecer novas perspectivas para alvos terapêuticos na acalasia.
- DIAGNÓSTICO
O teste de deglutição de bário é um método diagnóstico crucial para avaliar a morfologia do esôfago, incluindo seu diâmetro e alinhamento. No contexto da acalasia, esse exame revela achados característicos como a ausência da bolha gástrica, um afilamento do esôfago distal configurando um “bico de pássaro”, e dilatação do órgão proximal, às vezes com níveis hidroaéreos (Prado Junior et al., 2023). A deglutição de bário cronometrada, uma variação do exame clássico, é utilizada para avaliar o esvaziamento esofágico, medindo a altura da coluna de bário após cinco minutos e a largura esofágica antes e depois do tratamento (Prado Junior et al., 2023; Pesce & Sweis, 2021).
A Classificação de Rezende e Mascarenhas (1982) utiliza o esofagograma para avaliar a gravidade da acalasia, categorizando a condição em quatro graus: Grau I, onde o calibre esofágico permanece inalterado, com menos de 4 cm e retenção mínima de contraste; Grau II, que apresenta aumento moderado do calibre esofágico entre 4 e 7 cm, com retenção de contraste e ondas terciárias; Grau III, com aumento significativo do calibre esofágico de 7 a 10 cm, frequentemente associado à hipotonia; e Grau IV, que corresponde ao dolico-megaesôfago, caracterizado por um calibre esofágico superior a 10 cm (Prado Junior et al., 2023).
O escore de sintomas de Eckardt avalia a frequência dos quatro principais sintomas da acalasia: disfagia, regurgitação, dor retroesternal e perda de peso. Cada sintoma é pontuado de 0 a 3, totalizando uma pontuação de 0 a 12, onde pontuações iguais ou menores que 3 indicam uma boa resposta ao tratamento (Prado Junior et al., 2023; Pesce & Sweis, 2021).
A manometria de alta resolução (HRM) é essencial no diagnóstico e tratamento da acalasia, especialmente na miotomia endoscópica (Prado Junior et al., 2023).
A endoscopia digestiva alta é integral na investigação da acalasia, confirmando o diagnóstico em casos de estase e resistência no esfíncter inferior. É crucial para descartar pseudo acalasia e outras condições como neoplasias e esofagite (Prado Junior et al., 2023). Os tratamentos para acalasia visam reduzir o tônus do esfíncter esofágico inferior por meios farmacológicos, endoscópicos ou cirúrgicos, aliviando sintomas de disfagia, melhorando o esvaziamento esofágico e prevenindo a dilatação progressiva do órgão (Prado Junior et al., 2023).
- CLASSIFICAÇÃO
A manometria de alta resolução (HRM) é considerada a ferramenta padrão ouro para avaliar a função esofágica em pacientes com disfagia não maligna. Além de seu papel no diagnóstico, a HRM ajuda a orientar o tratamento, especialmente em casos de suspeita de acalasia ou obstrução funcional (Pesce & Sweis, 2021). A classificação de Chicago (CC) para distúrbios de motilidade esofágica, recentemente atualizada para sua quarta versão (CC v4.0), introduziu um protocolo que inclui deglutições supinas e eretas, além de testes provocativos adicionais (Pesce & Sweis, 2021).
A dismotilidade esofágica é avaliada hierarquicamente, começando pela obstrução do fluxo de saída e, em seguida, problemas de peristaltismo esofágico. O parâmetro manométrico chave é a pressão de relaxamento integrada (IRP), que mede o gradiente de pressão entre o corpo esofágico e o estômago proximal (Pesce & Sweis, 2021). Uma IRP persistentemente elevada indica um distúrbio do fluxo de saída esofagogástrico. Na presença de motilidade normal do corpo esofágico, isso é definido como “Esophagogastric junction outflow obstruction” ou EGJOO. Se o peristaltismo estiver ausente ou espástico, a acalasia é diagnosticada (Pesce & Sweis, 2021).
A HRM distingue três subtipos de acalasia:
- Tipo I: Ausência completa de atividade peristáltica, geralmente em um esôfago dilatado;
- Tipo II: Pressurizações pan-esofágicas em um esôfago não dilatado, sem peristaltismo;
- Tipo III: Contrações espásticas prematuras com preservação da contratilidade do músculo liso.
Os padrões manométricos são considerados resultados de diferentes mecanismos fisiopatológicos. A acalasia tipo III pode resultar de uma resposta imunomediada que preserva os neurônios inibitórios, enquanto os tipos I e II são caracterizados por uma perda progressiva de neurônios mioentéricos devido a um efeito citotóxico imunomediado (Pesce & Sweis, 2021; Nurczyk & Patti, 2020).
A classificação de Chicago não apenas facilita o diagnóstico, mas também prevê os resultados do tratamento. Pacientes com acalasia tipo II tendem a ter melhores taxas de sucesso terapêutico, enquanto o tipo III está associado a uma resposta menor ao tratamento cirúrgico e pode representar uma variante distinta do espasmo esofágico distal (Pesce & Sweis, 2021; Nurczyk & Patti, 2020).
A EGJOO, caracterizada por um EEI não relaxante com motilidade normal do corpo esofágico, pode resultar de anomalias estruturais ou distúrbios funcionais isolados. O diagnóstico de EGJOO requer a exclusão de patologias estruturais e a confirmação de obstrução do fluxo por meio de investigações complementares (Nurczyk & Patti, 2020). A EGJOO idiopática pode ser tratada com terapias similares às da acalasia, mas mais estudos são necessários para esclarecer seu manejo e relação com a acalasia (Nurczyk & Patti, 2020).
- DIAGNÓSTICO DIFERENCIAL
Quando um paciente apresenta disfagia, é essencial considerar a possibilidade de malignidade no diagnóstico diferencial. Outros distúrbios que também devem ser levados em conta incluem espasmo esofágico difuso, esclerodermia, Doença do Refluxo Gastroesofágico (DRGE), estreitamentos esofágicos, anel de Schatzki, hérnia de hiato e hérnia paraesofágica (Momodu & Wallen, 2023).
- TRATAMENTO
O tratamento da acalasia visa diminuir a resistência decorrente do não relaxamento do esfíncter esofágico inferior. As opções terapêuticas incluem medicamentos (bloqueadores dos canais de cálcio, nitratos e inibidores da fosfodiesterase), intervenções endoscópicas (miotomia endoscópica peroral, injeção de toxina botulínica e dilatação pneumática) e cirurgia (miotomia de Heller laparoscópica) (Jia et al., 2023).
O tratamento farmacológico envolve o uso de relaxantes musculares que atuam no EEI. Os principais medicamentos são nitratos, bloqueadores dos canais de cálcio e, mais recentemente, inibidores da fosfodiesterase 5, que reduzem a pressão do EEI em 30-60%. Esses medicamentos oferecem alívio sintomático, mas não são soluções de longo prazo (Forero-Vásquez; Yopasa-Romero, 2023).
Nas intervenções endoscópicas e cirúrgicas, inicialmente utilizava-se dilatações pneumáticas ou injeções de toxina botulínica. A miotomia de Heller laparoscópica foi introduzida na década de 90 e, mais recentemente, surgiu a miotomia endoscópica peroral (Costantini; Salvador; Costantini, 2022).
A toxina botulínica, considerada uma terapia mista, envolve a injeção da toxina nas fibras do EEI via endoscopia. Este procedimento reduz o tônus do EEI, facilitando a passagem de alimentos e saliva. Suas vantagens incluem facilidade de execução, ampla disponibilidade, baixa taxa de complicações e ser uma opção para pacientes que não podem realizar procedimentos mais invasivos. Contudo, requer repetição periódica e pode interferir em tratamentos subsequentes (Costantini; Salvador; Costantini, 2022; Pesce & Sweis, 2021).
A dilatação pneumática utiliza balões de polietileno não flexíveis, com diâmetros de 30, 35 e 40 mm, inseridos endoscopicamente no esôfago e inflados até uma pressão fixa. O maior diâmetro do balão tende a proporcionar melhores resultados, embora aumente o risco de perfuração esofágica (Costantini; Salvador; Costantini, 2022; Pesce & Sweis, 2021). Este tratamento é amplamente disponível, realizado sob sedação em ambiente ambulatorial, e não interfere em futuros tratamentos. Apesar disso, pode necessitar de repetição em 25% dos casos, é menos eficaz em pacientes jovens, não indicado para acalasia tipo III, e pode causar DRGE em 30% dos casos (Costantini; Salvador; Costantini, 2022; Swanstrom, 2019).
A miotomia de Heller laparoscópica é segura e eficaz a curto e médio prazo, aplicável a todos os tipos de acalasia, e pode ser realizada após falhas de miotomias anteriores. A cirurgia envolve uma abordagem laparoscópica com cinco portas e, frequentemente, é complementada com uma fundoplicatura para prevenir DRGE. Requer um cirurgião experiente, com uma curva de aprendizado de mais de 20 casos (Costantini; Salvador; Costantini, 2022; Swanstrom, 2019).
A miotomia endoscópica peroral (POEM), introduzida em 2007, é ideal para distúrbios esofágicos com segmentos mais longos, como acalasia tipo III. A técnica é relativamente segura, com bons resultados a curto e médio prazo, mas apresenta uma curva de aprendizado mais longa, necessitando de 50 casos. Realizada com endoscópio padrão sob anestesia geral, cria-se um túnel submucoso para a miotomia dos músculos até 2-3 cm além do EEI, na cárdia (Costantini; Salvador; Costantini, 2022; Pesce & Sweis, 2021).
A esofagectomia cirúrgica é um procedimento radical, reservado como última opção para casos avançados de acalasia (Mari et al., 2021).
- COMPLICAÇÕES
A obstrução persistente da junção gastroesofágica provoca uma dilatação progressiva e o alongamento do esôfago, conferindo uma aparência sigmóide à acalasia em estágio avançado. Entre as principais complicações estão perfuração esofágica, recorrência, doença do refluxo gastroesofágico e inchaço. A relação entre acalasia e carcinoma permanece controversa (Fajardo et al., 2020; Momodu & Wallen, 2023).
CONCLUSÃO:
A acalasia de esôfago é uma doença rara, que interfere na atividade peristáltica do esôfago, sendo um distúrbio advindo de predisposição genética, infecções virais e respostas autoimunes, resultando em neurodegeneração do EEI. Caracterizada pela redução de certos componentes, como NO, VIP e ICCs. E afeta igualmente tanto mulheres quanto homens.
O quadro clínico pode ser confundido com outras doenças (DGRE e malignidades), por possuir sintomas mais abrangentes, como disfagia e regurgitação, refluxo, dor abdominal e retroesternal, perda de peso, tosse noturna e azia. Assim, é necessário um diagnóstico através da deglutição de bário, e a correta classificação da função esofágica do indivíduo por meio da HRM junto com a análise da gravidade por meio da classificação Rezende e Mascarenhas.
O tratamento da acalasia de esôfago não é curativo, porém tem como objetivo diminuir a resistência decorrente do não relaxamento do esfíncter esofágico inferior interferindo assim nos sintomas relatados, por meios farmacológicos e não farmacológicos (intervenções endoscópicas e cirurgia).
REFERÊNCIAS:
YADLAPATI, R. et al. What is new in Chicago Classification version 4.0?. Neurogastroenterology and motility, vol. 33, 1, e14053, Janeiro 2021. DOI: 10.1111/nmo.14053
PINHEIRO, F. A. S. Acalasia: Definição, Sintomas e Tratamento. Colégio Brasileiro de Cirurgia Digestiva, 2022. Disponível em: https://cbcd.org.br/biblioteca-para-o-publico/acalasia-definicao-sintomas-e-tratamento/. Acesso em 22 julho 2024.
MARI, A. et al. Diagnosis and Management of Achalasia: Updates of the Last Two Years. Journal of clinical medicine vol. 10, 16 3607, Agosto 2021. DOI: 10.3390/jcm10163607
ARAÚJO, S. C. V. Acalásia em idade pediátrica: Artigo de revisão. Trabalho final do 6º ano médico com vista a atribuição do grau de mestre no âmbito do ciclo de estudos do Mestrado Integrado em Medicina – Faculdade de Medicina, Universidade de Coimbra. Portugal, p 57. Maio 2020.
CAMÕES, A. C. D. G. S. Acalásia: o paradigma de uma doença atual. Revista Portuguesa de Cirurgia – Monografia (Mestrado Integrado em Medicina) – Faculdade de Medicina, Universidade do Porto. Portugal, p. 48. Março 2017.
FERNANDEZ, P. M.; LUCIO, L. A. G.; POLLACHI, F. Acalasia de esôfago de causa desconhecida na infância. Jornal de Pediatria, v. 80, n. 6, p. 523–526, Novembro 2004. DOI: https://doi.org/10.1590/s0021-75572004000800016.
BRINDISE, E.; KHASHAB M.A.; EL ABIAD R. Insights into the endoscopic management of esophageal achalasia. Therapeutic advances in gastrointestinal endoscopy vol. 14, 26317745211014706, Maio 2021. DOI: 10.1177/26317745211014706
COSTANTINI, M.; SALVADOR, R.; COSTANTINI, A. Esophageal Achalasia: Pros and Cons of the Treatment Options. World journal of surgery vol. 46, 7, 1554-1560, Julho 2022. DOI: 10.1007/s00268-022-06495-z
FAJARDO, R. A. et al. Endoscopic and Surgical Treatments for Achalasia: Who to Treat and How?. Gastroenterology clinics of North America vol. 49,3 481-498, Setembro 2020. DOI: 10.1016/j.gtc.2020.05.003
FORERO-VÁSQUEZ, B. N.; YOPASA-ROMERO, J. J. Diagnóstico Y Manejo Actual De La Acalasia. Revista Colombiana de Cirurgía, vol. 38, 330-338, Abril 2023. DOI: https://doi.org/10.30944/20117582.2187
FRANÇA, I. R. et al. Miotomia Endoscópica Peroral Para O Tratamento de Acalásia No Sistema Único de Saúde (SUS): Resultados de Seguimento No Curto-Prazo. Revista Do Colégio Brasileiro de Cirurgiões, vol. 49, 6, p. e20223244, Janeiro 2023. DOI: https://doi.org/10.1590/0100-6991e-20223244.
JIA, X. et al. Achalasia: The Current Clinical Dilemma and Possible Pathogenesis. Journal of neurogastroenterology and motility, vol. 29, 2, 145-155, Abril 2023. DOI: 10.5056/jnm22176
JUNG, H. K. et al. 2019 Seoul Consensus on Esophageal Achalasia Guidelines. Journal of neurogastroenterology and motility, vol. 26, 2, 180-203, Abril 2020. DOI: 10.5056/jnm20014
JUNG, K. W. Chicago Classification ver. 4.0: Diagnosis of Achalasia and Esophagogastric Junction Outflow Obstruction. The Korean journal of gastroenterology, vol. 79, 2, 61-65, Janeiro 2022. DOI: 10.4166/kjg.2022.017
LAURINO-NETO et al. Evaluation of Esophageal Achalasia: From Symptoms to the Chicago Classification. ABCD. Arquivos Brasileiros de Cirurgia Digestiva (São Paulo), vol. 31, n. 2, p. e1376, Julho 2018. DOI: https://doi.org/10.1590/0102-672020180001e1376.
MARTINS, R. K. et al. Peroral (POEM) or Surgical Myotomy For The Treatment of Achalasia: A Systematic Review and Meta-analysis. Arquivos de Gastroenterologia, v. 57, n. 1, p. 79–86, Janeiro-Março 2020. doi.org/10.1590/S0004-2803.202000000-14
MOMODU, I. I.; WALLEN, J. M. Achalasia. StatPearls Publishing, Julho 2023. PMID: 30137800.
NURCZYK, K.; PATTI, M. G. Surgical management of achalasia. Annals of gastroenterological surgery, vol. 4, 4, 343-351. Maio 2020. DOI: 10.1002/ags3.12344
PESCE, M. et al. Modern Achalasia: Diagnosis, Classification, and Treatment. Journal of neurogastroenterology and motility, vol. 29, 4, 419-427, Outubro 2023. DOI: 10.5056/jnm23125
PESCE, M.; SWEIS, R. Advances and caveats in modern achalasia management. Therapeutic advances in chronic disease, vol. 12, 2040622321993437, Março 2021. DOI: 10.1177/2040622321993437
PRADO JUNIOR, F. P. P. et al. Peroral Endoscopic Myotomy for Achalasia: Safety Profile, Complications and Results of 94 Pacientes. ABCD. Arquivos Brasileiros de Cirurgia Digestiva (São Paulo), v. 36, p. e1784, 2023. DOI: https://doi.org/10.1590/0102-672020230066e1784
SLIM, N.; WILLIAMSON, J. M. L. Achalasia: investigation and management. British journal of hospital medicine (London, England), vol. 84, 1, 1-9, Janeiro 2023. DOI: 10.12968/hmed.2022.0437
STAVROPOULOS, S. N. et al. Diagnosis and management of esophageal achalasia. BMJ (Clinical research ed.), vol. 354, i2785. Setembro 2016. DOI: 10.1136/bmj.i2785
SWANSTRON, L. L. Achalasia: treatment, current status and future advances. The Korean journal of internal medicine, vol. 34, 6, 1173-1180, Novembro 2019. DOI: 10.3904/kjim.2018.439
TUSTUMI, F. et al. Management of Symptoms Recurrence After Myotomy for Achalasia. A Pratical Approach. ABCD. Arquivos Brasileiros de Cirurgia Digestiva (São Paulo), v. 36, p. e1780, 2023. DOI: https://doi.org/10.1590/0102-672020230062e1780
