REGISTRO DOI: 10.69849/revistaft/th10247022009
Isabela Cintra Ribeiro
Vitoria Cintra Ribeiro
Américo Fernando de Oliveira Júnior
Isabela Vieira de Araujo
Larissa Monteiro Nunes Ubinha
Giovana Marques Fargiani
Patrícia Mattoso Riomao
Priscila Chaves Reis
INTRODUÇÃO:
O esôfago de Barrett é uma patologia caracterizada pela presença de epitélio colunar metaplásico na porção distal do esôfago, substituindo o epitélio escamoso estratificado normal. Entre os principais fatores de risco para o aparecimento do esôfago de Barrett, destacam-se a doença do refluxo gastroesofágico (DRGE), a idade avançada e o gênero masculino. Além desses, acredita-se que fatores como obesidade central, tabagismo e diabetes mellitus tipo 2 também influenciam seu desenvolvimento (Gómez et al., 2021).
O esôfago de Barrett é geralmente identificado por meio de uma endoscopia digestiva alta, sendo aproximadamente duas a três vezes mais comum em homens do que em mulheres, além de ser raro em negros e asiáticos (Medeiros Filho et al., 2020).
Uma das complicações mais sérias da DRGE é o esôfago de Barrett (EB), que é um importante fator de risco para o adenocarcinoma esofágico (EAC). A incidência de EAC tem aumentado rapidamente na Europa e América do Norte. Cerca de 10% dos pacientes com DRGE desenvolvem EB, com um risco de progressão para EAC entre 0,5% e 7%, dependendo do grau de displasia (Elsheaita et al., 2020).
A vigilância do EB é crucial para a detecção precoce do EAC, melhorando as chances de um tratamento eficaz. A triagem seletiva é recomendada para pacientes com DRGE crônica e fatores de risco específicos. O diagnóstico de EB requer a identificação endoscópica de mucosa salmão e confirmação histopatológica. O protocolo de Seattle, que envolve biópsias direcionadas e aleatórias, é o padrão ouro para triagem e vigilância, apesar de sua complexidade (Elsheaita et al., 2020).
Esta patologia foi descrita pela primeira vez na literatura na década de 1950 pelo médico britânico Norman Barrett, que mencionou um esôfago distal com revestimento colunar não justificado e que o epitélio não atendia às características do epitélio gástrico. Posteriormente, foi reconhecido que se tratava de uma condição adquirida, sendo então denominada esôfago de Barrett (Volkweis et al., 2008).
A relevância desse estudo é presente devido ao aumento da incidência dessa patologia nos últimos anos e à baixa quantidade de estudos disponíveis na literatura em comparação com a importância dessa doença.
METODOLOGIA:
Esta revisão sistemática foi conduzida seguindo as diretrizes do protocolo PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses). Os critérios de inclusão definidos foram: artigos publicados nos últimos cinco anos, nos idiomas português, inglês e espanhol; artigos gratuitos e disponíveis na íntegra, indexados nas bases de dados MEDLINE/PubMed, Scielo, LILACS e Cochrane. Utilizou-se exclusivamente o descritor DeCS/MeSH “Esôfago de Barrett”.
Inicialmente, foram identificados 194 artigos. Os títulos e resumos desses artigos foram revisados, e excluídos aqueles cujo tema principal não era pertinente ao descritor DeCS/MeSH escolhido, que focavam em outras doenças esofágicas, ou que abordavam intervenções, populações ou contextos não relevantes, além daqueles que não apresentavam resultados primários significativos para o tema.
Artigos sem resumo foram separados para leitura integral subsequente. Após a seleção inicial, 42 artigos foram separados para leitura completa. Artigos duplicados e aqueles não encontrados na íntegra foram excluídos (n=1). Após leitura integral dos 41 artigos, foram excluídos 22, restando apenas 19 estudos que foram incluídos na revisão.
Os resultados foram organizados em seções para facilitar a compreensão, abrangendo tópicos como epidemiologia, fatores de risco, fisiopatologia, diagnóstico, diagnóstico diferencial e tratamento.
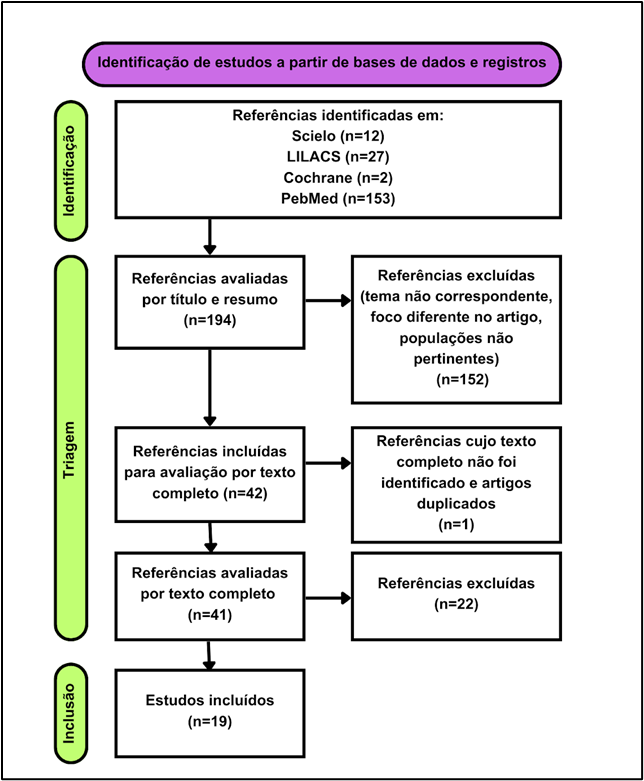
Fluxograma 1: Fluxo de identificação e seleção dos artigos
DISCUSSÃO:
EPIDEMIOLOGIA
O esôfago de Barrett (EB) é uma condição patológica adquirida, resultante de uma resposta adaptativa ao dano crônico causado pelo refluxo gastroesofágico, caracterizada pela presença de epitélio colunar metaplásico na porção distal do esôfago, essa transformação epitelial é uma resposta adaptativa ao dano crônico causado por refluxo gastroesofágico, que expõe a mucosa esofágica ao ácido gástrico à bile (Cook &Thrift, 2021; Kamboj et al., 2021).
A epidemiologia do esôfago de Barrett (EB) tem sido objeto de intensa investigação devido ao seu papel como condição precursora do adenocarcinoma esofágico. Sua prevalência do EB varia amplamente entre diferentes populações e regiões geográficas. Segundo estudos recentes, estima-se que a prevalência global em indivíduos submetidos à endoscopia é de aproximadamente 1-2%, no entanto, pode ser subestimada, uma vez que muitos casos permanecem não diagnosticados, especialmente em indivíduos assintomáticos ou com sintomas leves de refluxo gastroesofágico (Esteban et al., 2020; Tan et al., 2021).
O esôfago de Barrett é geralmente identificado por meio de uma endoscopia digestiva alta, sendo aproximadamente duas a três vezes mais comum em homens do que em mulheres, além de ser raro em negros e asiáticos (Oliva Cosme et al., 2022).
Sua incidência está aumentando rapidamente na Europa e América do Norte. Cerca de 10% dos pacientes com DRGE desenvolvem EB, com um risco de progressão para EAC entre 0,5% e 7%, dependendo do grau de displasia. A vigilância do EB é crucial para a detecção precoce do EAC, melhorando as chances de um tratamento eficaz. A triagem seletiva é recomendada para pacientes com DRGE crônica e fatores de risco específicos (Oliva Cosme et al., 2022).
FATORES DE RISCO
A identificação dos fatores de risco é fundamental para a implementação de estratégias eficazes de prevenção e diagnóstico precoce. Estudos epidemiológicos indicam que o refluxo gastroesofágico crônico, caracterizado por episódios frequentes e prolongados de refluxo ácido, promove a metaplasia intestinal no epitélio esofágico e por isso é um dos principais fatores predisponentes para o desenvolvimento do EB, aumentando significativamente o risco de progressão para adenocarcinoma esofágico (Medeiros Filho et al., 2020).
Além disso, a obesidade, especialmente a obesidade central que aumenta a pressão intra-abdominal e exacerba o refluxo, o tabagismo, que prejudica a função do esfíncter esofágico inferior e retarda o esvaziamento gástrico, a presença de uma hérnia de hiato, que facilita o refluxo de conteúdo gástrico para o esôfago, a dieta rica em gorduras e a ingestão de bebidas alcoólicas e cafeinadas, influência de fatores genéticos e ambientais agravam os sintomas da DRGE e, consequentemente, aumentam o risco de desenvolvimento do esôfago de Barrett (Cook &Thrift, 2021; Kamboj et al., 2021).
QUADRO CLÍNICO
A clínica do esôfago de Barrett envolve diversos sintomas e manifestações que podem variar de acordo com a gravidade da condição e a presença de complicações. Pacientes frequentemente apresentam sintomas de refluxo gastroesofágico, como azia e regurgitação ácida, que podem ser persistentes e difíceis de tratar com medicação convencional. Além disso, a dor torácica e a disfagia são sintomas comuns, resultantes da inflamação crônica e possíveis ulcerações no esôfago (Medeiros Filho et al., 2020).
Em casos mais avançados, onde há progressão para displasia ou adenocarcinoma esofágico, os pacientes podem experimentar perda de peso inexplicada, anemia e sinais de obstrução esofágica, refletindo um agravamento do quadro clínico. Adicionalmente, sintomas como disfagia e dor torácica podem sugerir complicações mais graves, como úlceras ou estenoses esofágicas, necessitando de avaliação imediata (Eusebi et al., 2021).
Pacientes com EB podem ser assintomáticos ou apresentar sintomas típicos de DRGE, como pirose e regurgitação ácida, acabando assim por descobrir sua condição incidentalmente durante endoscopias realizadas por outras indicações (Medeiros Filho et al., 2020).
DIAGNÓSTICO:
O diagnóstico do EB se baseia principalmente na endoscopia digestiva alta (EDA) e na biópsia, sendo diagnosticado principalmente em adultos de meia-idade e idosos, com uma média de idade de 55 anos no momento do diagnóstico (Alves et al., 2020; Medeiros Filho et al., 2020).
Para que seja feito o diagnóstico, devem se seguir critérios que são: o revestimento de epitélio colunar estar ≥1 cm no esôfago distal e ao exame histológico da biópsia, deve revelar metaplasia do epitélio colunar para células caliciformes. O surgimento de técnicas alternativas à EDA tradicional pode aprimorar a detecção de EB, devido à boa aceitação dos pacientes com as técnicas (Medeiros Filho et al., 2020).
O uso de biópsias guiadas por cromo endoscopia eletrônica gera grande redução no número de biópsias necessárias para alcançar as melhores taxas de identificação histológica do EB (Alves et al., 2020).
RASTREAMENTO:
Até o momento, não existem evidências nível 1 no que tange a efetividade do rastreio e validade da terapia endoscópica na prevenção da progressão para adenocarcinoma esofágico em ensaios clínicos randomizados. Diretrizes atuais das sociedades sugerem que o rastreamento do esôfago de Barrett seja iniciado em pacientes que possuam refluxo crônico e outros fatores de risco, como idade superior a 50 anos, paciente do sexo masculino, tabagismo, obesidade central e histórico familiar de adenocarcinoma esofágico ou esôfago de Barrett (Medeiros Filho et al., 2020).
FISIOPATOLOGIA:
Nos pacientes com esôfago de Barrett, é extremamente aceito que a patogênese inclui o dano crônico pela doença do refluxo gastroesofágico (DGRE) na mucosa escamosa esofágica que então, é substituída por uma mucosa colunar metaplásica contendo células epiteliais com características gástricas e intestinais (QUE et al., 2019). O esôfago de Barrett é considerado uma lesão pré neoplásica, que por conter uma alta heterogeneidade clonal e carga mutacional acentuada predispõe a displasia epitelial e a formação do adenocarcinoma esofágico (Maslenkina et al., 2023).
O desenvolvimento de esôfago de Barrett pode ser explicado por duas grandes hipóteses: a partir do mecanismo de cura de uma lesão cáustica e através da mudança fenotípica no contexto de uma chamada tempestade de citocinas (Maslenkina et al., 2023). Esses processos levariam a reativação das vias de sinalização centrais para o desenvolvimento do epitélio esofágico colunar embrionário (Beydoun et al., 2023).
Esses mecanismos não são necessariamente exclusivos e, portanto, podem ser mútuos, levando à reprogramação de células tronco e mudanças na arquitetura da mucosa esofágica, causando uma mudança no tipo epitelial local e a criação de um microambiente inflamatório no tecido (Maslenkina et al., 2023).
A mudança do pH no segmento distal esofágico, causado pelo refluxo ácido, permite que os sais biliares fiquem solúveis e sejam capazes de entrarem nas células epiteliais, o que provoca uma cascata de sinalização intracelular, resultando em lesões nas organelas, como na membrana mitocondrial, ocasionando uma geração sem controle de espécies reativas de oxigênio, estresse oxidativo e danos ao DNA. Além disso, os ácidos biliares provocam a produção e o aumento de citocinas pró inflamatórias, o que previne apoptose e aumenta a proliferação de células epiteliais (Maslenkina et al., 2023).
O refluxo é a principal causa da lesão do epitélio escamoso do esôfago e a causa de esofagite erosiva, que frequentemente leva à ulceração esofágica, geralmente delimitada proximalmente por escamosa e distalmente pelo epitélio gástrico (Que et al., 2019).
Esse dano é reparado a partir de um tecido de granulação que protege tecidos profundos e é coberto por um epitélio reparador não funcional. Essa área, então, é cercada a partir de um crescimento lateral de criptas/glandulares e células progenitoras até que esse epitélio seja restaurado e volte a sua funcionalidade. Após a proliferação de células progenitoras no epitélio escamoso e da primeira glândula secretora de ácido clorídrico nas margens da úlcera, elas se espalham e sofrem evolução clonal, que contribui para formação de outros fenótipos das glândulas no esôfago de Barrett (Que et al., 2019).
Caso haja um refluxo contínuo, como no caso da presença de DGRE, as células progenitoras irão dominar sobre o tecido escamoso original, o que causará a reepitelização do esôfago escamoso ulcerado (Maslenkina et al., 2023). Além de provavelmente sofrer uma reprogramação celular, que origina um revestimento celular anormal (Que et al., 2019).
A segunda hipótese diz respeito à tempestade citocinas e um microambiente pró-inflamatório, que relaciona o aparecimento de úlceras mediadas por citocinas e não pelo refluxo e o mecanismo de reparação de lesão cáustica. A exposição ao ácido biliar e o ambiente com um pH reduzido aumenta as espécies reativas de oxigênio, que após um processo de sinalização celular, eleva a expressão de citocinas e leva a um estado de inflamação persistente que induz o desenvolvimento de metaplasia intestinal originando o esôfago de Barrett (Maslenkina et al., 2023).
A metaplasia celular pode ser explicada por dois fenômenos: a transdiferenciação e transcomprometimento. O primeiro refere-se a um processo que ocorre com células esofágicas maduras que são reprogramadas e adquirem capacidades semelhantes à de células progenitoras e, posteriormente, são transformadas em células colunares diferenciadas, ou seja, metaplásicas, com maior resistência ao refluxo ácido. A transdiferenciação ocorre por um mecanismo principal, a palingênese, em que a célula madura reentra no ciclo celular para reparar tecido lesionado ou se transdiferenciando para outro possivelmente mais resistente à agressão do ambiente em que se encontra. Esse processo por poder ser repetido frequentemente frente a uma lesão crônica, porém, células que já sofreram mutação, ao serem re-diferenciadas, podem levar à expansão clonal e à carcinogênese. O segundo refere-se a um mecanismo em que uma célula progenitora tem sua diferenciação alterada para uma célula não originalmente programada, mas mais adaptada ao novo ambiente hostil causado pelo refluxo ácido. No esôfago de Barrett, o transcomprometimento explicaria a persistência da doença mesmo após o controle da DGRE. As possíveis células progenitoras envolvidas nesse processo são as nativas do próprio esôfago, do estômago proximal, células da junção esofagogástrica e células progenitoras da medula óssea transportadas pelo sangue (Que et al., 2019).
Sendo assim, esse processo multifatorial e de diversas etapas de desenvolvimento do esôfago de Barrett está em constante progressão e por isso é considerado um fator de risco para o desenvolvimento de displasias e câncer esofágico. É importante ressaltar, que embora essa seja a história natural da doença, é certo que pacientes com EB têm dez vezes mais chances de morrer de outras causas do que câncer esofágico. Porém esse fato não dispensa a necessidade de tratamento e vigilância do esôfago de Barrett (Maitra et al., 2022).
TRATAMENTO:
Acredita-se que o esôfago de Barrett tenha uma progressão natural determinada por diferentes estágios: primeiro, esôfago de Barrett não displásico, seguido por uma displasia de baixo grau, alto grau e câncer. O tratamento, portanto, irá depender da etapa em que se encontra a doença (Han et al., 2022).
Para pacientes que não possuem evidências de displasia tecidual é recomendado a supressão ácida com inibidores de bomba de prótons para controle de sintomas, sendo que o uso prolongado, entre 2 e 3 anos, tem resultados melhores (Han et al., 2022).
Para a displasia de baixo grau deve ser considerada a ressecção endoscópica. Porém também tem sido estudada a utilização a ablação por radiofrequência endoscópica (Maitra et al., 2022).
Pacientes que possuem uma displasia de alto grau são recomendados a fazer ressecção endoscópica da mucosa seguido por uma ablação por radiofrequência da área, porém se o paciente se negar a esse tratamento, há possibilidade da vigilância a cada três meses para análise da progressão da doença (Han et al., 2022). O tratamento era feito apenas com cirurgia, porém, atualmente, a esofagetotectemia é sugerido para pacientes com invasão da submucosa, carcinoma multifocal ou que não conseguem ser controladas apenas com o tratamento endoscópico (Maitra et al., 2022).
O manejo pós-tratamento deve ser feito com inibidores de bomba de prótons em alta dose e uma supressão de ácido por duas semanas para cicatrização do tecido, além de uma dieta normal, mas apropriada, de acordo com os sintomas pós-endoscópicos do paciente (Nieuwenhuis et al., 2021).
CONCLUSÃO:
O esôfago de Barrett (EB) é uma condição adquirida que surge como uma resposta adaptativa ao dano crônico causado pelo refluxo gastroesofágico, caracterizada pela presença de epitélio colunar metaplásico na porção distal do esôfago. Sua importância epidemiológica está associada ao risco aumentado de desenvolver adenocarcinoma esofágico.
A identificação dos fatores de risco, como refluxo gastroesofágico crônico, obesidade, tabagismo e hérnia de hiato, é crucial para a implementação de estratégias de prevenção e diagnóstico precoce. A patogênese do EB envolve danos causados pelo refluxo ácido associado ao DRGE, que levam à metaplasia intestinal e alterações celulares que aumentam o risco de adenocarcinoma, a caracterizando como lesão pré-neoplásica.
O diagnóstico é baseado na endoscopia e biópsia, e a vigilância endoscópica é recomendada para a detecção precoce de displasia e câncer. O tratamento varia conforme o estágio da doença, desde o uso de inibidores de bomba de prótons para controle de sintomas até intervenções endoscópicas e cirúrgicas para casos mais avançados. O manejo eficaz do EB requer um monitoramento contínuo e uma abordagem terapêutica adaptada ao grau de progressão da doença, com o objetivo de prevenir a evolução para câncer esofágico.
REFERÊNCIAS:
- VOLKWEIS, B. S.; RICHARD, V.; GURSKI, R. Esôfago de Barrett 114 Artigo de Revisão ESÔFAGO DE BARRETT: ASPECTOS FISIOPATOLÓGICOS E MOLECULARES DA SEQÜÊNCIA METAPLASIA-DISPLASIA-ADENOCARCINOMA -ARTIGO DE REVISÃO BARRETT’S ESOPHAGUS: PHYSIOPATHOLOGICAL AND MOLECULAR ASPECTS OF METAPLASIA-DYSPLASIA-ADENOCARCINOMA SEQUENCE -REVIEW ARTICLE. [s.l: s.n.]. Disponível em: <https://www.scielo.br/j/rcbc/a/49Q6HrvwJ89MmY7wLT5JkJS/?format=pdf&lang=pt>.
- ALVES, J. R. et al. DIAGNOSIS, TREATMENT AND FOLLOW-UP OF BARRETT’S ESOPHAGUS: A SYSTEMATIC REVIEW. Arquivos de Gastroenterologia, v. 57, n. 3, p. 289–295, jul. 2020.
- ARMERENTOS-TORRES et al. El Hybrid-APC en el tratamiento endoscópico del esófago de Barret. AMC vol.25 no.1 Camagüey ene.-feb. 2021 Epub 01-Feb-2021
- BEYDOUN, Ahmed Sam et al. Cancer risk in Barrett’s esophagus: a clinical review. International Journal of Molecular Sciences, v. 24, n. 7, p. 6018, 2023.
- Cook, Michael B, and Aaron P Thrift. “Epidemiology of Barrett’s Esophagus and Esophageal Adenocarcinoma: Implications for Screening and Surveillance.” Gastrointestinal endoscopy clinics of North America vol. 31,1 (2021): 1-26. doi:10.1016/j.giec.2020.08.001
- ELSHEAITA, A. et al. Seattle protocol vs narrow band imaging guided biopsy in screening of Barrett’s esophagus in gastroesophageal reflux disease patients. Medicine, v. 99, n. 8, p. e19261, fev. 2020. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7034706/
- Eusebi, Leonardo H et al. “Systematic review with meta-analysis: risk factors for Barrett’s oesophagus in individuals with gastro-oesophageal reflux symptoms.” Alimentary pharmacology & therapeutics vol. 53,9 (2021): 968-976. doi:10.1111/apt.16321
- GÓMEZ, G. M. Risk factors associated with Barrett’s esophagus in hospitalized patients. Revista de la Facultad de Medicina Humana, v. 21, n. 1, p. 171–183, 12 jan. 2021. DOI: http://dx.doi.org/10.25176/rfmh.v21i1.3119
- Grillo, Federica et al. “Neoplastic and pre-neoplastic lesions of the oesophagus and gastro-oesophageal junction.” Pathologica vol. 112,3 (2020): 138-152. doi:10.32074/1591-951X-164
- HAN, Shiwei; LOW, Donald E. LAPAROSCOPIC ANTIREFLUX SURGERY: ARE OLD QUESTIONS ANSWERED? SHOULD IT BE USED CONJOINED WITH ENDOSCOPIC THERAPY FOR BARRETT’S ESOPHAGUS?. ABCD. Arquivos Brasileiros de Cirurgia Digestiva (São Paulo), v. 35, p. e1664, 2022.
- Kamboj, Amrit K et al. “Endoscopic Screening for Barrett’s Esophagus and Esophageal Adenocarcinoma: Rationale, Candidates, and Challenges.” Gastrointestinal endoscopy clinics of North America vol. 31,1 (2021): 27-41. doi:10.1016/j.giec.2020.08.002
- Maitra, Ishaan et al. “Towards screening Barrett’s oesophagus: current guidelines, imaging modalities and future developments.” Clinical journal of gastroenterology vol. 13,5 (2020): 635-649. doi:10.1007/s12328-020-01135-2
- Marques de Sá, Inês et al. “The global prevalence of Barrett’s esophagus: A systematic review of the published literature.” United European gastroenterology journal vol. 8,9 (2020): 1086-1105. doi:10.1177/2050640620939376
- MARTÍNEZ et al. Tratamento endoscópico del esófago de Barret con displasia de bajo y alto grado. Medicentro Electrónica. Vol. 26 no
- Maslenkina, Ksenia et al. “Signaling Pathways in the Pathogenesis of Barrett’s Esophagus and Esophageal Adenocarcinoma.” International journal of molecular sciences vol. 24,11 9304. 26 May. 2023, doi:10.3390/ijms24119304
- MEDEIROS FILHO et al. ARTIGO DE REVISÃO Esôfago de Barrett: o estado da arte Barrett’s Esophagus: the state of the art. [s.l: s.n.]. Disponível em: <https://www.sbcm.org.br/ojs3/index.php/rsbcm/article/download/764/427>.
- Nieuwenhuis, Esther A et al. “Role of Endoscopic Mucosal Resection and Endoscopic Submucosal Dissection in the Management of Barrett’s Related Neoplasia.” Gastrointestinal endoscopy clinics of North America vol. 31,1 (2021): 171-182. doi:10.1016/j.giec.2020.09.001
- OLIVA COSME, Yordanys et al. Prevalencia del esófago de Barrett y características epidemiológicas de los pacientes. Rev. cuba. med. mil. [S.l.], v. 51, n. 1, p. e4, mar. 2022. Disponível em: <https://pesquisa.bvsalud.org/portal/resource/pt/biblio-1408788>
- Que, Jianwen et al. “Pathogenesis and Cells of Origin of Barrett’s Esophagus.” Gastroenterology vol. 157,2 (2019): 349-364.e1. doi:10.1053/j.gastro.2019.03.072
- Tan, Wei Keith et al. “Progress in Screening for Barrett’s Esophagus: Beyond Standard Upper Endoscopy.” Gastrointestinal endoscopy clinics of North America vol. 31,1 (2021): 43-58. doi:10.1016/j.giec.2020.08.004
- Triggs, Joseph R, and Gary W Falk. “Best Practices in Surveillance for Barrett’s Esophagus.” Gastrointestinal endoscopy clinics of North America vol. 31,1 (2021): 59-75. doi:10.1016/j.giec.2020.08.003
