INVESTIGATION OF HUMAN POLYOMAVIRUS (HPYV) IN OYSTERS (CRASSOSTREA GASAR ADANSON, 1757) COMMERCIALIZED IN THE STATE OF PARÁ, BRAZIL
INVESTIGACIÓN DEL POLIOMAVIRUS HUMANO (HPYV) EN OSTRAS (CRASSOSTREA GASAR ADANSON, 1757) COMERCIALIZADAS EN EL ESTADO DE PARÁ, BRAZIL
REGISTRO DOI: 10.5281/zenodo.12557502
Dorotéa de Fátima Lobato da Silva; Leda Mani França Arruda; Maefnys Leão Alencar Fontes; Ana Paula Cunha Chaves; Dielle Monteiro Teixeira; Fernanda Sagica do Espírito Santo; Bruno Santana Carneiro; Mônica Cristina de Moraes Silva.
RESUMO
Foi realizada detecção genômica e quantificação da carga viral dos poliomavírus JC e BK em amostras de ostreicultura procedentes de fazendas produtoras de ostras, localizadas em cinco municípios do nordeste paraense, a fim de propor o uso dos poliomavírus como possíveis bioindicadores de qualidade sanitária em ostreicultura. Foram analisadas 128 amostras de água e 40 pools de ostras (1 pool = parte mole de 12 ostras) procedentes de cinco fazendas localizadas na mesorregião nordeste paraense. Utilizou-se a técnica da PCR em Tempo Real para detecção e quantificação genômica dos vírus JC e BK. Nenhuma amostra foi positiva para JCV, e o polioma BKV foi detectado em 22,5% dos pools de ostras e 15,6% das amostras de água. Em ostras a carga viral (CV) variou de 5,20 a 157,50 cópias/mL, enquanto na água variou de 1,00 a 132,50 cópias/mL. Os resultados deste estudo mostram que as áreas onde estão implantados os cultivos de ostras encontram-se contaminadas com rede de esgotos, haja vista que o BKV é um vírus específico do homem. Embora o JCV não tenha sido detectado, é provável que outros patógenos de veiculação alimentar estejam presentes nestas áreas. Portanto, é necessário que haja fiscalização sanitária da ostreicultura na região. Apesar de JCV e BKV não serem utilizados como bioindicadores da qualidade higiênico da maricultura, sugerimos que os poliomavírus sejam incluídos neste tipo de avaliação, bem como sua inclusão na legislação ambiental.
PALAVRAS-CHAVE: Poliomavírus. Ostreicultura. Controle Sanitário.
ABSTRACT
Genomic detection and quantification of the viral load of the JC and BK polyomaviruses were carried out in oyster farming samples from oyster farms located in five municipalities in northeastern Pará, to propose the use of polyomaviruses as possible bioindicators of sanitary quality in oyster farming. A total 128 water samples and 40 pools of oysters (1 pool = soft part of 12 oysters) from five farms located in the northeastern mesoregion of Pará were analyzed. The Real Time PCR was used for genomic detection and quantification of JC and BK viruses. No samples were positive for JCV, and the BKV polyoma was detected in 22.5% of oyster pools and 15.6% of water samples. In oysters, the viral load (CV) ranged from 5.20 to 157.50 copies/mL, while in water it ranged from 1.00 to 132.50 copies/mL. The results of this study show that the areas where oyster farms are located are contaminated with the sewage system, given that BKV is a human-specific virus. Although JCV was not detected, other foodborne pathogens are likely present in these areas. Therefore, there is a need for sanitary inspection of oyster farming in the region. Although BKV and JCV are not used as bioindicators of the hygienic quality of mariculture, we suggest that polyomaviruses be included in this type of evaluation, as well as their inclusion in environmental legislation.
KEYWORDS: Polyomavirus. Oyster farming. Health Control.
RESUMEN
La detección genómica y la cuantificación de la carga viral de los poliomavirus JC y BK fueron realizadas en muestras de ostras de granjas ubicadas en cinco municipios del noreste de Pará, con el fin de proponer el uso de poliomavirus como posibles bioindicadores de calidad sanitaria en el cultivo de ostras. Se analizaron 128 muestras de agua y 40 estanques de ostras (1 estanque = parte blanda de 12 ostras) de cinco granjas ubicadas en la mesorregión nororiental de Pará. Se utilizó la técnica Real Time PCR para la detección y cuantificación genómica de los virus JC y BK. Ninguna muestra resultó positiva para JCV y el polioma BKV se detectó en el 22,5 % de las piscinas de ostras y en el 15,6 % de las muestras de agua. En ostras la carga viral (CV) varió de 5,20 a 157,50 copias/mL, mientras que en agua varió de 1,00 a 132,50 copias/mL. Los resultados de este estudio muestran que las áreas donde se encuentran los cultivos de ostras están contaminadas con el sistema de alcantarillado, dado que el BKV es un virus específico del ser humano. Aunque no se detectó el JCV, es probable que haya otros patógenos transmitidos por los alimentos en estas áreas. Por lo tanto, existe la necesidad de una inspección sanitaria del cultivo de ostras en la región. Aunque BKV y JCV no se utilizan como bioindicadores de la calidad higiénica de la maricultura, sugerimos que los poliomavirus se incluyan en este tipo de evaluación, así como su inclusión en la legislación ambiental.
PALABRAS CLAVE: Poliomavirus. Cultivo de ostras. Control de Salud.
1. INTRODUÇÃO
Os poliomavírus BK (BKV) e JC (JCV) são vírus de DNA dupla fita, não envelopados, medindo 45 nm de diâmetros pertencentes à família Polyomaviridae, onde alguns membros que afetam seres humanos estão relacionados à formação de tumores (DECAPRIO et al., 2013). Na população, a soroprevalência desses vírus é elevada com índices superiores a 80% (KHANNA et al., 2009). Acredita-se que a primeira infecção ocorra geralmente na infância com estabelecimento de latência no organismo persistindo até a idade adulta, podendo ser reativado em condições de imunossupressão severa (DOERRIES, 2006).
Devido à forma de excreção viral do organismo humano, na urina e/ou nas fezes, os poliomavírus têm sido considerados agentes bioindicadores de contaminação ambiental, visto que já foram detectados em elevada prevalência e estabilidade em amostras colhidas do meio ambiente, sendo considerados mais resistentes ao tratamento convencional de águas residuais do que os indicadores bacterianos (BOFFIL-MAS et al., 2000; BOFFIL-MAS et al., 2006; FUMIAN et al., 2010; FUMIAN et al., 2013; VIEIRA, 2016).
Determinadas condições de temperaturas, pH e salinidade, podem contribuir para a viabilidade dos poliomavírus em água de esgoto e rios assim como em organismos ali presentes, inclusive moluscos bivalves (MORESCO et al.,2012). Sabe-se que as ostras são organismos filtrantes e armazenadores de microrganismos, metais e biotoxinas presentes no meio hídrico, atuando como fonte de infecção de doenças transmissíveis ao homem.
No estado do Pará, a ostreicultura é uma atividade alternativa para obtenção de alimento e renda para pequenos agricultores de áreas costeiras (HOSHINO, 2009) e vem recebendo incentivos de instituições públicas e privadas dado ao potencial comercial desta prática para a região. Todavia, o aumento na produção e, consequentemente a comercialização e consumo de ostras devem obedecer aos critérios sanitários exigidos para retirada e comercialização (BRASIL, 2012; Agência de Defesa Agropecuária do Estado do Pará – ADEPARÁ, 2017). Apesar das exigências sanitárias, no Pará o processo de fiscalização da cadeia produtiva de ostras ainda não está totalmente implantado, dada às dificuldades de operacionalização por parte de órgãos fiscalizadores e da distância entre áreas de cultivo e os laboratórios responsáveis pelas análises. Este fato, associado ao aumento da comercialização e ao cultivo destes mariscos em águas propícias à contaminação antrópica, podem favorecer a contaminação do homem por patógenos, como os poliomavírus JC e BK, entre outros, sendo os bivalves um veículo eficaz para a transmissão viral (Lees, 2000).
No Brasil, pouco se conhece sobre a circulação dos vírus JC e BK no ambiente e em ostras de comercialização. Assim, este estudo objetivou investigar a presença destes patógenos em fazendas de ostras localizadas na mesorregião nordeste paraense e sua relação com fatores físico-químicos do ambiente. Os resultados irão nortear a adequação das legislações que estabelecem os parâmetros higiênico-sanitários da maricultura, bem como o uso desses vírus como possíveis bioindicadores de qualidade ambiental.
2. MÉTODO
2.1 AMOSTRAGEM
Durante o ano de 2017 e 2018, foram feitas coletas bimestrais (duas período seco e duas período chuvoso) de água e ostras procedentes de cinco fazendas (denominadas de fazenda 1, 2, 3, 4 e 5) localizadas na mesorregião nordeste paraense. De cada fazenda foi comprado um lote de 12 ostras (Crassostrea gasar ADANSON, 1757) e embaladas em sacos plásticos. Quando possível foram comprados mais de um lote. Do mesmo ponto de retirada das ostras, foi coletado um litro (1 L) de água em frasco de polipropileno estéril. Todas as amostras foram acondicionadas em caixa térmica refrigerada (± 4-8°C) para transporte até o laboratório onde procederam as análises. No momento da coleta de água, foram mensurados os valores de pH, temperatura (°C) e salinidade (‰) utilizando um medidor multiparâmetro (HI9828, HANNA®). Importante destacar que na fazenda 3 foram feitas apenas duas coletas (no 1º semestre/2017) ao longo de todo o projeto devido a desativação da ostreicultura.
2.2 PESQUISA DE BKV E JCV EM OSTRAS
Para pesquisa dos vírus BK e JC nas ostras fez-se um pool a partir de um macerado da parte mole de 12 espécimes. O pool foi submetido à etapa de extração do material genético utilizando o método da sílica em coluna por meio de kit comercial BioGene (®Bioclin). Para detecção e quantificação viral utilizou-se a técnica de Reação em Cadeia da Polimerase em Tempo Real quantitativa (RT-qPCR). Para BKV foi utilizado o kit XGEN Master BKV (®X-Gen), e para JCV o kit Bio Gene Research JCV PCR (®Bioclin). Os procedimentos técnicos para preparo das reações e as temperaturas de ciclagem obedeceram às recomendações de cada fabricante. A PCR ocorreu em equipamento QuantStudio 5 Real-Time PCR System (Applied Biosystems™. ®TermoFisher).
2.3 PESQUISA DE BK E JC EM AMOSTRAS DE ÁGUA
A água (1 L) foi submetida a um processo de concentração viral utilizando o método de floculação orgânica com leite desnatado (CALGUA et al., 2008). O concentrado foi submetido à etapa de extração do material genético utilizando o método da sílica em coluna por meio de kit comercial BioGene (®Bioclin). Para detecção e quantificação viral utilizaram-se os mesmos protocolos descritos para as ostras.
2.4 ANÁLISE DOS DADOS
A relação entre parâmetros ambientais e a carga viral foi avaliada através do teste t student, sendo considerado p<0,05. O teste ANOVA foi utilizado para avaliar se houve diferença significativa entre as médias da carga viral e as médias dos fatores ambientais nas amostras de água. Também se utilizou o teste binomial duas proporções de amostras independentes para avaliar os índices de contaminação entre amostras de ostras e de água. Todos os testes estatísticos foram feitos utilizando o software Biostat 5.0® (AnalysSoft).
3. RESULTADOS
3.1 DETECÇÃO DE BKV E JCV
Foram analisados 40 pools de ostras e 128 amostras de água. Entre os pools, nove (22,5%) foram positivos para BKV, detectados em três das cinco fazendas analisadas, e com percentuais elevados, sendo maior nas fazendas 1 (45,4%; 5/11) e 4 (30,0%; 3/10). Quadro 1. Nenhum pool foi positivo para JC.
Quadro 1. Resultados de detecção dos vírus BK e JC em amostras (pools) de ostras e águas procedentes de fazendas da mesorregião nordeste paraense.
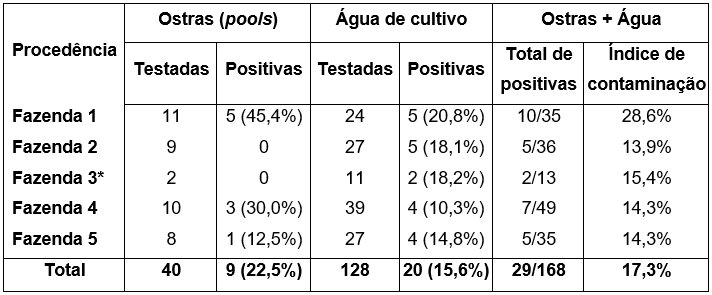
*Foram analisados apenas dois pools de ostras no primeiro semestre de 2017, devido à extinção da ostreicultura.
Fonte: Dados da pesquisa.
Entre as 128 amostras de água, o índice de contaminação foi 15% (n=20), todas positivas para BK. A maior positividade foi na fazenda 1 (20,5%), seguida da fazenda 5 (14,8%). Nenhuma amostra foi positiva para JC. Quadro 1.
Considerando os índices de contaminação em ambos os tipos amostrais simultaneamente, observou-se que BK foi observado em amostras de água de todas as fazendas, com maior positividade na fazenda 1, equivalente a 28,6% (10/35) e menor na fazenda 2. Quadro 1. Não houve diferença estatística nos índices de contaminação entre ambos os tipos amostrais (p = 0,16).
3.2 ANÁLISE DA CARGA VIRAL (CV)
A estimativa da carga viral (CV) de BKV foi dada em número de cópias detectadas/mL. Em amostras de ostras, os maiores valores de CV (cópias/mL) foram observados nas amostras (pools) procedentes da fazenda 4 (CVmín: 16,70; CVmáx: 157,00), seguido da fazenda 1 (CVmín: 6,00; CVmáx: 42,50) e fazenda 5 (CVmín: 6,00; CVmáx: 42,50). Os valores médios de CV e as médias dos valores de temperatura, pH e salinidade foram considerados para avaliar da relação entre essas variáveis, não tendo sido encontrada relação significativa (t = 1,3452; p = 0,22) entre o número de cópias de BKV e os parâmetros físico-químicos analisados. Tabela 1.
Tabela 1. Relação entre as médias de carga viral de ostras contaminadas por BKV e os parâmetros físico-químicos da água.
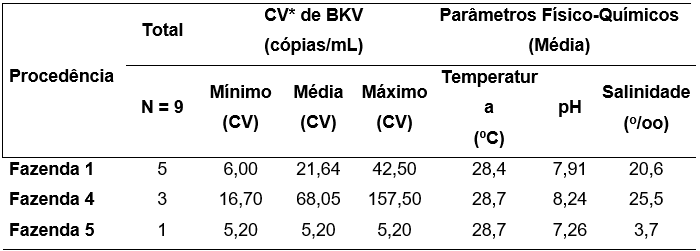
*CV: Carga Viral.
Comparação de Médias CV: t = 1,3452 p = 0,22.
Fonte: Dados da pesquisa.
Quanto à análise quantitativa da carga viral em amostras de água, a maior CV foi observada nas fazendas 1 (CVmín: 15,00; CVmáx: 80,00) e 2 (CVmín: 20,00; CVmáx: 132,00). A menor carga viral ocorreu nas fazendas 3 (CVmín: 1,00; CVmáx: 7,50) e 4 (CVmín: 4,90; CVmáx: 27,60). (Tabela 2). Para análise da relação entre a CV e os parâmetros físico-químicos foram considerados os valores médios dessas variáveis, não tendo sido observada relação significativa (h = 7,6672; p = 0,10). Tabela 2.
Tabela 2. Relação entre as médias de carga viral em amostras de água positivas para BKV e os valores médios dos parâmetros físico-químicos da água.
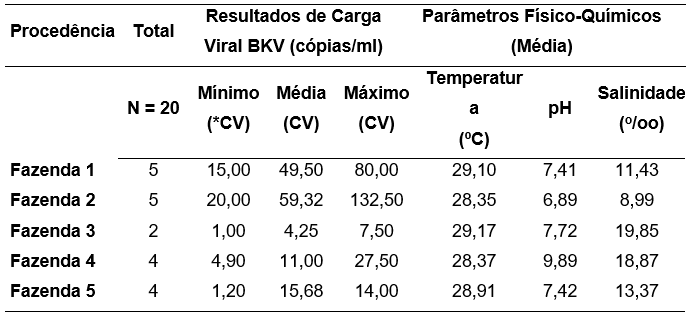
*CV= Carga Viral.
ANOVA CV: h=7,6672; p=0,10.
Fonte: Dados da pesquisa
4. DISCUSSÃO
No Estado do Pará a ostreicultura é feita por pequenos agricultores em áreas distantes dos principais centros urbanos e com uma estrutura precária em termos de saneamento básico, o que torna fundamental a investigação de patógenos de importância em saúde humana na cadeia produtiva das ostras, destinadas a comercialização na região. De acordo com os dados do presente estudo foi observado que 17% (29/168) de amostras das ostreiculturas estavam contaminadas por BKV, o que também sugere a possibilidade de contaminação por outros patógenos de veiculação hídrica alimentar (VHA) haja vista a que não há tratamento adequado dos esgotos em nossa região. De acordo com Costa e Pinheiro (2018), as regiões norte e nordeste têm as piores condições de saneamento do país, portanto considerando esse aspecto, nosso estudo pode revelar uma mostra desta realidade nos pequenos ambientes hídricos em nossa região.
Os dados obtidos mostraram um maior índice de contaminação viral em ostras do que nas águas de cultivo. Pela sua característica filtradora, as ostras tendem a reter e acumular vírus e outras partículas presentes na água (Lees, 2020), o que não foi observado em ostras procedentes de duas fazendas (fazendas 2 e 3) que, apesar da detecção de BKV na água, não foi detectado o genoma viral nos polls analisados. Resultados semelhantes foram encontrados no estudo de Nagarajan et al. (2022) que avaliou a presença de norovírus e adenovírus em ostras e águas de fazendas de Taiwan. Esses autores observaram que mesmo esses vírus estivessem presentes na água, nem sempre eram detectados nas ostras, e vice-versa. Portanto, para avaliação sanitária de ostras de consumo, é necessário avaliar tanto as ostras quanto as águas de cultivo, especialmente em locais onde não há o emprego de processos de depuração de ostras, antes de sua comercialização.
No estado do Pará, até o momento, apenas um estudo foi registrado sobre a pesquisa de poliomavírus BK e JC em ostras de cultivo. Este estudo foi realizado por Abreu et al. (2020) em ostras procedentes das mesmas fazendas aqui estudadas, com o emprego de uma técnica de qPCR “in house”. Os autores detectaram apenas o genoma do JCV, com índice de contaminação de 18,1% nos pools analisados. No presente estudo, BKV foi detectado em 22,5% dos macerados e em 15,6% das amostras de água de cultivo, apesar de JCV não ter sido detectado em nenhuma amostra. Embora Abreu et al. (2020) não tenham investigado BKV e JCV em água de cultivo, os dados acima mostram que ambos os vírus são encontrados no ambiente estuarino amazônico contaminando ostras de consumo e outros bivalves ali presentes. Tal fato é apoiado pelo estudo de Costa et al., 2022, que observaram prevalência de 30,2% e 46,6% de poliomavírus entre indivíduos com e sem doença renal da população paraense, com maior frequência de JCV (77,8%) em relação a BKV (22,2%). É importante destacar que Costa et al. (2022) que BKV e JCV foram detectados em amostras de urina, e que por meio destas excretas estão chegando ao ambiente contaminando os rios da região através do esgoto.
Os poliomavírus parecem se mostrar estáveis em matrizes de esgoto por um bom período de tempo. Boffil-Mas e Girones (2003) conseguiram estimar a estabilidade de JC nestas matrizes. Segundo estes autores são necessários 26,7 dias e 61,5 dias, respectivamente, para degradação de 90% e 99% das partículas virais de JC no esgoto a uma temperatura de ± 20 ºC.
Considerando o clima amazônico e a avaliação dos fatores ambientais no momento da coleta, observou-se que todos os parâmetros estavam dentro dos padrões normais de água salobra segundo os critérios da CONAMA 357 (2005). A temperatura média foi em torno de 29º.C, pH alcalino (7,9) e salinidade variável entre 8,99 e 19,85o/oo, entretanto quando se considera os dados descrito em outras regiões de clima variado (BOFFIL-MAS; GIRONES, 2003), percebe-se que os poliomavírus são adaptáveis nas diferentes condições climáticas, o que é um fator favorável do ponto de vista do estabelecimento de indicadores de qualidade para uso em ostreicultura, soma-se a isso o fato de que os vírus têm sido considerados por alguns pesquisadores bons indicadores de qualidade ambiental quando comparado com as bactérias bioindicadoras, devido eles serem mais persistentes e resistentes a determinados tipos de tratamento ambiental do que as bactérias (BOFFIL-MAS; GIRONES, 2003; BOFFIL-MAS et al., 2006).
Quando se analisa os dados quantitativos de CV, observou-se variação no número de cópias nos diferentes municípios, os valores de CV variaram entre 1,0 e 132,5 cópias/ml em amostras de água e em amostras de ostras as variações ocorreram entre 5,2 a 157,5 cópias/ml (tabelas 1 e 2). Acredita-se que essa variação pode estar relacionada aos índices pluviométricos da região que em determinados períodos são mais intensos, assim como à dinâmica das marés que podem influenciar nos valores das cargas virais.
Uma pesquisa realizada por Boffil-Mas e Girones (2003) encontrou em cinco amostras de mariscos, entre eles ostras, o poliomavírus JC em concentrações de 1 a 10 partículas virais por grama de tecido digestivo e em água de esgoto encontraram BKV em concentração de 101 a 10 partículas virais/ml. Outro estudo realizado por Boffil-Mas et al. (2000) em água de esgotos, sendo que esses autores consideram valores igual ou superior a 102 partículas virais/4ml em amostras ambientais elevados por oferecer risco à saúde humana e ambiental. Os valores máximos obtidos na presente análise estão acima dos valores encontrados nos estudos realizados por Boffil-Mas et al. (2000), portanto tanto a detecção qualitativa quanto os valores quantitativos da carga viral são ferramentas importantes no contexto epidemiológico para avaliação dos índices de contaminação por dejetos humanos capazes de levar à infecção por poliomavírus em uma dada região (CONDEZ et al., 2022). Segundo a OMS 1 a 100 partículas virais podem causar infecção em indivíduos susceptíveis se ocorrerem ingestão ou contato com água contaminada. A detecção e a quantificação da carga viral dos poliomavírus BK em nossa região de clima equatorial sugere a inclusão desses agentes como bioindicadores de qualidade ambiental na legislação vigente por serem resistentes às variações de temperatura como observado no presente estudo e em outros realizados em regiões de clima frio.
5. CONCLUSÃO
A alta frequência de BKV observada neste estudo, tanto nas amostras de ostras quanto nas águas de cultivo, mostra que este poliomavírus está circulando de forma endêmica na população da região e chegando ao ambiente estuarino através de derrame de esgoto na água. Porém, novos estudos são necessários para conhecer o papel das ostras na transmissão de BKV e JCV. Em adição, o estudo mostra a necessidade do estabelecimento da vigilância sanitária da ostreicultura na região, assim como o uso dos poliomavírus como biondicadores da qualidade da produção e sua inclusão na legislação ambiental vigente.
REFERÊNCIAS
- ABREU, I. N. et al. Detection of human polyomavirus 2 (HPyV2) in oyster samples in northern Brazil. Virol J., v. 17, n. 85, p. 1-6, 2020. DOI: 10.1186/s12985-020-01360-8
- ADEPARA, Agência de Defesa Agropecuária do Estado do Pará. Portaria Nº 3036, de 01 de agosto de 2017. Estabelece o Regulamento Técnico de Identidade e Qualidade Higiênico-Sanitária da Produção de Carne de Moluscos Bivalves e Ostras Vivas e dá outras providências. Diário Oficial do Estado do Pará; 2017.
- BOFFIL-MAS, S.; GIRONES, R. Role of the environment in the transmission of JC vírus. J of Neurovirol, v. 9, n. 1, p. 54-58, 2003. DOI:10.1080/13550280390195306
- BOFFIL-MAS, S. et al.. Documenting the epidemiologic patterns of polyomaviruses in human populations by studying their presence in urban sewage. Appl Environ Microbial., v. 66, n. 1, p. 238-245, 2000. DOI: 10.1128/AEM.66.1.238-245.2000
- BOFILL-MAS, S. et al. Quantification and stability of human adenoviruses and polyomavirus JCPyV in wastewater matrices. Appl Environ Microbial., v. 72, n. 12, p. 7894-7896, 2006. DOI: 10.1128/AEM.00965-06
- BRASIL, MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO. Instrução Normativa Interministerial MAPA/MPA nº 7, de 8 de maio de 2012. Institui o Programa Nacional de Controle Higiênico-Sanitário de Moluscos Bivalves (PNCMB), estabelece os procedimentos para a sua execução e dá outras providências. Diário Oficial da União; 2012.
- CALGUA, B. et al. Detection and quantification of classic and emerging viruses by skimmed-milk flocculation and pcr in river water from two geographical areas. Water Res., v. 47, n. 8, p. 2797-2810, 2013. DOI: 10.1016/j.watres.2013.02.043
- CALGUA, B. et al. Development and application of a one-step low cost procedure to concentrate viruses from seawater samples. J Virol Methods, v. 153, n. 2, p. 79-83, 2008. DOI: 10.1016/j.jviromet.2008.08.003
- CONDEZ, A. C. et al. Human Polyomaviruses (HPyV) in wastewater and environmental samples from the Lisbon Metropolitan Area. detection and genetic characterization of viral structural protein-coding sequences. Pathogens, v. 10, n. 10, p. 1309, 2021. DOI: 10.3390/pathogens10101309
- COSTA, R. N. P.; PINHEIRO, E. M. O cenário do saneamento básico no Brasil. 2018. Disponível em: http://www.revistaea.org/artigo.php?idartigo=3523. Acesso: abril/2023.
- COSTA, S. S. V. A. et al. Prevalence of JC and BK Polyomavirus infection in patients with chronic kidney disease in the State of Pará, Brazil. Trop Med Infect Dis., v. 8, n. 1, p. 9, 2022. DOI: 10.3390/tropicalmed8010009.
- DECAPRIO, J.A.; GARCEA, R.L. A cornucopia of human polyomaviruses. Nat Rev Microbiol., v. 11, n. 4, p. 264-276, 2013. DOI: 10.1038/nrmicro2992
- DEL VALLE, L; KHALILI, K. Induction of brain tumors by the archetype strain of human neurotropic JCPyV in a transgenic mouse model. Viruses; v. 13, n. 2, p. 162, 2021. DOI: 10.3390/v13020162
- DOERRIES, K. Human polyomavirus JC and BK persistent infection. In: Ahsan, N. (eds) Polyomaviruses and human diseases. Advances in experimental medicine and biology, v. 577. Springer, New York, NY; 2006. DOI: 10.1007/0-387-32957-9_8
- FUMIAN, T. M. et al. Molecular detection, quantification and characterization of human polyomavirus JC from waste water in Rio de Janeiro, Brazil. J Water Health, v. 8, n. 3, p. 438-445, 2010. DOI: 10.2166/wh.2010.090
- FUMIAN, T. M. et al. Assessment of burden of virus agents in a urban sewage treatment plant in Rio de Janeiro, Brazil. J Water Health, v. 11, n. 1, p. 110-119, 2013. DOI: 10.2166/wh.2012.123
- HOSHINO, P. Avaliação e Comparação de Projetos Comunitários de Ostreicultura Localizados no Nordeste Paraense. Belém. Mestrado. Universidade Federal do Pará, 99 p., Brasil; 2009.
- KHANNA, N. et al. JC virus-specific immune responses in human immunodeficiency virus type 1 patients with progressive multifocal leukoencephalopathy for the Swiss HIV cohort study. J Virol., v. 83, n. 9, p. 4404-4411, 2009. DOI: 10.1128/JVI.02657-08
- LEES, D. Viruses and bivalve shellfish. Int J Food Microbiol., v. 59, n. 1-2, p. 81-116, 2000. DOI: 10.1016/s0168-1605(00)00248-8
- MORESCO, V. et al. Microbiological and physicochemical analysis in coastal waters of southern Brazil. Mar Pollut Bull., v. 64, n. 1, p. 40-48. 2012. DOI: 10.1016/j.marpolbul.2011.10.026
- NAGARAJAN et al. Surveillance of adenovirus and norovirus contaminants in the water and shellfish of major oyster breeding farms and fishing ports in Taiwan. Pathogens, v. 11, n. 3, p. 316, 2022. DOI: 10.3390/pathogens11030316
- RIGOTTO, C. et al. Assessment of adenovirus, hepatitis A virus and rotavirus presence in environmental samples in Florianopolis, South Brazil. J Appl Microbiol., v. 109, n. 6, p. 1979-1987, 2010. DOI: 10.1111/j.1365-2672.2010.04827.x
- VIEIRA, C. B. et al. Viruses surveillance under different season scenarios of the Negro River basin, Amazonia, Brazil. Food Environ. Virol., v. 8, n. 1, p. 57-69, 2016. DOI: 10.1007/s12560-016-9226-8
Autor para contato: Dorotéa de Fátima Lobato da Silva: dorotealobato@iec.gov.br/dorotea.lobato@gmail.com
