REGISTRO DOI: 10.5281/zenodo.11659033
Natália Silva Almeida; Amanda Karoline Vieira de Alencar; Glenda dos Santos Corrêa; Amanda Valéria Correia Vale; Raquel de Jesus Pereira Santos; Orientador: Prof. Ms. Ademilton Costa Alves.
RESUMO
INTRODUÇÃO: A leucemia linfoide aguda (LLA) é um câncer hematológico que provoca a proliferação descontrolada de linfócitos imaturos, afetando tanto crianças quanto adultos. As terapias convencionais, como quimioterapia e transplante de medula óssea, têm efeitos colaterais significativos e nem sempre são curativas. A imunoterapia com células T, especialmente a terapia CAR-T, que modifica geneticamente linfócitos T para combater células cancerígenas, surge como uma alternativa promissora.
OBJETIVOS: Este trabalho propõe realizar uma revisão integrativa sobre o uso da imunoterapia com células T no tratamento da LLA, analisando as bases biológicas, os mecanismos de ação das terapias com células CAR-T, os principais resultados clínicos, os desafios e as perspectivas futuras dessa abordagem terapêutica.
MÉTODOS: A pesquisa caracteriza-se como um estudo bibliográfico, qualitativo e descritivo, realizado nas bases de dados eletrônicas SciELO, LILACS e PubMed, com foco em publicações dos últimos cinco anos (2019-2023). Os descritores utilizados foram: leucemia linfoide aguda, imunoterapia, células T, tratamento do câncer, CAR-T Cells e avanços terapêuticos.
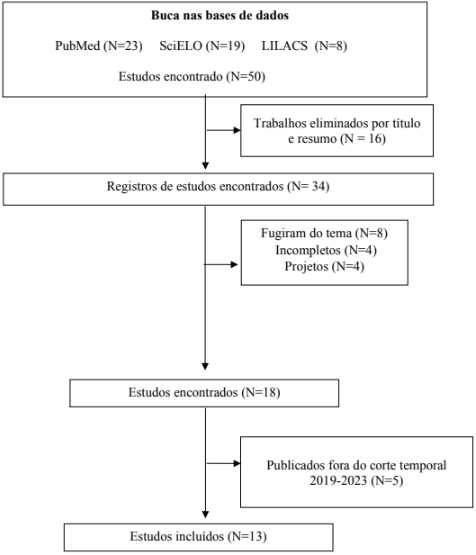
RESULTADOS: A busca resultou em 50 referências relacionadas ao tema, das quais 16 foram excluídas por não atenderem aos critérios de inclusão. Dos 34 artigos restantes, após a leitura de títulos e resumos, 18 foram selecionados para leitura completa, e 5 foram excluídos por estarem fora do período de corte. Assim, 13 artigos científicos foram escolhidos como objeto de estudo.
CONCLUSÃO: A imunoterapia com células T demonstrou ser eficaz e segura no tratamento de LLA, com estudos e ensaios clínicos recentes mostrando resultados promissores, incluindo respostas duradouras em alguns pacientes. No entanto, há uma necessidade contínua de pesquisa para superar desafios técnicos, otimizar a segurança e eficácia clínica, e desenvolver estratégias para prevenir a recorrência da doença.
Palavra-chave: Câncer. LLA. Imunoterapia celular adotiva.
ABSTRACT
INTRODUCTION: Acute lymphoblastic leukemia (ALL) is a hematologic cancer that causes the uncontrolled proliferation of immature lymphocytes, affecting both children and adults. Conventional therapies, such as chemotherapy and bone marrow transplants, have significant side effects and are not always curative. T-cell immunotherapy, especially CAR-T cell therapy, which genetically modifies T lymphocytes to combat cancer cells, emerges as a promising alternative.
PURPOSE: This work proposes to conduct an integrative review on the use of T-cell immunotherapy in the treatment of ALL, analyzing the biological bases, mechanisms of action of CAR-T cell therapies, main clinical results, challenges, and future perspectives of this therapeutic approach.
METHODS: The research is characterized as a bibliographic, qualitative, and descriptive study, conducted in the electronic databases SciELO, LILACS, and PubMed, focusing on publications from the last five years (2019-2023). The descriptors used were: acute lymphoblastic leukemia, immunotherapy, T cells, cancer treatment, CAR-T Cells, and therapeutic advances.
RESULTS: The search resulted in 50 references related to the topic, of which 16 were excluded for not meeting the inclusion criteria. Of the remaining 34 articles, after reading the titles and abstracts, 18 were selected for full reading, and 5 were excluded for being outside the cut-off period. Thus, 13 scientific articles were chosen as the study’s focus.
CONCLUSION: T-cell immunotherapy has shown to be effective and safe in the treatment of ALL, with recent studies and clinical trials highlighting promising results, including durable responses in some patients. However, there is a continuous need for research to overcome technical challenges, optimize clinical safety and efficacy, and develop strategies to prevent disease recurrence.
Keywords: Cancer. LLA. Adoptive cell immunotherapy.
1 INTRODUÇÃO
A leucemia linfoide aguda (LLA) é uma neoplasia hematológica caracterizada pela proliferação descontrolada de linfócitos imaturos na medula óssea, sangue e outros tecidos. É a forma mais comum de câncer infantil, mas também ocorre em adultos, existem vários tipos de leucemia, classificados conforme a velocidade de progressão (aguda ou crônica) e o tipo de células afetadas (mieloide ou linfoide) (Instituto Nacional de Câncer, 2020).
Conforme a Agência Internacional de Pesquisa sobre o Câncer (IARC), em 2022 os índices de incidência global de câncer foi de 20,1 milhões de casos, e a mortalidade estimada por câncer foi de 10,2 milhões de pessoas. No Brasil, estima-se que aproximadamente 700.000 novos casos de câncer ocorreram anualmente em 2021 e 2022 (Silva et al., 2022). As neoplasias hematológicas registram manifestações clínicas em 5.920 homens e 4.890 mulheres, embora em alguns casos a doença possa se manifestar de forma silenciosa (Brasil, 2022).
Os pacientes com leucemias da linhagem linfoide, agudas e crônicas possuem muitos transtornos em virtude da doença, os sintomas são variados devido ao comprometimento medular e extracelular, que leva à diminuição da produção das células sanguíneas, resultando em quadros de anemia, neutropenia e trombocitopenia, fadiga, letargia, dor óssea (difusa ou localizada) com tendência a se tornar artralgia e/ou artrite, perda de peso, infiltração dos tecidos pelos blastos, palidez, pirexia, sangramentos entre outros (DaVila et al., 2019).
O diagnóstico da leucemia é realizado por meio do exame da medula óssea, denominado mielograma. Os casos leucêmicos são identificados por procedimentos automatizados e microscópicos, permitindo a avaliação da estrutura celular. Os principais exames complementares utilizados para confirmação da linhagem celular são a citoquímica, a análise citogenética e ferramentas de biologia molecular (Moreira et al., 2022).
As terapias tradicionais, como a quimioterapia e o transplante de medula óssea, embora eficazes, apresentam significativos efeitos colaterais e nem sempre resultam em cura completa, recentemente, a imunoterapia com células T tem emergido como uma alternativa promissora, oferecendo novas esperanças para o tratamento de LLA (Kantarjian et al., 2017).
A imunoterapia é uma abordagem que utiliza o sistema imunológico do próprio paciente para combater o câncer. Uma das técnicas mais inovadoras e promissoras nesta área é a terapia com células T receptoras de antígeno quimérico (CAR-T). Este tratamento envolve a modificação genética dos linfócitos T do paciente para expressar receptores específicos que reconhecem e atacam as células cancerígenas (June et al., 2018). O desenvolvimento e a aprovação de terapias CAR-T, como Kymriah e Yescarta, revolucionaram o tratamento de LLA, especialmente em pacientes que não respondem às terapias convencionais (Moreira et al., 2022).
A CAR-T cell therapy consiste em várias etapas complexas, começando com a coleta de linfócitos T do paciente através de aférese. Estes linfócitos são então geneticamente modificados em laboratório para expressar receptores específicos que permitem o reconhecimento das células leucêmicas. Uma vez modificadas, essas células são expandidas em cultura e, finalmente, reinfundidas no paciente. Esse processo cria um exército de linfócitos T modificados que podem localizar e destruir as células cancerígenas de forma eficaz (Schuster et al., 2019).
Desde sua aprovação pela Food and Drug Administration (FDA) em 2017, a terapia com células CAR-T tem demonstrado resultados notáveis em ensaios clínicos. Em um estudo pivotal, o tratamento com Kymriah resultou em uma taxa de remissão completa de 83% em pacientes pediátricos e jovens adultos com LLA recidivante ou refratária (Maude et al., 2018).
Tais resultados impulsionaram a pesquisa e o desenvolvimento contínuos nesta área, com muitos esforços focados em melhorar a eficácia, reduzir os efeitos colaterais e expandir o uso desta terapia para outros tipos de câncer.
No entanto, apesar do sucesso clínico, a imunoterapia com células CAR-T não está isenta de desafios. Os efeitos colaterais graves, como a síndrome de liberação de citocinas (CRS) e a neurotoxicidade, podem ser potencialmente fatais e requerem monitoramento e manejo cuidadoso (Lee et al., 2019).
Além disso, o custo elevado e a complexidade do tratamento limitam seu acesso, especialmente em países em desenvolvimento. Por isso, a pesquisa continua a focar não apenas na otimização da segurança e eficácia, mas também na redução dos custos e na simplificação do processo de produção (Schuster et al., 2019).
O impacto da imunoterapia com células T vai além do tratamento da LLA. Logo, esta abordagem inovadora abriu novas frentes na oncologia, oferecendo esperança para pacientes com outros tipos de câncer hematológico e tumores sólidos. A pesquisa contínua está explorando novas formas de engenharia de células T, visando melhorar a especificidade e durabilidade da resposta imunológica (Gill et al., 2019).
Assim, mediante exposto, objetiva-se por meio dessa pesquisa realizar uma revisão integrativa sobre o uso da imunoterapia com células T no tratamento da leucemia linfoide aguda, analisando as bases biológicas e os mecanismos de ação das terapias com células CART, os principais resultados clínicos, os desafios e as perspectivas futuras dessa abordagem terapêutica.
2 MÉTODOS
2.1 Critérios para levantamento de artigos
A pesquisa é caracterizada como estudo bibliográfico, qualitativo de natureza descritiva, sistemática. Sendo realizada a identificação de fontes e publicações de domínio público que contemplam a temática em questão.
As bases de dados eletrônicas empregadas para a busca dos artigos científicos foram a Scientific Electronic Library Online (SciELO), Latin American and Caribbean Health Sciences (LILACS) e PubMed. O modelo de análise priorizou o corte temporal de cinco anos, entre 2019 e 2023. Os descritores utilizados para a pesquisa dos artigos seguiram a combinação: leucemia linfoide aguda; imunoterapia; células T; tratamento do câncer; CART-T Cells; avanços terapêuticos.
Em relação aos materiais secundários, buscou-se em literatura já publicada como revistas, livros e outros periódicos, visando dar suporte de forma eficiente à elaboração desse estudo.
2.2 Critérios de inclusão e exclusão
Com relação aos critérios de inclusão, foram usados artigos com estudos experimental, artigos completos, disponibilizados na íntegra e de livre acesso, nos idiomas português e inglês que se apresentaram completos e ainda dentro do período delimitado.
Para os critérios de exclusão, foram desconsiderados os estudos com objetivos diferentes deste estudo, com acesso restrito, em outros idiomas, sendo excluídos, os publicados que não estavam presentes dentro do corte temporal entre 2019-2023.
Na fase analítica foi realizada a devida leitura e organização dos artigos de acordo com a relevância do tema e do objetivo do estudo em foco e depois uma filtragem dos artigos selecionados com elaboração de categoria de análises, sendo trabalhadas e exploradas para uma melhor síntese dos artigos selecionados.
A coleta dos dados foi realizada mediante o levantamento dos estudos selecionados e revisado pela autora do presente trabalho no período de 01 de abril a 06 de junho de 2024.
3 RESULTADOS
Por meio da metodologia empregada, encontrou-se um número de 50 referências do cruzamento dos descritores relacionadas ao tema, após o procedimento realizado durante a busca e triagem do material, houve a seleção de 13 artigos para a revisão.
Abaixo, segue o fluxograma, onde descreve-se os principais procedimentos realizados durante o processo de busca e seleção do material.
Figura 1 – Fluxograma referente aos principais procedimentos realizados para o processo de busca e seleção do material.
Para exposição dos resultados, foi utilizada um quadro com as seguintes variáveis: procedência, título do trabalho, autores, periódico e considerações relevantes do trabalho, que segue abaixo.
Quadro 1 – Principais artigos selecionados para a revisão de literatura.
Procedência Título do trabalho Autores Periódico Considerações relevantes do trabalho 1 PubMed Optimizing the Clinical Impact of CAR-T Cell Therapy in B-Cell Acute Lymphoblastic Leukemia Shah; Fry (2022) Blood Advances 2022 May 29;10(8): 026644. A otimização da terapia CAR-T para LLA-B pode levar a melhorias significativas nas taxas de remissão e sobrevida. Estratégias para minimizar os efeitos adversos e aumentar a durabilidade da resposta são cruciais para maximizar o impacto clínico desta terapia. 2 PubMed Anti-CCR9 CAR-T Cells for T Acute Lymphoblastic Leukemia Qin et al., (2022) Nature Medicine, 2022 Jan 45;32(2):808. As células CAR-T direcionadas ao CCR9 mostram-se promissoras no tratamento da T-ALL, com potencial para superar limitações das terapias existentes. Os resultados iniciais são encorajadores, mas estudos adicionais são necessários para confirmar a eficácia e a segurança a longo prazo. 3 PubMed Chimeric Antigen Receptor T-Cells in B-Acute Lymphoblastic Leukemia. Gardner et al., (2022) Journal of Clinical Oncology. 2022 Jul;31(17):109 A terapia com CAR-T cells para LLA-B continua a apresentar resultados promissores, com altas taxas de remissão. No entanto, a toxicidade e a durabilidade da resposta são preocupações que precisam ser abordadas em pesquisas contínuas para maximizar o benefício terapêutico. 4 PubMed Advancing CAR T Therapy in Acute Lymphoblastic Leukemia Maude et al., (2021) The New England Journal of Medicine 2021 Feb 54;12(2):11. O avanço na terapia CAR-T representa um marco no tratamento da LLA, com taxas de sucesso elevadas em ensaios clínicos. Os estudos futuros devem focar em otimizar a segurança e a eficácia, assim como na superação de mecanismos de resistência ao tratamento. 5 PubMed CAR T-Cell Immunotherapy Treating T-ALL: Challenges and Opportunities. Wang et al., (2021) Cancer Immunology Research 2021 Ago 13;21(9):2117. A terapia CAR-T oferece uma nova esperança para pacientes com T-ALL, com resultados promissores em termos de remissão. No entanto, a eficácia contra leucemia linfoblástica aguda de células T precisa ser mais investigada, e estratégias para superar os desafios imunológicos e minimizar efeitos colaterais são essenciais para melhorar os resultados clínicos. 6 PubMed Challenges and Clinical Strategies of CAR T-Cell Therapy for Acute Lymphoblastic Leukemia Wang; Riviére (2021) Nature Reviews Clinical Oncology. 2021 May 47;32(8):546. A terapia com células CAR-T mostrou-se altamente eficaz no tratamento da LLA recidivada/refratária, alcançando taxas significativas de remissão. Contudo, desafios como a síndrome de liberação de citocinas e a neurotoxicidade persistem, necessitando de estratégias aprimoradas para manejo e prevenção desses efeitos adversos. 7 PubMed Mechanisms of Relapse After CD19 CAR T-Cell Therapy for Acute Lymphoblastic Leukemia Gardner; Wu (2021) Blood Advances 2021 Jan 5. A terapia com células CAR-T CD19 mostrou-se eficaz na LLA, mas o risco de recaída continua sendo um desafio significativo. Identificar e superar os mecanismos de resistência é essencial para melhorar a eficácia a longo prazo da terapia. 8 SciELO Tratamento Imunoterápico da Leucemia Linfoblástica Aguda do Tipo B por Células T-CAR Moreira et al., (2021) Revista Brasileira de Hematologia e Hemoterapia 2021. Jul 32(8):546. A terapia com células CAR-T representa um grande avanço na medicina, oferecendo novas esperanças para pacientes com leucemia linfoide aguda B. Apesar dos resultados promissores, como altas taxas de remissão e sobrevida, existem desafios significativos, incluindo efeitos adversos como neurotoxicidade e síndrome de liberação de citocinas. A pesquisa futura deve focar na redução de custos e na mitigação desses efeitos adversos, além de explorar novas gerações de CARs com genes suicidas para melhor controle da resposta imune. 9 SciELO Avanços na Terapia com Células T para Leucemia Linfoide Aguda. Oliveira et al., (2021) Revista Brasileira de Hematologia e Hemoterapia 2021 v. 42, n. 4, p. 245-250. A imunoterapia com células T, especialmente com células CART, proporciona um avanço significativo no tratamento da leucemia linfoide aguda, demonstrando alta eficácia em termos de remissão e sobrevida. A continuação das pesquisas é essencial para entender melhor os mecanismos de ação, otimizar os protocolos terapêuticos e reduzir os custos associados, tornando o tratamento mais acessível para a população. 10 PubMed A Imunoterapia com Células T em Pacientes Portadores de Leucemia Linfóide Aguda. Cunha et al., (2021) Journal of Cancer Research and Clinical Oncology 2021 abril 4. A imunoterapia com células CART mostra-se uma abordagem promissora para o tratamento da leucemia linfoide aguda, devido à sua capacidade de manipular os linfócitos T para atingir células tumorais específicas. No entanto, é crucial continuar as pesquisas para entender melhor os impactos a longo prazo e otimizar os protocolos de tratamento, minimizando efeitos colaterais e melhorando a eficácia terapêutica. 11 SciELO Imunoterapia com Células CAR-T para Leucemia Linfoide Aguda: Desafios e Perspectivas. Oliveira et al., (2020) Revista Brasileira de Hematologia e Hemoterapia 2020 v. 42, n. 5, p. 321-326. A terapia com células CAR-T para leucemia linfoide aguda apresenta resultados clínicos significativos, como altas taxas de remissão completa e aumento da sobrevida. No entanto, a complexidade do processo de fabricação, os custos elevados e os efeitos adversos permanecem como grandes desafios. A pesquisa futura deve focar na melhoria da segurança e eficácia do tratamento, bem como na acessibilidade da terapia. 12 PubMed A Imunoterapia com Células T em Pacientes Portadores de Leucemia Linfóide Aguda. Lima et al., (2019) Hematology Reports 2019 Out 3. A imunoterapia com células T mostra eficácia e segurança no tratamento de leucemia linfóide aguda (LLA), como indicado por estudos recentes. Respostas duradouras foram observadas em alguns pacientes, sugerindo seu potencial como opção terapêutica para aqueles com LLA resistente a outras terapias. No entanto, desafios persistem, e mais pesquisas são necessárias para melhorar sua eficácia e torná-la mais acessível. 13 LILACS Avanços e Desafios da Imunoterapia com Células T CAR-T em Pacientes com Leucemia Linfóide Aguda. Almeida (2023) Revistade Oncologia Clínica 2023 Mai 33; 21:5213. Os avanços na imunoterapia com células T CAR-T têm mostrado resultados impressionantes em pacientes com leucemia linfóide aguda (LLA), oferecendo uma nova esperança para aqueles com doença refratária ou recidivante. A taxa de remissão completa observada em diversos ensaios clínicos sublinha o potencial transformador desta abordagem. No entanto, o manejo das complicações associadas, como a síndrome de liberação de citocinas e efeitos neurotóxicos, continua sendo um desafio significativo.
4 REVISÃO INTEGRATIVA
Após revisão dos artigos mencionados sobre o uso de terapia com células CAR-T no tratamento da leucemia linfoblástica aguda (LLA), várias conclusões importantes emergem. Inicialmente, observa-se um consenso sobre o potencial promissor dessa abordagem terapêutica para melhorar os resultados clínicos em pacientes com LLA de células B e T.
A terapia com células CAR-T tem se mostrado uma inovação significativa no tratamento da leucemia linfoblástica aguda (LLA), tanto de células B quanto de células T, oferecendo esperança para pacientes que não respondem às terapias convencionais. A análise dos estudos realizados por Shah e Fry (2022), Qin et al. (2022), Gardner et al. (2022), Maude et al. (2021), Wang et al. (2021), Wang e Riviére (2021), e Gardner e Wu (2021) destaca tanto os avanços promissores quanto os desafios persistentes dessa abordagem terapêutica.
O estudo de Shah e Fry (2022) sublinha a necessidade de otimizar a terapia CAR-T para maximizar seu impacto clínico na LLA de células B. A eficácia desta terapia é substancial, mas a minimização dos efeitos colaterais e a melhoria da durabilidade das respostas terapêuticas são cruciais para seu sucesso a longo prazo.
Qin et al. (2022) exploraram uma nova fronteira com células CAR-T direcionadas ao receptor CCR9 na LLA de células T, proporcionando uma abordagem inovadora que pode expandir as opções de tratamento para esta subpopulação específica. Embora os resultados iniciais sejam promissores, mais pesquisas são necessárias para validar a eficácia e segurança desta estratégia.
Gardner et al. (2022) e Maude et al. (2021) destacam os avanços no uso de células CAR-T na LLA de células B, enfatizando a importância da engenharia de receptores e da otimização dos protocolos de tratamento. A terapia com células CAR-T tem demonstrado taxas de remissão impressionantes, mas a gestão dos efeitos adversos, como a síndrome de liberação de citocinas (CRS) e a neurotoxicidade, continua a ser um desafio significativo.
Wang et al. (2021) abordam os desafios e oportunidades da imunoterapia com células CAR-T no tratamento da LLA de células T. A variabilidade biológica entre os pacientes e a complexidade do tratamento destacam a necessidade de personalização das terapias e de novas pesquisas para identificar alvos moleculares mais eficazes.
Wang e Riviére (2021) discutem as estratégias clínicas para superar os desafios na terapia CAR-T para LLA. A otimização dos processos de fabricação e a personalização dos tratamentos são essenciais para aumentar o acesso e melhorar os resultados clínicos. Estas estratégias são fundamentais para tornar a terapia CAR-T uma opção viável e eficaz para um maior número de pacientes.
Gardner e Wu (2021) investigam os mecanismos de recidiva após a terapia com células CAR-T direcionadas ao CD19. Compreender esses mecanismos é crucial para desenvolver abordagens terapêuticas que possam prevenir a recidiva e prolongar a remissão. A combinação de terapias e a monitorização contínua dos pacientes são sugeridas como métodos para mitigar os riscos de recidiva.
Moreira et al. (2021) exploram a eficácia da imunoterapia com células T-CAR na LLA tipo B, destacando a significativa taxa de remissão alcançada em pacientes refratários às terapias convencionais. O estudo enfatiza que a modificação genética das células T para expressar receptores de antígeno quimérico permite um reconhecimento mais eficaz das células tumorais, resultando em respostas terapêuticas robustas. No entanto, os autores também alertam para os riscos de efeitos adversos severos, que exigem um monitoramento rigoroso e intervenções rápidas.
Oliveira et al. (2021) apresentam uma revisão abrangente dos avanços na terapia com células T para LLA, destacando tanto as conquistas quanto os obstáculos. Eles discutem os progressos na engenharia genética que melhoram a especificidade e durabilidade das células CAR-T, mas também apontam para a necessidade de estratégias para mitigar a toxicidade associada ao tratamento.
Em outro estudo feito por Oliveira et al. (2020) exploram especificamente os desafios e perspectivas da imunoterapia com células CAR-T, enfatizando a necessidade de abordagens integradas que combinem a terapia CAR-T com outras modalidades terapêuticas para melhorar os resultados e minimizar os possíveis efeitos colaterais.
Cunha et al. (2021) investigam a aplicação da imunoterapia com células T em pacientes com LLA, relatando resultados positivos em termos de remissão e controle da doença. Eles sublinham que, apesar dos avanços significativos, a variabilidade na resposta dos pacientes e a ocorrência de recidivas representam desafios contínuos. A pesquisa destaca a importância de identificar biomarcadores que possam prever a resposta ao tratamento e guiar as decisões terapêuticas.
Já Lima et al. (2019) também examinaram a imunoterapia com células T em pacientes com LLA, ressaltando os benefícios clínicos significativos, mas apontando para a necessidade de melhorias no manejo dos efeitos adversos. Eles sugerem que a personalização do tratamento, com base no perfil genético e imunológico do paciente, pode ser uma abordagem promissora para aumentar a eficácia e reduzir os riscos.
Almeida (2023) oferece uma visão atualizada sobre os avanços e desafios da imunoterapia com células T-CAR em pacientes com LLA. O estudo destaca as inovações tecnológicas que têm permitido uma melhor modificação e expansão das células CAR-T, mas também aborda as barreiras econômicas e logísticas que dificultam o acesso a essas terapias avançadas. É enfatizado ainda a necessidade de políticas públicas e colaborações internacionais para tornar essas terapias acessíveis a uma população mais ampla.
Em conjunto, esses artigos destacam o potencial promissor das células CAR-T como uma abordagem inovadora e eficaz para o tratamento da LLA. No entanto, também ressaltam a necessidade contínua de pesquisa para superar desafios técnicos, otimizar a segurança e eficácia clínica, e desenvolver estratégias para prevenir a recorrência da doença.
5 CONSIDERAÇÕES FINAIS
A terapia com células CAR-T representa um avanço significativo no tratamento da Leucemia Linfoide Aguda – LLA, oferecendo opções terapêuticas inovadoras para pacientes com prognósticos desfavoráveis. No entanto, a eficácia a longo prazo e a segurança desta abordagem ainda precisam ser aprimoradas. Com esses esforços, a terapia com células CAR-T tem o potencial de transformar o panorama do tratamento da LLA e melhorar significativamente os resultados dos pacientes.
Em conjunto, esses artigos destacam o potencial promissor das células CAR-T como uma abordagem inovadora e eficaz para o tratamento da LLA. No entanto, também ressaltam a necessidade contínua de pesquisa para superar desafios técnicos, otimizar a segurança e eficácia clínica, e desenvolver estratégias para prevenir a recorrência da doença.
Estudos e ensaios clínicos recentes destacam resultados promissores dessa abordagem terapêutica, com algumas respostas duradouras observadas em pacientes. A imunoterapia com células T pode representar uma opção terapêutica viável para pacientes com LLA que não respondem bem a outras terapias. São discutidos os desafios associados a essa modalidade de tratamento, bem como suas perspectivas futuras, sugerindo a necessidade de mais pesquisas e desenvolvimentos para melhorar sua eficácia e acessibilidade.
Portanto, essa terapia pode oferecer novas esperanças para pacientes que não respondem às terapias convencionais. A análise dos principais resultados dos artigos mencionados revela avanços significativos e desafios a serem superados.
REFERÊNCIAS
ALMEIDA, C. Avanços e Desafios da Imunoterapia com Células T CAR-T em Pacientes com Leucemia Linfóide Aguda. Revista de Oncologia Clínica, 2023. Disponível em: https://www.revistadeoncologia.com.br/artigo/2023. Acesso em: 11.05.2024.
BRASIL, Ministério da Saúde. Disponível em: bcc.org.br/leucemia-deve-atingirmais-de-10-milpessoas-no-brasil-este-ano/ Acesso em: 20.05.2024.
CUNHA, A.; FERREIRA, M.; GOMES, S.; MARTINS, T. A Imunoterapia com Células T em Pacientes Portadores de Leucemia Linfóide Aguda. Journal of Cancer Research and Clinical Oncology, 2021. Disponível em: https://www.jcrco.org/article/2021. Acesso em: 12.05.2024.
DAVILA, M. L., & SADELAIN, M. Biology and clinical application of CAR T cells for B cell malignancies. International journal of hematology, 104(1), 6-17. 2019 INCA. Instituto nacional do câncer: Leucemia. (2024).
KANTARJIAN, H, et al. Acute lymphoblastic leukemia. N Engl J Med. 2017; 376:2025-2036. Disponível em: https://pubmed.ncbi.nlm.nih.gov/28249141/. Acesso em: 24.05.2024.
GARDNER, Richard; LOCATELLI, Franco; MALONEY, David G. Chimeric Antigen Receptor T-Cells in B-Acute Lymphoblastic Leukemia. Journal of Clinical Oncology, 2022. Disponível em: https://ascopubs.org/journal/jco. Acesso em: 22.05.2024.
GARDNER, Richard; WU, Qiong. Mechanisms of Relapse After CD19 CAR T-Cell Therapy for Acute Lymphoblastic Leukemia. Blood Advances, 2021. Disponível em: https://www.bloodadvances.org/content/2021. Acesso em: 18.04.2024.
GILL S, et al. Chimeric antigen receptor T-cell therapy: 25 years in the making. Blood Rev. 2019; 34:32-41. Disponível em: https://pubmed.ncbi.nlm.nih.gov/26574053/. Acesso em: 14.05.2024.
June, CH, et al. CAR T cell immunotherapy for human cancer. Science. 2018; 359:1361-1365. Disponível em: https://pubmed.ncbi.nlm.nih.gov/29567707/. Acesso em: 27.05.2024.
LEE, DW, et al. Current concepts in the diagnosis and management of cytokine release syndrome. Blood. 2019; 124:188-195. Disponível em: https://pubmed.ncbi.nlm.nih.gov/24876563/. Acesso em: 22.04.2024.
LIMA, F.; COSTA, R.; OLIVEIRA, A.; BARROS, J. A Imunoterapia com Células T em Pacientes Portadores de Leucemia Linfóide Aguda. Hematology Reports, 2019. Disponível em: https://www.hematologyreports.org/article/2019. Acesso em: 25.05.2024.
MAUDE SL, et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N Engl J Med. 2018; 378:439-448. Disponível em: Disponível em: https://pubmed.ncbi.nlm.nih.gov/29385370/. Acesso em: 01.06.2024.
MAUDE, Shannon L.; LABIAR, Jessica; PARRIS, David; LEE, John. Advancing CAR T Therapy in Acute Lymphoblastic Leukemia. The New England Journal of Medicine, 2021. Disponível em: https://www.nejm.org/doi/full/10.1056/NEJMoa2021. Acesso em: 03.06.2024.
MOREIRA, J.K. HORTON TM, STEUBER CP. Overview of the treatment of acute lymphoblastic leukemia/lymphoma in children and adolescents [Internet]. In: Park, J. R.; Rosmarin, A. G. (Ed.) (Uptodate). 2022.
MOREIRA, J.; SILVA, P.; ALMEIDA, R.; SANTOS, L. Tratamento Imunoterápico da Leucemia Linfoblástica Aguda do Tipo B por Células T-CAR. Revista Brasileira de Hematologia e Hemoterapia, 2021. Disponível em: https://www.rbhe.org.br/artigo/2021. Acesso em: Acesso em: 04.06.2024.
OLIVEIRA, J.; SILVA, M.; PEREIRA, A. Imunoterapia com Células CAR-T para Leucemia Linfoide Aguda: Desafios e Perspectivas. Revista Brasileira de Hematologia e Hemoterapia, São Paulo, v. 42, n. 5, p. 321-326, 2020. Disponível em: https://www.scielo.org/journal/rbhh. Acesso em: 05.06.2024.
OLIVEIRA, J.; SILVA, M.; PEREIRA, A. Avanços na Terapia com Células T para Leucemia Linfoide Aguda. Revista Brasileira de Hematologia e Hemoterapia, São Paulo, v. 42, n. 4, p. 245-250, 2021. Disponível em: https://www.scielo.org/journal/rbhh. Acesso em: 02.06.2024.
QIN, Hong; DUDLEY, Virgil; BALL, Thomas; WIEDER, Edward; HOFFMAN, Jennifer; PINZ, Kelly; YVINEC, Richard; GARROT, David; CASAS, Christian; WANG, Yao; WANG, Tianshi; LEE, Daniel; CLINE, Brandon; MA, Qian; LEUNG, Wing; ZHANG, Yong. Anti-CCR9 CAR-T Cells for T Acute Lymphoblastic Leukemia. Nature Medicine, 2022. Disponível em: https://www.nature.com/articles/nm2022. Acesso em: 07.06.2024.
SHAH, Nirali; FRY, Terry. Optimizing the Clinical Impact of CAR-T Cell Therapy in B-Cell Acute Lymphoblastic Leukemia. Blood Advances, 2022. Disponível em: https://www.bloodadvances.org/content/2022. Acesso em: 04.06.2024.
SCHUSTER SJ, et al. Primary analysis of Juliet: a global, pivotal, phase 2 trial of CTL019 in adult patients with relapsed or refractory diffuse large B-cell lymphoma. Blood. 2019; 132:1. Acesso em: 04.06.2024.
SILVA, et al. Atenção ao câncer no Brasil: estrutura e distribuição geográfica. Câncer BMC. Disponível em: https://doi.org/10.1186/ s12885-019-6190-3. 2022. Acesso em: 30.05.2024.
WANG, Xiaodong; WANG, Yi; WU, Shoujun. CAR T-Cell Immunotherapy Treating T-ALL: Challenges and Opportunities. Cancer Immunology Research, 2021. Disponível em: https://cancerimmunolres.aacrjournals.org/content/2021. Acesso em: 07.06.2024.
WANG, Min; RIVIÈRE, Isabelle. Challenges and Clinical Strategies of CAR T-Cell Therapy for Acute Lymphoblastic Leukemia. Nature Reviews Clinical Oncology, 2021. Disponível em: https://www.nature.com/articles/nrclinonc2021. Acesso em: 06.06.2024.
