REGISTRO DOI: 10.5281/zenodo.11621047
Amanda Onofre de Souza1,
Mariana Ferancini De La Cruz2,
Marina Luiza dos Santos Siqueira Alves3,
Chimene Kuhn Nobre4
RESUMO
A esquistossomose é uma doença infecciosa que pode evoluir para formas clínicas extremamente graves e levar o paciente a óbito. No Brasil, a esquistossomose é considerada um problema endêmico de saúde pública. Comumente, a infecção por esquistossomose acomete indivíduos em situação de vulnerabilidade social, a exemplo de populações ribeirinhas e indígenas que em sua maioria vivem na Amazônia Legal. Em 2020 o país enfrentou a pandemia de COVID- 19 que acarretou impactos econômicos e sociais, além de implicações no sistema de saúde pública que necessitou atender a demanda da pandemia sem prejudicar o fluxo de atendimento das Doenças Tropicais Negligenciadas, como a esquistossomose. O presente estudo pretende realizar uma análise epidemiológica de caráter descritivo e retrospectivo a partir de casos notificados da esquistossomose, considerando o tempo e espaço como objetos de estudo para uma compreensão de sua dinâmica, tendo como principal cenário os estados da Amazônia Legal nos anos de 2018 a 2022, a fim de gerar resultados que contribuam para a saúde pública na elaboração de estratégias que atendam às necessidades de saúde das populações vulneráveis no território da doença, por fim os objetivos deste estudo é analisar o perfil epidemiológico da esquistossomose na Amazônia Legal o qual abrange Amazonas, Acre, Rondônia, Roraima, Pará, Maranhão, Amapá, Tocantins e Mato Grosso, durante o período de pandemia de COVID-19, bem como relatar os aspectos históricos da esquistossomose mansônica comparando o número de casos notificados da doença em anos anteriores e durante a pandemia com base em faixa etária e sexo.
Palavras chaves: esquistossomose; saúde pública; Amazônia Legal; COVID-19.
ABSTRACT
Schistosomiasis is an infectious disease that can evolve into extremely serious clinical forms and lead to patient death. In Brazil, schistosomiasis is considered an endemic public health problem. Schistosomiasis infection commonly affects individuals in socially vulnerable situations, such as riverside and indigenous populations who mostly live in the Legal Amazon. In 2020, the country faced the COVID-19 pandemic, which had economic and social impacts, as well as implications for the public health system, which needed to meet the demand of the pandemic without compromising the flow of care for Neglected Tropical Diseases, such as schistosomiasis. The present study intends to carry out a descriptive and retrospective epidemiological analysis based on reported cases of schistosomiasis, considering time and space as objects of study to understand its dynamics, having as its main scenario the states of the Legal Amazon in the years 2018 to 2022, in order to generate results that contribute to public health in the development of strategies that meet the health needs of vulnerable populations in the territory of the disease. Finally, the objectives of this study are to analyze the epidemiological profile of schistosomiasis in the Legal Amazon, which covers Amazonas, Acre, Rondônia, Roraima, Pará, Maranhão, Amapá, Tocantins and Mato Grosso, during the COVID- 19 pandemic period, as well as reporting the historical aspects of schistosomiasis mansoni comparing the number of reported cases of the disease in previous years and during the pandemic based on age group and gender.
Keywords: schistosomiasis; public health; Legal Amazon; COVID-19.
1 INTRODUÇÃO
A esquistossomose, também conhecida como „barriga d’água‟ ou „doença do caramujo‟, é uma parasitose intestinal de veiculação hídrica, de caráter endêmico, que atinge as populações que apresentam um índice de desenvolvimento humano (IDH) muito baixo.
A esquistossomose é considerada uma doença endêmica universal que afeta pessoas que vivem principalmente nos países da América latina, continente africano e asiático.
No Brasil encontra-se a esquistossomose do tipo mansônica que chega a atingir mais de seis milhões de pessoas (Pordeus, 2008). Tomando por referência o cenário epidemiológico, a esquistossomose é um mal que degenera a saúde da população, principalmente aquela desprovida dos serviços básicos de saneamento, educação sanitária e acesso à água tratada (Sousa, 2020; França et. al., 2020).
A infecção por esquistossomose acontece em várias partes do mundo, principalmente nas regiões do Oriente Médio, África, Ásia e América do Sul. As estimativas apontam que há mais de 200 milhões de pessoas infectadas no mundo e 700 milhões de pessoas vivem em áreas de riscos para a contaminação de uma ou mais espécies de esquistossoma. (Espirito Santo, 2013).
Considerando que na Amazônia Legal existe um grande número de comunidades ribeirinhas e indígenas que vivem com a ausência de saneamento básico e sem educação sanitária, a região tornou-se um foco importante a ser estudado, tanto pelo fato da população ser considerada altamente vulnerável quanto por sua hidrografia que é ricamente banhada por rios, o meio de transmissão da doença.
Diante disso, o objetivo de estudo compreendeu a analise da incidência da esquistossomose na região da Amazônia Legal durante o período de 2019 a 2022. Entendem-se como Amazônia Legal os seguintes Estados: Amazonas, Acre, Rondônia, Roraima, Pará, Maranhão, Amapá, Tocantins e Mato Grosso, esse período foi um período crucial para o controle de varias doenças, onde o Brasil e o mundo enfrentou a pandemia do COVID-19 que interrompeu intervenções e programas de eliminação das Doenças Tropicais Negligenciadas (DTN), o qual a esquistossomose faz parte. Essa interrupção interferiu diretamente nas pesquisas e rastreamento ativo de casos, paralisando também ações de intervenção, sendo retomada gradualmente em 2021.
No entanto, a Organização Pan-Americana de Saúde (OPAS) alertou que essas interrupções podem atrasar a eliminação e o controle de algumas dessas DTN além dos prazos que foram propostos antes da pandemia. (OPAS, 2022) .
Desta forma, se faz necessário conhecer o ciclo da doença, além de caracterizar o seu perfil, apontando os impactos que a pandemia de COVID-19 acarretou sobre a esquistossomose na região da Amazônia Legal. Objetiva-se analisar epidemiologicamente a esquistossomose na Amazônia Legal, abordando suas características clínicas, identificando áreas-chave nas quais mais pesquisas poderão contribuir para o controle da esquistossomose na Amazônia Legal.
2 MATERIAL E MÉTODOS
Trata-se de um estudo de caráter descritivo e retrospectivo. Os estudos descritivos têm por objetivo determinar a distribuição de doenças ou condições relacionadas à saúde, segundo o tempo, o lugar e/ou as características dos indivíduos. (Costa; Barreto, 2006, p. 191).
O local de realização da pesquisa será a região da Amazônia Legal, que corresponde à área de atuação da Superintendência de Desenvolvimento da Amazônia – SUDAM delimitada em consonância ao Art. 2º da Lei Complementar nº 124, de 03.01.2007. Sua região corresponde a 59% do território brasileiro e engloba a totalidade de oito estados (Acre, Amapá, Amazonas, Mato Grosso, Pará, Rondônia, Roraima e Tocantins) e parte do Estado do Maranhão (a oeste do meridiano de 44ºW). Nela residem 56% da população indígena brasileira.
A Amazônia Legal apresenta uma área de 5.015.067,86 km2, correspondendo a cerca de 58,93% do território brasileiro, com uma população de mais de 28 milhões o que representa cerca de 13% da população brasileira.
A população trabalhada será a população feminina, população masculina, população menor de um ano, população de 1 a 4 anos, população 5 a 14 anos, população 15 a 49 anos e população 50 anos ou mais e ainda por meio dos estados pertencentes à Amazônia Legal. A amostra utilizada será todos os casos notificados no período anterior e durante a pandemia, isto é de 2019 a 2022 na região mencionada.
Como critério de inclusão serão considerados todos os casos em que a notificação de caso estiver presente na base de dados do SINAN-NET e TABNET classificada como esquistossomose, no período de 2019 a 2022 segundo a região de notificação dos estados pertencentes a Amazônia Legal.
Os critérios de exclusão determinados serão aqueles que possuem acesso restrito, como também os que se encontrarem fora do período estipulado, e por fim os que não se encontrarem na região estudada.
Para a análise será utilizado o banco de dados de casos confirmados de esquistossomose por unidade federativa do Brasil que é disponibilizado pelo Ministério da Saúde, por meio do SINAN-NET e TABNET comparando as taxas de incidência de esquistossomose na população futuramente estudada a partir do ano de 2019 até 2022. Os dados coletados serão analisados e expostos em gráficos percentuais.
Ademais, outras publicações serão acrescentadas a revisão, visando sua importância a fim de embasar o presente estudo. Serão utilizados artigos que apresentam relevância na saúde pública, e os trabalhos científicos a serem utilizados serão ordenados de acordo com o ano de publicação, objetivos, resultados e conclusão.
3 EPIDEMIOLOGIA DA ESQUISTOSSOME MANSÔNICA NO BRASIL
De acordo com Sousa (2020) a esquistossomose é uma parasitose intestinal de veiculação hídrica. França et al. (2020) em concordância com Sousa, afirma que essa doença atinge a populações com baixo índice de desenvolvimento humano (IDH). Segundo a Fiocruz, Katz (2018), a introdução da esquistossomose no Brasil decorreu do tráfico de escravos vindos da África para o nordeste. Seguindo a mesma teoria, o Ministério da Saúde (2018) acrescenta que com o declínio do regime de escravidão resultou uma forte migração para outras regiões do país que disseminou juntamente a doença ao longo do percurso.
Ferreira et. al. (2021) salientam que a esquistossomose é um dos maiores problemas de saúde pública em regiões tropical e subtropical, como Brasil. Souza, Grala e Vilella (2021) dizem que a incidência da patologia está relacionada com as condições adequadas para a proliferação do hospedeiro intermediário. Nessa questão, Katz (2018) afirma que há outros fatores condicionantes como higiene precária e ausência de educação para a saúde, bem como Massaraet al. (2016) escreveu que a educação em saúde associada a outras medidas de controle, contribui para a redução da prevalência da esquistossomose.
No mundo as estimativas de mortalidade variam entre 24.000 e 200.000 mortes por ano, afirmam Llanwarne e Helmby (2020). Ao longo da história a esquistossomose mansônica tem sido endêmica no Brasil, mas segundo o Ministério da Saúde (2018) sua distribuição geográfica não é homogênea, Andrade et. al. (2022) reforça esta afirmação ao declarar que o estado de Minas Gerais representa cerca de 70% dos casos nacionais. Enquanto no Brasil Lima et. al. (2019) afirmam que já foram registrados cem milhões de casos nos últimos trinta e sete anos.
3.1 FISIOPATOLOGIA DA ESQUISTOSSOMOSE
De acordo com McManuset. al. (2018) a esquistossomose é uma doença tropical negligenciada causada por platelmintos parasitas do gênero Schistosoma e pode levar a doenças crônicas. No Brasil a espécie de platelminto é o Schistosoma mansoni e seu hospedeiro intermediário é o caramujo Biomphalariaglabrata conforme elucidam Lira, Campos e Silva (2019). Para Cardoso et. al. (2019) a patologia da infecção pelo S. mansoni é predominantemente causada pela resposta imune do hospedeiro aos antígenos do ovo. Costain, MacDonald e Smits (2018) declaram que os esquistossomos podem persistir em seus hospedeiros por 3 e até 10 anos.
Em relação à classificação da esquistossomose, McManuset. al. (2018) classificam em três fases: infecção aguda, infecção ativa estabelecida e infecção crônica tardia. Diferente de Queiroz (2012) que a classifica apenas em fase aguda e crônica. No entanto McManuset. al. (2018) acreditam que geralmente a esquistossomose aguda não é sintomática, por isso considera a fase de infecção ativa estabelecida. Prata e Coura (2008) diz que o termo mais adequado seria “fase inicial” substituindo “fase aguda” quando assintomática. Como nas duas fases a doença pode ser assintomática, a literatura usualmente é classificada em fase aguda e crônica somente quando sintomáticas, como França et. al. (2020) ressaltaram.
Seguindo a classificação mais frequente, Oliveira e Rosa (2020) informa que a fase aguda pode apresentar manifestação de coceiras, dermatite, febre, tosse, cefaleia, náusea, vômito e emagrecimento.
Segundo Pinheiro (2022) a fase aguda da esquistossomose é conhecida como a Febre de Katayama. Enquanto a fase crônica, (França et. al. 2020) descreveu que pode se apresentar sob três formas: intestinal, hepatointestinal e hepatoesplênica.
A fase aguda ocorre após a penetração das cercárias na pele. Oliveira (2016) assinala que os sintomas da fase aguda geralmente se manifestam em pacientes infectados pela primeira vez. (Prata e Coura 2008) esclarecem que nesta fase ocorre uma reação inflamatória em dois estágios. (Souza et. al. 2011) vão chamar esses dois estágios de pré-patente e pós-patente.
O estágio pré-patente, segundo (Rodrigues et. al. 2021), é o período de trinta a sessenta dias posteriores à infecção, quando ainda não houve a oviposição, ou seja, quando ainda não houve o deposito de ovos. (Queiroz 2012) elucida que nesse estágio há uma resposta imediata com liberação de substâncias histamina-like que em poucos minutos leva a formação de manchas avermelhados e pruridos. O estágio pós-patente, segundo (Prata e Coura 2008), ocorre de quarenta e cinco a noventa dias após a penetração das cercarias na pele desenvolvendo erupções micropapulares eritematosas conhecida como dermatite cercariana, conforme pode ser observado na figura 1.
Figura 1: Dermatite cercariana, provocada por penetração de cercárias de S. mansoni
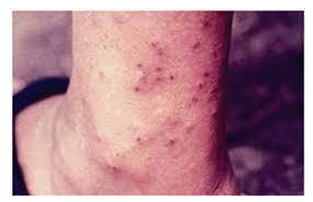
Fonte: LAMBERTUCCI, 2006 apud BRASIL, 2014, p. 45
Por fim, sucede a disseminação massiva de granulomas no fígado, pulmão, pâncreas e linfonodos que Oliveira (2016) caracterizada como o início da oviposição.
Souza et. al. (2011) dizem que ao exame físico, na fase aguda é possível notar emagrecimento, desidratação, hepatoesplenomegalia, taquicardia e hipotensão arterial sistêmica. Marculinoet. al (2017) afirmam que os esquistossômulos que escapam da fase aguda seguem para a circulação sanguínea e/ou linfática em direção ao pulmão, onde permanecem de 3 a 31 dias e segundo Sousa (2020) consequentemente produz uma reação alérgica de hipersensibilidade, provocando tosse e febre, ou até hemoptise, sintomas característicos da pneumonite larval. Souza et. al (2011) ressaltam que na maioria dos pacientes a fase aguda dura em média quatro a oito semanas.
Durante a fase crônica, um terço dos ovos são levados pelo sangue para o fígado, segundo Gomes, Domingues e Barbosa (2019) ali encalham em pequenos ramos venosos portais pré-sinusoidais e desencadeiam uma reação granulomatosalocal. Na opinião de Santos e Cardoso (2020) inicialmente a ação imunológica consiste em uma resposta celular aguda de células Th1 direcionada ao invasor adulto. Oliveira et. al. (2014) acrescentam que após a oviposição a resposta Th1 é alterada para resposta Th2, que se falhar resulta em uma inflamação granulomatosa mediada por Th1 e Th17. Então, as células inflamatórias são gradualmente abolidas e substituídas por fibroblastos e os granulomas encolhem e podem calcificar, afirmam Barsoum, Esmat e El-Baz (2013).
Para Ross et. al. (2007) os sintomas da esquistossomose são causados por reações de hipersensibilidade sistêmica e formação de imunocomplexos em resposta aos antígenos que são liberados durante a migração dos esquistossômulos ou no início da oviposição. McManuset. al. (2018) declararam que a esquistossomose aguda é raramente observada em pessoas que vivem em áreas endêmicas de S. mansoni.
Os dados do estudo de Saninet. al. (2015) sugerem que possivelmente essa suscetibilidade é devida a exposição repetida a cercárias penetrantes na pele, visto que induzem a produção de IL-10 por células T CD4 na pele, resultando em uma resposta imune reguladora.
Na fase crônica apresentada na forma intestinal Pinheiro (2022) argumenta que ocorre a retenção de ovos na parede do intestino, causando diarreia sanguinolenta, cólicas e emagrecimento. Carneiro (2021) cita que pode ocorrer ulcerações na parede do intestino, granulomas e obstrução à passagem das fezes, o que Pinheiro (2022) explica resultar da intensa resposta inflamatória contra os ovos. Quanto à forma hepatoesplênica, Melo e Araújo (2005) explicam que se inicia mediante alguns ovos que embolizam para ramos da árvore portal no fígado. Santos (2022) refere que por efeito da reação granulomatosa no fígado pode ocorrer hepatomegalia e esplenomegalia como demonstrado na figura 2.
Figura 2: Criança com barriga d‟água
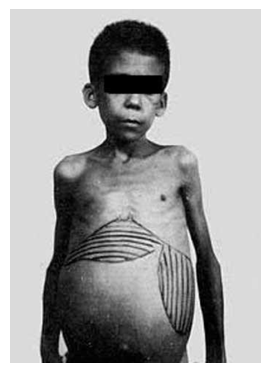
Fonte: Centro Cultural Ministério da Saúde
Ademais, Melo e Araújo (2005) ressaltam que também são encontrados resultados como: hipertensão portal, varizes esofágicas e outros.
Na forma hepatointestinal, de acordo com o Ministério da Saúde (2018) é observado no exame físico dor à palpação dos cólons, fígado palpável entre dois e seis centímetros do rebordo costal direito, de consistência aumentada e, às vezes, com hipertrofia do lobo esquerdo, não sendo o baço palpável. Souza et. al. (2011) relata que em geral, são observados sintomas como eructações, sensação de plenitude gástrica.
Náuseas, vômito, pirose, flatulência e anorexiia, associados à dor abdominal e acompanhada por pequenos surtos diarreicos.
Sobre as consequências da patologia no corpo humano Wilson et. al. (2007, p.148) afirmam que:
[…]Após a infecção, parasitas adultos de S. mansoni migram para as veias mesentéricas onde vivem até 10 anos ou mais, colocando centenas de ovos por dia. Alguns dos ovos ficam presos na microvasculatura do fígado e, uma vez lá, induzem uma vigorosa resposta granulomatosa. Subsequentemente, podem ocorrer fibrose, hipertensão portal e vasos colaterais, que são as principais causas de morbidade em indivíduos infectados e, em alguns casos, podem ser letais. Consequentemente, grande parte da sintomatologia da esquistossomose é atribuída à resposta inflamatória granulomatosa induzida pelo ovo e à fibrose associada[…]
Portanto, Wilson et. al. (2007) foram categóricos ao expor a gravidade que a esquistossomose pode trazer a saúde dos indivíduos, relatando a possibilidade de a doença levar a óbito. Assim, identifica-se a importância do estudo da fisiopatologia da esquistossomose mansônica a fim de compreender os efeitos e sua gravidade que impactam diretamente a saúde pública e a vida das populações mais vulneráveis.
4 RESULTADOS
Nesta seção, empreendemos uma análise minuciosa dos dados notificados, abarcando casos de esquistossomose ocorridos na região da Amazônia Legal ao longo dos três anos compreendidos entre 2019 e 2022. Os dados utilizados nesta análise foram obtidos a partir do SINAN-NET e TABNET, ferramentas de registro e gerenciamento de informações de saúde, permitindo uma abordagem abrangente e de qualidade.
O processo de análise teve como ponto de partida a aquisição e organização dos dados, seguida por uma etapa de processamento no ambiente do Microsoft Excel. Este software desempenhou um papel fundamental na geração de gráficos, tabelas e representações visuais que se mostraram essenciais para simplificar a complexidade dos dados brutos, bem como para a apresentação clara e coerente dos resultados.
A análise compreendeu diversos aspectos, incluindo a distribuição geográfica dos casos por estado, a demografia da população afetada, segmentada por faixa etária e sexo, e também a classificação das formas clínicas da doença. Essa abordagem holística permitiu uma compreensão mais profunda e abrangente da dinâmica da esquistossomose na região da Amazônia Legal durante o período sob análise.
Todas as análises foram conduzidas com o objetivo de gerar informações sólidas e subsidiar a tomada de decisões e a formulação de políticas de saúde pública. A seguir, os resultados dessa análise serão apresentados em detalhes, de forma que proporcione um panorama do impacto da esquistossomose na região Amazônica.
5 DISCUSSÃO
Com base na análise abrangente dos dados de esquistossomose na região da Amazônia Legal, no período de 2019 a 2022, foram identificados insights valiosos que contribuem para um entendimento mais profundo dessa doença negligenciada na região (OPAS, 2022). Discussão profícua entre sua pesquisa e os autores que publicam sobre o tema abordado, de forma que promova uma produção científica.
5.1 DISTRIBUIÇÃO GEOGRAFICA
A análise da distribuição geográfica (Tabela 1) revelou que Rondônia desponta com o maior número de casos confirmados, totalizando 90, seguido por Pará com 56 casos e Mato Grosso com 54. Por outro lado, Roraima registrou zero casos no período analisado.
Tabela 1: Casos confirmados por UF de notificação:
UF de notificação Casos confirmados Rondônia 90 Acre 2 Amazonas 2 Pará 56 Amapá 4 Tocantins 4 Maranhão 48 Mato Grosso 54 Roraima 0 Total 260
Na Amazônia Legal, a esquistossomose é principalmente associada aos cursos d’água e aos hábitos de vida das populações locais. As condições ambientais favoráveis, como a presença de água doce e a vegetação densa, proporcionam um habitat ideal para os caramujos que encontrados em grande quantidade em lagos, rios, riachos e açudes, especialmente em áreas onde há pouca infraestrutura sanitária e de saneamento básico.
A distribuição geográfica da esquistossomose na Amazônia Legal é fortemente influenciada pela interação entre fatores ambientais, socioeconômicos e comportamentais. Por exemplo, comunidades ribeirinhas que dependem diretamente dos recursos hídricos para suas atividades cotidianas, como pesca, agricultura e transporte, estão em maior risco de contrair a doença devido ao contato frequente com água contaminada.
Além disso, em muitas áreas da Amazônia Legal, o tratamento de água e esgoto é limitado ou inexistente, levando as pessoas a usarem fontes de água contaminada para suas necessidades diárias.
Os padrões de distribuição da esquistossomose na Amazônia Legal também podem variar de acordo com as práticas de controle e prevenção implementadas em diferentes comunidades. Programas de saúde pública, como campanhas de tratamento em massa, educação sanitária e controle de caramujos, desempenham um papel crucial na redução da incidência da doença.
5.2 ANÁLISE POR FAIXA ETÁRIA
A análise demográfica por faixa etária (Tabela 2) revelou que a faixa dos 40 a 59 anos foi a mais afetada, com 85 casos confirmados, seguida pela faixa dos 20 a 39 anos, com 67 casos. Notavelmente, a faixa etária mais jovem (5 a 9 anos) teve um número menor de casos, com apenas 3 ocorrências. (Prestes; Araújo; et. al. 2023)
Tabela 2: casos confirmados por faixa etária
Faixa Etária Casos Confirmados 5 a 9 3 10 a 19 17 20 a 39 67 40 a 59 85 60 a 79 31 80 ou mais 6 TOTAL 209
A análise por faixa etária destaca que os adultos jovens estão em risco significativo de contrair a esquistossomose na Amazônia Legal. Isso pode ser devido ao envolvimento em atividades laborais que os colocam em contato com ambientes aquáticos contaminados, como agricultura e pesca, ou à falta de acesso a medidas preventivas, como tratamento e educação sobre higiene.
Surpreendentemente, a análise revela que os idosos também não estão isentos do risco de infecção por esquistossomose na região. Embora a prevalência possa ser menor em comparação com outras faixas etárias, os idosos ainda podem ser afetados.
Com base nessas descobertas, é evidente que estratégias de controle da esquistossomose na Amazônia Legal devem ser multifacetadas e adaptadas às necessidades específicas de cada faixa etária. Isso pode incluir campanhas de educação pública direcionadas a crianças e adolescentes para promover práticas de higiene adequadas e reduzir a exposição à água contaminada. Para os adultos jovens, é essencial implementar medidas de controle vetorial e oferecer acesso facilitado a tratamento e medidas preventivas, como o uso de medicamentos antiparasitários. Quanto aos idosos, é importante garantir que recebam cuidados de saúde adequados e que sejam monitorados de perto para detectar e tratar qualquer infecção por esquistossomosse.
5.3 DIFERENÇA POR SEXO
A análise da diferença por sexo (Tabela 3) demonstrou uma predominância de casos no sexo masculino, totalizando 143 casos, em comparação com 117 casos no sexo feminino. Essa disparidade de gênero pode estar relacionada a diferenças na exposição ocupacional e comportamental dos indivíduos.
Tabela 3: Casos confirmados por Sexo:
Ano Notificação Masculino Feminino Total 2019 37 32 69 2020 26 19 45 2021 34 28 62 2022 46 38 84 TOTAL 143 117 260
A esquistossomose tem como foco de contaminação predominante no gênero masculino, visto que, em muitas sociedades, eles estão mais expostos às atividades que aumentam o risco de infecção, como a pesca, a agricultura e outras formas de trabalho manual em ambientes aquáticos.
5.4 FORMAS CLÍNICAS
A análise das formas clínicas da esquistossomose (Tabela 4) revelou que a maioria dos casos foi classificada como Intestinal (113 casos), seguida por Ign/Branco (62 casos), que abrange dados não especificados. Formas clínicas menos comuns incluíram Hepato Intestinal (7 casos), Hepato Esplênica (11 casos) e Aguda (11 casos).
Tabela 4: Casos confirmados por Forma Clínica:
Forma Clínica 2019 2020 2021 2022 Total Ign/Branco 16 11 17 18 62 Intestinal 39 23 18 33 113 Hepato Intestinal 3 1 1 2 7 Hepato Esplênica 4 3 2 2 11 Aguda 2 1 2 6 11 Outra – – 3 5 8 TOTAL 64 39 43 66 212
O diagnóstico e tratamento precoces são essenciais para mitigar o impacto da esquistossomose na Amazônia Legal. Estratégias de controle, como o tratamento em massa com o praziquantel, a melhoria das condições de saneamento e a educação em saúde, são fundamentais para reduzir a prevalência e morbidade da doença na região. Além disso, a pesquisa contínua é necessária para entender melhor a epidemiologia e as formas clínicas da esquistossomose na Amazônia e desenvolver abordagens eficazes de prevenção e controle.
No conjunto, esses resultados fornecem uma compreensão do período de 2019 a 2022 da epidemiologia da esquistossomose na Amazônia Legal durante os anos analisados. Essa análise destaca a necessidade de medidas preventivas eficazes para abordar essa doença negligenciada na região. A ênfase na faixa etária mais jovem e as diferenças de gênero também abrem portas para investigações futuras e aprimoramentos nas estratégias de controle.
6 CONSIDERAÇÕES FINAIS
A análise dos dados sobre a esquistossomose na região da Amazônia Legal, no período de 2019 a 2022, forneceu insights valiosos para o entendimento e enfrentamento dessa doença negligenciada na região. A distribuição geográfica revela uma variação significativa no número de casos confirmados, destacando a necessidade de estratégias de controle diferenciadas para atender às particularidades de cada estado.
Os dados demográficos enfatizam a importância de considerar as diferentes faixas etárias ao planejar intervenções. A faixa etária dos 40 a 59 anos emergiu como a mais afetada, enquanto medidas de controle eficazes na faixa etária mais jovem (5 a 9 anos) podem ter contribuído para um menor número de casos nesse grupo.
A disparidade de gênero, evidenciada pela predominância de casos no sexo masculino, sugere a necessidade de uma análise mais profunda das diferenças na exposição ocupacional e comportamental. Isso pode direcionar o desenvolvimento de estratégias específicas de prevenção e conscientização.
A análise das formas clínicas destaca a predominância da forma Intestinal, indicando a necessidade de alocação de recursos e tratamentos adequados para essa categoria, enquanto as formas clínicas menos comuns também devem ser consideradas.
Por fim, os resultados fornecem uma visão da epidemiologia da esquistossomose na Amazônia Legal usando a estratégias de controle direcionadas. A análise destaca a necessidade de medidas preventivas eficazes para abordar essa doença negligenciada na região.
À medida que enfrentamos o desafio de reduzir a incidência da esquistossomose na Amazônia Legal, é crucial adaptar as ações de controle, priorizando as faixas etárias mais afetadas e considerando as diferenças de gênero.
REFERÊNCIAS
ANDRADE, S. M. de .; SANTOS, D. A. .; ROSA, L. M. V.; PIRES, L. G. de F. .;
SILVA, J. C. R. A. da .; COSTA, P. R. C.; PEREIRA JÚNIOR, J. L. .; OLIVEIRA, E.
H. de . Epidemiological profile ofSchistosomiasis cases in Brazilbetween 2010 and 2017. Research, Society and Development, v. 11, n. 11, 2022. Disponível em: <https://rsdjournal.org/index.php/rsd/article/view/33834>. Acesso em: 5 abr. 2023.
BARSOUM, R. S.; ESMAT, G.; EL-BAZ, T. HumanSchistosomiasis: Clinical Perspective. Journal of Advanced Research, v. 4, n. 5, p. 433–444, 2013.
BRASIL, Ministério da Saúde.. Secretaria de Vigilância em Saúde. Guia de Vigilância Epidemiológica Esquistossomose Mansonica. 7ª edição, caderno 10, p 19-30, Brasília, 2009.
CARDOSO, L. S. et al. Infecção pelo Schistosoma mansoni: resposta imune associada à patogênese e proteção do hospedeiro. Avanços da Pesquisa em Imunologia na Bahia: 30 Anos de contribuição do Programa de Pós-Graduação em Imunologia da UFB, v.1, 2019.Dísponível em:<https://repositorio.ufba.br/ri/handle/ri/30950>. Acesso em: 13 mar. 2022 CARNEIRO, Luiz. Esquistossomose. Disponível em: <https://profluizcarneiro.com. br/doencas/figado/esquistossomose/> . Acesso em: 22 mar. 2023
COSTAIN, A. H.; MACDONALD, A. S.; SMITS, H. H. SchistosomeEggMigration: Mechanisms, Pathogenesisand Host Immune Responses. Frontiers in Immunology, v. 9, n. December, p. 1–16, 2018.
DE OLIVEIRA, L. das G. R.; MARA ROSA , F. ESQUISTOSSOMOSE GIBI E MASSA DE MODELAR COMO ESTRATÉGIAS DE ENSINO. Lynx, v. 1, n. 1, 2020. Disponível em: https://periodicos.ufjf.br/index.php/lynx/article/view/25665. Acesso em: 5 abr. 2023.
ESPÍRITO SANTO, M. C. C.; GRYSCHEK, R. C. B. Estudo comparativo da acurácia de diferentes técnicas para o diagnóstico laboratorial da esquistossomose mansoni em áreas de baixa endemicidade. p. 189, 2013.
FERREIRA, F. dos S. et al. Avaliação do perfil epidemiológico da esquistossomose na região norte / Evaluationoftheepidemiological profile ofschistosomiasis in thenorthern region. Brazilian Journal of Health Review, v. 4, n. 6, p. 25486–25496, 2021.Disponível em: <https://ojs.brazilianjournals.com.br/ojs/index.php/BJHR/article/view/39710>. Acesso em: 5 abr. 2023.
FRANÇA, F. S. de et al. Esquistossomose: uma endemia de importância no Brasil.
Revista Brasileira de Análises Clínicas, v. 52, n. 3, p. 2018–2021, 2020.
GOMES, E. C. S.;DOMINGUES, A. L. C.; BARBOSA,C.S.; Esquistossomose: manejo clínico e epidemiológico na atenção básica. Ministério da Saúde, 2017. Disponível em:<http://www.schisto.fiocruz.br/wp-content/uploads/2021/07/Livro- DigitalEsquistossomose-V3-Ago-2019.pdf>. Acesso em: 07 mar. 22
KATZ, Naftale.Inquérito Nacional de Prevalência da Esquistossomose mansoni e Geo-helmintoses. Belo Horizonte, 2018. p. 76.
LLANWARNE, F.; HELMBY, H. Granuloma formationandtissuepathology in Schistosoma japonicum versus Schistosoma mansoni infections. Parasite Immunology, v. 43, n. 2, p. 1–12, 2021. Disponível em: <https://doi.org/10.1111/pim.12778>. Acesso em: 10 feb. 2022
LIMA, C. de et al. Pré-diagnóstico da esquistossomose no semiárido: régua antropométrica e aplicativo colaborativo. Revista Tecnologia e Sociedade, v. 15, n. 36, p. 272–293, 2019.
MASSARA, C. L. et al.. Caracterização de materiais educativos impressos sobre esquistossomose, utilizados para educação em saúde em áreas endêmicas no Brasil. Epidemiologia e Serviços de Saúde, v. 25, v. 25, n. 3, p. 575–584, 2016.
MARCULINO, H. H. S. et al. ESQUISTOSSOMOSE: UMA QUESTÃO DE SAÚDE PÚBLICA. Mostra Interdisciplinar do curso de Enfermagem, v. 2, n. 1, mar. 2017. Disponível em: <http://publicacoesacademicas.unicatolicaquixada.edu.br/index.php/ mice/article/view/1113>. Acesso em: 01 abr. 2023.
MCMANUS, D.P. et al. Esquistossomose. Nature Reviews Disease Primers, v.4, p. 1–19, 2018. Disponível em: <https://doi.org/10.1038/s41572-018-0013-8>. Acesso em: 26 fev. 2023.
MELO, P., ARAÚJO, R. Esquistossomose, 2005. Disponível em: <http://www. medicina.ufba.br/patologia_i/monitoria/casos/ehe.htm>. Acesso em: 03 mar. 2023
MENEZES, A. M. F. et al. Epidemiological profile of dengue in Brazilbetween 2010 and 2019. Brazilian Journal of Health Review, v. 4, n. 3, p. 13047–13058, 2021.
MOURÃO, R. Comunidades Tradicionais: Ribeirinhos, 2017. Disponível em:<http://www.ecobrasil.eco.br/site_content/30-categoria- conceitos/1195comunidades-tradicionais-ribeirinhos>. Acesso em: 17 fev. 2023.
OLIVEIRA, S. M. DE .et al..Associationbetweenallergic responses and Schistosoma mansoni infection in residents in a low-endemic setting in Brazil. Revista da Sociedade Brasileira de Medicina Tropical, v. 47, n. Rev. Soc. Bras. Med. Trop., 2014 47(6), p. 770–774, nov. 2014.
(OPAS) Organização Pan-Americana da Saúde. Doenças tropicais negligenciadas: OPAS pede fim dos atrasos no tratamento nas Américas. Brasília: OPAS; 2022
PINHEIRO, P. Esquistossomose: o que é, sintomas e tratamento, 2022. Disponível em:<https://www.mdsaude.com/doencasinfecciosas/parasitoses/esquistossomose/#Infeccao_cronica_pela_esquistossomose>. Acesso em: 25 fev. 2023.
PORDEUS, L. C. et al. A ocorrência das formas agudas e crônicas da esquistossomose mansônica no Brasil no período de 1997 a 2006: uma revisão da Literatura. Epidemiologia e Serviço de Saúde. Revista do SUS , Brasília, v. 17, n. 3, pág. 163-175, conjunto. 2008. Disponível em <http://scielo.iec.gov.br/scielo.php?script=sci_arttext&pid=S1679- 49742008000300002&lng=pt&nrm=iso>. Acesso em:12 mar. 2023.
ROSS, A. G. Katayama syndrome. The Lancet Infectious Diseases, 2007. Disponível em:<https://doi.org/10.1016/S1473-3099(07)70053-1>. Acesso em: 12 mar. 2023
RODRIGUES, B. T. F. et al. Estudo Sobre a Esquistossomose com ênfase no diagnóstico eno tratamento da doença. Revista Ibero-Americana de Humanidades, Ciências e Educação, v. 7, n. 9, p. 1276–1287, 2021.
SANIN, D. E. et al. HelminthInfectionandCommensal Microbiota Drive Early IL-10 Production in theSkinby CD4+ T CellsThat Are FunctionallySuppressive. PLoS Pathogens, v. 11, n. 5, p. 1–23, 2015.
SANTOS, M. V. Resumo de esquistossomose: diagnóstico, tratamento e mais, 2022. Disponível em:<https://med.estrategia.com/portal/conteudos- gratis/doencas/resumode-esquistossomose-diagnostico-tratamento/>. Acesso em: 22 fev. 2023.
SOUSA, D.G.S Ocorrência de Biomphalariastraminea em corpos hídricos do município de Picos, Piauí: Avaliação do risco de transmissão da esquistossomose mansoni, 2020. Disponível em: <https://acervos.icict.fiocruz.br/man/mestrado_bibmang/darlesson_sousa_ioc_mest_2020.pdf>. Acesso em: 05 fev. 2023
SOUZA, F. P. C. de et al., Esquistossomose mansônica: aspectos gerais, imunologia, patogênese e história natural. Revista Brasileira de Clínica Medica. v. 9, n. 4, p. 300–307, 2011.
SOUZA, C. B. DE; GRALA, A. P.; VILLELA, M. M. Óbitos Por Moléstias Parasitárias Negligenciadas No Brasil: Doença De Chagas, Esquistossomose, Leishmaniose E Dengue / DeathsDueToNeglectedParasiticDiseases in Brazil: Chagas Disease, Schistosomiasis, Leishmaniasisand Dengue. Brazilian Journal of Development, v. 7, n. 1, p. 7718–7733, 2021.
WILSON, M. S. et al. Immunopathology of schistosomiasis. Immunology and Cell Biology, v. 85, n. 2, p. 148–154, 2007.
Coura, J. R., Amaral, R. S., & Orefice, F. (2004). Schistosomiasis mansoni in the Brazilian Amazon: a clinical and epidemiological review. Revista da Sociedade Brasileira de Medicina Tropical, 37(1), 1-18.
BARBOSA, C. S., & BARBOSA, F. S. (2014). Esquistossomose na Amazônia. In: Esquistossomose. Rio de Janeiro: Guanabara Koogan.
OLIVEIRA, G., RODRIGUES, N. B., & PISSINATTI, A. (2017). Esquistossomose mansônica na Amazônia Brasileira: avaliação do nível de endemicidade em municípios do Estado do Pará. Revista Pan-Amazônica de Saúde, 8(1), 39-48.
KLOOS, H., & Correa-Oliveira, R. (2010). Human Schistosomiasis in Brazil: Historical Perspective, Control Efforts, and Current Challenges. In Advances in Parasitology, 72, 313-315.
Hotez, P. J., Bottazzi, M. E., Franco-Paredes, C., Ault, S. K., & Periago, M. R. (2008). The neglected tropical diseases of Latin America and the Caribbean: a review of disease burden and distribution and a roadmap for control and elimination. PLoS Neglected Tropical Diseases, 2(9), e300.
Kloos H, Correa-Oliveira R. A cultura de água e saneamento e o controle da esquistossomose mansônica na Amazônia brasileira. Revista Pan-Amazônica de Saúde. 2010;1(1):65-80.
Pinheiro MCC, Reis DC, Rodrigues KJF, et al. Prevalência de Schistosoma mansoni em escolares de comunidades ribeirinhas da Amazônia legal brasileira. Cad Saúde Pública. 2012;28(10):1909-1916.
Favre TC, Pereira AP, Beck LC, et al. Esquistossomose mansoni na Amazônia: análise da história de infecção em áreas endêmicas no Brasil. Cad Saúde Pública. 2016;32(2):e00164914.
Melo EV, de Lima AS, Vieira ML, et al. Situação epidemiológica da esquistossomose mansoni em dois municípios da Amazônia Legal brasileira. Rev Pan-Amaz Saude. 2017;8(1):57-64.
Amaral RS, Tauil PL, Lima DD, et al. Prevalência da infecção e da doença de Manson no Brasil: revisão sistemática e meta-análise de estudos epidemiológicos. Cad Saúde Pública. 2019;35(6):e00203018.

