REGISTRO DOI: 10.5281/zenodo.11557792
Isabel Zago Vieira Lessa¹; Thayane de Matos Guimarães¹; Júlia Abreu Rezende¹; Maristhela Alves Rodrigues¹; Ana Paula Machado Frizzo¹; Lorena de Freitas Gottardi¹; Luiza Lessa Ramos Kelly¹; Ana Maria Cascabulho¹; Tarcílio Machado Pimentel¹; Paula Martins R. Garcia1.
INTRODUÇÃO
O Toxoplasma gondii (T. gondii) é um parasita protozoário intracelular obrigatório, cujo ciclo de vida depende de gatos domésticos e selvagens, os únicos hospedeiros que eliminam os oocistos nas fezes. Outros mamíferos, como bovinos, ingerem o oocisto, que é liberado no intestino. Os seres humanos são infectados ao ingerirem cistos presentes em alimentos crus ou mal cozidos contaminados, por meio de fezes de gatos contaminados, transmissão vertical (TV), transfusão sanguínea ou transplante de órgãos de doadores infectados.1 O Brasil corresponde, em conjunto com América central, Europa e África Central, a uma das regiões com taxas elevadas de toxoplasmose na população com cerca de 40 a 80% de soroprevalência em adultos no país.2
A infecção materna pode ocorrer até três meses antes da concepção e mesmo assim resultar em toxoplasmose congênita, bem como pode resultar da reativação de toxoplasmose em gestante que foi exposta previamente, mas ficou gravemente imunocomprometida durante a gestação, ou ainda de reinfecção materna por uma cepa mais virulenta, principalmente pela ingestão de alimentos contaminados.3
Se contraída no início da gravidez, a toxoplasmose materna pode levar a aborto espontâneo ou complicações neurológicas graves. A taxa de aborto relacionada à toxoplasmose é de cerca de 0,5%, e quando há comprovação de infecção fetal, estima-se que o risco de morte fetal seja de 1,3% a 2%. No segundo trimestre podem haver casos de aborto espontâneo ou parto prematuro, resultando em crianças que podem nascer sem complicações aparentes ou com graves anomalias características, como microcefalia, hidrocefalia, óbito, hepatoesplenomegalia, icterícia, retardo mental, miocardite e pneumonia. As infecções do terceiro trimestre são geralmente subclínicas e alguns indivíduos infectados desenvolvem coriorretinite ou incapacidade neurológica mais tarde na vida. A incidência de lesões cerebrais foi relatada como 30% na 5ª semana de gestação, 10% na 20ª semana de gestação e menos de 5% na 28ª semana.4,17
O rastreio da toxoplasmose durante o pré-natal é feito por meio de testes sorológicos e avidez de IgG, que apresentam limitações. 5-6 Os testes moleculares permitem maior agilidade e precisão diagnóstica.7 A alta sensibilidade e especificidade da reação em cadeia da polimerase em tempo real (qPCR) no líquido amniótico levou à inclusão deste exame na rotina de atendimento a gestantes com toxoplasmose em centros de referência.8
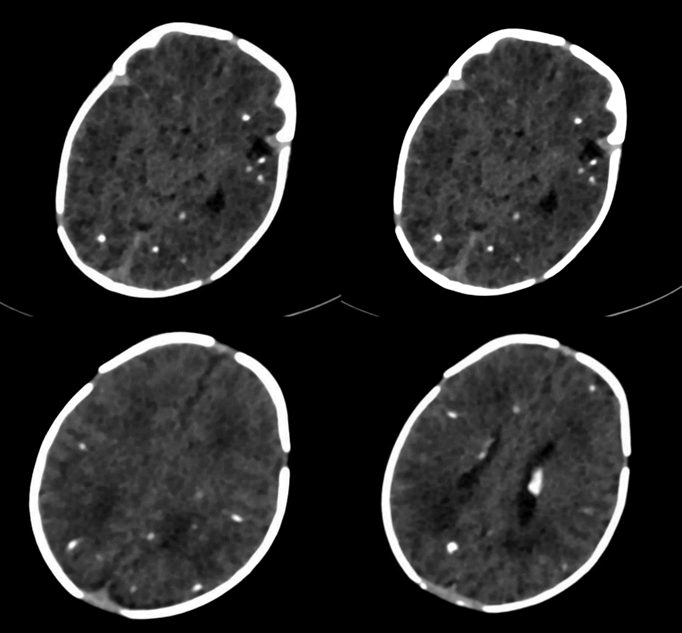
Diante disso, o objetivo do presente relato de caso é descrever o caso clínico de um recém-nascido proveniente de uma cidade do interior do estado do Rio de Janeiro com soropositividade dos anticorpos imunoglobulina M (IgM) e imunoglobulina G (IgG) anti-Toxoplasma Gondii (T. Gondii) além da tomografia de crânio apresentando aumento de ventrículo esquerdo e múltiplas calcificações difusas intraparenquimatosas.
Palavras-chaves: Toxoplasmose Congênita; Infecções congênitas; Toxoplasma Gonddi.
METODOLOGIA
Trata-se de um estudo de relato de caso, retrospectivo com pesquisa exploratória, descritiva e qualitativa. A coleta de dados foi realizada diretamente via prontuário semiestruturado do Hospital São José do Avaí. Fora realizada revisão bibliográfica nas plataformas PubMed, Scielo, Sociedade brasileira de Pediatria e Ministério da Saúde. Este estudo obedeceu a todas as normas e preceitos éticos, atendendo a resolução 466/12/CONEP.
RELATO DE CASO:
Recém-nascido (RN) N A.F.P.S., sexo feminino, pré-termo de 36 semanas e 4 dias, nascido de parto vaginal em apresentação cefálica com peso adequado para idade gestacional, APGAR 8/9, sem alterações relevantes ao exame físico, apresentando história gestacional de mãe com rastreio sorológico negativo durante o primeiro trimestre da gestação, porém, evoluindo com sorologias IgG e IgM reagentes para toxoplasmose no último trimestre. Dessa forma, de acordo com o registro do cartão de pré-natal da gestante, o obstetra assistente iniciou, de forma imediata, o tratamento com esquema tríplice (sulfadiazina, pirimetamina e ácido folínico). Devido ao histórico materno de soropositividade para toxoplasmose na gestação, foi necessário manter o recém-nascido internado para realização da investigação de toxoplasmose congênita.
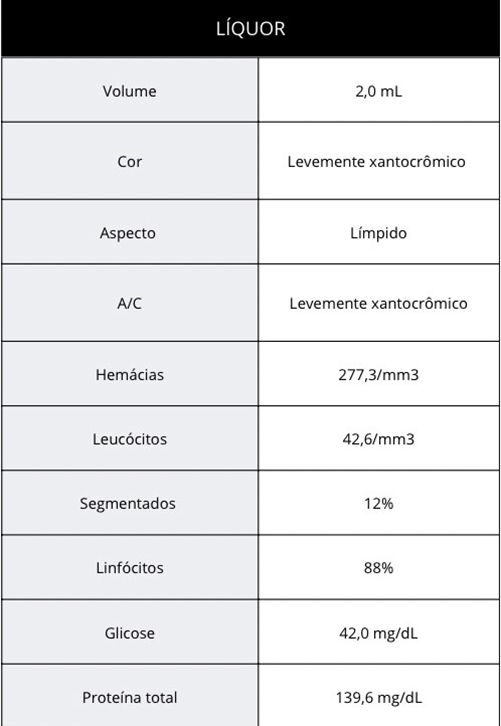
Realizou-se o rastreio de forma completa, incluindo os exames laboratoriais, sorologia para toxoplasmose IgG reagente e IgM 3,86 UI/ml (VR superior a 0,59); Mapeamento de retina evidenciando alteração macular e em arcada inferior temporal em olho esquerdo, sugestiva de coriorretinite; Ultrassonografia transfontanela, que evidenciou ampliação do corno posterior do ventrículo lateral esquerdo e discretos focos ecogênicos em região da coroa radiada bilateralmente, sendo então indicado tomografia computadorizada de crânio, comprovando múltiplas calcificações difusas intraparenquimatosas e aumento de ventrículo esquerdo (imagem 1); Radiografia de ossos longos (sem alterações); Análise de LCR (quadro1).
Quadro 1. Resultado da análise de líquor.
Após resultados dos exames e discussão do caso com a infectologista pediátrica, foi confirmado o diagnóstico de toxoplasmose congênita sendo iniciado o tratamento com sulfadiazina na dose de 100 mg/kg/dia de 12/12 horas, pirimetamina na dose de 1 mg/kg/dia de 24/24 horas, ácido folínico na dose de 10 mg/dia 3 vezes na semana e prednisolona na dose de 1 mg/kg/dia de 12/12 horas, conforme preconizado em diretriz do Ministério da Saúde publicada em 2023.
Após término do rastreio completo e início do tratamento adequado, a paciente recebeu alta hospitalar em boas condições clínicas com encaminhamento para acompanhamento ambulatorial pela infectologista pediátrica, neuropediatra, oftalmologista, otorrinolaringologista e pelo ambulatório de alto risco.
DISCUSSÃO
A toxoplasmose congênita é uma infecção ocasionada pelo parasita Toxoplasma gondii proveniente da primo-infeção materna durante a gestação ou da reativação da infecção latente na gestante imunocomprometida, sendo transmitida ao feto, ainda intraútero, via transplacentária. 9,16
O risco de transmissão fetal no primeiro trimestre é de 55%, seguido de 44 % no segundo trimestre e 71 % no terceiro trimestre. Visto isto, conclui-se que o risco de contaminação no início da gestação é menor quando comparado ao término, porém, sendo inversamente proporcional quanto as manifestações de complicações e gravidade. 10
O quadro clínico exibe uma gama variada de manifestações, que podem se estender desde casos assintomáticos até quadros graves de doença multissistêmica com repercussões importantes, sendo os pacientes prematuros os mais propícios a apresentarem a forma grave da doença em comparação a recém-nascidos a termo. 11
Sucintamente, a toxoplasmose congênita pode se manifestar com retardo do crescimento intraútero, prematuridade, ascite, hepatomegalia, catarata, microftalmia, miocardite, entre outras condições. Adicionalmente, é reconhecida pela tríade clássica composta por hidrocefalia, coriorretinite e calcificações intracranianas. Com o decorrer dos anos até décadas, a criança pode evoluir com aparecimento de complicações neurológicas, tais como surdez e retardo mental, além de problemas oftalmológicos que conduzem a déficits visuais.10
Após o nascimento do RN, é necessária a realização de diversos exames para rastreio da Toxoplasmose congênita, como exame de fundo de olho, ultrassonografia transfontanela, tomografia computadorizada de crânio, análise do líquido cefalorraquidiano, hemograma, perfil hepático e renal, exame audiológico, entre outros, além dos exames para confirmação diagnóstica, como testes sorológicos de IgM ou IgA específica (até 6 meses de idade), PCR para detecção de T. gondii em tecidos ou fluidos corporais, progressão dos níveis de IgG específica no lactente e presença de IgG específicas associadas às manifestações clínicas típicas na criança. O diagnóstico laboratorial em recém-nascidos é realizado idealmente pela aglutinação (ISAGA), oferecendo uma sensibilidade de 54 a 87% e especificidade de 77,7 a 100%. Porém, teste de triagem negativo, não exclui um possível diagnóstico de toxoplasmose congênita. Em decorrência disto, o diagnóstico sorológico no recém-nascido, é realizado por meio de pesquisa de IgA/ IgM materno e do concepto e teste de avidez para IgG. Contudo, a progressão da IgG após 12 meses de vida é avaliada como padrão ouro para o diagnóstico da doença congênita. É importante destacar que a triagem neonatal para toxoplasmose congênita foi estabelecida como um dos exames obrigatórios pelo Ministério da Saúde, conforme disposto na Portaria nº 1369, de 6 de junho de 2022. 9,10, 12-14
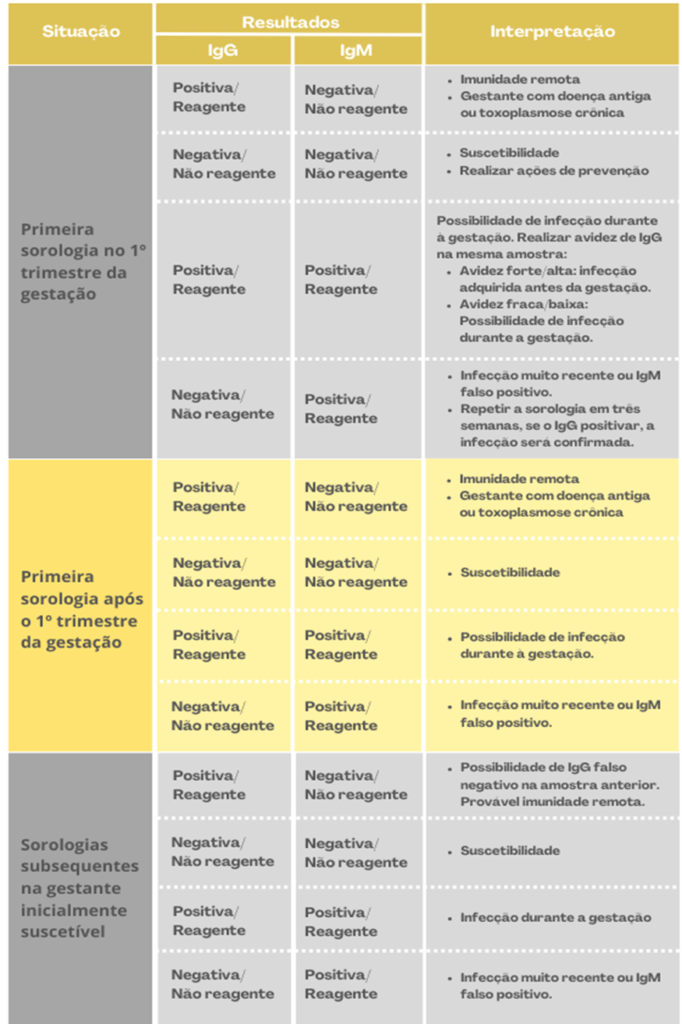
O Ministério da Saúde do Brasil recomenda a realização da Triagem sorológica, essencialmente em áreas com grande prevalência da doença, sendo utilizados primordialmente as sorologias de imunoglobulina M e imunoglobulina G e Avidez de IgG, podendo ainda ser solicitado o PCR, de acordo com acessibilidade de cada local. Esta medida permite um acompanhamento adequado durante toda a gestação, com o intuito de prevenir a transmissão fetal. Entretanto, em casos de detecção de transmissão intrauterina, essa abordagem também possibilita o diagnóstico precoce, com a implementação do tratamento ideal e a prevenção de futuras sequelas. A sorologia é aplicada no primeiro trimestre, e os casos confirmados, são conduzidos para o acompanhamento no pré-natal de alto risco. Para rastreio obstétrico, realiza-se a pesquisa de imunoglobulina G, que pode ser interpretada da seguinte forma: quando comparadas duas amostras dos títulos de IgG, que foram colhidas com no mínimo 3 semanas de intervalo, juntamente com a presença de um exame negativo para IgG, e outro positivo para IgG, ou aumento de IgG concomitantemente IgM positivo, resulta na confirmação da infecção aguda pelo T. Gonddi. Entretanto na triagem neonatal, a interpretação da sorologia para detecção de IgG é complexa, devido à transferência dos anticorpos IgG da mãe para o recém-nascido, cuja degradação pode levar cerca de um ano após o parto. Portanto, é de suma importância acompanhar os níveis de IgG ao longo do primeiro ano de vida. O diagnóstico é excluído quando não há soroconversão após os 12 meses de idade, sendo obrigatória a repetição do teste após 2 meses da realização do exame anterior. Por outro lado, presença de imunoglobulina G e Imunoglobulina A, em crianças menores que 6 meses de vida, confirma a doença congênita. Pode ainda, utilizar o teste de avidez de IgG, o qual permite determinar o período em que a infecção foi adquirida, onde uma alta avidez, indica a presença de anticorpos formados há mais de 12 semanas a 16 semanas. Essa interpretação sugere que, quando há alta avidez e resultados positivos para IgM e IgG no primeiro trimestre, a infecção ocorreu antes da gestação, aproximadamente 4 meses antes. No entanto, uma baixa avidez, em conjunto com resultados positivos para IgM e IgG, informa uma recente infecção. Sendo assim, crucial repetir o exame, pois a associação entre baixa avidez de IgG e títulos altos de IgM e IgG é indicativo significativo que indica um processo de infecção aguda ativa. Desta forma, foi adaptado o Quadro 2, para sistematização dinâmica da interpretação de exames de rastreio frente aos valores obtidos. 15.
Quadro 2. Sumariza os resultados dos exames de rastreio da toxoplasmose congênita, e subsequente interpretação e conduta.
O tratamento é obrigatório, devendo ser iniciado, preferencialmente, a partir da primeira semana de vida e mantido durante todo o primeiro ano de vida do paciente, conforme o esquema terapêutico do ministério da saúde que orienta o uso, por via oral, de Sulfadiazina na dose de 100 mg/kg/dia em duas doses diárias ; Pirimetamina na dose de 1 mg/kg/dia em uma dose diária, por 2 a 6 meses, e depois 1 mg/kg/dia, três vezes por semana e ácido folínico na dose de 10 mg/dia, administrado 3 vezes na semana e mantido até 1 semana após a suspensão da pirimetamina.16
Caso haja alterações oculares ou neurológicas, deve-se acrescentar ao tratamento anteriormente citado a prednisolona na dose de 1 mg/kg/dia de 12/12 horas, por via oral, durante quatro semanas. Vale ressaltar a importância de realizar o tratamento de forma correta, a fim de evitar piora do quadro e sequelas futuras. 16
A prevenção primaria da infecção aguda pelo T. Gondii durante a gestação, pode ser realizada por meio da educação higiênica dietético, ou seja, a lavagem adequada de alimentos, frutas e legumes, o consumo de carnes bem passadas, evitando as formas cruas ou mal passadas, higienização frequente das mãos, principalmente à manipulação de alimentos, evitar contato direto com fezes de gatos, e locais potencialmente contaminados, como caixas de areia, praias e jardins, e optar por consumo de água filtrada. Além das medidas de prevenção primária, é importante a sistematização de um pré-natal adequado para promover as realizações das triagens sorológicas do primeiro trimestre e mensalmente nas gestantes vulneráveis, com o objetivo de identificar precocemente a doença e tratar adequadamente afim de um prognóstico mais favorável. A recente implementação da triagem neonatal para toxoplasmose no Brasil, que inclui a pesquisa de anticorpos IgM, complementa a investigação materna durante a gravidez. Essa estratégia representa um aliado significativo na redução da incidência de infecção do concepto. 16
CONCLUSÃO
A toxoplasmose congênita é uma doença com desfechos altamente desfavoráveis e complicados se não conduzida de forma apropriada. É de suma importância o diagnóstico durante a realização do pré-natal e início da terapêutica adequada precocemente. Além disso, realizar os exames de rastreio do lactente ainda durante internação hospitalar e iniciar o tratamento auxilia a diminuírem as chances de agravamento e sequelas do quadro do recém-nascido, uma vez que nesses pacientes, a infecção pode se dar de forma assintomática inicialmente, podendo evoluir negativamente com o comprometimento neuropsicomotor significativo. Mudar Ademais, os pontos-chaves para evitar que tal infecção se propague são o trabalho de conscientização e prevenção da população, principalmente em gestantes, e o acompanhamento adequado durante o pré-natal, a fim de não suceder a toxoplasmose congênita.
REFERÊNCIAS BIBLIOGRÁFICAS
- Brazilian Journal of Implantology and Health Sciences. Volume 6,Issue2 (2024),Page 1349-1357.
- Rodrigues NJL, Manzini S, Pereira JKF, Cruz TS, Bertozzo TV, Moraes GN, Abbade JF, Langoni H.Atualizações e padrões da toxoplasmose humana e animal.Vet. e Zootec. 2022; v29: 001-015.
- MANDELBROT, L. & PETERSEN, E. Toxoplasmosis and pregnancy. UpToDate, 2022. Disponível em: https://www.uptodate.com/contents/toxoplasmosis-and-p regnancy. Acesso em: 18 mar. 2024.
- Revista Thêma et Scientia – Vol. 11, no 1, jan/jun2021.
- Peyron, F. et al. Maternal and congenital toxoplasmosis: Diagnosis and treatment recommendations of a French multidisciplinary working group. Pathogens 8, 1–15(2019).
- Pomares, C. & Montoya, J. G. Laboratory Diagnosis of Congenital Toxoplasmosis. J. Clin. Microbiol. 54, 2448–2454 (2016).
- Robert, M. G., Brenier-Pinchart, M. P., Garnaud, C., Fricker-Hidalgo, H. & Pelloux, H. Molecular diagnosis of toxoplasmosis: recent advances and a look to the future. Expert Rev. Anti. Infect. Ther. 19, 1529–1542 (2021).
- De Oliveira Azevedo, C. T., Do Brasil, P. E. A. A., Guida, L. & Moreira, M. E. L. Performance of Polymerase chain reaction analysis of the amniotic fluid of pregnant women for diagnosis of congenital toxoplasmosis: A systematic review and meta- analysis. PLoS One 11, 1–26 (2016).
- Galit Holzmann-Pazgal. Congenital Toxoplasmosis in Cloherty and Starks. Manual of Neonatal Care. 8th ed., Wolters Kluwer, Philadelphia, 2017; p720727.
- Sociedade brasileira de triagem neonatal erros inatos do metabolismo. Departamento Cientifico de Neonatologia. Toxoplasmose congênita. Documento científico, set. 2022.
- Khan K, Khan W. Toxoplasmose congênita: Uma visão geral das manifestações neurológicas e oculares. Parasitol Int. Dezembro de 2018;67(6):715-721.
- Maldonado YA, Read JS. Diagnosis, Treatment, and Prevention of Congenital Toxoplasmosis in the United States. Pediatrics Commitee on Infectious Diseases. Pediatrics. 2017;139(2):1-46.
- Inagaki ADM. Analise Espacial de Prevalência de Toxoplasmose em Gestantes em Aracaju. Ver Bras Ginecol Obstet. 2014; 36:12.
- Fontes AA. Study of brainstem auditory evoke potentials in early diagnosis of congenital Toxoplasmosis. Braz J Otorhinolaryngol. 2018; 651:1-9.
- BRASIL. Ministério da Saúde. Protocolo de notificação e investigação: Toxoplasmose gestacional e congênita. Brasília/DF, Editora MS. 2018. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/protocolo_notificacao_investigacao_ toxoplasmose_gestacional_congenita.pdf.Acesso em:18 de março de 2024
- Sociedade brasileira de pediatria. Departamento Científico de Neonatologia. Toxoplasmose congênita. Documento Científico, jul. 2020
- Toxoplasmose no 2º trimestre de gravidez e sua atuação em patogenias do tecido nervoso: uma revisão de literatura. A microbiologia na contemporaneidade 2. Atena, 2023.p.37-46.Acesso em: 20 de março de 2024.
¹Hospital São José do Avaí, Itaperuna, Rio de Janeiro, Brasil
