EVENTS SUPPOSEDLY ATTRIBUTABLE TO COVID-19 VACCINATION IN ELDERLY PEOPLE IN THE STATE OF BAHIA
REGISTRO DOI:10.5281/zenodo.11536913
Beatriz Ferreira Chagas 1
Danilo Ribeiro Alves 2
Jeane Moraes Costa 3
Rodrigo Santos Damascena 4
Daiane Porto Ney 5
Orientadora: Alessandra Souza de Oliveira 6
Coorientadora: Arianna Oliveira Santana Lopes 7
Resumo
A pandemia da COVID-19 emergiu em Wuhan, China, em dezembro de 2019, declarada pela OMS como uma emergência internacional em janeiro de 2020. Desse modo, houve a necessidade de controlar a propagação e prevenção de complicações graves, para isso várias vacinas foram desenvolvidas e disponibilizadas. Este estudo visa identificar os eventos supostamente atribuíveis à vacinação em idosos e avaliar a incidência desses eventos em diferentes vacinas contra a COVID-19. Trata-se de estudo descritivo, documental, retrospectivo e com abordagem quantitativa. O estudo foi realizado com dados do e-SUS Notifica, no estado da Bahia, durante o período de janeiro de 2021 a setembro de 2022, realizado com 2073 notificações de idosos com idade média de 67,56 anos. Predominaram efeitos colaterais sistêmicos como febre, cefaleia e mialgia, a vacina AstraZeneca foi responsável pelo maior percentual de eventos adversos; 88,40% das notificações foram classificadas como não graves, sendo a CoronaVac associada ao maior número de eventos graves e óbitos. Apesar dos eventos adversos registrados, as vacinas permanecem eficazes na prevenção de doenças, com benefícios superando os riscos.
Palavras-chave: Idoso. SARS-CoV-2. Vacinas.
1 INTRODUÇÃO
A pandemia da COVID-19, iniciou com um surto repentino de pneumonia com origem desconhecida, em dezembro de 2019, em Wuhan, uma cidade situada na China. Inicialmente, foi tratado como epidemia, sendo necessário medidas de controle com a testagem em massa e isolamento social. Em janeiro de 2020, a Organização Mundial da Saúde (OMS) declarou o novo coronavírus, denominado de SARS-CoV-2, responsável pela Covid-19, como uma emergência internacional devido à sua alta transmissibilidade e letalidade. Como resultado da pandemia, houve uma perda significativa de vidas humanas, repercussões econômicas e um aumento na pobreza (Bee et al., 2022; Ciotti et al., 2020; Farias, 2020; Filho et al., 2022).
Com o aumento no número de casos, elevadas taxas de mortalidade e superlotação dos serviços de saúde, tornou-se necessário a elaboração de um tratamento eficaz para frear a doença. Desde então, diferentes tecnologias foram empregadas para desenvolver vacinas contra a infecção, como o vírus inativado, vetor viral e RNA mensageiro. Nesse contexto, até o momento existem quatro vacinas disponíveis no Brasil, que foram autorizadas pela Agência Nacional de Vigilância Sanitária (ANVISA) e disponibilizadas à população, sendo elas, as vacinas Oxford/Astrazeneca, Janssen, CoronaVac e Pfizer (Comirnaty) (Bee et al., 2022; Brasil, 2022).
Ainda existem inúmeros questionamentos sobre a segurança e eficiência das vacinas contra a Covid-19, uma vez que foram vacinas disponibilizadas em caráter emergencial e desenvolvidas em curto período de tempo. Entretanto, a aceleração e intensificação no desenvolvimento dos imunobiológicos teve como objetivo travar a pandemia e diminuir o impacto econômico, na saúde e na sociedade. A agilidade na produção da vacina ocorreu a partir da inovação, motivação e vasto conhecimento da comunidade científica, fundamentado no compartilhamento de saberes e criação de parcerias científicas e tecnológicas. (Filho et al., 2022; Kuter et al., 2021; Silva et al., 2021a).
No processo de administração das vacinas é fundamental a vigilância dos efeitos adversos, investigando os eventos supostamente atribuíveis à vacinação ou imunização (ESAVI). O ESAVI é uma ocorrência médica indesejada, que pode ocorrer após a administração de um imunobiológico, com a manifestação de sintomas, doenças ou achados laboratoriais anormais. Outrossim, existem os eventos esperados e inesperados, sendo importante a sua identificação e classificação para a implementação de novas tecnologias aplicadas às vacinas (Brasil, 2020a; Brasil, 2020b).
Os ESAVIs podem ser classificados como Eventos Adversos Graves (EAG), que representam ameaça à vida do paciente, exigindo intervenção médica imediata e/ou hospitalização para evitar disfunções significativas, incapacidades permanentes, podendo levar a anomalias congênitas ou resultar em óbito. Em contrapartida, existem os Eventos Adversos Não Graves (EANG), que englobam todos os outros eventos que não atendem aos critérios estabelecidos para EAG (Brasil, 2020c; Silva et al, 2021a).
Os idosos foram caracterizados como grupo de risco para a doença e prioritários para o recebimento das vacinas, pois passam por um processo denominado de imunosenescência que promove a diminuição da resposta imunológica, reduzindo a capacidade de combater infecções, que associada às comorbidades prévias limitam ainda mais a resposta imune. Dessa maneira, estão mais propensos a adquirir a doença e apresentar complicações decorrentes da infecção. Ademais, os dados epidemiológicos demonstram maior número de internações em terapia intensiva e maiores taxas de mortalidade nessa população (Bee et al., 2020; Figueiredo et al., 2020; Filho et al., 2022; Flores et al., 2020; Guo et al., 2020; Liu et al., 2020).
Diante do exposto, o objetivo deste estudo foi identificar os eventos supostamente atribuíveis à vacinação contra a covid-19, os sinais e sintomas e quais vacinas apresentaram maior incidência de eventos adversos em idosos.
2 FUNDAMENTAÇÃO TEÓRICA OU REVISÃO DA LITERATURA
2.1 A PANDEMIA COVID 19
O novo coronavírus, denominado de SARS-CoV 2, surgiu em dezembro de 2019 na cidade de Wuhan, na China. A origem ainda não está totalmente clara, mas é provável sua associação com o morcego, visto que o SARS-CoV 2 é semelhante, geneticamente, com o coronavírus do tipo SARS do morcego, isolado em 2015. Esses dados fortalecem a hipótese de que o Covid-19 foi originado no morcego e transmitido para o ser humano (Benvenuto et al., 2020).
Inicialmente, a Organização Mundial de Saúde (OMS) declarou como uma emergência de saúde pública e posteriormente, em março de 2020, declarou como uma pandemia mundial, uma vez que o número de regiões afetadas e o número de infectados aumentavam diariamente. A partir de então, houve grandes esforços coletivos na produção de estudos, pesquisas e informações para sanar as dúvidas acerca da doença (Galvão; Roncalli, 2021).
No Brasil, o primeiro caso da doença surgiu em 26 de fevereiro de 2020, tratando-se de um homem idoso, 61 anos, com história de viagem recente à Itália (Brasil, 2020d). Após o primeiro caso confirmado, o país apresentou um aumento significativo no número de casos e também de mortes, até o dia 13 de abril de 2022 o Brasil já havia registrado 29.992.22 casos e 660.108 óbitos, sendo que atualmente é possível identificar uma redução dos casos e óbitos a partir de fevereiro de 2022 (Brasil, 2022a).
Ao longo da pandemia, a Bahia apresentou números preocupantes, tanto de casos quanto de óbitos. Nos primeiros meses o total de casos confirmados, diariamente, eram relativamente baixos, mas durante a pandemia as curvas dos gráficos apresentavam crescimento, mesmo com as medidas de controle estabelecidas. No dia 27 de junho de 2020, a Bahia chegou a registrar 8.822 novos casos, perdendo apenas para o dia 03 de fevereiro de 2022 que apresentou 15.536 novos casos (Bahia, 2022; Brasil, 2022a).
Em relação à situação da cobertura vacinal, identifica-se um parâmetro contrário ao número de casos, observa-se um aumento significativo no número de pessoas vacinadas. O total de doses aplicadas em toda a Bahia corresponde a 28.312.409, sendo 88,4% até o dia 27 de maio de 2022. Em relação a região Sudoeste do estado, a macrorregião de saúde é composta por 74 municípios, tendo 3.616.489 doses aplicadas, o que corresponde a 82,1% (Bahia, 2022).
2.2 COVID 19: A PESSOA IDOSA COMO PARTE DOS 19 GRUPOS DE RISCO
É possível observar que o vírus penetra no organismo pelo trato respiratório, se replica na mucosa respiratória e nas células epiteliais alveolares, promovendo, como consequência, danos ao epitélio da mucosa brônquica e as células epiteliais alveolares. Entretanto, é importante salientar que os fatores intrínsecos do indivíduo, como por exemplo as respostas imunológicas, podem contribuir para a patogênese da doença (Silva et al., 2021b; Yao et al., 2020).
Pacientes que possuem uma alteração no seu sistema imunológico estão mais suscetíveis a contrair a doença, pois sua linha de defesa não é capaz de frear o vírus, aumentando riscos de formas graves da doença. Porém, mesmo com esses grupos estabelecidos por períodos específicos notou-se um aumento de complicações e número de óbitos em pacientes mais jovens no período final da pandemia (Mehra et al.,2020; Minussi et al., 2020; Zhou et al., 2020).
Dentre os grupos de risco, os dados mostram que entre os idosos a doença se apresenta com maior letalidade, apresentando taxas de mortalidade que variam de 3,6% a 14,8%. Estudo realizado por Wang, et al. (2020) demonstra que a doença pode progredir mais rapidamente em idosos do que em pessoas mais jovens. A partir desses achados e ao longo da pandemia, a população idosa ganhou destaque e é caracterizada como um grupo de risco (Mehra et al., 2020; Wang et al., 2020).
O covid-19 se disseminou rapidamente desde o primeiro caso, em Wuhan, e demonstrou um quadro clínico de amplo espectro de gravidade, podendo ser assintomático ou sintomático. Pacientes com idade avançada, têm menor contagem de células T CD4, e presença de marcadores que indicam imunossupressão estão associados aos casos mais graves onde foi necessário internação em unidade de terapia intensiva. Por este motivo, a pessoa idosa é considerada um integrante em potencial de risco para contaminação pelo Covid 19 (Flores et al., 2020; Guan et al., 2020; Silva et al., 2021b;Yao et al., 2020;).
Os idosos estão mais suscetíveis ao agravamento da doença, podendo apresentar sintomas incomuns e lesões em diversos órgãos. Além disso, durante o processo de hospitalização tendem a ter mais complicações. A vulnerabilidade à covid-19 da população idosa pode ser explicada por dois fatores principais: imunossenescência, caracterizada como a diminuição da eficácia do sistema imunológico, provocada pelo processo natural do envelhecimento, em que o organismo não responde corretamente a processos infecciosos; e a presença de comorbidades preexistentes no idoso que limitam a resposta do sistema imunológico (Figueiredo et al., 2020; Guo et al., 2020).
2.3 AS VACINAS DE COVID – 19 E EVENTOS SUPOSTAMENTE ATRIBUÍVEIS ÀS VACINAS
A rápida disseminação do vírus gerou inúmeros danos à saúde da população, ademais houveram grandes consequências na economia mundial, na saúde mental das pessoas e no acesso a bens essenciais, como por exemplo: alimentação, transporte, saúde, medicamentos, entre outros. Com isso, em busca de reduzir a propagação do vírus, cientistas do mundo inteiro trabalham com o objetivo de desenvolver uma vacina para combater o Sars-CoV 2 (Araújo et al., 2021).
Até o momento de elaboração deste estudo, existem 4 vacinas aprovadas pela Agência de Vigilância Sanitária (ANVISA) do Brasil, sendo elas, as vacinas Oxford/Astrazeneca, Janssen, CoronaVac e Pfizer, trata-se de vacinas com mecanismos, eficácia, esquemas e custos diferentes. Através desse registro aprovado pela ANVISA, garante o direito de comercialização, distribuição e utilização dessas vacinas pelos brasileiros (Agência Nacional de Vigilância Sanitária – ANVISA, 2021; Brasil, 2022b).
2.3.1 CORONAVAC
A coronavac é uma vacina produzida com o vírus inativado, por ser uma vacina que utiliza o vírus morto é mais estável, mais fácil de transportar, e armazenar, além disso é caracterizada por um menor índice de eventos adversos pós vacinal. (Instituto Butantan, 2021). Trata-se de uma vacina produzida pela Sinovac, na China, tendo apresentação em suspensão injetável, podendo ser unidose ou multidose. A cada dose é administrado 0,5mL, essa dose vai conter 600 UI do vírus inativado e sua via de administração é intramuscular (Instituto Butantan, 2021).
A vacina se mostrou bastante eficaz, uma vez que demonstrou eficácia de 51% contra a infecção sintomática, de acordo com estudo de fase 3, no Brasil, após administração de duas doses com intervalo de 14 dias entre as doses. Já em relação à hospitalização e casos graves, a vacina se mostrou 100% eficaz, além disso nenhuma morte pelo vírus ocorreu no grupo que recebeu a vacina (Organização Pan-Americana de Saúde – OPAS, 2021).
Em relação aos eventos adversos pós vacinal em adultos e idosos, trazidos em bula, são divididos em eventos muito comuns, comuns e incomuns. Acerca dos eventos incomuns pode-se citar: vômitos, dor abdominal, distensão abdominal, tonturas, tosse, perda de apetite, reações alérgicas, elevação da pressão arterial, inchaço, coceira, hiperemia, endurecimento e diminuição da sensibilidade. No que se refere aos eventos adversos comuns, a bula apresenta: cansaço, febre, dor no corpo, diarreia, náuseas e dor de cabeça como sintomas comumente encontrados após administração da vacina. No que se diz respeito aos eventos muito comuns a bula cita apenas a dor. Vale citar que os eventos adversos mais graves, citados como eventos incomuns, podem ocorrer em apenas 0,1 a 1% dos pacientes que recebem a vacina (Instituto Butantan, 2021).
2.3.2 ASTRAZENECA
A vacina ChAdOx1nCoV-19, mais conhecida como Astrazeneca ou Oxford, é produzida utilizando vetor viral (KNOLL et al, 2021). Apresenta-se em forma de suspensão injetável, multidose, ou seja 5 mL. Cada dose da vacina corresponde a 0,5 mL que contém 5 × 1010 partículas virais (pv) do vetor adenovírus recombinante de chimpanzé, deficiente para replicação (ChAdOx1), que expressa a glicoproteína SARS-CoV-2 Spike (S) (Fundação Oswaldo Cruz – Fiocruz, 2021).
Assim como a Coronavac, os eventos adversos são divididos a partir da frequência, sendo que essas reações adversas foram menos reportadas em idosos, maiores de 65 anos. No que se diz aos eventos muitos comuns, a bula cita cefaléia, náuseas, mialgia, artralgia, sensibilidade no local da administração, dor local, sensação de calor no local de injeção, prurido no local de injeção, equimose no local de injeção, fadiga, mal-estar, febre, calafrios (Fiocruz, 2021).
No que se refere a eventos comuns, a bula traz sintomas como, inchaço no local de injeção, eritema no local de injeção, endurecimento no local de injeção, pirexia , sintomas semelhantes à influenza, dor nas extremidades, vômito,diarreia. Em relação aos efeitos adversos incomuns pode-se mencionar: Hiperidrose, prurido, erupção cutânea, urticária, dor abdominal, tontura , sonolência, redução do apetite e linfadenopatia (Fiocruz, 2021).
2.3.3 COMIRNATY
A vacina Comirnaty, também conhecida como Tozinameran e BNT162b2, porém é conhecida popularmente como Pfizer, desenvolvida pela Pfizer-BioNTech, trata-se de um imunobiológico formulado em nanopartículas lipídicas de mRNA modificado por nucleosídeo que codifica a glicoproteína presente no vírus causador da covid – 19. A partir da formulação em nanopartículas lipídicas é possível que o RNA mensageiro não replicante entre na célula hospedeira permitindo que ocorra a expressão do antígeno S do vírus (Khehra et al., 2021; Pfizer, 2021).
O mRNA codifica a proteína S a partir de duas mutações na hélice central. A mutação destes dois aminoácidos para a prolina bloqueia a proteína S numa conformação pré-fusão antigenicamente preferida, promovendo a produção de anticorpos que neutralizam o antígeno (Pfizer, 2020). A administração de 2 doses da Pfizer-BioNTech com intervalo de 21 dias demonstrou 95% de eficácia na prevenção de infecção sintomática causada pelo covid-19 (Banerji et al., 2021).
Em relação aos efeitos adversos relatados no ensaio clínico, a dor local leve a moderada foi o sintoma mais relatado entre os pacientes vacinados entre 7 dias após a administração da vacina, sendo que os participantes com mais de 55 anos relataram menos dor do que os participantes mais jovens. Sobre os efeitos sistêmicos foram relatados com maior frequência em pacientes mais jovens, sendo os mais relatados a fadiga e a cefaléia (Polack et al., 2020).
De forma geral, os sintomas mais relatados após administração da vacina foram: Sensibilidade/dor no local da injeção (84,1%), inchaço no local da injeção (10,5%), vermelhidão no local da injeção (9,5%), febre (14,2%), fadiga (62,9%), cefaleia (55,1%), dores musculares (38,3%), calafrios (31,9%), dor nas articulações (23,6%), náusea (1,1%), mal-estar (0,5%), linfadenopatia (0,3%), reação alérgica grave (raro), queda facial unilateral temporária (raro) (Padda; Parmar, 2021).
2.3.4 JANSSEN
A vacina Ad26.COV2.S, desenvolvida pela Johnson & Johnson, utiliza a técnica de um vetor de adenovírus recombinante para replicar o sorotipo 26, Ad 26, que codifica a proteína S do vírus. A vacina foi derivada da primeira cepa isolada em Wuhan, na China. As vacinas baseadas em Ad26 são geralmente seguras e altamente imunogênicas (Sadoff et al., 2021).
O adenovírus possui a capacidade de funcionar como um tipo de transportador de material externo ao do indivíduo infectado. Dessa forma, a técnica se torna efetiva ao remover os adenovírus, que são prejudiciais ao organismo humano, que atribuem características infecciosas e prejudiciais aos seres humanos, e substituí-los por genes virais já conhecidos. Na vacina Janssen, o gene retirado impede o adenovírus de auto replicar – se e de qualquer manifestação patológica do vírus se desenvolver. Já o gene alocado no adenovírus, pertence ao Sars-CoV 2 e é responsável pela codificação das proteínas (Filho et al., 2022).
Quanto aos efeitos adversos são divididos com base na frequência. Sendo os sintomas mais comuns: dor de cabeça, náusea, dores musculares, dor no local da injeção e sensação de muito cansaço. No que se refere aos comuns a bula menciona os seguintes sintomas: vermelhidão no local da injeção, inchaço no local da injeção, arrepios, dor nas articulações, tosse e febre. Por fim, os sintomas considerados incomuns são: irritação na pele, fraqueza muscular, dor no braço ou perna, sensação de fraqueza, sensação de indisposição geral, espirros, dor de garganta, dor nas costas, tremor, suor excessivo, sentimento incomum na pele, como formigamento ou sensação de formigamento (parestesia), diarreia e tontura (Janssen, 2023).
3 METODOLOGIA
Trata-se de um estudo descritivo, documental, retrospectivo e com abordagem quantitativa dos dados. A pesquisa documental trata-se de um tipo de estudo que baseia-se em dados que ainda não receberam tratamento analítico ou que podem ser reelaborados a depender do tipo de pesquisa. São dados que ainda não foram analisados profundamente. Esse tipo de pesquisa tem o objetivo de selecionar, tratar, analisar e interpretar a informação bruta. Ademais, a pesquisa retrospectiva analisa e explora dados anteriores ao momento de realização do estudo, ou seja, o pesquisador coleta dados que precedem a elaboração do estudo (Camargo, et al., 2019; Fontelles, et al., 2009; Silva; Grigolo, 2002).
O estudo foi realizado com dados do e-SUS Notifica, no estado da Bahia, durante o período de janeiro de 2021 a setembro de 2022. Analisou-se os casos suspeitos e notificados de ESAVI das vacinas contra covid-19, na faixa etária entre 60 e 80 anos, totalizando 2.073 casos.
O estado da Bahia está localizado na região Nordeste do país, é caracterizado como o quinto estado com maior extensão territorial com 564.760.427km². Composto por 417 municípios, sendo dividido em 28 regiões de saúde que se consolida em 9 macrorregiões: Leste, Centro Leste, Norte, Centro Norte, Nordeste, Oeste, Sudoeste, Sul, Extremo Sul (Bahia, 2024).
Neste estudo, foram analisados eventos abertos, em andamento e encerrados. Durante a análise dos dados foram excluídos eventos supostamente atribuíveis a outras vacinas. As variáveis analisadas foram o município, idade, o imunobiológico administrado (Astrazeneca, Coronavac, Pfizer e Janssen), tipo de evento (graves e não graves), evolução do caso (acompanhamento, cura sem sequelas, necessidade de hospitalizacão, óbito e perda de seguimento), sexo, raça, comorbidades associadas e reações adversas.
Os dados foram coletados a partir das fichas de notificação e investigação do Centro de Referência de imunobiológicos especiais – CRIE, provenientes do Sistema e-SUS Notifica. Após coleta de dados, estes foram organizados em planilhas, utilizando o software Google planilhas, de acordo com os critérios de inclusão e exclusão. A análise estatística descritiva dos dados foi processada pelo software STATA para Windows, versão 14.0, considerando-se um nível de significância de 5% (α=0,05). O teste do Qui-quadrado (χ2) e o teste Exato de Fisher foram empregados na comparação de proporções.
Por se tratar de uma pesquisa documental que envolverá a consulta de dados que não são de domínio público e por se tratar de uma pesquisa com seres humanos, houve a necessidade de ser submetido ao Comitê de Ética em Pesquisa – CEP. Dessa forma, o presente estudo faz parte de um projeto aprovado previamente pelo CEP/Faculdade Independente do Nordeste – FAINOR com parecer nº: 5835567.
4 RESULTADOS E DISCUSSÕES OU ANÁLISE DOS DADOS
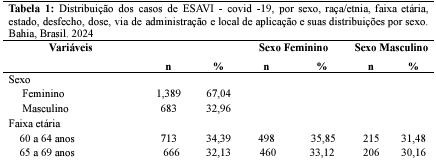
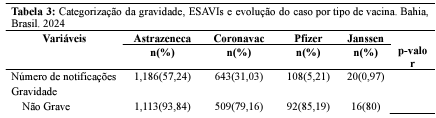
A partir da análise dos dados, conforme apresentado na tabela 1, foi identificado que 61,36% das notificações foram registradas no interior do Estado. Analisando o perfil epidemiológico dessa população, este estudo mostra que a maioria dos casos, mais especificamente 34,39%, ocorreu em idosos entre 60 e 64 anos, com uma média de idade de 67,56 anos. Além disso, as mulheres foram mais afetadas, representando 67,04% do total de notificações. Em relação às características de raça e etnia dos afetados, 38,85% se autodeclararam como pardos.
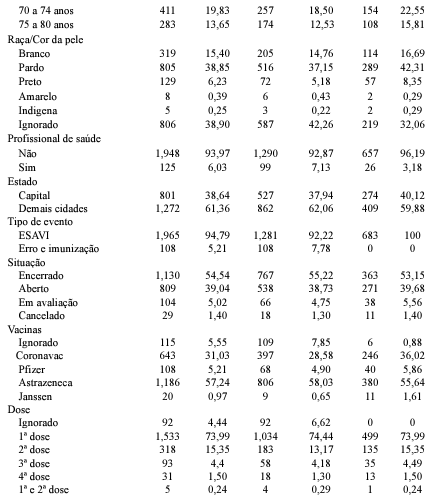
Durante a pandemia e início da vacinação no mundo, a disponibilização de vacinas foi limitada. Nesse contexto, houve a liberação emergencial de apenas duas vacinas no Brasil, sendo os imunobiológicos do laboratório Butantan e Astrazeneca, que foram administradas em grupos prioritários (Brasil, 2024a). Do total de notificações, 94,79% correspondem a eventos adversos e os demais correspondem a erro de imunização, sendo que a maior parte dos casos foram atribuídos ao imunobiológico da Astrazeneca, totalizando 57,24%, seguida pela Coronavac (31,03%).
Além disso, uma proporção representativa de 73,99% das notificações surgiram após a aplicação da primeira dose, seguida pela segunda dose, com 15,35%. Esses dados corroboram com os resultados do estudo conduzido por Andrzejczak-Grządko e Czudy (2021), onde 96,5% dos participantes da pesquisa relataram pelo menos uma reação adversa após receber a primeira dose da vacina Astrazeneca. Ademais, Silva (2023) também demonstra que a maior porcentagem de eventos adversos esteve associada à vacina do laboratório Oxford/FioCruz.
É importante observar que houve uma redução na cobertura vacinal em todo o país após a administração das primeiras e segundas doses (Brasil, 2024a). Desse modo, espera-se que a maioria dos eventos supostamente atribuíveis à vacinação estejam associados à primeira e segunda dose das vacinas.
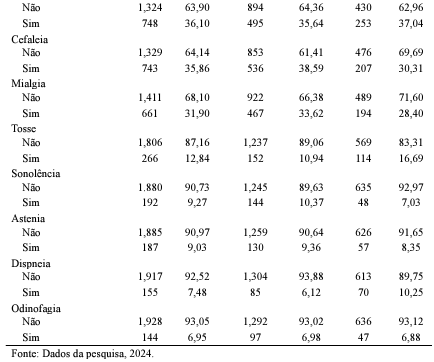
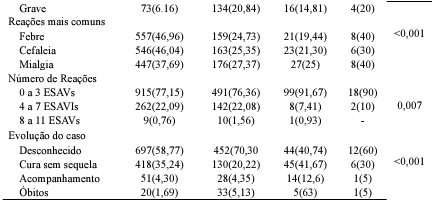
Em relação às reações adversas, foi observada uma predominância de febre em 36,10% dos casos, seguida de cefaleia (35,86%) e mialgia (31,90%) (Tabela 2). Os achados de estudos anteriores corroboram com os dados encontrados nesta pesquisa, uma vez que identificam febre, cefaleia e mialgia como sintomas comumente relatados após a administração de imunobiológicos. Ríos et al. (2021) demonstra que, ao analisar eventos adversos em adultos com mais de 60 anos, a mialgia foi o evento adverso mais frequente, ocorrendo em 79% dos casos, seguida pela febre, presente em 63% dos casos. Esses resultados confirmam a análise conduzida por Mahapatra et al. (2021), que também destacou a mialgia, a febre e a cefaleia como os sintomas sistêmicos mais relatados, com incidências de 70,2%, 55% e 46,2%, respectivamente.
Além disso, Menni et al. (2022) identificou a cefaleia como a reação sistêmica mais comum após a administração das vacinas contra a Covid-19, ocorrendo em 15,9% dos casos. A cefaleia, assim como a mialgia e a febre, são sintomas descritos em bula como eventos comumente esperados. Portanto, é previsto que essas reações sejam responsáveis por uma maior porcentagem dos casos de eventos supostamente atribuíveis à vacinação (Instituto Butantan, 2021; FioCruz, 2023; Pfizer, 2022).
A maior parte das reações adversas esteve associada à vacina Astrazeneca, com incidências de 46,04% para febre, 37,69% para cefaleia e 46,96% para mialgia. Outras reações adversas apresentaram uma incidência inferior a 10%, incluindo diarreia em 7,57% dos casos, náusea em 6,56%, dor abdominal em 6,27% e tontura em 5,21%. Essa distribuição demonstra que, embora as reações mais comuns sejam significativas, outras reações adversas também foram relatadas, ainda que em menor frequência.
Conforme descrito nas informações contidas nas bulas das vacinas, certas reações adversas são classificadas como raras, a Síndrome de Trombose com Trombocitopenia (TTS), que se caracteriza pela formação de coágulos sanguíneos é trazida como uma reação rara. Pesquisas indicam que após a administração da vacina contra a COVID-19, alguns pacientes desenvolveram tromboembolismo venoso severo em locais incomuns, juntamente com trombocitopenia e a presença de anticorpos circulantes contra o fator plaquetário 4 (FP4), clinicamente semelhante à trombocitopenia autoimune induzida por heparina. (Greinacher et al., 2021a; Schultz et al., 2021; Scully et al., 2021).
Neste estudo, foram identificados 18 casos de trombose, sendo 12 associados à vacina Astrazeneca, representando 0,86% do total de notificações. Entre esses casos, 12 foram classificados como EAG e 06 como EANG. Não houve registros de óbitos decorrentes dessas reações. Embora a causa desses eventos ainda não esteja completamente compreendida, as autoridades regulatórias afirmam que os benefícios da vacinação superam os riscos desses efeitos extremamente raros (Brasil, 2024b). Além disso, foram identificados 08 casos de hemorragia, sendo 05 referentes à vacina Astrazeneca, o que representa 0,24% do total de notificações. Estes dados ratificam os achados relacionados à trombocitopenia evidenciado em estudos anteriores (Freire et al., 2022; Greinacher et al., 2021b; Nepomuceno et al., 2022; Sobreira et al., 2021).
A ocorrência de dor torácica foi identificada como uma reação rara, afetando apenas 0,77% da população notificada. Este dado é consistente em todas as vacinas, já que todas registraram apenas um caso. De acordo com a Sociedade Brasileira de Cardiologia (2022), a dor torácica, característica do infarto agudo do miocárdio (IAM), é o sintoma mais prevalente da miocardite. Esses dados podem ser correlacionados com estudos que apontam uma incidência de miocardites agudas, após a administração da vacina contra a COVID-19, nos quais todos os participantes relataram experiência de dor torácica (Gomes et al., 2022; Kim et al., 2021).
Estudos indicam uma possível associação entre as vacinas e um aumento na pressão arterial. Uma análise conjunta de vários estudos revelou que os pacientes apresentaram pressão arterial anormal ou elevada após a vacinação. Além disso, 0,6% desses casos foram classificados como hipertensão em estágio III ou emergências hipertensivas (Angeli et al., 2022; Meylan et al., 2021; Zappa et al., 2021). O laboratório Butantan (2021), menciona a hipertensão arterial como um evento incomum, esperado em apenas 0,1% a 1% dos casos. Esses achados estão em consonância com este estudo, uma vez que identificou-se a elevação da pressão arterial em 0,91% dos casos, em pacientes que não haviam sido diagnosticados com Hipertensão Arterial Sistêmica (HAS) anteriormente.
Houve reações menos comuns, com uma incidência ainda mais baixa, que não se mostraram significativas em relação à população total do estudo. As reações identificadas neste estudo estão alinhadas com as possíveis reações das vacinas contra a doença, conforme descrito em bula e em estudos anteriores. Geralmente, os efeitos colaterais relatados após a administração da vacina não persistiram por mais do que alguns dias (Brasil, 2023; Instituto Butantan, 2021; FioCruz, 2023; Majumder et al., 2024; Ramasamy et al., 2020).

Em relação ao número de reações adversas, conforme tabela 3, foi observado que 78,86% dos indivíduos apresentaram até três reações. No entanto, cerca de 1,56% da população do estudo relataram de 08 a 11 reações, após a administração da Coronavac. Associado a aplicação da Astrazeneca esse percentual foi de 0,76%.
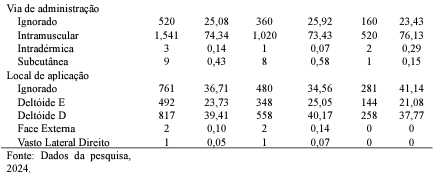
Ademais, a via de administração com maior percentual identificado foi a intramuscular com 74,34% e o local de aplicação predominante foi o deltóide direito (39,41%). Em relação a via de administração espera-se que a via intramuscular seja responsável pelo maior percentual, uma vez que é a via recomendada para aplicação das vacinas contra a covid-19, disponibilizadas no Brasil, conforme bulas (Instituto Butantan, 2021; FioCruz, 2023; Janssen, 2023; Pfizer, 2022).
Fonte: Dados da pesquisa, 2024.
Segundo a classificação dos ESAVIs, 11,60% foram classificados como EAG, sendo que 3,01% evoluíram para óbito. No entanto, 88,40% das reações foram classificadas como EANG. Os resultados deste estudo corroboram com os dados apresentados pelo Boletim Epidemiológico do Ministério da Saúde, onde a maioria dos casos de eventos adversos notificados foram classificados como EANG. Esses dados reiteram a eficácia dos imunobiológicos disponíveis no país para combater a doença. Portanto, os benefícios da vacinação superam os riscos, especialmente em idosos, que têm maior probabilidade de desenvolver formas graves da doença devido às alterações fisiológicas associadas ao envelhecimento (Brasil, 2021; Brasil, 2024c; Voysey et al., 2021).
Na análise da gravidade dos eventos e das vacinas administradas, destaca-se que a Coronavac apresentou o maior percentual de eventos graves (59%), seguida pela vacina da Astrazeneca (32,1%). Esses achados refutam os resultados de Gouveia et al., (2022), visto que não identificou-se eventos graves após a administração da Coronavac. Além disso, conforme o boletim epidemiológico de monitoramento dos eventos adversos pós-vacinação, a vacina Astrazeneca foi responsável pelo maior número de Eventos Adversos Graves, seguida pela Coronavac, Pfizer e Janssen (Brasil, 2023).
Entretanto, Silva (2023), demonstra que a vacina do laboratório Butantan foi responsável pela maior incidência de eventos adversos graves, seguida pela Astrazeneca, análise que corrobora com os achados deste estudo. Espera-se que o maior percentual de eventos adversos em idosos estejam associados a estas duas vacinas, uma vez que foram as primeiras disponibilizadas pelo Ministério de Saúde para o Estado da Bahia e consequentemente administradas nos idosos, que estão inclusos nos grupos prioritários para o recebimento do imunobiológico (Bahia, 2021). É essencial ressaltar que as notificações e classificações de eventos podem ser realizadas por qualquer profissional de saúde, não exclusivamente por profissionais de nível superior, o que pode resultar em erros na classificação.
Outro aspecto analisado foi a necessidade de assistência médica após as reações. A maioria precisou de atendimento ambulatorial (8,58%), seguido por internação superior a 24 horas (5,64%), observação inferior a 24 horas (2,12%) e internação em Unidade de Terapia Intensiva (UTI) (0,91%). Importante destacar que 86,97% das notificações não incluíram essa informação, uma lacuna significativa na análise. Entre os internados em UTI, foram relatadas reações como cefaleia, dor torácica, acidente vascular cerebral (AVC), trombose, hipoxemia, dispneia, dor abdominal e diarreia. De acordo com as bulas das vacinas analisadas neste estudo, reações como trombose, cefaleia, diarreia e dor abdominal são caracterizadas como muito raro ou com incidência desconhecida, muito comum e comum, respectivamente (Instituto Butantan, 2021; FioCruz, 2023; Janssen, 2023; Pfizer, 2022).
Ao analisar o padrão de hospitalização de pacientes, após eventos adversos pós-vacinação contra a COVID-19 em um hospital na Bahia, Nepomuceno et al. (2022) constata que a maioria das internações foram devido a trombose (91,2%), embora também tenham sido identificados casos de encefalite, pericardite, miocardite e Síndrome de Guillain-Barré. No entanto, este dado não coincide com os resultados deste estudo, já que apenas 0,33% dos participantes que necessitaram de assistência médica apresentaram trombose como reação notificada.
Quanto aos desfechos das notificações, 60,78% dos casos resultaram em perda de seguimento ou desconhecimento, 31,07% culminaram em cura sem sequelas, 5,26% estavam em acompanhamento até o momento da coleta de dados e 2,9% evoluíram para óbito. No que diz respeito aos óbitos, a distribuição dos imunobiológicos responsáveis foi a seguinte: Coronavac (55%), seguida pela Astrazeneca (33,3%), Pfizer (8,3%) e, por último, a Janssen com 3,3%, sendo que observou-se maior ocorrência após a primeira dose (71,6%). Esses resultados reforçam a análise conduzida por Silva (2023), que demonstrou que a maior parte dos óbitos foi registrada após a administração da vacina Coronavac.
Ao analisar o perfil dos pacientes que evoluíram para óbito, verificou-se que 76,6% deles possuíam comorbidades prévias. As comorbidades mais frequentes foram a Hipertensão Arterial Sistêmica, presente em 41,6% dos casos, seguida pelo Diabetes Mellitus, encontrada em 36,6% das notificações. Outras comorbidades, como Doença Pulmonar Obstrutiva Crônica (DPOC), sequelas de Acidente Vascular Cerebral, pneumopatias, cardiopatias, nefropatias, obesidade e neoplasias, também foram identificadas, embora em proporções menores. Silva et al. (2021a) demonstra que a maioria dos indivíduos que evoluíram a óbito após administração de vacinas contra a covid-19 possuíam alguma comorbidade ou residiam em instituições de longa permanência, este resultado corrobora com dados identificados neste estudo.
Após a análise dos óbitos associados à vacina Coronavac, verificou-se um total de 60 comorbidades descritas. Apenas 07 notificações não apresentavam descrição de comorbidades, das quais 05 foram diagnosticadas com infecção por covid-19. Em contraste, nos óbitos associados à vacina Astrazeneca, foram identificadas 24 comorbidades prévias. Esse achado corrobora com Silva (2023), que destaca que 85,2% dos óbitos após a administração das vacinas contra o Sars-Cov-2 foram decorrentes de “condições preexistentes causadas por outros fatores e não por vacinas”, enquanto apenas 0,2% foram associados ao produto, conforme a literatura.
Após a administração das vacinas, ocorre a ativação do sistema imunológico, pois os antígenos liberados pelos imunobiológicos simulam uma infecção natural, necessitando a mobilização de células de defesa (Mesquita et al., 2010). No entanto, com o envelhecimento, os idosos passam por um processo de imunossenescência, em que as células do sistema imunológico inato apresentam um declínio funcional (Torres et al., 2011). Figueiredo et al. (2020), afirma que a presença de comorbidades preexistentes em idosos, como hipertensão arterial, diabetes mellitus, doenças cardiovasculares, entre outras, enfraquece a capacidade funcional do organismo e limita a resposta imunológica. Dessa forma, o envelhecimento, aliado ao número de comorbidades identificadas nos idosos que receberam a vacina Coronavac, pode estar relacionado ao percentual de óbitos nessa população.
Do total de pacientes que evoluíram a óbito, 38,3% apresentaram resultados laboratoriais positivos para o vírus SARS-CoV-2. Em relação aos óbitos após a aplicação da Coronavac, 28,3% tiveram exame positivo para a doença, enquanto a AstraZeneca foi associada a 11,6% dos casos. Vale destacar que, entre esses óbitos, apenas 14 pacientes não tinham histórico de doenças prévias; no entanto, 64,2% desse grupo foi diagnosticado com COVID-19. Oliveira et al. (2021) destaca que os fragmentos contidos na vacina Coronavac não têm potencial para causar a doença. Portanto, esses óbitos podem estar relacionados à infecção pelo vírus da COVID-19 e às comorbidades associadas, e não especificamente às vacinas.
A média de idade da população que veio a óbito neste estudo foi de 71,2 anos. Esse valor é superior à média de idade das pessoas que apresentaram reações adversas. Este dado pode estar relacionado às vulnerabilidades da pessoa idosa que aumentam devido ao próprio envelhecimento, declínio fisiológico, associado às comorbidades adquiridas, hospitalizações frequentes e redes sociais inadequadas (Barbosa et al., 2019).
5 CONSIDERAÇÕES FINAIS
Em resposta aos objetivos deste estudo, observou-se que a maioria dos eventos foram classificados como EANG, com predominância de notificações entre mulheres. Houve um maior percentual de reações após a administração da vacina AstraZeneca. Os sintomas mais frequentemente relatados foram febre, cefaleia e mialgia, caracterizados como reações esperadas, conforme descrito nas bulas das vacinas. A Coronavac apresentou o maior percentual de eventos graves, seguida pela vacina AstraZeneca, assim como o número de óbitos. Apesar de haver um número de eventos considerados graves, sua incidência foi baixa. Portanto, as vacinas se mostraram seguras para a população idosa, com os benefícios superando os riscos.
No entanto, este estudo apresenta como limitação a utilização de dados provenientes de bancos de dados secundários, os quais se restringem às informações contidas nas fichas de notificação. É importante reconhecer que tais dados podem conter inconsistências, uma vez que as notificações no sistema e-SUS Notifica são inseridas por diversos profissionais de saúde. Portanto, é crucial que a equipe esteja devidamente capacitada para realizar essas notificações, a fim de garantir que sejam completas e detalhadas. Essa abordagem é fundamental, pois tais informações são essenciais para facilitar as investigações dos ESAVIs, avaliar os riscos associados à administração de vacinas e, consequentemente, garantir a segurança do processo de vacinação.
Os dados apresentados neste estudo podem contribuir para a reformulação das campanhas de vacinação contra a COVID-19, fornecendo subsídios para que os profissionais de saúde esclareçam as dúvidas sobre as vacinas e incentivem a vacinação, desmistificando preconceitos. Destaca-se a importância da vigilância dos eventos adversos pós-vacinação e a necessidade contínua de avaliação da segurança das vacinas. Além disso, este estudo busca estimular a investigação de novas questões a serem exploradas em pesquisas futuras, incentivando a análise constante de eventos supostamente atribuíveis à vacinação.
REFERÊNCIAS
ANDRZEJCZAK-GRZĄDKO, Z. S.; CZUDY, M. D. Side effects after COVID-19 vaccinations among residents of Poland. Eur Rev Med Pharmacol Sci, Poland v. 25, n. 12, p. 4418-4421, 2021. DOI 10.26355/eurrev_202106_26153. Disponível em: https://www.europeanreview.org/article/26153. Acesso em : 10 mai. 2024.
ANGELI, F.et al. Blood Pressure Increase following COVID-19 Vaccination: A Systematic Overview and Meta-Analysis. J Cardiovasc Dev Dis, v. 9, n. 5, p. 150, 2022. Disponível em: https://pubmed.ncbi.nlm.nih.gov/35621861/. Acesso em : 10 fev. 2024.
ANVISA. Agência Nacional De Vigilância Sanitária. Anvisa concede o primeiro registro definitivo para vacina contra a Covid-19 nas Américas. Brasília, DF. Disponível em: https://www.gov.br/pt-br/noticias/saude-e-vigilancia-sanitaria/2021/02/anvisa-concede-primei ro-registro-definitivo-para-vacina-contra-a-covid-19-nas-americas. Acesso em: 21 mai. 2022.
ARAÚJO, I. G. et al. Imunopatologia do SARS-CoV-2 e análise dos imunizantes no território brasileiro. Revista de Casos e Consultoria, v. 12, n. 1, 2021. Disponível em: https://periodicos.ufrn.br/casoseconsultoria/article/view/23990. Acesso em: 16 nov. 2023.
BAHIA, Secretaria Estadual de Saúde. Central Integrada De Comando E Controle Da Saúde. Brasil, 2022. Disponível em: https://bi.saude.ba.gov.br/transparencia/. Acesso em: 27 mai. 2022.
BAHIA. Chegada de 54.600 doses da CoronaVac leva a Bahia a atingir mais de meio milhão de vacinas recebidas. Bahia, 2021. Disponível em: https://www.saude.ba.gov.br/2021/01/25/chegada-de-54-600-doses-da-coronavac-leva-a-bahia -a-atingir-mais-de-meio-milhao-de-vacinas-recebidas/. Acesso em : 20 mai. 2024.
BAHIA. Governo Do Estado Da Bahia. Municipais e Regionalização. Bahia, 2024. Disponível em: htps://www.saude.ba.gov.br/municipios-e-regionalizacao/. Acesso em : 10 fev. 2024.
BANERJI, A. et al. mRNA Vaccines to Prevent COVID-19 Disease and Reported Allergic Reactions: Current Evidence and Suggested Approach. J Allergy Clin Immunol Pract. Estados Unidos, v. 9, n. 4, p. 1423-1437, 2021. Disponível em: htps//pubmed.ncbi.nlm.nih.gov/33388478/. Acesso em: 27 out. 2023.
BARBOSA, K. T. F.; OLIVEIRA, F. M. R. L.; FERNANDES, M. G. M. Vulnerability of the elderly: a conceptual analysis. Revista brasileira de enfermagem, Paraíba, v. 72, n. 2, p. 337–344, 2019. Disponível em: https://pubmed.ncbi.nlm.nih.gov/31826228/. Acesso em : 10 mai. 2024.
BEE, G. R. et al. Vacinas contra COVID-19 disponíveis no Brasil / Vaccines against COVID-19 available in Brazil. Brazilian Journal of Development, [s. l.],v. 8, n. 1, p. 6246–6263, 2022. Disponível em: https://ojs.brazilianjournals.com.br/ojs/index.php/BRJD/article/view/43157. Acesso em : 10 mai. 2024.
BENVENUTO, D. et al. The 2019-new coronavirus epidemic: evidence for virus evolution. J Med Virol, v. 92, n. 6, p. 568-576, 2020. Disponível em: <https://doi.org/10.1002/jmv.25688>. Acesso em: 11 abr. 2022
BRASIL. Ministério da Saúde. Manual de Vigilância Epidemiológica de Eventos Adversos Pós-Vacinação. Brasília, DF; 2020a. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/manual_vigilancia_epidemiologica_eventos_vaci nacao_4ed.pdf. Acesso em : 10 out. 2023.
BRASIL. Ministério da Saúde. Cobertura Vacinal COVID-19. Brasil, 2024a Disponível em: https://infoms.saude.gov.br/extensions/SEIDIGI_DEMAS_COBERTURA_COVID_RESIDE NCIA/SEIDIGI_DEMAS_COBERTURA_COVID_RESIDENCIA.html#. Acesso em: 18 abr. 2024.
BRASIL. Ministério da Saúde. Covid-19: Ministério Da Saúde Garante Que Os Efeitos Adversos Da Vacina São Leves. Brasília, 2024b Disponível em: https://www.gov.br/saude/pt-br/assuntos/saude-com-ciencia/noticias/2023/novembro/covid-19 -ministerio-da-saude-garante-que-os-efeitos-adversos-da-vacina-sao-leves. Acesso em: 18 mai. 2024.
BRASIL. Ministério da Saúde. Covid-19: O Ministério da Saúde garante que os efeitos adversos da vacina são leves. Brasília: Ministério da Saúde, 2023. Disponível em: https://www.gov.br/saude/pt-br/assuntos/saude-com-ciencia/noticias/2023/novembro/covid-19 -ministerio-da-saude-garante-que-os-efeitos-adversos-da-vacina-sao-leves. Acesso em : 10 fev. 2024.
BRASIL. Ministério da Saúde. Entenda O Efeito Colateral Raro Da Vacina Da AstraZeneca Contra covid-19. Brasil, 2024c. Disponível em: https://www.gov.br/saude/pt-br/assuntos/saude-com-ciencia/noticias/entenda-o-efeito-colatera l-raro-da-vacina-da-astrazeneca-contra-covid-19. Acesso em: 18 mar. 2024.
BRASIL. Ministério da Saúde. Painel Coronavírus. Brasil, 2022a. Disponível em: https://covid.saude.gov.br/. Acesso em: 03 abr. 2022.
BRASIL. Ministério da Saúde. Plano Nacional de Operacionalização da Vacinação contra a Covid-19. Brasília, DF; 2020b. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/svsa/coronavirus/plano-na. Acesso em: 03 abr. 2022.
BRASIL. Ministério da Saúde. Vacinas – Covid-19. Brasil, 2022b. Disponível em: <https://www.gov.br/anvisa/pt-br/assuntos/paf/coronavirus/vacinas>. Acesso em: 21 mai. 2022.
BRASIL. Secretaria Estadual De Saúde. Central Integrada de Comando e Controle da Saúde – COVID-19. Brasil, 2021. Disponível em: https://bi.saude.ba.gov.br/transparencia/. Acesso em: 27 mai. 2022.
BRASIL. Una-SUS. Coronavírus: Brasil confirma primeiro caso da doença. Brasil, 2020d. Disponível em: https://www.unasus.gov.br/noticia/coronavirus-brasil-confirma-primeiro-caso-da-doenca#:~:te xt=O%20Minist%C3%A9rio%20da%20Sa%C3%BAde%20confirmou,para%20It%C3%A1li a%2C%20regi%C3%A3o%20da%20Lombardia. Acesso em: 03 abr. 2022.
CAMARGO, L. M. A.; SILVA, R. P. M.; MENEGUETTI, D. U. D. O. Research methodology topics: Cohort studies or prospective and retrospective cohort studies. Journal of Human Growth and Development, São Paulo, v. 29, n. 3, p. 433–436, 2019. Disponível em: http://dx.doi.org/10.7322/jhgd.v29.9543. Acesso em : 10 mai. 2024.
CIOTTI, M. et al. The COVID-19 pandemic. Critical reviews in clinical laboratory sciences, v. 57, n. 6, 2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32645276/. Acesso em : 10 mai. 2024.
FARIAS, H. S. O avanço da Covid-19 e o isolamento social como estratégia para redução da vulnerabilidade. Espaço e Economia. Revista brasileira de geografia econômica, v. 17, 2020. Disponível em: https://doi.org/10.4000/espacoeconomia.11357. Acesso em : 10 mai. 2024.
FIGUEIREDO, M. N. et al. Espectro Clínico Da Covid-19 Em Idosos: Revisão Integrativa Da Literatura / Covid-19 Clinical Spectrum In Elderly: Integrative Literature Review. Brazilian Journal of Development, v. 6, n. 9, p. 68173-68186, 2020. Disponível em: https://www.researchgate.net/publication/346078627_ESPECTRO_CLINICO_DA_COVID-1 9_EM_IDOSOS_REVISAO_INTEGRATIVA_DA_LITERATURA_COVID-19_CLINICAL_ SPECTRUM_IN_ELDERLY_INTEGRATIVE_LITERATURE_REVIEW. Acesso em: 27 nov. 2023.
FILHO, A. D. S. V. et al. Vacinas para Covid-19: Uma revisão de literatura. Brazilian Journal of Development, v. 8, n. 1, p. 1880-1901, 2022. Disponível em: https://api.semanticscholar.org/CorpusID:246576694. Acesso em: 15 set. 2023.
FLORES, T. G.; LAMPERT, M. A. Por que idosos são mais propensos a eventos adversos com a infecção por covid-19?. Revista Amazonense de Geriatria e Gerontologia, Edição Especial, p. 5-8, 2020. Disponível em: https://raggfunati.com.br/docs/RAGG_Especial_covid-19.pdf. Acesso em: 27 set. 2023.
FONTELLES, M. J. et al. Metodologia da pesquisa científica: diretrizes para a elaboração de um protocolo de pesquisa. Revista paraense de medicina, v. 23, n. 3, p. 1–8, 2009. Disponível em: https://pesquisa.bvsalud.org/portal/resource/pt/lil-588477. Acesso em : 10 mai. 2024.
FREIRE, C.R.C. et al. Síndrome de Trombose com Trombocitopenia Induzida Por Vacina Para Covid-19: Relato De Diagnóstico e Manejo Precoce. Hematology, Transfusion and Cell Therapy, v. 44, n. 2, 2022. Disponível em: https://www.sciencedirect.com/science/article/pii/S2531137922012871. Acesso em: 15 mai. 2024.
FUNDAÇÃO OSWALDO CRUZ. Vacina covid-19 (recombinante). [Bula]. Rio de Janeiro: Fundação Oswaldo Cruz, 2021. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=VACINA%20COVID-19%20. Acesso em: 20 nov. 2023.
FUNDAÇÃO OSWALDO CRUZ. Vacina covid-19 (recombinante). [Bula]. Rio de Janeiro: Fundação Oswaldo Cruz, 2023. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=VACINA%20COVID-19%20. Acesso em: 16 mai. 2024.
GALVÃO, M. H. R; RONCALLI, A.G. Fatores associados a maior risco de ocorrência de óbito por COVID-19: análise de sobrevivência com base em casos confirmados. Revista brasileira de epidemiologia, v. 23, 2021. Disponível em: https://doi.org/10.1590/1980-549720200106. Acesso em: 27 set. 2023.
GOMES, D. A. et al. Miocardite Aguda após a Vacina de mRNA contra a COVID-19. Arquivos Brasileiros de Cardiologia, v. 118, n. 4, p. 783–786, 2022. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9007017/. Acesso em : 10 mai. 2024.
GOUVEIA, M. DA P. G. et al. Eventos adversos às vacinas coronavac e AstraZeneca em Uma coorte de trabalhadores da saúde. The Brazilian journal of infectious diseases: an official publication of the Brazilian Society of Infectious Diseases, v. 26, 2022. Disponível em: https://www.sciencedirect.com/science/article/pii/S1413867021004979. Acesso em : 10 mai. 2024.
GREINACHER, A. et al. Insights in ChAdOx1 nCoV-19 vaccine-induced immune thrombotic thrombocytopenia. Blood, v. 138, n. 22, p. 2256-2268, 2021b. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8483989/ Acesso em: 10 mai. 2024.
GREINACHER, A. et al. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. New England Journal of Medicine, v. 384, n. 22, 2021a. Disponível em: https://www.nejm.org/doi/full/10.1056/NEJMoa2104840. Acesso em: 10 mai. 2024.
GUAN, Wei-jie et al. Características clínicas da doença de coronavírus 2019 na China. New England Journal of Medicine, v. 382, n. 18, p. 1708-1720, 2020. Disponível em: <https://www.nejm.org/doi/full/10.1056/nejmoa2002032>. Acesso em: 10 ago. 2023.
GUO, T. et al. Clinical Characteristics of Elderly Patients with COVID-19 in Hunan Province, China: A Multicenter, Retrospective Study. Gerontology, v. 66, p. 467-475, 2020. Disponível em: https://www.semanticscholar.org/paper/Clinical-Characteristics-of-Elderly-Patients-with-A-G uo-Shen/ddb2610492450c2e7417462832c57094338d89c1. Acesso em: 15 ago. 2023.
INSTITUTO BUTANTAN. Vacina adsorvida covid-19 (inativada). [Bula]. São Paulo: Instituto Butantan, 2021. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/medicamentos/bulas-e-rotulos/bulas-uso-emergencia l/vacinas/bula-coronavac-atualizada.pdf. Acesso em: 20 set. 2023.
JANSSEN-CILAG FARMACÊUTICA. Covid-19 Vaccine Janssen suspensão injetável. [Bula]. Estados Unidos: Janssen-Cilag Farmacêutica Ltda, 2023. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?numeroRegistro=112363438. Acesso em: 10 jan. 2024.
KHEHRA, N. et al. Tozinameran (BNT162b2) Vaccine: The Journey from Preclinical Research to Clinical Trials and Authorization. AAPS PharmSciTech, v. 22, n. 172, 2021. Disponível em: https://doi.org/10.1208/s12249-021-02058-y. Acesso em : 10 mai. 2024.
KIM, H. W. et al. Patients With Acute Myocasilvarditis Following mRNA COVID-19 Vaccination. JAMA Cardiology, v. 6, n. 10, 29 jun. 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34185046/. Acesso em : 10 mai. 2024.
KUTER, B. J.; OFFIT, P. A.; POLAND, G. A. The development of COVID-19 vaccines in the United States: why and how so fast?. Vaccine, v. 39, n. 18, p. 2491-2495, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33824043/. Acesso em: 15 set. 2023
LIU, K. et al. Clinical features of COVID-19 in elderly patients: A comparison with young and middle-aged patients. J Infect, v. 80, n. 6, p. 14-18, 2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32171866/. Acesso em: 10 ago. 2023.
MAHAPATRA, S. et al. Adverse events occurring post-covid-19 vaccination among healthcare professionals–A mixed method study. International Immunopharmacology, v. 100, p. 108136, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34587578/. Acesso em : 10 jan. 2024.
MAJUMDER, M. A. A. et al. Self-reported side effects of COVID-19 vaccines among health professions students in India. PeerJ, v. 12, 2024. Disponível em:https://pubmed.ncbi.nlm.nih.gov/38590705/. Acesso em: 05 mai. 2024
MEHRA, A. et al. A crisis for elderly with mental disorders: Relapse of symptoms due to heightened anxiety due to COVID -19. Asian Journal of Psychiatry, v. 51, p. 102-114, 2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7166027/Minimal. Acesso em: 16 set. 2023.
MENNI, C. et al. Vaccine side-effects and SARS-CoV-2 infection after vaccination in users of the COVID Symptom Study app in the UK: a prospective observational study. The Lancet Infectious Diseases, v. 21, n. 7, p. 939–949, 27 abr. 2021.Disponível em: https://pubmed.ncbi.nlm.nih.gov/33930320/. Acesso em : 01 mai. 2024.
MESQUITA, D. J. et al. Immune system – part II: basis of the immunological response mediated by T and B lymphocytes. Revista Brasileira de Reumatologia, v. 50, n. 5, p. 552-580, 2010. Disponível em: https://pubmed.ncbi.nlm.nih.gov/21125191/. Acesso em: 22 mai. 2024.
MEYLAN, S. et al. Stage III Hypertension in Patients After mRNA-Based SARS-CoV-2 Vaccination. Hypertension, v.77, n.6. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33764160/. Acesso em : 10 mai. 2024.
MINUSSI, B. B. et al. Grupos de risco do COVID-19: a possível relação entre o acometimento de adultos jovens “saudáveis” e a imunidade. Brazilian Journal of Health Review, Curitiba, v. 3, n. 2, p. 3739-3762, 2020. Disponível em: <https://ojs.brazilianjournals.com.br/ojs/index.php/BJHR/article/view/9303/8445>. Acesso em: 15 ago. 2023.
NEPOMUCENO, A. F. S. F. et al. Perfil de hospitalização e fatores associados a Eventos Adversos de Interesse Especial após vacinação para COVID-19 em um hospital universitário da Bahia, Brasil. Jornal de Assistência Farmacêutica e Farmacoeconomia, v. 1, n. s.2, p. 26, 2023. Disponível em: https://ojs.jaff.org.br/ojs/index.php/jaff/article/view/519#:~:text=Objetivo%3A%20Descrever %20o%20perfil%20de%20hospitaliza%C3%A7%C3%A3o%20e%20fatores,realizado%20atr av%C3%A9s%20da%20an%C3%A1lise%20das%20hospitaliza%C3%A7%C3%B5es%20por %20EAIE.. Acesso em : 10 mai. 2024.
OLIVEIRA, S. A. A. N. L. Eventos Adversos Pós-Vacinação em Pacientes Vacinados Contra Covid-19 Atendidos no Hospital Do Servidor Público Municipal no Ano de 2021. Trabalho de Conclusão de Curso. 2022. (Residência em Clínica Médica) – Hospital do Servidor Público Municipal, São Paulo, 2022. Disponível em: https://docs.bvsalud.org/biblioref/2023/02/1416208/tcc-sahra-aparecida-oliveira.pdf. Acesso em: 16 mai. 2024.
Organização Pan-americana de Saúde (OPAS). OMS valida vacina contra COVID-19 da Sinovac para uso emergencial e emite recomendações de políticas provisórias. 2021. Disponível em: https://www.paho.org/pt/noticias/1-6-2021-oms-valida-vacina-contra-covid-19-da-sinovac-par a-uso-emergencial-e-emite. Acesso em: 21 mai. 2022.
PADDA, I. S.; PARMAR, M. Vacina Parmar M. COVID (SARS-COV-2) Vaccine. StatPearls [Internet]. 2021. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK567793/. Acesso em: 20 set. 2023.
PFIZER. Comirnaty®. [Bula]. Bélgica: Pfizer Manufacturing Belgium NV, 2021. Disponível em: https://www.consultas.anvisa.gov.br/#/bulario/detalhe/1924271?nomeProduto=COMIRNATY. Acesso em: 10 ago. 2023.
POLACK et al. Safety and efficacy of the BNT161b2 mRNA covid-19 vaccine. New England Journal of Medicine, v. 383, n. 27, p. 2603 -2615, 2020. Disponível em: <https://doi.org/10.1056/NEJMoa2034577>. Acesso em: 11 nov. 2023.
RAMASAMY, M. N. et al. Safety and immunogenicity of ChAdOx1 nCoV-19 vaccine administered in a prime-boost regimen in young and old adults (COV002): a single-blind, randomised, controlled, phase 2/3 trial. The Lancet, v. 396, 2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33220855/. Acesso em : 10 mai. 2024.
RIOS, C. D. M. et al. Percepción de eventos adversos en adultos mayores de 60 años luego de recibir la vacuna contra covid 19. Corrientes. 2021. Notas enferm. (Córdoba), v. 22, n. 39, p. 33–41, 2022. Disponível em: https://pesquisa.bvsalud.org/portal/resource/es/biblio-1380354. Acesso em : 10 mai. 2024.
SADOFF J. et al. Interim results of a phase 1–2a trial ofAd26. COV2. S Covid-19 vaccine.The New England journal of medicine, v. 384, n. 19, p. 1824–1835, 2021. Disponível em: <https://doi.org/10.1056/NEJMoa2034201>. Acesso em: 28 ago. 2023.
SCHULTZ, N. H. et al. Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination. New England Journal of Medicine, v. 384, n. 22, 9 abr. 2021.Disponível em: https://www.nejm.org/doi/full/10.1056/NEJMoa2104882. Acesso em : 10 mai. 2024.
SCULLY, M. et al. Pathologic antibodies to platelet factor 4 after ChAdOx1 nCoV-19 vaccination. The New England journal of medicine, v. 384, n. 23, p. 2202–2211, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33861525/. Acesso em : 10 mai. 2024.
SILVA, C.C et al. Covid-19: Aspectos da origem, fisiopatologia, imunologia e tratamento-uma revisão narrativa. Revista Eletrônica Acervo Saúde, v. 13, n. 3, 2021b. Disponível em: https://doi.org/10.25248/reas.e6542.2021 Acesso em: 27 nov. 2023.
SILVA, M. B.; GRIGOLO, T. M. Metodologia para iniciação científica à prática da pesquisa e da extensão II. Florianópolis: Udesc, 2002. (Caderno Pedagógico). Disponível em: https://educapes.capes.gov.br/bitstream/capes/560947/2/Metodologia_Pesquisa_web%202.pdf . Acesso em: 01 mai. 2024.
SILVA, R. B. DA. Epidemiologia dos eventos supostamente atribuíveis às vacinas covid-19 durante o primeiro ano da vacinação em Minas Gerais. Dissertação de Mestrado em Enfermagem. 2023. Universidade Federal de Minas Gerais, Belo Horizonte, p. 87–87, 2023. Disponível em: https://repositorio.ufmg.br/bitstream/1843/59248/1/25_09_23%3DFinal%20Disserta%C3%A 7%C3%A3o.pdf. Acesso em : 10 mai. 2024.
SILVA, T. M. R. DA. et al. Vacinas contra a COVID-19: principais plataformas e bases imunológicas. Estratégias de vacinação contra a COVID-19 no Brasil: capacitação de profissionais e discentes de enfermagem. Brasília, DF: Editora ABen, p. 41-51, 2021a. Disponível em: https://doi.org/10.51234/aben.21.e08.c0. Acesso em: 15 mai. 2024.
SOBREIRA, M. L. et al. Vacinas para covid-19 e complicações tromboembólicas. Jornal Vascular Brasileiro, v. 20, 2021. Disponível em: https://qa1.scielo.br/j/jvb/a/MThF6Rss3THGXJKLXZwd4Zc/. Acesso em: Acesso em: 10 mai. 2024.
TORRES K. C. L. et al. Imunossenescência: a relação entre leucócitos, citocinas e doenças crônicas. Revista Brasileira De Geriatria E Gerontologia, v. 11, n. 2, p. 259–273, 2011. Disponível em: https://doi.org/10.1590/1809-9823.2008.110210. Acesso em: 22 mai. 2024.
VOYSEY, M et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials. Lancet (London, England), v. 397, n. 10277, p. 881–891, 2021. Disponível em: https://doi.org/10.1016/S0140-6736(21)00432-3. Acesso em : 10 mai. 2024.
WANG, Weier; TANG, Jianming; WEI, Fangqiang. Updated understanding of the outbreak of 2019 novel coronavirus (2019‐nCoV) in Wuhan, China. Journal of medical virology, v. 92, n. 4, pág. 441-447, 2020. Disponível em: :https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7167192/. Acesso em: 21 Ago. 2023.
YAO, X. H. et al. A pathological report of three COVID-19 cases by minimal invasive autopsies Zhonghua Bing Li Xue Za Zhi, v. 49, n. 5, p. 411-417, mai. 2020. Disponível em: https://doi.org/10.3760/cma.j.cn112151-20200312-00193. Acesso em: 05 Ago. 2023.
ZAPPA, M. et al. Blood pressure increase after Pfizer/BioNTech SARS-CoV-2 vaccine. European Journal of Internal Medicine, v. 90, p. 111–113, jun. 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34158234/. Acesso em : 10 mai. 2024.
ZHOU, M.; ZHANG, X.; QU, J. Coronavirus disease 2019 (COVID-19): a clinical update. Front. Med. v. 14, n. 2, p. 126-135, 2020. Disponível em: https://doi.org/10.1007/s11684-020-0767-8. Acesso em: 28 set. 2023.
1 Discente do Curso Superior contato.beatrizfc@gmail.com de Enfermagem da Faculdade Independente do Nordeste e-mail:
2 Discente do Curso Superior daniloribeiro.a@hotmail.com de Enfermagem da Faculdade Independente do Nordeste e-mail:
3 Discente do Curso Superior de Enfermagem da Faculdade Independente do Nordeste e-mail: jeanemoraes.c@gmail.com
