EPIDEMIOLOGICAL PROFILE OF PATIENTS WITH LEPROSY IN PARNAÍBA-PI FROM 2012 – 2022
REGISTRO DOI:10.5281/zenodo.10910078
ARAUJO, Letícia Pereira Lima1
SANTOS, Lívia Noleto1
DE OLIVEIRA, Marisa Coragem Alves1
FONSECA, Maria Tavares Machado2
Introdução: A Hanseníase é uma doença infectocontagiosa causada pelo Mycobacterium leprae, acometendo principalmente pele e/ou nervos periféricos. É potencialmente incapacitante e, embora curável, seu diagnóstico causa grande impacto psicossocial, pelos preconceitos e estigmas que a envolvem desde a antiguidade. Nesse contexto, o Brasil ocupa o segundo lugar entre os países com maior número de casos no mundo, atrás apenas da Índia. A região Nordeste do país é a terceira com maior coeficiente de detecção geral e o Piauí está na 7ª posição, em nível nacional, e é o 2º estado do nordeste com maior prevalência de novos casos. No que se refere a Parnaíba, o município não atingiu a meta proposta pela OMS de ter a prevalência da hanseníase menor que 1 caso para cada 10.000 habitantes e ainda apresenta grande número de casos novos notificados. Objetivo: Analisar o perfil epidemiológico de pacientes portadores de Hanseníase em Parnaíba no Piauí. Metodologia: O trabalho de conclusão de curso será um estudo epidemiológico descritivo quantitativo e retrospectivo, elaborado a partir de dados obtidos do Sistema de Notificação de Agravos de Notificação (SINAN), no período de janeiro de 2012 a dezembro de 2022. Serão analisados os seguintes dados: sexo, faixa etária, raça, escolaridade, forma clínica, lesões cutâneas, classificação operacional no diagnóstico, nível de endemicidade, tipos de saída e grau de incapacidade física. Resultados e Discussões: No período de 2012 a 2022, foram notificados 12.504 casos de Hanseníase no estado piauiense, sendo Parnaíba o segundo município do Piauí com o maior número de casos, registrando 565 casos nesse mesmo período. Identificou-se a prevalência da doença na população com faixa etária de 40 a 49 anos, no sexo feminino e, principalmente, nos indivíduos de cor parda. Quanto ao grau de escolaridade, a maior incidência deu-se entre aqueles com nível educacional entre a 1ª a 4ª série incompleta do ensino fundamental, representando 25,87 % (n= 104) dos casos. A forma clínica dimorfa representou a maioria dos casos, bem como a classificação operacional diagnóstico multibacilar. Conclusão: De acordo com os resultados obtidos, concluímos que o Mal de Hansen consiste em um importante problema de saúde pública no município de Parnaíba. Embora o número de casos tenha apresentado flutuações ao longo dos anos, é preocupante que a taxa de detecção geral tenha se mantido em níveis elevados. Isso demonstra como essa doença é estigmatizada e negligenciada. Espera-se que estas informações propiciem o melhor conhecimento da situação de saúde da população parnaibana, caracterizando a dinâmica da epidemia e fortalecendo o sistema de vigilância epidemiológica da Hanseníase, reafirmando sua missão de instrumento de informação para a tomada de decisões baseadas em evidências no município.
Palavras-chave: Hanseníase; Mycobacterium leprae; Perfil epidemiológico.
1 INTRODUÇÃO
A Hanseníase encontra-se entre as doenças mais antigas já relatadas pelo homem. Dados apontam que, desde 4300 anos a.C, já havia descrição sobre a presença dessa patologia no Egito antigo. Além do mais, existem narrativas que remontam conhecimento sobre essa doença há mais de 4 mil anos na Índia, na China e no Japão. Nesse viés, fisiopatologicamente, a hanseníase é uma doença infectocontagiosa causada pelo Mycobacterium leprae, acometendo, principalmente, pele e/ou nervos periféricos. A doença pode afetar praticamente todos os órgãos e sistemas em que existam macrófagos, exceto o sistema nervoso central. Evolui de maneira crônica, podendo apresentar períodos de agudização denominados reações. É potencialmente incapacitante e, embora curável, seu diagnóstico causa grande impacto psicossocial, pelos preconceitos e estigmas que a envolvem desde a antiguidade (Silva, 2020; Azulay, 2015).
Por ser uma doença impossibilitadora, desde atividades simples até ações laborais, a Organização Mundial de Saúde (OMS) definiu, em 1991, como meta de eliminação, uma prevalência de menos de 1 caso a cada 10.000 habitantes. Para isso, implantou-se como principal estratégia a detecção precoce de casos, além do regime de poliquimioterapia (PQT) com rifampicina, clofazimina e dapsona.
Todavia, os fatores de risco dessa patologia dificultam o processo de combate à doença. Isso porque a Hanseníase está associada à desigualdade social e às condições socioeconômicas desfavoráveis, como analfabetismo, condições precárias de moradia, ausência de saneamento básico, crescimento urbano desorganizado e serviços de saúde ineficazes. Por isso, embora seja uma doença com conduta terapêutica reconhecida há muito tempo, a Hanseníase ainda é um problema de saúde pública em vários países, principalmente naquelas regiões subdesenvolvidas. Prova disso é que, segundo a Organização Mundial de Saúde (OMS), o Sudeste Asiático e as Américas são as áreas mais afetadas pela doença, com taxas de detecção de 7,72 e 2,86 casos por 100 mil habitantes, respectivamente. Ainda nesse sentido, a Índia, o Brasil e a Indonésia são os países mais endêmicos, responsáveis por 80% do total de casos registrados (Lopes, 2021; Rodrigues, 2020).
No cenário brasileiro, as regiões Sudeste e Sul já obtiveram êxito na redução acentuada de casos da Hanseníase, inclusive com coeficientes de prevalência abaixo da média nacional, que é de 8,49 novos casos por 100.000 habitantes. No entanto, as regiões Norte, Centro-Oeste e Nordeste ainda apresentam altos patamares de casos da doença. Apesar da tendência de estabilização dos coeficientes de detecção no Brasil, essa variação nos índices evidencia a relação das desigualdades regionais de desenvolvimento social e econômico com a história epidemiológica das doenças infectocontagiosas presentes no país. Assim, a dimensão sociocultural, ambiental e o padrão epidemiológico desigual da doença ainda constituem um desafio para os profissionais de saúde e para os próprios pacientes (Passos et al., 2016).
Nesse viés, a região Nordeste do país é a terceira com maior coeficiente de detecção geral, com 20,36/100 mil habitantes, o que caracteriza presença de alta endemicidade para a doença. Neste cenário, o estado do Piauí contribuiu com 879 novos casos em 2022 (27, 29 casos por 100 mil habitantes), ultrapassando o índice regional. Nesse cenário, o Piauí está na 7ª posição, em nível nacional, e é o 2º estado do nordeste com maior prevalência de novos casos. No que se refere a Parnaíba, o município não atingiu a meta proposta pela OMS de ter a prevalência da hanseníase menor que 1 caso para cada 10.000 habitantes, e apesar de contar com um Hospital Colônia de Carpina, que há quase 100 anos é referência no combate ao Mal de Hansen, e uma ampla cobertura populacional com equipes de Estratégia da Saúde da Família (ESF), que desenvolvem ações de controle da Hanseníase, ainda apresenta grande número de casos novos notificados (Brasil, 2022).
Diante desse cenário, considerando a importância de estudos epidemiológicos para a obtenção de dados sobre o perfil dos portadores da doença e sua tendência de acometimento, além de auxiliar na compreensão dos fatores que contribuem para a manutenção da endemicidade e subsidiar a implementação de ações para sua prevenção e controle, este artigo tem como objetivo analisar o perfil epidemiológico de pacientes portadores de Hanseníase em Parnaíba no Piauí no período de 2012 a 2022.
2 FUNDAMENTAÇÃO TEÓRICA
2.1 Perfil clínico da Hanseníase relacionado com a patogenia
O Mycobacterium leprae é um parasita intracelular obrigatório que parasita os macrófagos e células de Schwann, apresentando replicação lenta e longo período de incubação que pode chegar até 20 anos. O homem é o principal hospedeiro dessa bactéria, que é imóvel, gram positivo e álcool-ácido resistente. A pele e as vias aéreas são os principais locais de entrada do bacilo no indivíduo, sendo o trato respiratório o local mais provável para a ocorrência da infecção. Por isso, a transmissão ocorre de forma direta, por meio das vias aéreas superiores (mucosa nasal e orofaringe), através do contato entre indivíduos infectados com o M. leprae e indivíduos sadios. A resposta imunológica desencadeada pelo hospedeiro é um fator decisivo para a determinação da forma clínica, e essa resposta está principalmente relacionada às múltiplas interações e aos fatores solúveis como a ação de citocinas (Franciscon, 2013).
Quando se avalia o sistema imune humano, sabe-se que os linfócitos CD4+ são subdivididos em Th1 e Th2, com atividades imunorreguladoras. A subpopulação Th1 produz as citocinas interleucina 2 (IL-2), interferon gama (IFN-γ) e fator de necrose tumoral (TNF-β), responsáveis pela manutenção da resposta imune celular. A IL-2 ativa receptores dos linfócitos CD4+, estimulando a formação de clones celulares, responsáveis pela manutenção da produção de citocinas e, paralelamente, estimulam células natural killer (NK), com ação de potencializar uma maior produção de IFN-γ. O IFN-γ age sobre macrófagos, estimulando a fagocitose e os mecanismos de ativação celular, levando a maior produção de TNF-α, que incrementa a ativação macrofágica, e atuando através de um mecanismo sinérgico cíclico. A subpopulação Th2 produz as citocinas IL-4, IL-5, IL-6, IL-8 e IL-10. Nesse contexto, IL-4 e IL-10 são supressoras da atividade macrofágica, produzindo bloqueio da estimulação de macrófagos, com consequente desvio da resposta imunológica. Adicionalmente, IL-4 estimula linfócitos B, que se tornam produtores de imunoglobinas, e mastócitos, que passam a produzir mais IL-4, incrementando a resposta supressora macrofágica (Araoz, 2016).
Ainda não se sabe explicar porque algumas pessoas apresentam predisposição genética para uma resposta via Th1 ou para via Th2. Ao certo, sabe-se que, a depender da via imunológica, o infectado poderá ter uma doença mais branda ou mais grave. Nesse sentido, baseando-se na história natural da doença, observa-se que existe uma forma de alta resistência à infecção pelo Mycobacterium leprae, a Hanseníase Tuberculoide (HT), na qual as manifestações estão relacionadas à exacerbação da resposta imune celular, ocorrendo formação de granuloma bem definido, limitação das lesões e destruição completa dos bacilos. No outro pólo, encontra-se a forma de alta suscetibilidade à Hanseníase Virchoviana (HV), que se caracteriza por deficiência de resposta imune celular, excessiva multiplicação bacilar e disseminação da infecção para vísceras e tecido nervoso. A HV é a forma de importância epidemiológica, pois os bacilos estão maciçamente presentes nas lesões cutâneas, na proporção de 1010 bacilos por grama do tecido, propiciando a transmissão da doença por contato físico (Fransciscon, 2013; Mendonça, 2008).
A primeira linha de interação entre o M. leprae e o homem é mediada por receptores das células do hospedeiro que reconhecem padrões moleculares das micobactérias, os chamados receptores de reconhecimento de padrões (PRR). Os receptores do tipo Toll (TLRs), especialmente o TLR-2, são ativados por lipoproteínas do M. leprae, e a capacidade de iniciar a resposta protetora está diretamente relacionada com a secreção de IL-12/23 e a diferenciação de macrófagos e células dendríticas. Estas últimas apresentam o antígeno e causam a ativação de células T virgens através da secreção de IL-12. Esse processo pode levar à expansão e diferenciação de células Th1 produtoras de interferon (IFN-γ), que induz os elementos da resposta imune responsáveis pela eliminação do bacilo, controlando assim a evolução da doença (Da Silva Vieira et al., 2022; Abdallah, 2014).
Em alguns estudos realizados com o M. tuberculosis, os TLRs têm sido apontados como necessários para produção ótima de IL-12, citocina pró-inflamatória responsável pela indução da imunidade celular (Th1), assim como de TNF-α, citocina envolvida na ativação celular e formação do granuloma, que também está relacionada com a destruição tecidual associada aos surtos reacionais da Hanseníase (Araoz, 2016).
No que se refere às diferenças imunológicas, resumidas na tabela 1, por um lado tem-se a forma HT da doença, na qual há secreção de interferon IFN-γ, de citocina IL-2 e de linfotoxina-α nas lesões, resultando em atividade fagocítica intensa. Sob influência dessas citocinas, macrófagos, juntamente com os linfócitos, formam o granuloma. Os linfócitos CD4+ são encontrados, principalmente, dentro do granuloma, e os CD8 + são encontrados na área externa que o envolvem. Consequentemente, os pacientes portadores de Hanseníase da forma HT apresentam vigorosa resposta imune celular contra a micobactéria, o que limitaria a doença a poucas e bem definidas lesões de pele e de troncos nervosos (Abdallah, 2014; Araoz, 2016).
Por outro lado, os pacientes portadores de Hanseníase da forma Virchoviana apresentam ausência da resposta imune celular específica (anergia) contra a micobactéria, ocorrendo proliferação do M. leprae, com a presença de muitas lesões e infiltrações extensas na pele e nos nervos. Na HV, há predomínio de resposta Th2, com liberação de citocinas IL-4, IL-6 e IL-10, que diminuem a ativação de macrófagos e estimulam linfócitos B e mastócitos. Sendo assim, não há formação de uma resposta granulomatosa eficaz, uma vez que os macrófagos englobam os bacilos, mas só são capazes de destruí-los parcialmente. Os pacientes são caracterizados pela forte imunidade humoral, a qual exibe altas concentrações de anticorpos específicos ao M. leprae no soro, como o anti PGL-1 (glicolipídeo-fenólico-1). Nota-se também um aumento das citocinas IL-4, IL-5 e IL-10 que possibilitam a sobrevivência e proliferação do bacilo, levando à doença sistêmica, com a presença de muitas lesões e infiltrações extensas na pele e nos nervos, caracterizando assim a forma Virchoviana, conhecida como multibacilar (Mendonça, 2008; Abdallah, 2014).
Entretanto, torna-se importante ressaltar que até 95% dos pacientes expostos ao M. leprae não desenvolveram a doença, sugerindo que a imunidade do hospedeiro desempenha um papel importante na progressão e controle da doença. O tempo de incubação é variável, variando de 2 a 20 anos ou mais. Porém, quando há manifestações clínicas, observa-se sinais e sintomas dermatológicos como lesões na pele e nervos periféricos, principalmente nos olhos, mãos e pés, além das vias aéreas superiores, apresentando sinais e sintomas como manchas claras, avermelhadas ou amarronzadas com diminuição da sensibilidade e apresentação de dormência e dores nas articulações (Da Silva Vieira et al., 2022; Mendonça, 2008).
Ademais, o comprometimento de nervos periféricos é a principal característica da doença, que tem como consequência a incapacidade física, podendo inclusive evoluir para deformidades permanentes. A neurite se manifesta a partir de um processo agudo e é acompanhada de dores intensas no início da doença podendo não haver comprometimento funcional do nervo. No entanto, as lesões nos nervos com o passar do tempo podem se tornar crônicas e o portador pode apresentar alterações sensitivas na seguinte ordem: térmica, dolorosa e tátil. Distúrbios vasculares e da sudorese são reflexos das alterações simpáticas. As alterações sensitivas sempre precedem as outras manifestações neurológicas e são extremamente graves (Brasil, 2019; Da Silva Vieira et al., 2022).
Tabela 1 – Diferenças clínicas entre os tipos de hanseníase
Tipo Características Hanseníase Tuberculoide Esses pacientes apresentam placas eritematosas anulares bem definidas (Figura 1. A) e perda de sensibilidade, variando de uma a cinco lesões, podendo apresentar alopecia e/ou anidrose. Hanseníase Virchoviana Essa forma é caracterizada por extensas e múltiplas lesões bilaterais, que podem incluir máculas, pápulas, nódulos e placas (Figura 1. B). Hanseníase Indeterminada Quando há maior prevalência de características tuberculoides, as lesões variam em número de cinco a dez, com contornos maiores e menos bem-definidos (Figura 2. A). Nesse caso, a reação inflamatória presente na derme geralmente não toca a epiderme, nem é tão bem definida como na forma HT.Já quando se aproxima mais da forma Virchoviana, observa-se associação de pequenas máculas, pápulas e nódulos de diferentes formas e tamanhos (Figura 2.B). Hanseníase Dimorfa O achado clássico é a lesão dimórfica, tipicamente anular com bordas externas mal demarcadas e bordas internas bem definidas (Figura 3).
Fonte: autoria própria
Figura 1 – Diferença entre Hanseníase Virchoviana e Tuberculoide
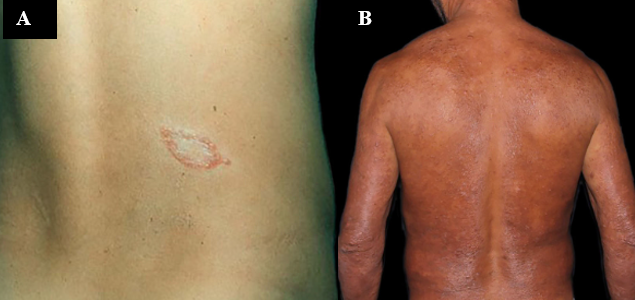
A. Hanseníase Tuberculoide. Placa bem delimitada por pápulas eritematosas e centro hipocrômico. B. Hanseníase Virchowiana. Enduração eritemato—ferruginosa difusa, entremeada por máculas e pápulas poupando a região da coluna e axila e predominando nos cotovelos. Fonte: Júnior; Sotto; Trindade, 2022.
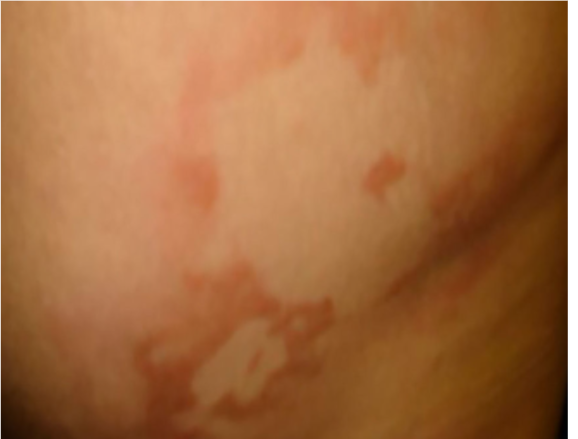
Figura 2 – Clínica das Hanseníases Indeterminadas
A; Hanseníase Indeterminada-Tuberculoide. Placa eritemato- endurada, foveolar, bordas interna e externas nítidas.
B. Hanseníase Indeterminada-Virchoviana. Placas eritematosas, centro hipocrômico bem delimitado e bordas externas imprecisas. Fonte: Júnior; Sotto; Trindade, 2022.
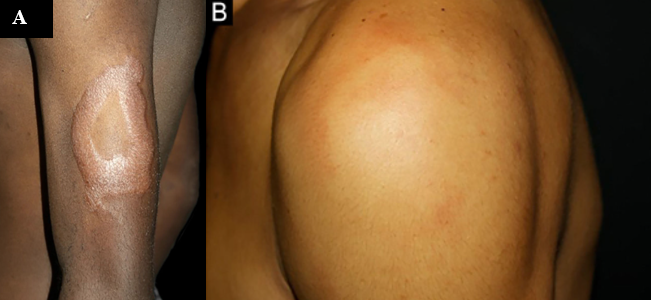
Figura 3 – Hanseníase Dimorfa
Placas e pápulas eritemato-edematosas bem delimitadas. Fonte: (Júnior; Sotto; Trindade, 2022).
2.2 Fatores de risco
Os fatores de risco para essa patologia são: residência em países endêmicos; contato próximo com pessoas com hanseníase, em comparação com pessoas sem contato próximo, apresentando o risco aumentado em até 10 vezes; suscetibilidade genética da hanseníase revelada por variantes de genes envolvidos na resposta imune, incluindo sinalização imune inata, função de macrófago e apresentação de antígeno; terapia medicamentosa com alguns fármacos, por exemplo, relatos de síndrome inflamatória de reconstituição imune associada à hanseníase (IRIS) de países onde a hanseníase é endêmica em pacientes recebendo terapia antirretroviral para infecção por HIV (Renee et al., 2023).
2.3 Diagnóstico e tratamento
O diagnóstico da hanseníase é eminentemente clínico. Para a definição da manifestação clínica, além do estudo pormenorizado das lesões cutâneas e do acometimento neurológico, utiliza-se o exame de bacterioscopia, auxiliado pelo teste de Mitsuda, e a histopatologia da lesão cutânea e, por exceção, do nervo periférico. De acordo com a OMS (2019), a hanseníase é diagnosticada encontrando-se pelo menos um dos seguintes sinais cardinais:
(1) Perda definitiva de sensação em uma área esbranquiçada (hipopigmentada) ou avermelhada da pele;
(2) Nervo periférico espessado ou aumentado, com perda de sensibilidade e / ou fraqueza dos músculos supridos por esse nervo;
(3) Presença de bacilos álcool-ácido resistentes em esfregaço de raspado intradérmico.
Além disso, com o intuito terapêutico, as tipologias da Hanseníase são agrupadas em paucibacilares (PB), que são as formas Indeterminadas e Tuberculiide (HI e HT) e multibacilares (MB), que são as formas Virchoviana e Dimorfos (HV e HD). Em 2016, a OMS lançou a Estratégia Global de Hanseníase 2016-2020 “Aceleração rumo a um mundo sem hanseníase” e em 2017, a OMS revisou as definições de casos de Hanseníase PB e MB, por meio do lançamento de um Guia de Monitoramento e Avaliação para a Hanseníase da seguinte forma: o caso paucibacilar é caracterizado como um caso de hanseníase com 1 a 5 lesões cutâneas, sem presença demonstrada de bacilos em baciloscopia; Já no que se diz respeito ao caso multibacilar, refere-se há situações de Hanseníase com mais de cinco lesões de pele; ou com envolvimento dos nervos (neurite pura ou qualquer número de lesões de pele e neurite); ou com a presença demonstrada de bacilos em esfregaço de pele, independentemente do número de lesões cutâneas.
Quanto ao tratamento, sabe-se que o objetivo maior é a cura do paciente, o mais precocemente possível, a fim de interromper a cadeia epidemiológica da doença e evitar, consequentemente, o aparecimento das incapacidades. O esquema terapêutico deverá ser o mais potente e eficaz, evitando o aparecimento de resistência microbiana, aliado à baixa ocorrência de efeitos colaterais. Ao lado do tratamento medicamentoso, deverão ser tomadas medidas para prevenção e tratamento das incapacidades. Na Tabela 2, apresenta-se a conduta terapêutica, de acordo com as diretrizes para o diagnóstico, tratamento e prevenção da Hanseníase de 2021.
Tabela 2 – Resumo das recomendações sobre tratamento da Hanseníase
Tratamento de paciente hansênico Duração Um regime de três medicamentos com rifampicina, dapsona e clofazimina. 6 meses para hanseníase PB e 12 meses para hanseníase MB. Tratamento da Hanseníase resistente aos medicamentos Duração Pacientes com Hanseníase com resistência à rifampicina podem ser tratados com pelo menos dois dos seguintes medicamentos de segunda linha: claritromicina, minociclina ou uma quinolona (ofloxacina, levofloxacina ou moxifloxacina), além de clofazimina diariamente.Os pacientes com Hanseníase com resistência tanto à rifampicina quanto à ofloxacina podem ser tratados com os seguintes medicamentos: claritromicina, minociclina e clofazimina. Uso de clofazimina diariamente durante 6 meses, seguido por clofazimina mais uma das segundas linha de medicamentos por mais 18 meses.
Uso de claritromicina, minociclina e clofazimina por 6 meses, seguidos por claritromicina ou minociclina mais clofazimina por mais 18 meses.
Fonte: OMS, 2021.
2.4 Potencialidade de transmissão ativa e recente da doença, por meio da quantificação da detecção em menores de 15 Anos
A detecção em menores de 15 anos é o principal indicador de monitoramento da endemia e sugere a intensa circulação do Mycobacterim leprae, transmissão ativa e recente da doença. Nesse âmbito, torna-se importante ressaltar que, embora o acometimento de crianças seja mais comum nas formas clínicas iniciais por conta do período de exposição e incubação, em muitas regiões brasileiras, essas crianças também são diagnosticadas nas formas clínicas multibacilares, reportando o atraso no diagnóstico pelos serviços de saúde, assim como em outros cenários (Monteiro et al., 2019).
Ademais, é válido ressaltar que na infância há maior dificuldade diagnóstica. Consequentemente, aumentam-se as chances de evolução para complicações e deformidades, revelando a pior gravidade da doença. Nesse viés, a avaliação de contatos de modo qualitativo é a ação primordial para detecção precoce em crianças. Porém, no Brasil, muitas crianças apresentam deformidades físicas visíveis. Logo, o diagnóstico precoce da Hanseníase em menores de 15 anos de idade se faz urgente para a prevenção de deformidades físicas, cujas repercussões são ainda mais catastróficas na vida dessas pessoas (Freitas et al., 2018; Pedrosa, 2018).
No que se refere aos fatores de risco, há evidências reportando que o contato familiar é responsável por 95% do adoecimento na infância. Sendo assim, o adoecimento de crianças por Hanseníase está fortemente relacionado com focos ativos de bacilos na comunidade, mais precisamente no seio familiar. A avaliação de contatos é, portanto, a barreira primordial a ser adotada. A doença presente em idade tão precoce também indica falhas no programa de controle para a detecção oportuna de casos novos por meio da avaliação de contatos e tratamento imediato, o que pode impactar na quebra da cadeia de transmissão (Freitas et al., 2018; Monteiro et al., 2019).
2.5 Epidemiologia da Hanseníase no Brasil e no mundo
Em 2020, foram reportados à Organização Mundial da Saúde (OMS) 127.396 casos novos da doença no mundo. Desses, 19.195 (15,1%) ocorreram na região das Américas e 17.979 foram notificados no Brasil, o que corresponde a 93,6% do número de casos novos das Américas. Brasil, Índia e Indonésia reportaram mais de 10.000 casos novos, correspondendo a 74% dos casos novos detectados no ano de 2020. Nesse contexto, o Brasil ocupa o segundo lugar entre os países com maior número de casos no mundo, atrás apenas da Índia (OMS, 2021).
Ainda segundo dados da OMS, 62 países reportaram casos novos em menores de 15 anos. No decorrer do ano de 2020, 8.629 novos casos foram diagnosticados nessa população, correspondendo a 6,8% do total de casos novos diagnosticados. Do total de casos novos diagnosticados no Brasil, 878 (4,8%) ocorreram em menores de 15 anos. Apesar dos elevados níveis de endemicidade da hanseníase no país, houve melhorias significativas no controle da doença nas últimas décadas, entre os anos de 2011 a 2020, foram diagnosticados 284.723 casos novos de hanseníase. A taxa de detecção geral de casos novos, nesse período, apresentou uma redução de 51,9%, passando de 17,65 em 2011 para 8,49 casos por 100.000 habitantes em 2020. Essa melhoria possibilitou a mudança no parâmetro de endemicidade do país, progredindo de alto para médio. Essa mudança de parâmetro também foi observada em 16 Unidades da Federação (UF) no ano de 2020 (OMS, 2021; Brasil, 2022).
Apesar de ter havido uma redução significativa no número de novos casos de hanseníase no contexto nacional, a quantificação dos casos é heterogênea no país, ademais, algumas regiões ainda apresentam elevado índice da doença presente. Por exemplo, em 2022, o Brasil registrou mais de 17 mil novos casos de hanseníase. Os maiores números foram registrados na região nordeste do país, cujo aumento local chegou a 7.700 novos casos, seguida pelas regiões Centro-Oeste (3300), Norte (2900), enquanto os menores registros foram referidos pelas regiões Sudeste (2600) e Sul (564) do país. Além disso, embora se observe uma diminuição dos casos de hanseníase ao longo dos anos, a redução mais acentuada nos últimos dois anos pode estar relacionada à menor detecção de casos ocasionada pela pandemia de covid-19 (Ramos et al., 2022; Brasil, 2022).
Figura 3 – Taxa de detecção geral de casos novos de Hanseníase entre 2011 a 2020 por região do Brasil
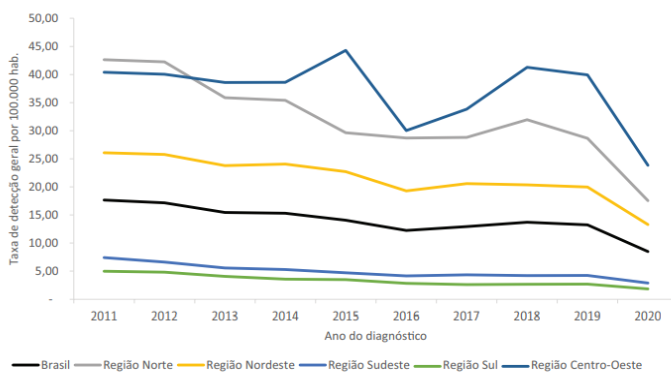
Fonte: Boletim Epidemiológico de Hanseníase, 2022.
3 METODOLOGIA
A pesquisa caracterizar-se-á por ser um estudo epidemiológico, descritivo, quantitativo, transversal e retrospectivo, no qual o cenário será o município de Parnaíba, que está localizado na microrregião da planície litorânea do Piauí, na região Nordeste do Brasil. De acordo com o censo realizado pelo Instituto Brasileiro de Geografia e Estatística (IBGE), em 2022, a população parnaibana é estimada em 162.159 habitantes.
Quanto à cronologia, a coleta de dados irá incluir as informações sobre todos os casos de Hanseníase notificados no período de janeiro de 2012 a dezembro de 2022. Estes dados são de domínio público e estão disponíveis no Sistema de Informação de Agravo de Notificações (SINAN).
Serão analisados os seguintes dados: sexo, faixa etária, raça, escolaridade, forma clínica, lesões cutâneas, classificação operacional no diagnóstico, nível de endemicidade, tipos de saída e grau de incapacidade física. O software Microsoft Excel será utilizado para a organização e análise dos dados, os quais serão apresentados através de gráficos e tabelas.
Por fim, todos os aspectos éticos e legais referentes às fases do projeto serão respeitados de acordo com a resolução 196/96 do Conselho Nacional de Saúde, que contêm diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Os dados serão utilizados tão somente para análise, interpretação, e divulgação de informações em saúde através de artigos dentre outras publicações científicas. Serão utilizados apenas os dados secundários obtidos no Sistema Nacional de Agravos de Notificação (SINAN) somente no apoio para a concretização do referido projeto, esclarecendo ainda que haverá todo rigor técnico nas análises estatísticas dos dados e que a fonte das informações será sempre enfatizada na elaboração de relatórios e artigos.
4 RESULTADOS E DISCUSSÕES
A história da Hanseníase na cidade Parnaíba não é recente e retrata um problema de saúde pública local. Ainda na década de 1930, construiu-se o hospital Colônia de Carpina para atender os parnaibanos portadores do Mal de Hansen. Àquela época, o estabelecimento servia não apenas para internações e tratamento ambulatorial, como também para abrigar os enfermos que eram discriminados socialmente. Devido à precariedade de informações, diagnose e terapia, o hospital abrigou quase 500 pessoas, revelando a alta epidemiologia da doença na região litorânea. Em um estudo realizado em 2020, revelou que o perfil da população abrigada na grande maioria é de pessoas analfabetas, com renda menor que um salário mínimo e a ocupação profissional de agricultor. Esses dados demonstram a relação entre a doença e a vulnerabilidade social (Passos & Araújo, 2020).
Com o tempo os estudos em relação à Hanseníase se intensificaram, melhorando a conduta terapêutica, diminuindo, assim, o grau de incapacidade física. No entanto, a epidemiologia dessa patologia ainda é alta. Prova disso é que o hospital Colônia de Carpina ainda continua funcionando, sendo uma instituição referencial no combate à doença no Brasil.
No período de 2012 a 2022, foram notificados 12.504 casos de Hanseníase no estado piauiense, sendo Parnaíba o segundo município do Piauí com o maior número de casos, registrando 565 casos nesse mesmo período. De acordo com os dados do SINAN, os anos com maiores prevalências foram 2016 com 75 novos diagnósticos, 61 confirmações em 2021, 62 casos em 2013 e 59 em 2012, como demonstrado na tabela 1.
Em relação aos anos, para a classificação dos níveis de endemicidade do município em cada ano conforme definido pelo Ministério da Saúde (MS) brasileiro, a taxa geral de detecção é considerada hiperendêmica quando > 40,00 casos por 100.000 habitantes; muito alta >20,00 a 39,99 casos por 100.000 habitantes; alta > 10,00 a 19,99 casos por 100.000 habitantes; média > 2,00 a 9,99 casos por 100.000 habitantes; e baixo menor que 2 casos por 100.000 habitantes.
Tabela 3 – Descrição dos níveis de endemicidade da Hanseníase em Parnaíba – PI entre os anos de 2012 a 2022
Ano População IBGE Casos novos Taxa de detecção geral Parâmetros 2012 147.732 59 39,93 Muito Alta 2013 148.237 62 41,82 Hiperendêmica 2014 149.348 37 24,77 Muito Alta 2015 149.803 52 34,71 Muito Alta 2016 150.201 75 49,93 Hiperendêmica 2017 150.547 54 35,86 Muito Alta 2018 152.653 32 20,96 Muito Alta 2019 152.985 49 32,02 Muito Alta 2020 153.482 26 16,94 Alta 2021 153.863 69 44,84 Hiperendêmica 2022 162.159 50 30,83 Muito Alta
Fonte: DATASUS/SINAN, 2023; IBGE, 2023.
Diante disso, pode-se observar que em Parnaíba os anos 2013, 2016 e 2021 apresentaram parâmetros hiperendêmicos (tabela 1). Além disso, observa-se que o município revela um padrão de endemicidade, com taxas de detecção geral quase sempre maiores que 20 novos casos a cada 100 mil habitantes, de tal forma que, no decorrer desses dez anos, o município apresentou características de hiperendemicidade, de muito alta endemicidade e alta endemicidade.
Em 2020, no entanto, Parnaíba registrou somente 26 novos casos. Esse dado foi de encontro com os dados normalmente informados no SINAN, visto que foi a única vez que o município apresentou uma taxa de detecção geral menor que 20 casos por 100.000 habitantes. Nesse contexto, pode-se associar à pandemia da COVID-19, na qual os municípios adotaram políticas de isolamento social (principalmente em 2020), resultado em uma menor procura pela Atenção Primária em Saúde e, consequentemente, uma possível subnotificação de outras patologias, que não fossem doenças respiratórias. Porém, ainda assim é possível perceber a grande frequência de diagnósticos de Hanseníase entre os parnaibanos, isso porque, apesar de ter reduzido o valor total no ano de 2020, ainda apresentou um parâmetro considerado alto em relação à taxa de detecção geral por 100.000 habitantes.
Quanto à forma clínica notificada demonstrada na tabela 2, a Dimórfica apresentou um número maior de registro, com 220 casos ao longo dos últimos 10 anos, logo em seguida tem-se a forma Indeterminada com 149 casos, Virchowiana com 110 notificações, Tuberculóide com 56 registros e os demais casos não foram classificados.
A apresentação Dimorfa, que representou 41% dos casos, é a forma clínica mais comum da doença, ocorrendo após um longo período de incubação (cerca de 10 anos), pois é um bacilo de lenta multiplicação. Essa prevalência alerta para um maior empenho do sistema de saúde local para os casos de Hanseníase, uma vez que nesta manifestação há perda parcial ou total da sensibilidade e diminuição de funções autonômicas (Brasil, 2017).
Além disso, a presença predominante multibacilar, na classificação operacional no diagnóstico, dificulta o sucesso terapêutico na maioria dos casos diagnosticados no município devido à longiquidade da PQT, que requer um empenho maior do paciente. Isso porque a poliquimioterapia nos casos MB apresenta uma durabilidade de 12 meses, de forma que o tratamento ocorre no dobro de tempo da terapêutica dos casos PB, além de ser utilizado o dobro de medicação. Sendo assim, aqueles que não seguem o tratamento com regularidade, estão sujeitos à cura retardada ou incompleta e poderão apresentar deformidades físicas, ajudando a perpetuar o estigma da doença, além da possibilidade de piorar os índices de cura da doença em Parnaíba e favorecer a multiplicação das formas resistente da bactéria.
Tabela 4 – Frequência de formas clínicas e lesões cutâneas notificadas em Parnaíba entre 2012 e 2022
Forma Clínica Notificada Frequência Porcentagem Dimórfica 220 41% Tuberculóide 56 10% Virchowiana 110 20% Indeterminada 149 27,85% Lesões Cutâneas Lesão Única 168 32,25% Entre 2 a 5 lesões 173 33,20% Mais do que 5 lesões 180 34,54% Classificação Operacional no Diagnóstico Multibacilar 359 63.31% Paucibacilar 208 39,69%
Fonte: DATASUS/SINAN, 2023.
No que se refere ao sexo, a doença mostrou-se mais prevalente nas mulheres, visto que entre elas registrou-se 287 novos casos, já no sexo masculino, notificou-se 280 novos casos. Uma diferença pequena de apenas 2,5%, revelando não haver tanta disparidade quanto ao sexo. Ainda nesse sentido, buscou-se compreender o perfil epidemiológico da Hanseníase, associando-se o sexo e a faixa etária como demonstrado na tabela 3 e no gráfico 1. Nesse viés, em ambos os sexos, a faixa etária com maior prevalência de hansênicos foi entre 40 e 49 anos com 73 notificações no público feminino e 52 notificações no sexo masculino.
Tabela 5 – Frequência de novos casos de hanseníase em Parnaíba – PI com base na idade e no sexo entre 2012 a 2022
Faixa Etária Número De Casos No Sexo Feminino Número De Casos No Sexo Masculino 0 a 4 anos Nenhum Registro Nenhum Registro 5 a 9 anos Nenhum Registro 7 10 a 14 anos 13 8 15 a 19 anos 12 4 20 a 29 anos 25 39 30 a 39 anos 41 36 40 a 49 anos 73 52 50 a 59 anos 41 45 60 a 69 anos 39 50 70 a 79 anos 33 32 ≥ 80 anos 7 7 Total 287 280
Fonte: DATASUS/SINAN, 2023.
Gráfico 1 – Relação entre as frequências de hansênicos com base na idade e no sexo em Parnaíba nos últimos dez anos
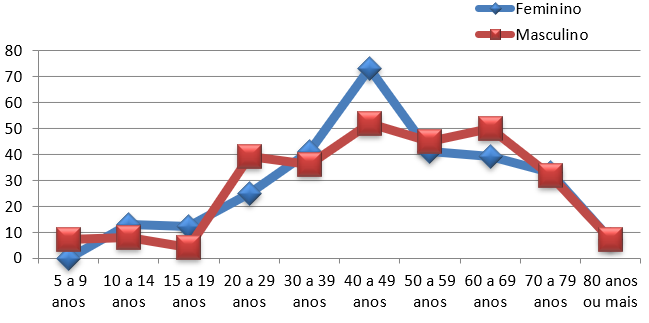
Fonte: DATASUS/SINAN, 2023.
Ao desenhar o gráfico sobre a frequência de pacientes com hanseníase com base no sexo e em diferentes faixas etárias, nota-se que, embora os dois sexos apresentem picos na mesma faixa etária (40 a 49 anos), entre as mulheres a prevalência de diagnósticos tende a cair com o avançar da idade. Por outro lado, no sexo masculino, os números ainda permanecem altos desde os 40 anos até os 69 anos, havendo uma diminuição significativa apenas a partir dos 70 anos.
As faixas etárias mais acometidas (a partir de 20 anos) incluem a população economicamente ativa, na qual a doença pode prejudicar o desempenho das atividades laborais, causando limitações e interrupções, com aposentadoria precoce e diminuição da qualidade de vida dos trabalhadores. Isso demonstra que a doença, além de ser um problema de saúde pública, apresenta impactos na economia estatal.
Quanto ao grau de escolaridade, em Parnaíba, a maior prevalência deu-se entre aqueles com nível educacional entre a 1ª a 4ª série incompleta do ensino fundamental, representando 25,87 % (n= 104) dos casos. Esse dado é preocupante, visto que os indivíduos com baixo grau de escolaridade estão mais propensos ao abandono do tratamento e ao desenvolvimento de incapacidade física. Isso porque, quanto menor o grau de escolaridade, menor o conhecimento sobre a doença e dificuldade de compreensão das orientações referentes ao tratamento, prevenção e autocuidado relacionado ao diagnóstico, entendimento e princípios da hanseníase (Almeida et al, 2018).
Tabela 6 – Nível de escolaridade dos pacientes com hanseníase em Parnaíba entre 2012 e 2022
Nível de Escolaridade Frequência Analfabeto 52 1ª a 4ª série incompleta do ensino fundamental 104 4ª série completa do ensino fundamental 29 5ª a 8ª série incompleta do ensino fundamental 66 Ensino fundamental completo 35 Ensino médio incompleto 30 Ensino médio completo 48 Educação superior incompleta 13 Educação superior completa 25
Fonte: DATASUS/SINAN, 2023.
No município estudado, houve predomínio da raça cor parda, como demonstrada na tabela 5. No entanto, no que se refere à cor da pele, não existem quaisquer correlações entre a pigmentação da pele e a variação da possibilidade de contágio da Hanseníase. Porém, o predomínio da raça parda pode ocorrer devido à forte miscigenação existente no país, principalmente na região Nordeste. Além disso, é sabido que raça/cor são fatores de condições sociais de saúde, de tal forma que, no Brasil, há uma grande associação entre as cores parda e negra à vulnerabilidade social, o que talvez possa favorecer a alta prevalência dessa doença.
Tabela 7 – Frequência de distribuição de pacientes com Hanseníase quanto à raça em Parnaíba entre 2012 e 2022
Raça Frequência Branca 104 Preta 39 Parda 411 Amarela 06 Indígena Não Registrado
Fonte: DATASUS/SINAN, 2023.
Entre os anos de 2012 e 2022, registrou-se 494 casos novos de Hanseníase em Parnaíba, e dentre os quais, 450 pacientes apresentavam algum grau de incapacidade física, como demonstrado na tabela 8. Distribuídos da seguinte forma: 324 pessoas com Grau Zero, 102 notificações de Grau I e 24 registros de Grau II, os demais ou não foram registrados ou não foram avaliados. Sendo assim, a proporção de casos novos de Hanseníase com grau de incapacidade física, avaliado no momento do diagnóstico, totalizou 91% nos últimos 10 anos. Essa porcentagem revela uma boa qualidade dos atendimentos de serviço de saúde de Parnaíba, uma vez que o Ministério da Saúde (MS), 2018, avalia a qualidade dos serviços de saúde de um município como boa quando essa proporção é maior ou igual que 90%, regular quando se encontra entre 75% a 89,9% e precário quando é menor que 75%.
Tabela 8 – Frequência por Ano Diagnóstico segundo a avaliação de incapacidade física no momento do diagnóstico
Ano Em branco Grau Zero Grau I Grau II Não Avaliado 2012 1 37 12 1 3 2013 10 31 11 2 4 2014 2 23 4 Ø 1 2015 1 32 11 2 1 2016 Ø 56 7 5 Ø 2017 1 36 9 Ø Ø 2018 Ø 16 5 2 3 2019 1 26 9 2 2 2020 Ø 10 4 4 4 2021 1 31 20 3 3 2022 6 25 10 3 1 TOTAL 23 324 102 24 22
Fonte: DATASUS/SINAN, 2023.
Ademais, ainda de acordo com o MS, naqueles municípios que apresentam um percentual maior ou igual a 75%, é possível avaliar a efetividade das atividades para detecção precoce de casos. Para isso, calcula-se a proporção de casos novos de Hanseníase com grau 2 de incapacidade física no momento do diagnóstico. Logo, a efetividade dessas ações é classificada como alta quando ≥ 10,0%, média se encontrar entre 5,0 a 9,9% e baixa se ≤ 5,0%. Tendo em vista que Parnaíba apresentou 24 registros de Grau II, pode-se concluir que isso representa 5,33% de todas as 450 notificações de incapacidade física. Sendo assim, é possível concluir que há uma média efetividade das estratégias de detecção precoce. Isso pode ser explicado em razão da fragilidade operacional da vigilância pela atenção primária, que provavelmente ocorre pela falta de oferta de treinamento efetivo para a detecção desses casos em tempo oportuno.
Por fim, dentre os 494 casos novos calculados nesse ínterim, 380 evoluíram para cura, 25 pacientes abandonaram o tratamento e 4 pessoas foram ao óbito. Quanto aos demais, ou não foi informado o motivo da saída ou foram transferidos para outros locais ou ainda estão em fase de acompanhamento pela Atenção Primária à Saúde.
5 CONSIDERAÇÕES FINAIS
A taxa de detecção cerne o monitoramento da Hanseníase e determina o nível de transmissão da infecção. Além desse, outros indicadores podem ser considerados de impacto para o monitoramento dessa infecção, como a proporção de multibacilares e proporção de casos com grau de incapacidade 2, entre os casos novos. As taxas de detecção de casos e o atraso no diagnóstico são dependentes de vários fatores, tais como idade, profissão, nacionalidade, endemicidade, tipo de Hanseníase e método de detecção (Silva Alves et al, 2017).
Nesse sentido, foi visto a prevalência da doença na população com faixa etária de 40 a 49 anos, no sexo feminino, principalmente nos indivíduos de cor parda. A forma clínica Dimorfa representou a maioria dos casos, bem como a classificação operacional diagnóstico multibacilar. No que se refere às lesões cutâneas, houve uma maior notificação de casos com mais de 5 lesões. No entanto, houve uma similaridade entre as porcentagens de lesões cutâneas, visto que tanto os pacientes com uma única lesão, quanto aqueles que apresentam entre 2 e 5 lesões ou os indivíduos com mais de 5 lesões apresentaram uma frequência de aproximadamente 33%.
De acordo com os resultados obtidos, concluímos que a Hanseníase consiste em um importante problema de saúde pública no município de Parnaíba. Embora o número de casos tenha apresentado flutuações ao longo dos anos, é preocupante que a taxa de detecção geral tenha se mantido em níveis elevados, especialmente considerando que a doença é totalmente prevenível e tratável com o adequado acompanhamento. Isso demonstra como essa doença é estigmatizada e negligenciada. Portanto, espera-se que estas informações propiciem o melhor conhecimento da situação de saúde da população parnaibana, caracterizando a dinâmica da epidemia e fortalecendo o sistema de vigilância epidemiológica da Hanseníase, reafirmando sua missão de instrumento de informação para a tomada de decisões baseadas em evidências no município.
REFERÊNCIAS
ABDALLAH, M et al.. Serum Th1/Th2 and macrophage lineage cytokines in leprosy; correlation with circulating CD4+ CD25high FoxP3+ T-regs cells. Exp. Dermatol. Volume 23, número 8, 2014.
ALMEIDA, K. T. et al.. Recidiva da hanseníase entre os anos 2005-2015. Revista de Enfermagem da Universidade Federal do Pernambuco. Recife, volume 12, páginas 2528 a 2534, 2018.
ARAOZ, R. et al..Towards na immunodiagnostic test for leprosy. Elsevier: micróbios e infecção, Rio de Janeiro, volume 8, número 8, 2016.
AZULAY, Rubem David. Dermatologia. 6. ed. Rio de Janeiro: Guanabara Koogan, 2015.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis. Boletim Epidemiológico de Hanseníase. Brasília, DF: Ministério da Saúde, 2022.
DA SILVA VIEIRA, S. M. et al.. Aspectos sobre a patogênese, a clínica, o diagnóstico e o tratamento da hanseníase: uma revisão narrativa: Journal of Education Science and Health, Teresina, volume 2, número 2, 2022.
FRANCISCON, G. B. Grau de ativação e frequência das sub-populações de monócitos entre os pacientes com a forma multibacilar e paucibacilar da hanseníase. Dissertação (Mestrado) – Universidade Federal da Bahia. Instituto de Ciências da Saúde. Salvador, 2013.
FREITAS, B.H.B.M. et al.. Hanseníase em menores de quinze anos em municípios prioritários, Mato Grosso, Brasil. Revista Brasileira de Epidemiologia, São Paulo, volume 21, número 4, 2018.
HABIF, Thomas P. Dermatologia clínica. 5 ed. Rio de Janeiro: Elsevier, 2015.
JUNIOR, L. A. R., SOTTO, M. N., & TRINDADE, M. A. B. Leprosy: clinical and immunopathological characteristics . Anais Brasileiros De Dermatologia, volume 97, número 3, 2022.
LOPES, F. de C. et al.. Hanseníase no contexto da Estratégia Saúde da Família em cenário endêmico do Maranhão: prevalência e fatores associados. Ciência & Saúde Coletiva, Rio de Janeiro, Volume 26, número 5, 2021.
MENDONÇA, V. A. et al.. Imunologia da hanseníase. Anais Brasileiros de Dermatologia. Volume 83, número 4, 2008.
MINISTÉRIO DA SAÚDE. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis Coordenação Geral de Hanseníase e Doenças em Eliminação. Banco de dados do programa: 2022(SINAN Nacional). Brasília, 2022.
MONTEIRO, L. D. et al.. Hanseníase em menores de 15 anos no estado do Tocantins, Brasil, 2001-2012: padrão epidemiológico e tendência temporal. Revista Brasileira de Epidemiologia, São Paulo, volume 22, número 7, 2019.
Organização Mundial da Saúde, Escritório Regional do Sudeste Asiático; 2017. Licença: CC BY-NC-SA 3.0 IGO.
PASSOS, A. L. V. & ARAÚJO, L. F. Representações sociais sobre um antigo hospital colônia: Um estudo com seus moradores. Psicologia: Teoria e Prática, São Paulo, volume 22, número 2, 2020.
PEDROSA, V. L. Perfil Clínico-Epidemiológico da hanseníase entre escolares menores de 15 anos na cidade de Manaus no Amazonas. 2018. Tese (Doutorado em Doenças Tropicais e Infecciosas) – Universidade do Estado do Amazonas, Manaus, Manaus, 2018.
RAMOS, A. C. V. et al.. Evolução temporal e distribuição espacial da hanseníase em município de baixa endemicidade no estado de São Paulo. Epidemiologia e Serviços de Saúde, Brasília, volume 31, número 1, 2022.
RENEE, R. et al.. Hanseníase. DynaMed. Lepra (hanseníase). Serviços de informação da EBSCO. Acessado em 17 de abril de 2023. https://www.dynamed.com/condition/leprosy-hansen-disease.
RODRIGUES, R.N. et al.. High-risk areas of leprosy in Brazil between 2001-2015. Revista Brasileira de Enfermagem, São Paulo, Volume 73, número 3, 2020.
SANTOS, A. R. dos; Ignotti, E.. Prevenção de incapacidade física por hanseníase no Brasil: análise histórica. Ciência & Saúde Coletiva, Rio de Janeiro, volume 25, número 10, 2020.
SANTOS, K. C. B. et al. Estratégias de controle e vigilância de contatos de hanseníase: revisão integrativa. Saúde em Debate. Volume 43, número 121,
SILVA, P. S. R. et al.. Perfil clínico-epidemiológico de pacientes portadores de hanseníase em um município do Maranhão. Revista Eletrônica Acervo Saúde, São Luís, volume 12, número 8, 2020.
SILVA ALVES, E. et al.. Perfil epidemiológico da hanseníase em um município do nordeste brasileiro: uma análise retrospectiva. Revista de Pesquisa Cuidado é Fundamental Online, Rio de Janeiro, vol. 9, número 3, p. 648-652, 2017.
SIMON, M. do V. Resposta imune a antígenos de M. leprae e M. tuberculosis na proteção e na patogênese da hanseníase. 2013. Tese (Doutorado em Ciências da Saúde) – Universidade Federal de Sergipe, Aracaju, 2013.
1Discente do Curso de Medicina da IESVAP, Parnaíba – Piauí
1leticiapla@outlook.com
1livianoletosantos@gmail.com
1marisacoragem2@gmail.com
2Médica Especialista em Medicina de Família e Comunidade Docente do Curso de Medicina da IESVAP, Parnaíba – Piauí
2Maria.fonseca@iesvap.edu.br
