ASSESSMENT OF THE ANTIMICROBIAL ACTIVITY OF ISATIN COMPLEXES
REGISTRO DOI: 10.5281/zenodo.10800830
Karla Leonardo Eremita1,
Vivian Chagas da Silveira2
Luiz Antonio Favero Filho3
RESUMO
O crescente número de bactérias resistentes a antibióticos e o surgimento constante de novas doenças, tem sido motivo de muita preocupação no mercado químico-farmacêutico. A busca por novos compostos que possam atuar contra essas resistentes bactérias é emergencial, diante disso, esse projeto testou o complexo de Isatina em duas formulações: complexos (S)-4-metilbenzil cisteína + Isatina + Perclorato de cobre e complexo (S)-4-clorobenzil cisteína + Isatina + Perclorato de cobre, frente a quatro bactérias gram-negativas e gram-positivas: Escherichia coli (ATCC 8739), Klebsiella pneumoniae (ATTCC 13883), Pseudomonas aeruginosa (ATCC 9027) e Staphyloloccus aureus (ATCC 25923). O microrganismo Bacillus cereus (ATCC 11778), não pode ser testado, pois não estava disponível na coleção do laboratório de microbiologia do CEUNES onde essa pesquisa foi realizada. O teste foi realizado em triplicatas em microplacas de 96 poços, para comprovação do resultado e nenhuma das formulações testadas apresentaram atividade antimicrobiana sobre as cepas estudadas.
Palavras chave: Teste Bactericida; Isatina; Resistência Bacteriana; Antimicrobianos.
ABSTRACT
The growing number of antibiotic-resistant bacteria and the constant emergence of new diseases has been a cause for great concern in the chemical-pharmaceutical market. The search for new compounds that can act against these resistant bacteria is an emergency, therefore, this project tested the Isatin complex in two formulations: (S)-4-methylbenzyl cysteine complexes + Isatin + Copper perchlorate and (S)- complex 4-chlorobenzyl cysteine + Isatin + Copper perchlorate, against four gram-negative and gram-positive bacteria: Escherichia coli (ATCC 8739), Klebsiella pneumoniae (ATTCC 13883), Staphyloloccus aureus (ATCC 25923), Pseudomonas aeruginosa (ATCC 9027) . The microorganism Bacillus cereus (ATCC 11778) cannot be tested, as it is not available in the collection of the CEUNES microbiology laboratory, where this research was carried out. The test was carried out in triplicates in 96-well microplates, to confirm the result they were repeated, and none of the bacteria had their activity inhibited.
Keywords: Bactericidal; Isatin; Bacterial resistance; antibacterial.
1 – INTRODUÇÃO
Em 1840 a Isatina (IST) foi reconhecida pela primeira vez por Erdmann e Laurent (ERDEMANN, 1840; LAURENT, 1840). A Isatina (IST) é um composto natural obtido das plantas do genero Isatis (GUO, 1986) e dos frutos da Couroupita guianensis Aubl (BERGMAN, 1985).
A IST é um composto farmacologicamente ativo, quimicamente conhecido como indol-1H-2,3-diona. O desenvolvimento de diferentes análogos baseados em IST adquiriu importância devido ao seu valioso potencial terapêutico como analgésico, anticancerígeno, antiinflamatório, antimicrobiano, antifúngico, antiviral (eficaz contra a protease 3C do coronavírus SARS) e muitas outras atividades, e representa uma importante classe de compostos heterocíclicos que podem ser usados como precursores para a síntese de muitas drogas úteis (CHAUAN, et al, 2021). Em humanos é encontrada como um derivado metabólico da adrenalina (HALKET et al, 1988; PALUMBO et al, 1989).
O surgimento de microrganismos resistentes aos fármacos já existentes faz com que a química medicinal seja fundamental para a saúde pública (THOMAS, 2003). Diversas classes de compostos orgânicos tem sido alvo de estudos, dentre os quais a IST. Tendo em conta a importância do problema que a resistência bacteriana vem causando, várias organizações nacionais reconhecem a relevância e urgência de pesquisas relacionadas a resistência de bactérias (LOUREIRO, 2016). Apesar da IST ser relacionada beneficamente em algumas literaturas, são poucos os trabalhos publicados referentes a esse complexo, fazendo com que seja relevante a realização de novas pesquisas. Muitas compostos com isatina já foram investigadas quanto às possíveis propriedades biológicas, algumas são antivirais, anti-inflamatórias, anticonvulsivantes, antitumorais e sedativo hipnóticas, mas não são comerciais (VINE,2013).
A síntese de diferentes derivativos/híbrido de IST ganharam significante atenção em razão de sua importância como antiviral (SIN et al, 2009; ABBAS et al, 2013; ZHANG et al, 2014), espermicida (PAIRA et al, 2009), anti-corrosiva (QURAISHI et al, 2008), analgésico (FIGUEIREDO et al, 2013), antioxidante (ANDREANI et al, 2010; NAIK et al, 2011), antidepressivo (MANLEY-KING et al, 2011), antiepiléptico (PRAKASH & RAJA, 2011), antimalárico (RAJ et al, 2014; TARUN & JIGNESH, 2013; KUMAR et al, 2014), anticonvulsivante (SMITHA et al, 2008; VERMA et al, 2004; SINGH et al, 1992) e antimicrobiano ((NANDAKUMAR et al, 2010; SARANGAPANI & REDDY, 1994; RAVICHANDRAN et al, 2007; PATEL et al, 2006; SRIDHAR et al, 2001), antiinflamatório e antinociceptivo (DANTAS et al, 2020).
Nesse trabalho serão sintetizados dois complexos de cobre derivados do allin e isatina. O alho cujo princípio ativo é conhecido como allin, possui atividade antibacteriana e antioxidante. Além disso apresenta uma estrutura organossufurada contendo anel aromático. A isatina é encontrada na natureza em diversas plantas, microorganismos e também é produzida por mamíferos, onde ocorre nos fluidos corporais e tecidos. Encontra-se distribuída no sistema nervoso e parece estar relacionada à modulação endógena da ingestão de alimentos.
2 – OBJETIVOS
O objetivo deste trabalho foi testar a atividade antimicrobiana da Isatina e seus complexos (S)-4-metilbenzil cisteína + Isatina + Perclorato de cobre e complexo (S)-4-clorobenzil cisteína +Isatina + Perclorato de cobre, frente a quatro bactérias gram-negativas e gram-positiva, sendo elas Escherichia coli (ATCC 8739), Klebsiella pneumoniae (ATTCC 13883), Pseudomonas aeruginosa (ATCC 9027) e Staphyloloccus aureus (ATCC 25923).
3 – METODOLOGIA
As etapas experimentais foram desenvolvidas no laboratório de microbiologia do Centro Universitário Norte do Espírito Santo da Universidade Federal do Espírito Santo (UFES).
3.1. SÍNTESE DOS COMPOSTOS QUÍMICOS
Complexos (S)-4-metilbenzil cisteína + Isatina + Perclorato de cobre
Em um balão de 100 mL foram adicionados 0,01 mol de (S)-4-metilbenzil cisteína (previamente sintetizado) dissolvido em 50 mL de metanol (Vetec). O sistema foi mantido em refluxo com agitação magnética, a 60ºC. Após a dissolução do ligante foi adicionado 0,01 mol de isatina (Vetec, 99%) e o pH foi ajustado para 5,5. A síntese do complexo foi realizada in situ adicionando 0,07 g de perclorato de cobre II e o complexo foi filtrado a vácuo e posto para secar no dessecador.
Complexo (S)-4-clorobenzil cisteína + Isatina + Perclorato de cobre
Foi realizado o mesmo procedimento descrito anteriormente, utilizando agora o ligante (S)-4-clorobenzil cisteína (previamente sintetizado).
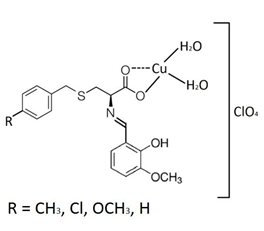
A estrutura esperada dos complexos é mostrada na Figura 1.
Onde R = CH3,Cl
Figura 1 – Estrutura provável dos complexos.
A determinação da concentração inibitória mínima (CIM) das substâncias frente aos microrganismos testados foi realizada por ensaio de microdiluição em caldo nas concentrações de 1024, 512, 256, 128, 64, 32, 16, 8, 4 e 2 µg/mL. O método CIM consistiu no preparo de diluições sucessivas das substâncias testadas em meios de cultivos próprios, inoculado com a bactéria em estudo, incubada e posteriormente verificada a menor concentração que inibiu o crescimento dos microrganismos. Para o preparo dos inóculos bacterianos foi utilizada a bactéria Gram positiva Staphyloloccus aureus (ATCC 25923) e as seguintes bactérias Gram negativas: enterobactérias Escherichia coli (ATCC 8739) e Klebsiella pneumoniae (ATCC 13883), e bacilo não fermentador Pseudomonas aeruginosa (ATCC 9027). Todos os microrganismos são mantidos no laboratório de Microbiologia do CEUNES e foram doados pela Fundação Oswaldo Cruz. Cada bactéria foi transferida do meio de manutenção para o meio Ágar Mueller- Hinton e incubada a 37ºC por 18-24 horas para ativação da respectiva cultura. Para o preparo do inóculo foram selecionadas de 4 a 5 colônias do microrganismo em Ágar Mueller-Hinton e transferidas para tubo de ensaio contendo 5,0mL de solução NaCl 0,86% estéril, seguidas de homogeneização. A densidade do inóculo seguiu densidade comparável com turvação 0,5 da escala de Mcfarland (CLSI, 2005).
Após a escolha do solvente mais adequado (DMSO), uma solução da substância teste com o solvente foi preparada na concentração de 50 mg/mL (solução mãe). Diluições da substância foram preparadas com o meio TSB (Caldo Triptona de Soja) a partir da solução mãe na concentração de 1024µg/mL até 2µg/mL de droga. O ensaio foi realizado em placa de 96 poços e controles positivo e negativo foram utilizados para análise do crescimento ou não do microrganismo. Para o ensaio de microdiluição em placa, 100µL de caldo TSB (Caldo Triptona de Soja) foi adicionado nos poços correspondentes ao controle negativo de cada diluição e ao controle positivo e 100µL de cada diluição da substância foi adicionada na placa em triplicata e nos poços correspondentes ao teste de controle negativo. 100µL da suspensão bacteriana compatível com a turvação 0,5 da escala de Mcfarland foi adicionada ao controle positivo e nos poços correspondentes às diluições (em triplicata). Posteriormente a primeira leitura foi realizada em leitor de Elisa e a placa foi incubada à 37oC por 24 horas. Após período de incubação, os poços foram homogeneizados e uma nova leitura foi realizada. A diferença entre a segunda e a primeira leitura correspondeu ao crescimento do microrganismo e a concentração inibitória mínima foi determinada na menor concentração que houve inibição total do crescimento bacteriano. Para descartar a possibilidade de interferência do solvente utilizado, antes da realização do ensaio de atividade antimicrobiana, foi realizado da mesma maneira como descrito acima, o mesmo teste utilizando-se apenas o solvente empregado, o meio de cultura e os microrganismos, com o objetivo de analisar a possível existência de atividade inibidora de crescimento bacteriano por parte do solvente (PESSIN, 2018).
4 – RESULTADOS E DISCUSSÃO
De acordo com os resultados obtidos, nenhuma das drogas testadas apresentou atividade inibitória, conforme demonstrado no quadro abaixo:
Atividade antimicrobiana de compostos associados à isatina frente aos microrganismos estudados:
Substâncias testadas Microrganismos Escherichia coli Klebsiella pneumoniae Pseudomonas aeruginosa Staphylococcus aureus (s)-4-metilbenzil cisteína+isatina+perclorato de cobre (-) (-) (-) (-) (s)-4-clorobenzil cisteína+isatina+perclorato de cobre (-) (-) (-) (-)
(-): substância não impediu o crescimento bacteriano
Para que pudessem ser comprovados os resultados obtidos, todos os testes foram repetidos. Os resultados de não inibição da atividade antibacteriana frente aos microrganismos testados em ambos os complexos de isatina foram mantidos.
5 – CONCLUSÕES:
Embora existam artigos demonstrando atividade antimicrobiana da isatina, o presente estudo demonstrou que os dois novos complexos não apresentam atividade inibitória bacteriana frente aos microrganismos testados.
6 – REFERÊNCIAS BIBLIOGRÁFICAS:
ABBAS, SY; FARAG, AA; AMMAR, YA; ATREES, AA; MOHAMED, AF; EL-HENAWY, AA Synthesis,characterization, and antiviral activity of novel fluorinated isatin derivatives. Monatsh. Chem., 2013, 144(11), 1725-1733.
ANDREANI, A; BURNELLI, S; GRANAIOLA, M; LEONI, A.; LOCATELLI, A; MORIGI, R; RAMBALDI, M; VAROLI, CREMONINI, MA; PLACUCCI, G; CERVELLATI, R; GRECO, E. New isatin derivatives with antioxidant activity. Eur. J. Med.Chem., 2010, 45(4), 1374-1378.
BERGMAN, J; LINDSTROM, JO; TILSTAM, U. The structure and properties of some indolic constituents in Couroupita guianensis aubl. Tetrahedron, 1985, 41, 2879-2881.
CHAUHAN, G; PATHAK, DP; ALI, F; BHUTANI, R; KAPOOR, G; KHASIMBI, S. Advances in Synthesis, Derivatization and Bioactivity of Isatin: A Review. Curr Org Synth. 2021;18(1):37-74.
CHAUHAN, G; PATHAK, DP; ALI, F; BHUTANI, R; KAPOOR, G; KHASIMBIL, S. Advances in Synthesis, Derivatization and Bioactivity of Isatin: A Review. Current Organic Synthesis, 2021, 18, 37-74
CLINICAL AND LABORATORY STANDARDS INSTITUTE (CLSI). Standards for antimicrobial susceptibility testing. Fifteenth Informational Supplement M100-S15, Wayne, PA, 2005
DANTAS, LLSFR, FONSECA, AG; PEREIRA; JR; FURTADO, AA. GOMES, PATM; FERNANDES-PEDROSA, MF; Leite, ACL;, Rêgo; MJBM. Pitta; MGR; Lemos; TMAM. Anti-inflammatory and antinociceptive effects of the isatin derivative (Z)-2-(5-chloro-2-oxoindolin-3-ylidene)-N-phenyl-hydrazinecarbothioamide in mice. Brazilian Journal of Medical and Biological Research (2020) 53(10): e10204.
ERDMANN, OL. Untersuchungen uber den Indigo. J. Prakt. Chem., 1840, 19,321-362.
FIGUEIREDO, GS; ZARDO, RS; SILVA, BV; VIOLANTE, FA; PINTO, AC; FERNANDES, PD. Convolutamydine A and synthetic analogues have antinociceptive properties in mice. Pharmacol. Biochem. Behav., 2013, 103(3), 431-439.
GUO,Y; CHEN,F; Zhongcaoyao1986, 17, 8.
HALKET, JM; WATKINS, PJ; PRZYBOROWSKA, A; GOODWIN, BL; CLOW, A; GLOVER, V; SANDLER, M J; ISCHIA, M; PALUMBO, A; PROTA, G. Tetrahedron1988, 44, 6441.
KUMAR, K; PRADINES, B; MADAMET, M; AMALVICT, R; BENOIT, N; KUMAR, V. 1H-1,2,3-triazole tethered isatin-ferrocene conjugates: Synthesis and in vitro antimalarial evaluation. Eur. J. Med. Chem., 2014, 87, 801-804.
LAURENT, A. Recherches sur l’indigo. Ann. Chim. Phys., 1840, 3, 393-434.
LOUREIRO, JR; ROQUE, F; RODRIGUES, AT; HERDEIRO, MT; RAMALHEIRA, E. O uso de antibióticos e as resistências bacterianas: breves notas sobre a sua evolução. Revista Portuguesa de saúde pública, v. 34, pag. 77-84. 2016.
MANLEY-KING, CI; BERGH, JJ; PETZER, JP. Inhibition of monoamine oxidase by selected C5- and C6-substituted isatin analogues. Bioorg. Med. Chem.,2011, 19(1), 261-274.
NAIK, N; VIJAY, KH; VIDYASHREE, PB. Synthesis and evaluation of antioxidant potential of novel isatin analogues. J. Pharm. Res., 2011, 4, 2686-2689.
NANDAKUMAR, A; THIRUMURUGAN, P; PERUMAL, PT; VEMBU, P; PONNUSWAMY, MN; RAMESH, P. One-pot multicomponent synthesis and anti-microbial evaluation of 2′-(indol-3-yl)-2-oxospiro(indoline-3,4′-pyran) derivatives. Bioorg. Med. Chem. Lett., 2010, 20(14), 4252-4258.
PAIRA, P; HAZRA, A; KUMAR, S; PAIRA, R; SAHU, KB; NASKAR, S; SAHA, P; MONDAL, S; MAITY, A; BANERJEE, S; MONDAL, NB. Efficient synthesis of 3,3-diheteroaromatic oxindole analogues and their in vitro evaluation for spermicidal potential. Bioorg. Med. Chem. Lett.,2009, 19(16), 4786-4789.
PALUMBO, A; ISCHIA, M; MISURACA, G; PROTA, G. Biochim. Biophys. Acta 1989, 990, 297.
PATEL, A.; BARI, S.; TELELE, G.; PATEL, J. SARANGAPANI. M. Synthesis and Antimicrobial Activity of Some New Isatin Derivatives. Iran. J. Pharm. Sci,2006, 4, 249-254.
PRAKASH, CR; RAJA, S. Design, synthesis and antiepileptic properties of novel 1-(substituted benzylidene)-3-(1-(morpholino/piperidino methyl)-2,3-dioxoindolin-5-yl)urea derivatives. Eur. J. Med. Chem., 2011, 46(12), 6057-6065.
PESSIN, JVP; TAVARES, LA; GRADELLA, DBT. Atividade antimicrobiana de maleimidas e seus respectivos ácidos âmicos.ENCICLOPÉDIA BIOSFERA, Centro Cientifico Conhecer – Goiania, v.15 n.28; p. 1 1 7 8 2018
QURAISHI, MA; AHAMAD, I; SINGH, AK; SHUKLA, SKN – (Piperidinomethyl)-3-[(pyridylidene)amino]isatin: A new and effective acid corrosion inhibitor for mild steel. Mater. Chem. Phys., 2008, 3, 1035-1039.
RAJ, R; GUT, J; ROSENTHAL, PJ; KUMAR, V. 1H-1,2,3-Triazole-tethered isatin-7-chloroquinoline and 3-hydroxy-indole-7-chloroquinoline conjugates: synthesis and antimalarial evaluation. Bioorg. Med. Chem. Lett., 2014, 24(3),756-759.
RAVICHANDRAN, V; MOHAN, S; KUMAR, SK. Synthesis and antimicrobial activity of Mannich bases of isatin and its derivatives with 2-[(2,6-dichlorophenyl)amino]phenylacetic acid. ARKIVOC, 2007, 14, 51-57.
SARANGAPANI, M; REDDY, VM. Synthesis and antimicrobial activity of 1-[(N, N-disubstituted amino) methyl]-3-[(2-phenyl-3, 4-dihydro-4-oxoquinazoline-3-yl] indole-2-one. Indian J. Heterocycl. Chem., 1994, 3, 257-260.
SIN, N; VENABLES, BL; COMBRINK, KD; GULGEZE, HB; YU, K.L.; CIVIELLO, RL; THURING, J; WANG, XA; YANG, Z; ZADJURA, L; MARINO, A; KADOW, KF; CIANCI, CW; CLARKE, J; GENOVESI, EV; MEDINA, I; LAMB, L; KRYSTAL, M; MEANWELL, NA. Respiratory syncytial virus fusion inhibitors. Part 7: structure-activity relationships associated with a series of isatin oximes that demonstrate antiviral activity in vivo. Bioorg. Med. Chem. Lett., 2009, 19(16), 4857-4862.
SINGH, GS; SIDDIQUI, N; PANDEYA, SN. Synthesis and anticonvulsant and anti-inflammatory activities of new 3-aryl/alkylimino-1-methylindol-2-ones. Arch. Pharm. Res., 1992, 15, 272-274.
SMITHA, S; PANDEYA, SN; STABLES, JP; GANPATHY, S. Anticonvulsant and sedative-hypnotic activities of N-Acetyl/Methyl isatin derivatives. Sci.Pharm., 2008, 76, 621-636.
SRIDHAR, SK; SARAVANAN, M; RAMESH, A. Synthesis and antibacterial screening of hydrazones, Schiff and Mannich bases of isatin derivatives. Eur. J. Med. Chem., 2001, 36(7-8), 615-625.
TARUN KUMAR, NA.; JIGNESH, PR. New carbodithioate derivatives: synthesis, characterization, and in vitro antibacterial, antifungal, antitubercular, and antimalarial activity. Med. Chem. Res., 2013, 22, 4700-4707.
THOMAS, G. Quimica Medicinal: uma introdução. Rio de Janeiro: Guanabara Koogan, 2003. 413p.
VERMA, M; PANDEYA, SN; SINGH, KN; STABLES, J.P. Anticonvulsant activity of Schiff bases of isatin derivatives. Acta Pharm., 2004, 54(1), 49-56. PMID: 15050044
VINE, KL; MATESIC, L; LOCKE JM; SKROPETA, D.Recent highlights in the development of isatin-based anticancer agents. In: M. Prudhomme (Eds.), Advances in Anticancer Agents in Medicinal Chemistry (pp. 254-312). Sharjah, UAE: Bentham Science Publishers, 2013.
ZHANG, HM; DAI, H; HANSON, PJ; LI, H; GUO, H; YE, X; HEMIDA, MG; WANG, L; TONG, Y; QIU, Y; LIU. S; WANG, F; SONG, F; ZHANG, B; WANG, J G; ZHANG, LX; YANG, D. Antiviral activity of an isatin derivative via induction of PERKNrf2-mediated suppression of cap-independent translation. ACS Chem. Biol., 2014, 9, 1015-1024.
1Licenciada em Ciências Biológicas pela Universidade Federal do Espírito Santo
2Docente do Departamento de Ciências Naturais da Universidade Federal do Espírito Santo
3Docente do Departamento de Ciências da Saúde da Universidade Federal do Espírito Santo
