REGISTRO DOI: 10.5281/zenodo.10719843
Carolina Minguetti Câmara1
Rose Mari Bennemann2
RESUMO
Embora as causas da infertilidade sejam frequentemente complicadas e difíceis de identificar, sabe-se que existem fatores de saúde e estilo de vida que afetam a capacidade de reprodução de homens e mulheres. A fertilidade pode ser afetada entre outros fatores por meio de mecanismos nutrigenéticos e metabólicos. Da mesma forma, estudos sugerem que modificações nutricionais adequadas podem melhorar a taxa de concepção natural de casais inférteis. Assim compreender essas relações é imprescindível na busca da diminuição dos casos de infertilidade, bem como auxiliar nos tratamentos de reprodução assistida, que atualmente tem resultados de taxa da gravidez insatisfatórios. O objetivo do presente estudo foi realizar uma revisão sistemática sobre a relação da nutrição com a infertilidade feminina. Para tanto, foi consultada a produção cientifica, de periódicos indexados, no período compreendido entre janeiro 2010 e janeiro de 2021, nos bancos de dados do Scientific Eletronic Library Online (SciELO) e da United StatesNational Library of Medicine (PubMed). Os resultados mostraram que os estudos sobre a nutrição e infertilidade são diversos, com foco tanto na melhora dos resultados de reprodução assistida, quanto sobre os efeitos da nutrição sobre a infertilidade. Entretanto a variedade de micronutrientes e dietas usadas, bem como, o uso frequente de preparações multinutrientes complica a análise estatística dos estudos clínicos, não permitindo a análise de micronutrientes individuais. dificultando a compreensão dos efeitos da nutrição sobre a infertilidade.
PALAVRAS-CHAVE: fertilidade; metabolismo; alimentação.
ABSTRACT
Although the causes of infertility are often complicated and difficult to identify, it is known that there are health and lifestyle factors that affect the ability of men and women to reproduce. Fertility can be affected, among other factors, through nutrigenetic and metabolic mechanisms. Likewise, studies suggest that adequate nutritional modifications can improve the natural conception rate of infertile couples. Thus, understanding these relationships is essential in the search for the reduction of infertility cases, as well as assisting in assisted reproduction treatments, which currently have unsatisfactory pregnancy rate results. The aim of the present study was to conduct a systematic review on the relationship between nutrition and female infertility. For that, the scientific production of indexed journals was consulted, in the period between January 2010 and January 2021, in the Scientific Electronic Library Online (SciELO) and United States National Library of Medicine (PubMed) databases. The results showed that studies on nutrition and infertility are diverse, focusing both on improving assisted reproduction outcomes and on the effects of nutrition on infertility. However, the variety of micronutrients and diets used, as well as the frequent use of multinutrient preparations complicates the statistical analysis of clinical studies, not allowing the analysis of individual micronutrients. making it difficult to understand the effects of nutrition on infertility.
KEYWORDS: fertility; metabolism; food
INTRODUÇÃO
A infertilidade é definida pela Organização Mundial da Saúde como uma doença caracterizada pelo fracasso em estabelecer uma gravidez clínica após 1 ano de relações sexuais regulares e desprotegidas.1 A prevalência da infertilidade varia de 9 a 18%, na população em geral. De acordo com as estatísticas mais recentes da OMS, aproximadamente 50–80 milhões de pessoas em todo o mundo sofrem de infertilidade.2
O aumento progressivo da incidência da infertilidade, pode ser devido a vários motivos, como infecções sexualmente transmissíveis, estresse, pressões de trabalho, urbanização, obesidade etc. De acordo com o Relatório de Resumo Nacional da Sociedade de Tecnologia de Reprodução Assistida, houve 197.737 ciclos iniciados em 2016, nos Estados Unidos, para recuperação de fertilidade.3 Essas estatísticas mostram o número impressionante de mulheres em tratamento de fertilidade.
A infertilidade é uma das causas mais importantes da depressão e suas consequências vão desde a insatisfação com a vida, medo, isolamento social até a violência e o suicídio. O Centro de Controle e Prevenção de Doenças (CDC) dos Estados Unidos considera a infertilidade como uma “prioridade de saúde pública”. Em função disso, criou uma iniciativa para identificar, prevenir e controlar a infertilidade.4
Estudos em grande escala mostraram que cerca de metade de todos os casos de infertilidade ocorrem devido a fatores femininos, 20 a 30 por cento a fatores masculinos e 20 a 30 por cento devido a causas comuns de ambos os sexos.5-7 A infertilidade feminina resulta de múltiplas etiologias, algumas que afetam a implantação e subsequente placentação, levando à disfunção placentária e a resultados adversos. Essas etiologias incluem a síndrome dos ovários policísticos (SOP), endometriose e infertilidade inexplicada.8
Embora as causas da infertilidade sejam frequentemente complicadas e difíceis de identificar, fatores de saúde e estilo de vida afetam a capacidade de reprodução de homens e mulheres. A variação genética que afeta o metabolismo dos nutrientes pode afetar a fertilidade por meio de mecanismos nutrigenéticos.9
De acordo com a Society forAssistedReproductive Technology (ART), de 39.573 ciclos de reprodução assistida realizados nas clínicas dos Estados Unidos, entre mulheres com menos de 35 anos em 2014, apenas 37,1% resultaram em nascidos vivos.10 Isto leva a pensar que existem ainda fatores desconhecidos que se elucidados podem melhorar os resultados das técnicas de reprodução assistida. Uma área de foco para os pesquisadores pode ser a relação entre o ambiente intra-folicular e a qualidade do oócito. De fato, uma gravidez viável está altamente relacionada à qualidade do oócito, que está relacionada ao ambiente folicular.11 Nesse sentido, tem sido demonstrado que o crescimento do oócito é sensível às mudanças no ambiente folicular, especialmente às mudanças de nutrientes. A variação na nutrição materna pode ter efeito significativo na atividade metabólica dos oócitos, na qualidade do oócito e no embrião resultante.12
Há evidências crescentes que sugerem relação entre vários componentes da dieta e fertilidade. Os padrões dietéticos são ferramentas nutricionais práticas que refletem os comportamentos alimentares usuais de um indivíduo. O uso de padrões dietéticos reduz o risco de efeitos colineares, sinérgicos e interativos entre fatores dietéticos individuais, sendo responsáveis por interações complexas entre vários fatores dietéticos que podem influenciar os estados de saúde e doença. Compreender essas relações é fundamental, pois, o aumento nas taxas de obesidade, parece aumentar a propensão para disfunção ovulatória, desregulação hormonal e infertilidade.13
Entretanto, embora a adesão a uma dieta adequada pareça ser protetora para a fertilidade, faz-se necessário uma revisão mais detalhada da relação da nutrição com a infertilidade. Assim, o objetivo do presente estudo foi realizar uma revisão sistemática sobre a relação da nutrição com a infertilidade feminina.
MÉTODOS
O presente estudo é uma revisão sistemática de literatura científica nacional e internacional, realizada conforme a metodologia Preferred Reporting Items for Systematic Reviews and Meta-Analyses.14 Foram analisados estudos publicados nos últimos 10 anos,no período compreendido entre janeiro 2010 até janeiro de 2021, nas bases de dados do PubMedda National Library of Medicine, Medical LiteratureAnalysisandRetrieval System Online (MEDLINE) e daScientific Eletronic Library Online (SciELO).Como estratégia de buscafoiutilizada a combinação de termospré-definidos de acordo com osDescritoresCiências da Saúde (DeSC), utilizando a seguintecombinação de descritoresemportuguês: infertilidade, estadonutricional, nutrição, esterilidade, termosequivalenteseminglês(infertility, nutrition, sterility) eboleanos que estãodescrito a seguir: Infertility-“infertiles”[All Fields] OR “infertilities”[All Fields] OR “infertility”[MeSH Terms] OR “infertility”[All Fields] OR “infertile”[All Fields] OR “infertility s”[All Fields]) AND (“nutrition s”[All Fields] OR “nutritional status”[MeSH Terms] OR (“nutritional”[All Fields] AND “status”[All Fields]) OR “nutritional status”[All Fields] OR “nutrition”[All Fields] OR “nutritional sciences”[MeSH Terms] OR (“nutritional”[All Fields] AND “sciences”[All Fields]) OR “nutritional sciences”[All Fields] OR “nutritional”[All Fields] OR “nutritionals”[All Fields] OR “nutritions”[All Fields] OR “nutritive”[All Fields]) AND (“infertility”[MeSH Terms] OR “infertility”[All Fields] OR “sterile”[All Fields] OR “sterility”[All Fields] OR “sterilant”[All Fields] OR “sterilants”[All Fields] OR “sterilely”[All Fields] OR “steriles”[All Fields] OR “sterilisation”[All Fields] OR “sterilization, reproductive”[MeSH Terms] OR (“sterilization”[All Fields] AND “reproductive”[All Fields]) OR “reproductive sterilization”[All Fields] OR “sterilization”[All Fields] OR “sterilization”[MeSH Terms] OR “sterilisations”[All Fields] OR “sterilised”[All Fields] OR “steriliser”[All Fields] OR “sterilisers”[All Fields] OR “sterilising”[All Fields] OR “sterilities”[All Fields] OR “sterilise”[All Fields] OR “sterilize”[All Fields] OR “sterilizations”[All Fields] OR “sterilized”[All Fields] OR “sterilizer”[All Fields] OR “sterilizers”[All Fields] OR “sterilizes”[All Fields] OR “sterilizing”[All Fields])) AND (y_10[Filter])
Foram excluídas reflexões, revisões sistemáticas, integrativas, metanálises, protocolos de estudo e capítulos de livros. Para serem incluídos no estudo, os artigos deveriam estar disponíveis na íntegra, ser em humanos e estarem relacionados à infertilidade feminina.
A busca e análise bibliográfica foi realizadaem quatro etapas. Na primeira etapa foram identificados todos os artigos relacionados ao tema, nos bancos de dados. Na segunda etapa foi realizada a triagem a partir da leitura dos títulos e dos resumos; na terceira etapa foram selecionados e excluídos os artigos que não corresponderam aos critérios de inclusão. Na quarta etapa foi realizada a leitura na integra dos artigos selecionados e somente após estas duas etapas o estudo foi contemplado (figura 1).
RESULTADOS
A pesquisa resultou em 284 artigos, 280 (98,6%) no PubMED, 4(1,4%) no MEDLINE e nenhum (0%) no SciELO. A partir dos títulos e resumos dos artigos, 85 artigos atenderam aos critérios de elegibilidade, dos quais 10foram removidos por não estarem disponíveis na íntegra (Figura 1), sendo assim comtemplados 75 artigos.
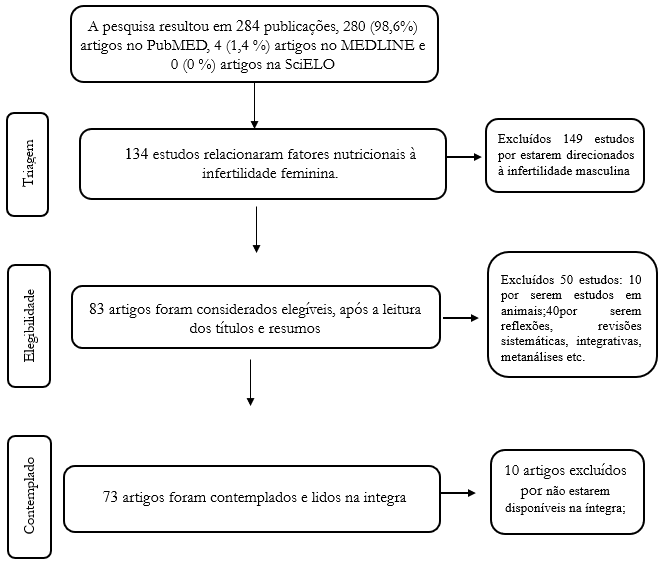
Figura 1. Fluxograma do processo de seleção dos estudos que relacionaram a nutrição com a infertilidade feminina.
Dos artigos comtemplados 26 relacionam as vitaminas, macro e micronutrientes com infertilidade (quadro 1). As principais características e achados de dez estudos que abordaram a associação da vitamina D com a infertilidade são mostrados no quadro 1. A maioria dos artigos (9) relacionou os níveis de vitamina D com a infertilidade, e somente 1 artigo relacionou o uso de vitamina D com os resultados de chance de gravidez. Ainda, no quadro 1, cinco (5) estudos avaliaram o efeito do uso de folato sobre a infertilidade, 3 avaliaram o efeito de outras vitaminas (B12, C e E) e 8 artigos avaliaram os efeitos de micronutrientes (selênio, cálcio, magnésio, ferro, cádmio). Muitos estudos não utilizaram um único agente, mas, uma mistura de 2 ou três nutrientes.
Foram incluídos na revisão, 12 artigos que relacionaram a obesidade com a infertilidade (quadro 2). Destes, 7 artigos verificaram a interferência do ganho de peso ou uso de dieta rica em gordura sobre a infertilidade, enquanto 5artigos avaliaram a influência da perda de peso ou uso de dieta hipocalórica sobre a infertilidade.
Alguns estudos incluídos investigaram a ação dos ácidos graxos ômega 3 e 6 sobre a infertilidade (6 artigos), descritos no quadro 3. No quadro 4 foram descritos artigos que investigaram o efeito da ingestão alimentar (álcool, cafeína, vegetais, laticíneos, pescado, soja, grãos integras, etc) e sua relação com a infertilidade (13 artigos). Mudanças dos hábitos alimentares e sua relação com à infertilidade foram descritos no quadro 5 (16 estudos).
Os artigos incluídos em todas as tabelas variaram consideravelmente quanto à natureza, dosagem, duração das intervenções, tamanho das amostras e tipo de estudo.
Quadro 1– Produção científica relacionada a vitaminas, macro e micronutrientes e infertilidade, segundo autores, ano, tipo de estudo, tamanho da amostra e evidencias encontradas.
Autores/ ano Tipo de estudo Tamanho da Amostra Evidências Abadia et al. (2016)15 Prospectivo – coorte 168 A vitamina D pode estar associada a maiores taxas de fertilização, mas esse aparente benefício não se traduz em maior probabilidade de gravidez ou nascido vivo. Arabian & Raoofi (2018)16 Transversal 153 Níveis de vitamina D estão associados à espessura endometrial e ao número de folículos antrais. Entretanto o estudo não encontrou relação entre o nível sérico de vitamina D na taxa de gravidez. Arnanz et al. (2021)17 Prospectivo observacional 37 Pacientes sem deficiência de vitamina D têm probabilidade significativamente maior de obter um blastocisto euplóide em comparação com pacientes com deficiência de vitamina D. Chen et al. (2018)18 Abordagem – casos controles 356/180 Foi levantada a hipótese de que a vitamina D pode reduzir o risco de infertilidade por fator tubário por meio da supressão da produção de IL-6. Jensen et al. (2020)19 Retrospectivo – coorte 16212 Mulheres inférteis expostas a vitamina D extra da margarina tiveram chance maior de nascidos vivos em comparação com mulheres inférteis não expostas a vitamina D extra. Paffoni et al. (2017)20 Transversal prospectivo 103 Não surgiram diferenças estatisticamente significativas ao avaliar a taxa de insuficiência de vitamina D de acordo com as causas de infertilidade. Aramesh et al. (2021)21 Intervenção – antes e depois 51 É possível que a vitamina D aumente os níveis de hormônio antimuleriano sem alterar a contagem de folículos antrais/reserva ovariana, em mulheres com reserva ovariana diminuída e deficiência de vitamina D. Abootorabi et al. (2018)22 Clínico randomizado controlado por placebo 44 Suplementação com vitamina D em mulheres com síndrome de ovários policísticos diminuiu a glicemia, aumentou HOMA e adiponectinas Walz et al. (2020)23 Transversal e observacional 287 Foi observada forte relação entre o desenvolvimento do blastocisto e a suficiência de vitamina D. No entanto, não houve associação entre a vitamina D e gravidez clínica ou resultados de nascidos vivos. Dastorani et al. (2018)24 Randomizado duplo-cego controlado por placebo 40 A vitamina D teve efeitos benéficos no metabolismo da insulina e no perfil lipídico de mulheres inférteis com síndrome de ovários policísticos Gaskin et al. (2014)25 Prospectivo de coorte 232 A maior ingestão de folato suplementar foi associada a maiores taxas de nascidos vivos após o tratamento com tecnologia de reprodução assistida. Gaskin et al. (2019a)26 – 304 Aumento da quantidade de folato levou a proteção contra as consequências reprodutivas adversas da poluição. Murto et al. (2014)27 Prospectivo caso controle 368 Aumento da quantidade de folato não aumenta a possibilidade de nascimento após tratamento de infertilidade de causa inexplicada. Murto et al. (2017)28 Prospectivo observacional 360 Mulheres inférteis aderiram menos à suplementação de folato. Polzikov et al. (2022)29 Prospetivo randomizado multicêntrico 110 Os autores sugeriram que o nível basal de folato sérico elevado e uma relação Ca/Mg mais baixa estão associados a piores resultados de técnicas de reprodução assistida em mulheres normogonadotrópicas. Gaskin et al. (2015a)30 Prospectivo de coorte 110 Concentrações séricas mais altas de folato e vitamina B-12 antes do tratamento por técnicas de reprodução assistida foram associadas a maiores taxas de nascidos vivos em uma população exposta à fortificação com ácido fólico. Ravichandran et al. (2021)31 Transversal 159 Diferentes concentrações de vitamina B12 levaram à probabilidade semelhante de gravidez. Amini et al. (2021)32 Randomizado triplo-cego controlado por placebo 60 O uso de vitamina C e E melhorou os sintomas da endometriose. Ruder et al. (2014)33 Randomizado controlado 503 O aumento da ingestão de β-caroteno, vitamina C e vitamina E foi associado ao tempo até a gravidez, mas o efeito desses nutrientes antioxidantes varia com o índice de massa muscular e a idade. Grieger et al. (2019)34 Prospectivo multicêntrico 1060 Necessário mais pesquisas para associar a diminuição dos oligoelementos selênio, zinco e cobre com dificuldade para engravidar Heidar et al. (2019)35 Randomizado, duplo-cego e controlado por placebo 36 A suplementação de selênio por 8 semanas, para mulheres inférteis candidatas à fertilização in vitro não teve efeito nos sintomas clínicos. Jamilian et al. (2018)36 Randomizado, duplo-cego e controlado por placebo 60 A coadministração de probiótico e selênio por 12 semanas para mulheres com síndrome de ovário policístico teve efeitos benéficos nos parâmetros de saúde mental, níveis séricos de testosterona total e hirsutismo. Hahn et al. (2019)37 Prospectivo de coorte 2969 A ingestão dietética de ferro não foi consistentemente associada à fecundidade. Lee et al. (2020a)38 – 124 Níveis baixos de cádmio e chumbo no sangue podem ser deletérios para a fecundidade feminina Alizadehet al. (2021)39 Randomizado, duplo-cego e controlado por placebo 84 O uso de magnésio e melatonina reduziu a testosterona total em mulheres com síndrome de ovário policístico. Mousavi et al. (2022)40 Randomizado, duplo-cego e controlado por placebo 84 A co-suplementação de magnésio e melatonina em mulheres com síndrome de ovário policístico teve efeito favorável nos níveis de hirsutismo, no fator de necrose tumoral (TNF-α) sérico e capacidade anti-oxidante total.
Quadro 2– Produção científica relacionada a obesidade e infertilidade, segundo autores, ano, tipo de estudo, tamanho da amostra e evidencias encontradas.
Autores/ano Tipo de estudo Tamanho da Amostra Evidências Gaskins et al. (2021)41 Prospectivo coorte 486 O ganho de peso na idade adulta está negativamente associado ao sucesso das técnicas de reprodução assistida, particularmente entre as mulheres que eram mais pesadas aos 18 anos. Gaskins et al. (2015b)42 Prospectivo coorte 1950 Ganhar peso na idade adulta, estar acima do peso ou obeso na idade adulta e estar abaixo do peso aos 18 anos foram associados a redução modesta na fecundidade. Kazemi et al. (2013)43 Observacional 236 Dieta rica em gordura pode induzir a estresse oxidativo no ambiente oocitário e influenciar negativamente o desenvolvimento embrionário. Legro et al. (2016)44 Multicêntrico randomizado duplo-cego 329 Melhora da ovulação e nascidos vivos após tratamento para infertilidade precedido de modificação do estilo de vida, com perda de peso comparado ao tratamento imediato, sem modificação do estilo de vida Legro et al. (2022)45 Randomizado controlado 379 Uma intervenção intensiva do estilo de vida, preconcepção para perda de peso, não melhorou os resultados de fertilidade ou nascimento em comparação com uma intervenção de exercício sem perda de peso direcionada. A melhora na saúde metabólica pode não se traduzir em melhora da fecundidade feminina. Chavarro et al. (2012)46 Prospectivo coorte 170 O sobrepeso e a obesidade foram relacionados a menores taxas de nascidos vivos em mulheres submetidas a técnicas de reprodução assistida. A perda de peso a curto prazo foi relacionada ao maior rendimento de oócitos maduros, particularmente entre mulheres com sobrepeso e obesidade, mas sem relação com os resultados clínicos. Li et al. (2019)47 Prospectivo coorte 264 A circunferência da cintura foi inversamente relacionada à probabilidade de nascidos vivos entre as mulheres submetidas à tecnologia de reprodução assistida independentemente do índice de massa muscular. Ruebel et al. (2019)48 Prospectivo – grupo controle 8/9 Os resultados sugeriram que a obesidade tem consequências importantes para o ambiente folicular durante o período preconcepção. Amirjani et al. (2019)49 Comparativo transversal 150/168 Ingestão limitada de energia e gordura é fortemente recomendada em mulheres iranianas com síndrome de ovário policístico. Becker et al. (2015)50 Randomizado controlado 26 Dieta hipocalórica de baixo índice glicêmico promoveu diminuição do índice de massa corporal percentual de gordura corporal e concentrações de leptina, o que melhorou o desenvolvimento oocitário e a taxa de gravidez. Mutsaerts et al. (2016)51 Randomizado multicêntrico 290/287 Em mulheres inférteis obesas, uma intervenção no estilo de vida precedendo o tratamento da infertilidade, em comparação com o tratamento imediato da infertilidade, não resultou em taxas mais altas de parto vaginal de um único filho saudável a termo dentro de 24 meses após a randomização. Einarsson et al. (2017)52 Prospectivo multicêntrico randomizado controlado 217 Não foram encontradas diferenças estatísticas nas taxas de nascidos vivos entre os grupos com redução de peso (que atingiram índice de massa corporal ≤ 25 kg/m2 ou atingiram perda de peso de pelo menos cinco unidades do índice de massa corporal, em relação ao grupo que realizou somente a fertilização in vitro.
Quadro 3– Produção científica relacionada a ácidos graxos e ômega 3 e 6 e infertilidade, segundo autores, ano, tipo de estudo, tamanho da amostra e evidencias encontradas.
Autores/ano Tipo de estudo Tamanho da Amostra Evidências Wise et al. (2018)53 Prospectivo – coorte 1126 Mostraram pouca evidência de uma associação entre fecundidade e ingestão de gordura total da dieta, ácidos graxos livres, ácidos graxos livres, ácidos graxos poli-insaturados (PUFA) e ácidos graxos ômega 6. Chiu et al. (2018a)54 Prospectivo – coorte 100 Níveis séricos mais elevados e ingestão de ômega 3 foram positivamente relacionados com a probabilidade de gravidez clínica e nascido vivo, entre as mulheres submetidas a técnicas de reprodução assistida. Mínguez-Alarcón et al. (2021)55 Prospectivo – coorte 353 Associações positivas de mercúrio capilar com a contagem de folículos antrais podem ser reflexo dos efeitos benéficos do ômega 3 na reserva ovariana. Nadjarzadeh et al. (2013)56 Clínico randomizado duplo-cego 78 A suplementação de ômega-3 pode reduzir as concentrações séricas de testosterona e regular o ciclo menstrual. Nadjarzadeh et al. (2015)57 Clínico randomizado duplo-cego controlado por placebo 84 A suplementação de ômega-3 em mulheres com SOP pode mostrar efeito benéfico na adiponectina, concentração de hormônio luteinizante (LH) e relação LH/ hormônio folículo estimulante (FSH). Este efeito não foi associado ao índice de massa corporal e aos níveisde visfatina, FSH e prolactina. Shahnazi et al. (2015)58 Estudo experimental – O ácido graxo ômega 3 afeta de forma diversa a expressão gênica do receptor do fator de crescimento semelhante à insulina de (Insulin-Like Growth Factor- IGF-1) ecicloxigenases COX-2 em células da granulosa sendo mais pronunciadas nas pacientes com síndrome de ovário policístico em relação ao controle.
Quadro 4– Produção científica relacionada a alimentos/tipo de dietas (substâncias químicas ou orgânicas) e infertilidade, segundo evidências, autores e ano.
Alimentos /tipo de dieta Evidências Autores/ano Álcool e cafeína Pré-tratamento de álcool e cafeína, no ano anterior ao tratamento da infertilidade, não foi associado aos resultados das técnicas de reprodução assistida. Abadia et al. (2017)59 Vegetais e tabagismo A ingestão materna inadequada de vegetais periconcepcionais e o tabagismo paterno reduzem significativamente o potencial de implantação de embriões após tratamento com ICSI. Hoeket al. (2020)60 Laticínios Diminuição de amido e laticínios na dieta levou à diminuição da testosterona em mulheres com síndrome de ovários policísticos. Maior ingestão de laticínios aumentou os nascidos vivos entre as mulheres com idade ≥35 anos em técnicas de reprodução assistida. Afeicheet al. (2016)61; Rajaeieh et al. (2014)62; Phy et al. (2015)63 Pescado O consumo de pescado está relacionado a maior probabilidade de nascidos vivos após tratamento de infertilidade com técnicas de reprodução assistida. Nassan et al. (2018)64 Soja A ingestão dietética de soja foi positivamente relacionada à probabilidade de ter um nascido vivo durante o tratamento de infertilidade com técnicas de reprodução assistida. Vanegas et al. (2015)65; Chavarro et al. (2016)66 Resíduos de agrotóxicos em frutas e hortaliças Leva a alterações no metaboloma sérico de mulheres em tratamento de infertilidade. Associado à menor probabilidade de gravidez. Chiu et al. (2018b)67 Grãosintegrais A maior ingestão de grãos integrais pré-tratamento foi relacionada à maior probabilidade de nascidos vivos entre as mulheres submetidas à fertilização in vitro. Gaskin et al. (2016)68 Dietas veganas A adoção de uma dieta vegana pode ser eficaz para promover a perda de peso a curto prazo entre mulheres com síndrome de ovário policístico. Turner-McGrievy et al. (2014)69 Simbióticos Suplementação simbiótica de 12 semanas não tem efeitos benéficos significativos em pacientes com síndrome de ovários policísticos. Karimi et al. (2018)70 Bebidas açucaradas Bebidas açucaradas, independentemente do teor de cafeína, podem ser uma ameaça maior ao sucesso reprodutivo do que cafeína e bebidas cafeinadas sem adição de açúcar. Machtinger et al. (2017)71
Quadro 5– Produção científica relacionada a mudanças de hábitos e infertilidade, segundo autores, ano, linha de estudo, e evidencias encontradas.
Autores/ano Linha de estudo Evidências Braga et al. (2015)72 Ingestão alimentar x qualidade embrionária O consumo de cereais, hortaliças, frutas e peixes influenciou positivamente na qualidade do embrião. Estar em dieta para perda de peso, consumo de carne vermelha, álcool e fumo teve influência negativa sobre o desenvolvimento embrionário. Gaskins et al. (2019b)73 Dieta “pró-fertilidade”: maior ingestão de ácido fólico, vitamina B12, vitamina D, grãos integrais, laticínios, alimentos de soja e frutos do mar A maior adesão pré-tratamento à dieta “pró-fertilidade” foi associada ao aumento da probabilidade de nascidos vivos entre as mulheres submetidas a técnicas de reprodução assistida. Lee et al. (2020b)74 Ingestão de refeições não preparadas em casa x infertilidade Podem ser um fator que contribui para a infertilidade, embora os achados requeiram confirmação. Maldonado-Cárceles et al. (2020)75 Padrões alimentares x reserva ovariana. Os padrões alimentares não foram relacionados à contagem de folículos antrais entre uma coorte de mulheres que se apresentaram em um centro de fertilidade. Noventa et al. (2016)76 Desequilíbrio nutricional x infertilidade inexplicada Quando comparadas com mulheres férteis, as pacientes com infertilidade inexplicada apresentaram alterações significativas nos hábitos alimentares. Oostingh et al. (2020)77 Comportamento nutricional x fertilização in vitro O programa de Coaching mHealth Smarter Pregnancy é eficaz e melhora os comportamentos nutricionais e de estilo de vida nos casais submetidos a tratamento de fertilização invitro. Oostingh et al. (2019)78 Mobile Health Coaching em Nutrição X Custo-Efetividade do tratamento de reprodução assistida. O uso do programa resultou em gestações adicionais. A maior economia de custos foi causada pelos custos evitados do tratamento de fertilização in vitro. Pieczyńska. (2018)79 A doença celíaca e a sensibilidade ao glúten não celíaca x efeitos nos distúrbios reprodutivos A doença celíaca é postulada para ser considerada na triagem pré-concepcional de pacientes com distúrbios reprodutivos, mas para a sensibilidade ao glúten não celíaca, o efeito sobre a fertilidade ainda não está comprovado. Weiss et al. (2021)80 Estilo de vida mais contraceptivos orais x disfunção sexual em mulheres SOP Os achados sugerem que tratamentos comuns para síndrome de ovário policístico, incluindo modificação intensiva do estilo de vida e a combinação de modificação intensiva do estilo de vida e anticoncepcionais orais, têm potencial de melhorar a função sexual dessas mulheres. Tsai et al. (2013)81 Nutrição x hormônios sexuais em mulheres com síndrome de ovário policístico. As mulheres com síndrome de ovário policístico (SOP) consomem menos energia e carboidratos em comparação com aquelas com infertilidade não relacionada à SOP. A ingestão de macronutrientes está apenas negativamente associada ao nível sérico de globulina de ligação aos hormônios sexuais no grupo SOP com hiperandrogenismo. Turner-McGrievy et al. (2015)82 Nutriçãox Síndrome de Ovário Policístico As dietas habituais dos participantes eram ricas em gorduras e gorduras saturadas e pobres em fibras, folato e ferro em comparação com mulheres sem síndrome de ovário policístico que se inscreveram em um programa comportamental de perda de peso. Twigt et al. (2012)83 Recomendações dietéticas do Centro de Nutrição da Holanda Resultados mostraram que a adesão às recomendações dietéticas holandesas, em mulheres submetidas ao tratamento de fertilização in vitro, aumenta a chance de manutenção de gravidez em andamento. Alibeigi et al. (2020)84 Dieta (medicina iraniana) X tratamento infertilidade O uso da dieta (medicina iraniana) foi correlacionada com número de óvulos, número de óvulos maduros, número de embriões, qualidade do embrião, taxa de fertilização e de gravidez significativamente maiores. Dupont et al. (2020)85 Estilo de vida x Infertilidade Mudar de forma benéfica os fatores nutricionais, deve ser considerado como tratamento de primeira escolha para infertilidade inexplicada e sugerido aos casais antes das técnicas de reprodução assistida. Jahangirifar et al. (2019)12 Dieta saudável, ocidental e não saudável Maior adesão à dieta saudável pode melhorar a qualidade e a quantidade de oócitos. Karayiannis et al. (2018)86 Dieta do mediterrâneo Aumenta o desempenho na fertilização in vitro.
DISCUSSÃO
Vitaminas
Relatos de estudos relacionados ao uso de vitaminas com a infertilidade feminina são poucos (Quadro 1). A maioria deles refere-se ao uso da vitamina D. Nas investigações da relação entre a vitamina D e a infertilidade, os estudos são variados, com diferentes variáveis de interesse, objetivos e resultados diversos. Abadia et al.59 ao investigarem a associação da vitamina D com as taxas de fertilização in vitro (FIV), verificaram aumento de fertilização, embora, de acordo com os autores, esse aparente benefício não se traduziu em maior probabilidade de gravidez ou de nascidos vivos. Outros autores23,17 verificaram que o aumento de vitamina D está relacionado com aumento de blastocistos, embora não tenham observado aumento da taxa de gravidez em FIV. Já Jensen et al.19 verificaram que a vitamina D aumenta as chances de gravidez.
Arabian & Raoofi16 verificaram efeito favorável da vitamina D na espessura do endométrio e no número de folículos antrais. Diferentemente Arameshet al.21, mostraram aumento da expressão do hormônio antimulleriano. Receptores de vitamina D podem ser encontrados em grande número de tecidos e em receptores dos órgãos reprodutivos, como os ovários e a placenta. No tecido ovariano humano, o colecalciferol (vitamina D3) estimula a produção de progesterona e estradiol, entretanto, dados clínicos são escassos.
O uso de vitamina D em mulheres com síndrome de ovários policísticos também tem sido investigado, sendo observado diminuição da glicemia, aumento do índice de secreção de insulina (HOMA) e adiponectinas22 e efeitos benéficos no metabolismo da insulina e no perfil lipídico.24
Apesar da tendência do efeito negativo da deficiência de vitamina D nos resultados das técnicas de reprodução assistida (Quadro 1), os resultados ainda são controversos e seriam necessários mais estudos para avaliar a influência da deficiência de vitamina D e estimar adequadamente a magnitude do efeito. Nossos resultados corroboram com resultados de meta-análise publicada em 2014 com dados entre janeiro de 1990 e fevereiro de 2014, onde os autores concluíram pela não recomendação da suplementação de vitamina D antes da fertilização in vitro.
Outro micronutriente que tem sido relacionado à infertilidade e, integrante do complexo B é o folato-vitamina B9 (Quadro1). É uma vitamina considerada importante para a qualidade e maturação do oócito, bem como para a implantação e continuação normal da gravidez. O folato desempenha papel importante na síntese de DNA e modificação epigenética, bem como na proliferação celular. Consequentemente, a deficiência de folato afeta particularmente células altamente proliferativas (por exemplo, células do tubo neural no feto em desenvolvimento), aumentando assim o risco de defeitos do tubo neural e vários outros defeitos congênitos. A deficiência de folato é geralmente causada por uma dieta pobre, pela má absorção do folato e pela deficiência de vitaminas B2, B 6 e B 12, visto que as mesmas são necessárias para o metabolismo do folato. Concentrações insuficientes dessas vitaminas prejudicam o metabolismo, causando deficiência funcional de folato acompanhada por altas concentrações de homocisteína.28
Maior ingestão de folato suplementar (ácido fólico) foi associada a maiores taxas de nascidos vivos após o tratamento com tecnologia de reprodução assistida25. Os autores verificaram em estudo prospectivo de coorte, que concentrações séricas mais altas de folato e vitamina B12 antes do tratamento com técnicas de reprodução assistida foram associadas a maiores taxas de nascidos vivos em uma população exposta à fortificação com ácido fólico.30 Segundo os autores, o aumento do folato levou à proteção contra consequências reprodutivas adversas da poluição.26 Murto et al.27,28 observaram que o aumento de folato não aumenta a possibilidade de nascimento após tratamento de infertilidade de causa inexplicada. Já Polzikovet al29, usando modelos de multivariáveis, sugeriram que o nível basal de folato sérico elevado (≥33,0 ng/ml) e uma relação Ca/Mg mais baixa estavam associados a piores resultados de técnicas de reprodução assistida em mulheres normogonadotrópicas.
Obesidade
Outro fator que tem sido associado à infertilidade é o excesso de peso e a obesidade, causados normalmente pela ingestão inadequada de nutrientes (Quadro 2). Chavarroet al.46 verificaram que o sobrepeso e a obesidade foram relacionados a menores taxas de nascidos vivos em mulheres submetidas às técnicas de reprodução assistida. Ainda, a perda de peso a curto prazo levou a maior rendimento na obtenção de oócitos maduros em metáfase II para o tratamento de fertilização in vitro, entretanto isso não levou a um aumento na taxa de nascidos vivos. Outro estudo concluiu que a circunferência da cintura foi inversamente relacionada à probabilidade de nascidos vivos entre as mulheres submetidas à tecnologia de reprodução assistida, independentemente do índice de massa muscular.47 O excesso de peso corporal nas mulheres que tentam engravidar sem assistência ou por meio de tecnologias de reprodução assistida tem sido associado a piores resultados reprodutivos, incluindo maiores riscos de anovulação, menstruação irregular, infertilidade, aborto espontâneo e natimorto. A literatura apoia os benefícios da prevenção de ganho de peso excessivo na idade adulta, em relação a fertilidade feminina.42,26
Embora as mulheres com excesso de peso ou obesas sejam frequentemente encorajadas a perder peso como forma de aumentar a fertilidade, a maioria das evidências vem de estudos que comparam mulheres com excesso de peso ou obesas com mulheres com peso adequado, em vez de estudos que avaliam diretamente os efeitos da perda de peso. Legro et al.44 mostraram o benefício da melhora da ovulação e nascidos vivos com o tratamento da infertilidade tardia com citrato de clomifeno quando precedido de modificação do estilo de vida com perda de peso em comparação com o tratamento imediato, em estudo randomizado. Entretanto, Legro et al45, em outro estudo randomizado e controlado, com intervenção intensiva no estilo de vida preconcepção para perda de peso, não observaram melhora nos resultados de fertilidade ou nascimento em comparação com uma intervenção de exercício sem perda de peso direcionada. Concluíram que a melhora na saúde metabólica pode não se traduzir em melhora da fecundidade feminina.
No quadro 5, observamos que a adesão a dietas mais saudáveis, tem ajudado nos tratamentos de infertilidade.72-74 Assim, mudar de forma benéfica os fatores nutricionais, deve ser considerado nos tratamentos para infertilidade. No estudo realizado por Braga et al.72, o consumo de cereais, hortaliças, frutas e peixes influenciou positivamente na qualidade do embrião. Entretanto, Einarson et al.52 não encontram diferenças estatisticamente significativas nas taxas de nascidos vivos entre os grupos com redução de peso ou sem redução de peso antes de tratamento para reprodução assistida.
Quando comparadas com mulheres férteis, as pacientes com infertilidade inexplicada apresentaram diferenças significativas nos hábitos alimentares. Essas diferenças foram desde mínimo desequilíbrio de micronutrientes a combinados e severos desequilíbrios de micronutrientes e macronutrientes, frequentemente associados à obesidade, levando os autores a levantar a hipótese de que a investigação e tratamento nutricional podem explicar e resolver um percentual de casos de infertilidade atualmente definidos como infertilidade “sem causa aparente”.76
Turner-McGriev et al.69 observaram que mulheres com síndrome de ovário policístico consumiam dietas ricas em gorduras saturadas, pobres em fibras, folato e ferro e com quantidades significativamente menores de carboidratos e grãos integrais em comparação com mulheres sem síndrome de ovário policístico que se inscreveram em um programa comportamental de perda de peso.
Até o momento, não houve uma investigação sobre quais estágios específicos do tratamento de fertilidade são afetados pelo excesso de peso corporal. Entretanto, estudos mostram que a dieta rica em gordura pode induzir a estresse oxidativo no ambiente oocitário, e assim, influenciar negativamente a maturação do ovócito.43 Ainda, o estudo clínico conduzido por Ruebel et al48 mostraram que mulheres obesas submetidas a tratamentos de fertilidade têm níveis elevados de triglicerídeos (TG), leptina e proteína C reativa (PCR) no fluido folicular, que foram positivamente associados ao índice de massa corpórea e pior qualidade do oócito e, consequentemente levaram a menores taxas de gravidez.
Além disso, uma dieta rica em gordura demonstrou afetar negativamente o ciclo hormonal com alta incidência de anovulação. Há evidências de que os ovários e a hipófise permanecem sensíveis à insulina após uma dieta rica em gordura enquanto a resistência sistêmica à insulina se desenvolve. Assim, é possível que os níveis séricos elevados de insulina observados após a exposição à dieta rica em gordura estejam constantemente estimulando as vias da insulina nos ovários e na hipófise, levando à disfunção reprodutiva.16
Mulheres com síndrome de ovário policístico (SOP) são subférteis, anovulatórias, hiperandrogênicas e, têm maiores taxas de aborto e endométrio disfuncional. Nestas mulheres há prevalência de obesidade e adiposidade central. Assim, a ingestão limitada de carboidratos e gordura é fortemente recomendada em mulheres com síndrome de ovário policístico.49
Ômega 3
Acredita-se que a suplementação de ácidos graxos poliinsaturados, como o ômega-3, exerça efeito benéfico na fertilidade feminina (Quadro 3). Aumento de ácidos graxos e diminuição da ingestão de ômega 3 levou à redução da fecundidade.88 Níveis séricos mais elevados e ingestão de ômega 3 foram positivamente relacionados com a probabilidade de gravidez clínica e nascido vivo, entre as mulheres submetidas à técnicas de reprodução assistida.54 Além disso, o consumo de ômega-3 e alimentos ricos em ômega-3 parece melhorar a probabilidade de concepção, diminuindo o risco de perda da gravidez. 89
O ácido graxo ômega 3 afeta de forma diversa a expressão gênica do receptor do fator de crescimento semelhante à insulina de (Insulin-Like Growth Factor- IGF-1) ecicloxigenases COX-2 em células da granulosa tendo efeito mais pronunciado nas pacientes com síndrome de ovário policístico em relação ao controle. O IGF-I é importante no crescimento, desenvolvimento e maturação ovocitária, atuando com efeito mitogênico nas células da granulosa, potencializando o efeito das gonadotrofinas nos tecidos foliculares.90 Quanto ao COX-2, não se conhece exatamente os mecanismos pelos quais ele estaria envolvido com a reprodução, entretanto, nos momentos próximos à ovulação a expressão do COX-2 nas células da granulosa atinge seus níveis máximos.91 Assim, esses achados representam os possíveis mecanismos moleculares subjacentes ao impacto positivo dos ácidos graxos ômega-3 na reprodução, especialmente em pacientes com síndrome de ovário policístico.58
Ainda, os ácidos graxos ômega-3 regulam a maturação e o desenvolvimento dos oócitos, principalmente através da regulação do receptor “peroxisomeproliferator-activated receptor (PPAR)”. A expressão de todas as três isoformas foram identificadas no tecido ovariano. A expressão de PPARγ aumenta com o crescimento do folículo e é subsequentemente diminuída rapidamente em resposta à liberação do hormônio luteinizante (LH) e ovulação. Além disso, os ácidos ômega-3 estimulam a ovulação por meio da expressão de genes e da atividade da COX-2.4
A suplementação de ômega-3 parece também influenciar os hormônios sexuais como a testosterona e consequentemente regular o ciclo menstrual.56 A suplementação de ômega-3 em mulheres com SOP mostrou efeito benéfico na adiponectina, na concentração de hormônio luteinizante e na relação hormônio luteinizante/hormônio folículo estimulante.57
Outros micronutrientes e macronutrientes
Em relação aos micronutrientes, ferro, magnésio, selênio, Zn e Cobre e infertilidade (Quadro 1), os estudos além de serem em número pequeno, em alguns casos, são controversos.35 36, 37, 34, 39, 40
Quanto aos macronutrientes (Quadro 4), diminuição de amido e laticínios na dieta levou à diminuição da testosterona em mulheres com síndrome de ovários policísticos. Maior ingestão de laticínios aumentou os nascidos vivos entre as mulheres com idade ≥35 anos em técnicas de reprodução assistida.61-63 O consumo de pescado também foi relacionado a maior probabilidade de nascidos vivos após tratamento de infertilidade. 64 A ingestão dietética de soja foi positivamente relacionada à probabilidade de ter um nascido vivo durante o tratamento de infertilidade com técnicas de reprodução assistida.65,66 Ainda, a maior ingestão de grãos integrais pré-tratamento foi relacionada à maior probabilidade de nascidos vivos entre as mulheres submetidas à fertilização in vitro68. A adoção de uma dieta vegana pode ser eficaz para promover a perda de peso a curto prazo entre mulheres com síndrome de ovário policístico.69
CONCLUSÃO
Os estudos sobre a nutrição e infertilidade são diversos, com foco tanto na melhora dos resultados de reprodução assistida, quanto sobre os efeitos da nutrição sobre a infertilidade. Entretanto a variedade de micronutrientes e dietas usadas, bem como, o uso frequente de preparações multinutrientes – e não uma única substância – complica a análise estatística dos estudos clínicos, não permitindo a análise de micronutrientes individuais. dificultando a compreensão dos efeitos da nutrição sobre a infertilidade.
Além disso, deve-se considerar que os resultados podem ser influenciados por inúmeras variáveis, que são difíceis de controlar em estudos clínicos, como forma de preparo e armazenamento dos alimentos, horário de ingestão, alimentos, nutrientes e medicamentos, entre outros fatores, que podem interferir na biodisponibilidade do(s) micronutriente(s) tornando, assim, os resultados úteis apenas como orientação.
Para a comprovação dos efeitos seriam necessários estudos prospectivos com retirada ou administração gradual de micronutrientes, entretanto por questões éticas, estudos assim, são inviáveis.
REFERÊNCIAS
1 ZEGERS-HOCHSCHILD F.; ADAMSON, G.D.; DYER, S.; et al. The International Glossary on Infertility and Fertility Care, 2017. FertilSteril., 108(3):393
2 AGHAJANOVA, L.; HOFFMAN, J.; MOK-LIN, E.; HERNDON, C.N. Obstetrics and Gynecology Residency and Fertility Needs. Reprod Sci., 2017; 24(3):428-434.
3 SART, National Summary Report. 2016, Society for Assisted Reproductive Technology: SART Website (www.sart.org).
4 ZAHMATKESHAN, M.; NAGHDI, M.; FARJAM, M.; MOKHTARAN, M.; YAZDANI, A; MAHMOUDVAND, Z; SAFDARI, R. ART Registries–Characteristics and experiences: A comparative study. J Family MedPrimCare, 2019; 8(2): 449–454.
5 KUMAR, N.; SINGH, A.K. Trends of male factor infertility, an important cause of infertility: a review of literature. J Hum Reprod Sci.,2015; 8(4):191-196
6 AGARWAL, A.; MULGUND, A.; HAMADA, A.; CHYATTE, M.R. A unique view on male infertility around the globe. Reprod Biol Endocrinol., 2015; 13(1):37.
7 MASOUMI, S.Z.; PARSA, P.; DARVISH, N.; MOKHTARI, S.; YAVANGI, M.; ROSHANAEI, G. An epidemiologic survey on the causes of infertility in patients referred to infertility center in Fatemieh Hospital in Hamadan. Iran J Reprod Med., 2015; 13(8):513.
8 PISARSKA, M.D.; CHAN, J.L.; LAWRENSON, K.; GONZALEZ, T.L.; WANG, E.T. Genetics and Epigenetics of Infertility and Treatments on Outcomes. J Clin Endocrinol Metab., 2019;104(6): 1871–1886.
9 VANDERHOUT, S.M.; RASTEGAR PANAH M.; GARCIA-BAILO B.; GRACE-FARFAGLIA P.; SAMSEL, K, DOCKRAY, J.; JARVI K.; EL-SOHEMY, A. Nutrition, genetic variation and male fertility. TranslAndrol Urol., 2021;10(3):1410-1431.
10 CDC-Centers for Disease Control and Prevention, American Society for Reproductive Medicine, Society for Assisted Reproductive Technology. 2014 Assisted Reproductive Technology. National Summary Report; 2016.
11 MELDRUM, D.R. Introduction: nongenetic markers of oocyte and embryo competence. Fertility and Sterility, 2015;103(2):301–302.
12 JAHANGIRIFAR M, TAEBI M, NASR-ESFAHANI MH, ASKARI GH. Dietary Patterns and The Outcomes of Assisted Reproductive Techniques in Women with Primary Infertility: A Prospective Cohort Study. Int J FertilSteril. 2019;12(4):316-323.
13 KAZEMI, M.; JARRETT, B.Y.; VANDEN BRINK, H.; LIN, A.W.; HOEGER, K.M.; SPANDORFER, S.D.; LUJAN, M.E. Obesity, Insulin Resistance, and Hyperandrogenism Mediate the Link between Poor Diet Quality and Ovarian Dysmorphology in Reproductive-Aged Women. Nutrients, 30;12(7):1953, 2020.
14 Moher D, Liberati A, Tetzlaff J, Altman DG, The PRISMA Group (2009). Preferred Reporting Items for Systematic Reviews and Meta-Analyses: The PRISMA Statement. PLoS Med 6(6): e1000097.
15 ABADIA L, GASKINS AJ, CHIU YH, WILLIAMS PL, KELLER M, WRIGHT DL, SOUTER I, HAUSER R, CHAVARRO JE; Environment and Reproductive Health Study Team. Serum 25-hydroxyvitamin D concentrations and treatment outcomes of women undergoingassisted reproduction. Am J Clin Nutr. 2016;104(3):729-35.
16 ARABIAN S, RAOOFI Z. Effect of serum vitamin D level on endometrial thickness and parameters of follicle growth in infertile women undergoing induction of ovulation. J ObstetGynaecol. 2018;38(6):833-835.
17 ARNANZ A, DE MUNCK N, EL KHATIB I, BAYRAM A, ABDALA A, MELADO L, LAWRENZ B, COUGHLAN C, PACHECO A, GARCIA-VELASCO JA, FATEMI HM. Vitamin D in Follicular Fluid Correlates With the Euploid Status of Blastocysts in a Vitamin D Deficien Population. Front Endocrinol (Lausanne). 2021;11:609524.
18 CHEN W, JIAO X, ZHANG J, WANG L, YU X. Vitamin D deficiency and high serum IL-6 concentration as risk factors for tubal factor infertility in Chinese women. Nutrition. 2018;49:24-31.
19 JENSEN A, NIELSEN ML, GULERIA S, KJAER SK, HEITMANN BL, KESMODEL US. Chance sof live birth after exposure to vitamin D-fortified margarine in women with fertility problems: results from a Danish population-based cohort study. FertilSteril. 2020;113(2):383-391.
20 PAFFONI A, FERRARI S, MANGIARINI A, NOLI S, BULFONI A, VIGANO P, PARAZZINI F, SOMIGLIANA E. Concordance of vitamin D peripheral levels in infertile couples’ partners. Gynecol Endocrinol. 2017;33(8):649-652.
21 ARAMESH S, ALIFARJA T, JANNESAR R, GHAFFARI P, VANDA R, BAZARGANIPOUR F. Does vitamin D supplementation improve ovarian reserve in women with diminished ovarian reserve and vitamin D deficiency: a before-and-after intervention study. BMC EndocrDisord. 2021;21(1):126.
22 ABOOTORABI M S, AYREMLOU P, BEHROOZI-LAK T, NOURISAEIDLOU S. The effect of vitamin D supplementation on insulin resistance, visceral fat and adiponectin in vitamin D deficient women with polycystic ovary syndrome: a randomized placebo-controlled trial. Gynecol Endocrinol. 2018;34(6):489-494.
23 WALZ NL, HINCHLIFFE PM, SOARES MJ, DHALIWAL SS, NEWSHOLME P, YOVICH JL, KEANE KN. Serum Vitamin D status is associated with increased blastocyst development rate in women undergoing IVF. Reprod Biomed Online. 2020;41(6):1101-1111.
24 DASTORANI M, AGHADAVOD E, MIRHOSSEINI N, FOROOZANFARD F, ZADEH MODARRES S, AMIRI SIAVASHANI M, ASEMI Z. The effects of vitamin D supplementation on metabolic profiles and gene expression of insulin and lipid metabolism in infertile polycystic ovary syndrome candidates for in vitro fertilization. Reprod Biol Endocrinol. 2018;16(1):94.
25 GASKINS AJ, AFEICHE MC, WRIGHT DL, TOTH TL, WILLIAMS PL, GILLMAN MW, HAUSER R, CHAVARRO JE. Dietary folate and reproductive success among women undergoing assisted reproduction. Obstet Gynecol. 2014;124(4):801-809.
26 GASKINS AJ, MÍNGUEZ-ALARCÓN L, FONG KC, ABU AWAD Y, DI Q, CHAVARRO JE, FORD JB, COULL BA, SCHWARTZ J, KLOOG I, ATTAMAN J, HAUSER R, LADEN F. Supplemental Folate and the Relationship Between Traffic-Related Air Pollution and Livebirth Among Women Undergoing Assisted Reproduction. Am J Epidemiol. 2019;188(9):1595-1604
27 MURTO T, SKOOG SVANBERG A, YNGVE A, NILSSON TK, ALTMAE S, WANGGREN K, SALUMETS A, STAVREUS-EVERS A. Folic acid supplementation and IVF pregnancy outcome in women with unexplained infertility. Reprod Biomed Online. 2014;28(6):766-72.
28 MURTO T, YNGVE A, SKOOG SVANBERG A, ALTMAE S, SALUMETS A, WANGGREN K, STAVREUS-EVERS A. Compliance to the recommended use of folic acid supplements for women in Sweden is higher among those under treatment for infertility than among fertile controls and is also related to socioeconomic status andlifestyle. Food Nutr Res. 2017;61(1):1334483.
29 POLZIKOV M, BLINOV D, BARAKHOEVA Z, VOVK L, FETISOVA Y, OVCHINNIKOVA M, TISCHENKO M, ZORINA I, YURASOV V, USHAKOVA T, SERGEYEV O. Association of the Serum Folate and Total Calcium and Magnesium Levels Before Ovarian Stimulation With Outcomes of Fresh In Vitro Fertilization Cycles in Normogonadotropic Women. Front Endocrinol (Lausanne). 2022;13:732731.
30 GASKINS AJ, CHIU YH, WILLIAMS PL, FORD JB, TOTH TL, HAUSER R, CHAVARRO JE; EARTH STUDY TEAM. Association between serum folate and vitamin B-12 and outcomes of assisted reproductive technologies. Am J Clin Nutr. 2015;102(4):943-50.
31 RAVICHANDRAN A, BABUJI M, GOWRI M, KARTHIKEYAN M, CHANDY A, KUNJUMMEN AT, KAMATH MS. Dietary pattern characterisation among subfertile South Asian women and the impact of vitamin B12 intake on frozen embryo transfer outcomes: a crosssectional study. Hum Reprod Open. 2021;2021(1):hoaa068.
32 AMINI L, CHEKINI R, NATEGHI MR, HAGHANI H, JAMIALAHMADI T, SATHYAPALAN T, SAHEBKAR A. The Effect of Combined Vitamin C and Vitamin E Supplementation on Oxidative Stress Markers in Women with Endometriosis: A Randomized, Triple-Blind PlaceboControlled Clinical Trial. Pain Res Manag. 2021;2021:5529741.
33 RUDER EH, HARTMAN TJ, REINDOLLAR RH, GOLDMAN MB. Female dietary antioxidantin take and time to pregnancy among couples treated for unexplained infertility. FertilSteril. 2014;101(3):759-66.
34 GRIEGER JÁ, GZESKOWIAK LE, WILSON RL, BIANCO-MIOTTO T, LEEMAGZ SY, JANKOVICKARASOULOS T, PERKINS AV, NORMAN RJ, DEKKER GA, ROBERTS CT. Maternal Selenium, Copper and Zinc Concentrations in Early Pregnancy, and the Association with Fertility. Nutrients. 2019;11(7):1609.
35 HEIDAR Z, HAMZEPOUR N, ZADEH MODARRES S, MIRZAMORADI M, AGHADAVOD E, POURHANIFEH MH, ASEMI Z. The Effects of Selenium Supplementation on Clinical Symptoms and Gene Expression Related to Inflammation and Vascular Endothelial Growth Factor in Infertile Women Candidate for In Vitro Fertilization. Biol Trace Elem Res. 2020;193(2):319-325.
36 JAMILIAN M, MANSURY S, BAHMANI F, HEIDAR Z, AMIRANI E, ASEMI Z. The effectsof probiotic and selenium co-supplementation on parameters of mental health, hormonal profiles, and biomarkers of inflammation and oxidative stress in women with polycystic ovary syndrome. J Ovarian Res. 2018;11(1):80.
37 HAHN KA, WESSELINK AK, WISE LA, MIKKELSEN EM, CUETO HT, TUCKER KL, VINCETI M, ROTHMAN KJ, SORENSEN HT, HATCH EE. Iron Consumption Is Not Consistently Associated with Fecundability among North American and Danish Pregnancy Planners. J Nutr. 2019;149(9):1585-1595.
38 LEE S, MIN JY, MIN KB. Female Infertility Associated with Blood Lead and Cadmium Levels. Int J Environ Res Public Health. 2020;17(5):1794.
39 ALIZADEH M, KARANDISH M, ASGHARI JAFARABADI M, HEIDARI L, NIKBAKHT R, BABAAHMADI REZAEI H, MOUSAVI R. Metabolic and hormonal effects of melatonin and/or magnesium supplementation in women with polycystic ovary syndrome: a randomized, double-blind, placebo-controlled trial. NutrMetab (Lond). 2021;18(1):57.
40 MOUSAVI R, ALIZADEH M, ASGHARI JAFARABADI M, HEIDARI L, NIKBAKHT R, BABAAHMADI REZAEI H, KARANDISH M. Effects of Melatonin and/or Magnesium Supplementation on Biomarkers of Inflammation and Oxidative Stress in Women with Polycystic Ovary Syndrome: a Randomized, Double-Blind, Placebo-Controlled Trial. Biol Trace Elem Res. 2022;200(3):1010-1019.
41 GASKINS AJ, ARVIZU M, MINGUEZ-ALARCON L, DADD R, SOUTER I, CHAVARRO JE; EARTH Study Team. Substantial Weight Gain in Adulthood Is Associated with Lower Probability of Live Birth Following Assisted Reproduction. J Nutr. 2021;151(3):649-656.
42 GASKINS AJ, RICH-EDWARDS JW, MISSMER SA, ROSNER B, CHAVARRO JE. Association of Fecundity With Changes in Adult Female Weight. ObstetGynecol. 2015;126(4):850-858.
43 KAZEMI A, RAMEZANZADEH F, NASR-ESFAHANI MH, SABOOR YARAGHI AA, AHMADI M. Does dietary fat intake influence oocyte competence and embryo quality by inducing oxidative stress in follicular fluid? Iran J Reprod Med. 2013;11(12):1005-12.
44 LEGRO RS, DODSON WC, KUNSELMAN AR, STETTER CM, KRIS-ETHERTON PM, WILLIAMS NI, GNATUK CL, ESTES SJ, ALLISON KC, SARWER DB, DIAMOND MP, SCHLAFF WD, CASSON PR, et al. Benefit of Delayed Fertility Therapy With Preconception Weight Loss Over Immediate Therapy in Obese Women With PCOS. J Clin Endocrinol Metab. 2016;101(7):2658-66.
45 LEGRO RS, HANSEN HR, DIAMOND MP, STEINER AZ, COUTIFARIS C, CEDARS MI, HOEGER KM, USADI R, JOHNSTONE EB, HAISENLEDER DJ, WILD RA, BARNHART KT, MERSEREAU J, TRUSSELL JC, KRAWETZ SA, KRIS-ETHERTON PM, SARWER DB, SANTORO N, EISENBERG E, HUANG H, ZHANG H; Reproductive Medicine Network. Effects of preconception lifestyle intervention in infertile women with obesity: The FIT-PLESE randomized controlled trial. PLoS Med. 2022;19(1): e1003883.
46 CHAVARRO JE, EHRLICH S, COLACI DS, WRIGHT DL, TOTH TL, PETROZZA JC, HAUSER R. Body mass index and short-term weight change in relation to treatment outcomes in women undergoing assisted reproduction. FertilSteril. 2012;98(1):109-16.
47 LI MC, MINGUEZ-ALARCON L, ARVIZU M, CHIU YH, FORD JB, WILLIAMS PL, ATTAMAN J, HAUSER R, CHAVARRO JE; EARTH Study Team. Waist circumference in relation to outcomes of infertility treatment with assisted reproductive technologies. Am J Obstet Gynecol. 2019;220(6):578.e1-578.e13.
48 RUEBEL ML, PICCOLO BD, MERCER KE, PACK L, MOUTOS D, SHANKAR K, ANDRES A. Obesity leads to distinct metabolomic signatures in follicular fluid of women undergoing in vitro fertilization. Am J Physiol Endocrinol Metab. 2019;316(3):E383-E396.
49 AMIRJANI S, ASEMI Z, BAZARGANIPOUR F, ARAMESH S, ALLAN H, SAYADI M, TABATABAEI MS, MOHAMADIAN Z, ZABTI F, IRANPARK N, HEYDARZADEH A, TAGHAVI AS, BADEHNOOSH B, KHASHAVI Z. Dietary intake and lifestyle behaviour in diferente phenotypes of polycystic ovarian syndrome: a case-control study. J Hum Nutr Diet. 2019;32(4):413-421.
50 BECKER GF, PASSOS EP, MOULIN CC. Short-term effects of a hypocaloric diet with low glycemic index and low glycemic load on body adiposity, metabolic variables, ghrelin, leptin, and pregnancy rate in overweight and obese infertile women: a randomized controlled trial. Am J Clin Nutr. 2015;102(6):1365-72.
51 MUTSAERTS MA, VAN OERS AM, GROEN H, BURGGRAAFF JM, KUCHENBECKER WK, PERQUIN DA, KOKS CA, VAN GOLDE R, KAAIJK EM, SCHIERBEEK JM et al. Randomized trial of a lifestyle program in obese infertile women. N Engl J Med. 2016;374:1942–53.
52 EINARSSON S, BERGH C, FRIBERG B, PINBORG A, KLAJNBARD A, KARSLTROM PO, KLUGE L, LARSSON I, LOFT A, MIKKELSEN-ENGLUND AL et al. Weight reduction intervention for obese infertile women prior to IVF: a randomized controlled trial. Hum Reprod. 2017;32:1621–30.
53 WISE LA, WESSELINK AK, TUCKER KL, SAKLANI S, MIKKELSEN EM, CUETO H, RIIS AH, TROLLE E, MCKINNON CJ, HAHN KA, ROTHMAN KJ, SORENSEN HT, HATCH EE. Dietary Fat Intake and Fecundability in 2 Preconception Cohort Studies. Am J Epidemiol. 2018;187(1):60-74.
54 CHIU YH, KARMON AE, GASKINS AJ, ARVIZU M, WILLIAMS PL, SOUTER I, RUEDA BR, HAUSER R, CHAVARRO JE; EARTH Study Team. Serum omega-3 fatty acids and treatment outcomes among women undergoing assisted reproduction. Hum Reprod. 2018;33(1):156-165.
55 MÍNGUEZ-ALARCÓN L, WILLIAMS PL, SOUTER I, SACHA C, AMARASIRIWARDENA CJ, FORD JB, HAUSER R, CHAVARRO JE. Hair Mercury level, intake of ômega-3 fatty acids and ovarian reserve among women attending a fertility center. Earth Study Team. Int J Hyg Environ Health;237:113825, 2021.
56 NADJARZADEH A, DEHGHANI FIROUZABADI R, VAZIRI N, DANESHBODI H, LOFTI MH, MOZAFFARIKHOSRAVI H. The effect of omega-3 supplementation on androgen profile and menstrual status in women with polycystic ovary syndrome: A randomized clinical trial. Iran J Reprod Med. 2013;11(8):665-72.
57 NADJARZADEH A, DEHGHANI-FIROUZABADI R, DANESHBODI H, LOTFI MH, VAZIRI N, MOZAFFARI-KHOSRAVI H. Effect of Omega-3 Supplementation on Visfatin, Adiponectin, and Anthropometric Indices in Women with Polycystic Ovarian Syndrome. J ReprodInfertil. 2015;16(4):212-20.
58 SHAHNAZI V, ZAREE M, NOURI M, MEHRZAD-SADAGHIANI M, FAYEZI S, DARABI M, KHANI S, DARABI M. Influence of ω-3 fatty acid eicosapentaenoic acid on IGF-1 and COX-2 gene expression in granulosa cells of PCOS women. Iran J Reprod Med. 2015;13(2):71-8.
59 ABADIA L, CHIU YH, WILLIAMS PL, TOTH TL, SOUTER I, HAUSER R, CHAVARRO JE, GASKINS AJ; EARTH Study Team. The association between pre-treatment maternal alcohol and caffeine intake and outcomes of assisted reproduction in a prospectively followed cohort. Hum Reprod. 2017;32(9):1846-1854.
60 HOEK J, SCHOENMAKERS S, BAART EB, KOSTER MPH, WILLEMSEN SP, VAN MARION ES, STEEGERS EAP, LAVEN JSE, STEEGERS-THEUNISSEN RPM. Preconceptional Maternal Vegetable Intake and Paternal Smoking Are Associated with Pre-implantation Embryo Quality. Reprod Sci. 2020;27(11):2018-2028.
61 AFEICHE MC, CHIU TH, GASKINS AJ, WILLIAMS PL, SOUTER I, WRIGHT DL, HAUSER R, CHAVARRO JE; EARTH Study team. Dairy intake in relation to in vitro fertilization outcomes among women from a fertility clinic. Hum Reprod. 2016;31(3):563-71.
62 RAJAEIEH G, MARASI M, SHAHSHAHAN Z, HASSANBEIGI F, SAFAVI SM. The Relationship between Intake of Dairy Products and Polycystic Ovary Syndrome in Women Who Referred to Isfahan University of Medical Science Clinics in 2013. Int J Prev Med. 2014;5(6):687-94.
63 PHY JL, POHLMEIER AM, COOPER JA, WATKINS P, SPALLHOLZ J,HARRIS KS, BERENSON AB, BOYLAN M. Low Starch/Low Dairy Diet Results in Successful Treatment of Obesity and Co-Morbidities Linked to Polycystic Ovary Syndrome (PCOS). J Obes Weight Loss Ther. 2015;5(2):259.
64 NASSAN FL, CHIU YH, VANEGAS JC, GASKINS AJ, WILLIAMS PL, FORD JB, ATTAMAN J, HAUSER R, CHAVARRO JE; EARTH Study Team. Intake of protein-rich foods in relation to outcomes of infertility treatment with assisted reproductive technologies. Am J Clin Nutr. 2018;108(5):1104-1112.
65 VANEGAS JC, AFEICHE MC, GASKINS AJ, MINGUEZ-ALARCON L, WILLIAMS PL, WRIGHT DL, TOTH TL, HAUSER R, CHAVARRO JE. Soy food intake and treatment outcomes of women undergoing assisted reproductive technology. FertilSteril. 2015;103(3):749-55.e2.
66 CHAVARRO JE, MÍNGUEZ-ALARCÓN L, CHIU YH, GASKINS AJ, SOUTER I, WILLIAMS PL, CALAFAT AM, HAUSER R; EARTH Study Team. Soy Intake Modifies the Relation Between Urinary Bisphenol A Concentrations and Pregnancy Outcomes Among Women Undergoing Assisted Reproduction. J Clin Endocrinol Metab. 2016;101(3):1082-90.
67 CHIU YH, WILLIAMS PL, GILLMAN MW, GASKINS AJ, MÍNGUEZ-ALARCÓN L, SOUTER I, TOTH TL, FORD JB, HAUSER R, CHAVARRO JE; EARTH Study Team. Association Between Pesticide Residue Intake From Consumption of Fruits and Vegetables and Pregnancy Outcomes Among Women Undergoing Infertility Treatment With Assisted Reproductive Technology. JAMA Intern Med. 2018;178(1):17-26.
68 GASKINS AJ, CHIU YH, WILLIAMS PL, KELLER MG, TOTH TL, HAUSER R, CHAVARRO JE; EARTH Study Team. Maternal whole grain intake and outcomes of in vitro fertilization. FertilSteril. 2016;105(6):1503-1510.e4.
69 TURNER-MCGRIEVY GM, DAVIDSON CR, WINGARD EE, BILLINGS DL. Low glycemic index vegan or low-calorie weight loss diets for women with polycystic ovary syndrome: a randomized controlled feasibility study. Nutr Res. 2014;34(6):552-8.
70 KARIMI E, MOINI A, YASERI M, SHIRZAD N, SEPIDARKISH M, HOSSEIN-BOROUJERDI M, HOSSEINZADEH-ATTAR MJ. Effects of synbiotic supplementation on metabolic parameters and apelin in women with polycystic ovary syndrome: a randomized double-blind placebo-controlled trial. Br J Nutr. 2018;119(4):398-406.
71 MATCHTINGER R, GASKINS AJ, MANSUR A, ADIR M, RACOWSKY C, BACCARELLI AA, HAUSER R, CHAVARRO JE. Association between preconception maternal beverage intake and in vitro fertilization outcomes. FertilSteril. 2017;108(6):1026-1033.
72 BRAGA DP, HALPERN G, SETTI AS, FIGUEIRA RC, LACONELLI A JR, BORGES E JR. The impact of food intake and social habits on embryo quality and the likelihood of blastocyst formation. Reprod Biomed Online. 2015;31(1):30-8.
73 GASKINS AJ, NASSAN FL, CHIU YH, ARVIZU M, WILLIAMS PL, KELLER MG, SOUTER I, HAUSER R, CHAVARRO JE; EARTH Study Team. Dietary patterns and outcomes of assisted reproduction. Am J Obstet Gynecol. 2019;220(6):567.e1-567.e18.
74 LEE S, MIN JY, KIM HJ, MIN KB. Association Between the Frequency of Eating Nonhome-prepared Meals and Women Infertility in the United States. J Prev Med Public Health. 2020;53(2):73-81.
75 MALDONADO-CARCELES AB, MINGUEZ ALARCON L, SOUTER I, GASKINS AJ, ARVIZU M, WILLIAMS PL, FORD JB, CHAVARRO JE; EARTH Study Team. Dietary patterns and ovarian reserve among women attending a fertility clinic. FertilSteril. 2020;114(3):610-617.
76 NOVENTA M, QUARANTA M, VITAGLIANO A, CINTHYA V, VALENTINI R, CAMPAGNARO T, MARCI R, PAOLA RD, ALVIGGI C, GANGEMI M, SACCARDI C, NARDELLI GB, GIZZO S. May Underdiagnosed Nutrition Imbalances Be Responsible for a Portion of So-Called Unexplained Infertility? From Diagnosis to Potential Treatment Options. ReprodVSci. 2016;23(6):812-22.
77 OOSTINGH EC, KOSTER MPH, VAN DIJK MR, WILLEMSEN SP, BROEKMANS FJM, HOEK A, GODDJIN M, et al. First effective mHealth nutrition and lifestyle coaching program for subfertile couples undergoing in vitro fertilization treatment: a single- blinded multicenter randomized controlled trial. FertilSteril. 2020;114(5):945-954.
78 OOSTINGH EC, OPHUIS RH, KOSTER MP, POLINDER S, LINGSMA HF, LAVEN JS, STEEGERSTHEUNISSEN RP. Mobile Health Coaching on Nutrition and Lifestyle Behaviors for Subfertile Couples Using the Smarter Pregnancy Program: Model- Based CostEffectiveness Analysis. JMIR MhealthUhealth. 2019;7(10):e13935.
79 PIECZYŃSKA J. Do celiac disease and non-celiac gluten sensitivity have the same effects on reproductive disorders? Nutrition.2018;48:18-23.
80 WEISS M S, ROE AH, ALLISON KC, DODSON WC, KRIS-ETHERTON PM, KUNSELMAN AR, STETTER CM, WILLIAMS MI, GNATUK CL, ESTES SJ, et al. Lifestyle modifications alone or combined with hormonal contraceptives improve sexual dysfunction in women with polycystic ovary syndrome. FertilSteril. 2021;115(2):474-482.
81 TSAI YH, WANG TW, WEI HJ, HSEU CY, HO HJ, CHEN WH, YOUNG R, LIAW CM, CHAO JC. Dietary intake, glucose metabolism and sex hormones in women with polycystic ovary syndrome (PCOS) compared with women with non-PCOS-related infertility. Br J Nutr. 2013;109(12):2190-8.
82 TURNER-MCGRIEVY G, DAVIDSON CR, BILLINGS DL. Dietary intake, eating behaviors, and quality of life in women with polycystic ovary syndrome who are trying to conceive. Hum Fertil (Camb). 2015;18(1):16-21.
83 TWIGT JM, BOLHUIS ME, STEEGERS EA, HAMMICHE F, VAN INZEN WG, LAVEN JS, STEEGERS-THEUNISSEN RP. The preconception diet is associated with the chance of ongoing pregnancy in women undergoing IVF/ICSI treatment. Hum Reprod. 2012;27(8):2526-31.
84 ALIBEIGI Z, JAFARI-DEHKORSI E, KHEIRI S, NEMATI M, MOHAMMADI-FARSANI G, TANSAZ M. The Impact of Traditional Medicine-Based Lifestyle and Diet on Infertility Treatment in Women Undergoing Assisted Reproduction: A Randomized Controlled Trial. Complement Med Res. 2020;27(4):230-241. English.
85 DUPONT C, AEGERTER P, FOUCAUT AM, REYRE A, LHUISSIER FJ, BOURGAIN M, CHABBERT-BUFFET N, CÉDRIN-DURNERIN I, SELLERET L, COSSON E, LÉVY R. Effectiveness of a therapeutic multiple-lifestyle intervention taking into account the periconceptional environment in the management of infertile couples: study design of a randomized controlled trial – the PEPCI study. BMC Pregnancy Childbirth. 2020;20(1):322.
86 KARAYIANNIS D, KONTOGIANNI MD, MENDOROU C, MASTROMINAS M, YIANNAKOURIS N. Adherence to the Mediterranean diet and IVF success rate among non-obese women attempting fertility. Hum Reprod. 2018;33(3):494-502.
1Discente do curso de Medicina da Universidade Cesumar -Unicesumar, bolsista PIBIC
2Professora Doutora. Docente do Mestrado e Doutorado em Promoção da Saúde, Universidade de Maringá-UNICESUMAR. Pesquisadora do Instituto CESUMAR de Ciência, Tecnologia e Inovação – ICETI
