REGISTRO DOI: 10.5281/zenodo.10671504
Magalí Tábata Tiburtino de Souza1, Janaína Monteiro Chaves2, Natália Spinola Costa da Cunha2, Alberto Bruning Guimaraes3.
RESUMO
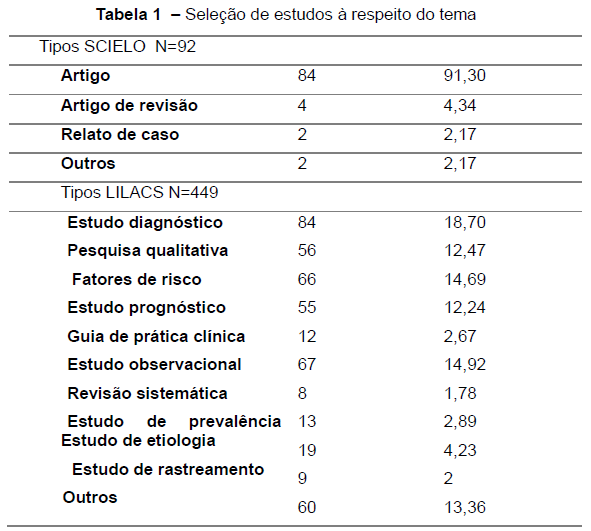
Introdução: Miastenia Gravis é uma doença de placa motora de etiologia autoimune cujo tratamento medicamentoso tem suas limitações. Em adultos já é bem descrita a timectomia mas nas crianças ainda se há pouco embasamento literário. Questionam-se o perfil de segurança, bem como a eficácia (redução do número de crises miastênicas, período de convalescença, redução de uso de medicações intercrises. Objetivo: Analisar a timectomia enquanto escolha terapêutica após o emprego de politerapia em pacientes com miastenia gravis na faixa etária pediátrica. Material e método: Trata-se de uma revisão sistemática da literatura. Foi utilizado banco de dados da Biblioteca Virtual em Saúde (BVS), LILACS, Pubmed para todos os artigos relevantes que incluíssem pacientes com Miastenia Gravis em uso de politerapia e que foram submetidos à timectomia. Foram excluídos pacientes que não estiveram em uso de politerapia. Resultados: Foram identificados 449 estudos sobre Miastenia Gravis (dispostos na tabela 1). Destes foram excluídos 400 dentre duplicados, listas de referências bibliográficas. Foram excluídos 19 artigos após triagem inicial com leitura de títulos e resumo, restando 30 artigos elegíveis pelos critérios de inclusão.
Dos 30 artigos foram eliminados 9 porque a amostra relatada focava nos biomarcadores da patologia. Ao final da análise, restaram 21 artigos. Conclusão: Na maioria dos casos analisados a timectomia mostrou-se um procedimento seguro, com desfecho clínico favorável e promissor, com redução de morbidades e mudança do curso da doença.
Palavras-chave: Miastenia Gravis, Miastenia Gravis Juvenil, Miastenia Gravis em pré puberes, Timectomia em Miastenia Gravis.
ABSTRACT
Introduction: Myasthenia Gravis is an autoimmune disease of the motor end plate whose drug treatment has limitations. In adults, thymectomy is well described, but in children there is still little literary basis. The big question is whether with surgical treatment it will be possible to verify a smaller number of myasthenic crises, as well as in the case of hospitalizations, how long will the convalescence period be. We also question whether the reduction of the drugs dosage and even the suspension of the corticotherapy would be possible. Objective: To analyze thymectomy as a therapeutic option after the use of polytherapy in patients with myasthenia gravis in the pediatric age group. Material and method: This is a systematic review of the literature. Searchs were performed on the Biblioteca Virtual em Saúde (BVS), on the LILACS database and on Pubmed for all relevant articles that included patients with Myasthenia Gravis using polytherapy and undergoing thymectomy. Patients who were not using polytherapy were excluded. Results: 449 studies on Myasthenia Gravis were identified (presented in table 1). After this first find, 400 were excluded from duplicates and bibliographic reference lists. 19 articles were excluded after initial screening by reading titles and abstracts, leaving 30 articles eligible according to the inclusion criteria.
Of the 30 articles, 9 were eliminated because the reported sample focused on pathological biomarkers. At the end of the analysis, 21 articles remained. Conclusion: In the majority of cases analyzed, thymectomy proved to be a safe procedure, with a favorable and promising clinical evolution, with a reduction in morbidities and a change in the course of the disease.
Keywords: Myasthenia Gravis, Juvenile Myasthenia Gravis, Myasthenia Gravis in prepubertal children, Thymectomy in Myasthenia Gravis
RESUMEN
Introducción: La miastenia gravis es una enfermedad autoinmune de la placa terminal cuyo tratamiento farmacológico tiene sus limitaciones. En adultos, la timectomía está bien descrita, pero en niños todavía hay poca base literaria. Se cuestiona el perfil de seguridad, así como la eficacia (reducción del número de crisis miasténicas, período de convalecencia, reducción del uso de medicamentos intercrisis). Objetivo: Analizar la timectomía como opción terapéutica tras el uso de politerapia en pacientes con miastenia. gravis en el grupo de edad pediátrica Material y método: Se trata de una revisión sistemática de la literatura, se utilizó la base de datos de la Biblioteca Virtual en Salud (BVS), LILACS, Pubmed, para todos los artículos relevantes que incluyeran pacientes con Miastenia Gravis en politerapia y sometidos a timectomía. Se excluyeron los pacientes que no recibieron politerapia.Resultados: Se identificaron 449 estudios sobre Miastenia Gravis (se muestran en la tabla 1), de los cuales 400 fueron excluidos entre duplicados, listas de referencias bibliográficas, 19 fueron artículos excluidos después de la selección inicial por lectura de títulos y resúmenes, quedando 30 artículos elegibles según los criterios de inclusión.
De los 30 artículos, 9 fueron excluidos porque la muestra informada se centró en biomarcadores de patología. Al final del análisis quedaron 21 artículos. Conclusión: En la mayoría de los casos analizados, la timectomía demostró ser un procedimiento seguro, con un resultado clínico favorable y prometedor, con reducción de morbilidades y cambio en el curso de la enfermedad.
Palabras clave: Miastenia Gravis, Miastenia Gravis Juvenil, Miastenia Gravis en niños prepúberes, Timectomía en Miastenia Gravis.
INTRODUÇÃO
Na miastenia gravis juvenil (MGJ), a doença pode ter início a partir dos 6 meses de idade, é semelhante à forma adulta e é caracterizada por anticorpos contra receptores de acetilcolina, na grande maioria dos casos (ANDREWS I et al., 1994).
A miastenia gravis (MG) é uma doença autoimune ocasionada mais comumente por autoanticorpos contra múltiplas proteínas da placa neuromuscular dirigidos para receptores de acetilcolina (ARROYO H, 2019). Apesar da maioria dos pacientes possuir anticorpos contra receptores nicotínicos musculares, ainda existem pacientes que são considerados um subgrupo especial da MG. Nesse grupo há anticorpos contra quinases específicas do músculo, moléculas localizadas próximas aos receptores nicotínicos nos músculos, garantindo a manutenção da integridade anatômica da junção neuromuscular (NAGUIB M e BRULL SJ, 2019).
A função do timo no desenvolvimento da miastenia gravis ainda não é completamente elucidada, todavia os resultados promissores da timectomia são atribuídos há 5 hipóteses. Considera-se que a cirurgia remova fonte de antígenos do receptor de acetilcolina, produção de anticorpos anti-receptor de acetilcolina; além de células T auxiliares sensibilizadas, as quais facilitam a produção de anticorpos pelos linfócitos periféricos do sistema imune e células T que atuam diretamente contra a placa motora, um provável fator tímico que atua diretamente na placa motora ou na ativação do sistema complemento (SOUZA E et al., 2000).
Quanto à terapêutica recomendada há o tratamento sintomático e o modificador de doenças. O primeiro é realizado com inibidores da acetilcolinesterase. E o segundo também chamado de terapia de manutenção é feito com imunossupressores, imunoglobulina, plasmaférese e timectomia. (MINISTÉRIO DA SAÚDE, 2022) .
Os inibidores da colinesterase (ChE-I) são usados como terapia inicial no tratamento da MGJ. O mais utilizado é a piridostigmina, que atua na junção neuromuscular inibindo a ação da acetilcolinesterase e assim resultando em maior disponibilidade de acetilcolina para se ligar aos receptores nicotínicos pós-sinápticos. (MEHNDIRATTA,2014)
Com a piridostigmina pode-se realizar uma prova terapêutica e em caso de resposta mantém-se o medicamento, analisando a dose mínima eficaz. Se necessário, associa-se à Prednisona. Apesar da falta de ensaios clínicos, a prednisolona é aceita como terapia imunossupressora de primeira linha na MGJ (FINNIS, 2011).
Se mesmo diante de dupla terapia, o paciente mantém-se sintomático associam-se terapias de segunda linha como Azatioprina ou Ciclosporina. A azatioprina é um agente poupador de esteróides útil, todavia seus efeitos podem levar até 12 meses para se tornarem totalmente eficazes (PALACE, 1998)
Em caso de remissão da doença, a orientação é manter o tratamento nas doses mínimas eficazes. Em caso de refratariedade, a recomendação é substituir a azatioprina por ciclofosfamida. A ciclofosfamida pode ser utilizada sozinha ou sem associação com a prednisona. Ressalva-se que nos casos moderados a graves o emprego de prednisona deve ser precoce. Em crises miastênicas deve-se considerar o uso de imunoglobulina humana ou plasmaférese. (MINISTÉRIO DA SAÚDE, 2022).
A timectomia, tratamento cirúrgico, aborda a causa subjacente da doença e tem resultados promissores, levando em consideração que é no timo que ocorre a produção dos auto-anticorpos (ALMEIDA, 2000).
A intervenção cirúrgica mais precoce (dentro de 2 anos do início dos sintomas) tem sido associada a melhores resultados (ANDREWS, 1994)
A timectomia está claramente indicada em adultos com timoma e é terapêutica empregada inclusive quando não há timoma, haja vista que pode remover centros germinativos do timo e interromper a diversificação de anticorpos mas sua utilidade no tratamento da Miastenia Gravis Juvenil não é tão clara (WOLFE GI et al.,2016; Hayashi, 2007).
Em um estudo com 18 pacientes foram analisados a timectomia em quatro pacientes com refratariedade no tratamento, sendo que elas apresentavam hiperplasia folicular linfóide do timo. Após a cirurgia houve melhora em 75 % e 25 % apresentou piora clínica tendo que ser empregada imunoglobulina endovenosa e azatioprina. (MORITA, 2021).
MÉTODOS
Trata-se de uma revisão realizada de acordo com a recomendação PRISMA (Principais Itens Para Relatar Revisões Sistemáticas e Meta-análises). A estratégia de pesquisa foi realizada através da Biblioteca Virtual em Saúde (BVS), LILACS, PubMed a partir de artigos que incluíssem em sua temática a relação entre Miastenia Gravis e tratamento cirúrgico da Timectomia. Foram considerados sintomatologia refratária ao tratamento conservador e proposto comparação com o tratamento cirúrgico amplamente difundido para adultos.
A seleção dos estudos ocorreu a partir dos títulos em português, inglês e espanhol (Myasthenia Gravis, Miastenia Gravis, thymoma, children, timectomia, thymectomy. Os componentes, objetivos e resultados foram analisados. Posteriormente, foram excluídos estudos irrelevantes.
Em seguida, os estudos selecionados foram lidos em sua totalidade visando o cumprimento dos critérios de inclusão.
A extração dos dados incluíram: artigos, relato de caso, estudo comparativo, estudo epidemiológico, artigo de revisão, análise, revisão de literatura.
Os critérios de inclusão dos estudos foram: (1) estudos quantitativos, qualitativos, mistos; (2) artigos publicados do ano de 1993-2021.. Na pesquisa foram selecionados estudos com as palavras chaves Miastenia Gravis, Miastenia Gravis Juvenil, Miastenia Gravis em pré puberes, Timectomia em Miastenia Gravis. Procurou-se casos em que foi empregada a terapêutica cirúrgica, bem como o seguimento clínico dos pacientes a fim de avaliar o impacto na qualidade de vida.
Foram excluídos artigos duplicados anteriores a 1993.
Seguindo a resolução 510 de 2016 do Conselho Nacional de Saúde, o presente estudo foi isento de necessidade de apreciação pelo Comitê de Ética.
Esta revisão seguiu as recomendações das diretrizes Preferred Reported Items for Systematic Reviews and Meta-Analyses (PRISMA) e foi registrada no PROSPERO 2023 (CRD42023441357).
A extração dos dados e as variáveis selecionadas incluíram: características dos participantes do estudo (sexo, idade), gravidade da doença, dificuldade diagnóstica, resultados da timectomia através da análise de relatos de casos.
RESULTADOS
Foram identificados 449 estudos sobre Miastenia Gravis (dispostos na tabela 1). Desses foram excluídos 400 dentre duplicados, listas de referências bibliográficas. Foram excluídos 19 artigos após triagem inicial com leitura de títulos e resumo, restando 30 artigos elegíveis pelos critérios de inclusão.
Dos 30 artigos foram eliminados 9 já que a amostra relatada focava apenas nos biomarcadores da patologia. Ao final da análise, restaram 21 artigos que cumpriam os critérios propostos. O quadro 1 mostra os estudos elegíveis.
A faixa etária dos participantes incluídos nos estudos variou de 3 aos 70 anos. Sete artigos relacionaram a Miastenia Gravis e a Timectomia auxiliando na indicação do tratamento cirúrgico. Dois artigos investigaram o timoma e a Miastenia Gravis.
Um artigo analisou a gravidade da doença com aspectos de sexo, raça e puberdade. Sete estudos analisaram a Miastenia Gravis, sintomatologia e opções terapêuticas.
Dois estudos discorreram apenas sobre as opções terapêuticas.
Um artigo descreveu 2 casos e realizou revisão de literatura sobre o tema. Um artigo tratou dos aspectos fisiopatológicos e clínicos da Miastenia Gravis.
As características dos estudos incluídos está descritas no quadro 1
Fonte: Dados extraídos em pesquisa virtual em Saúde e Scielo

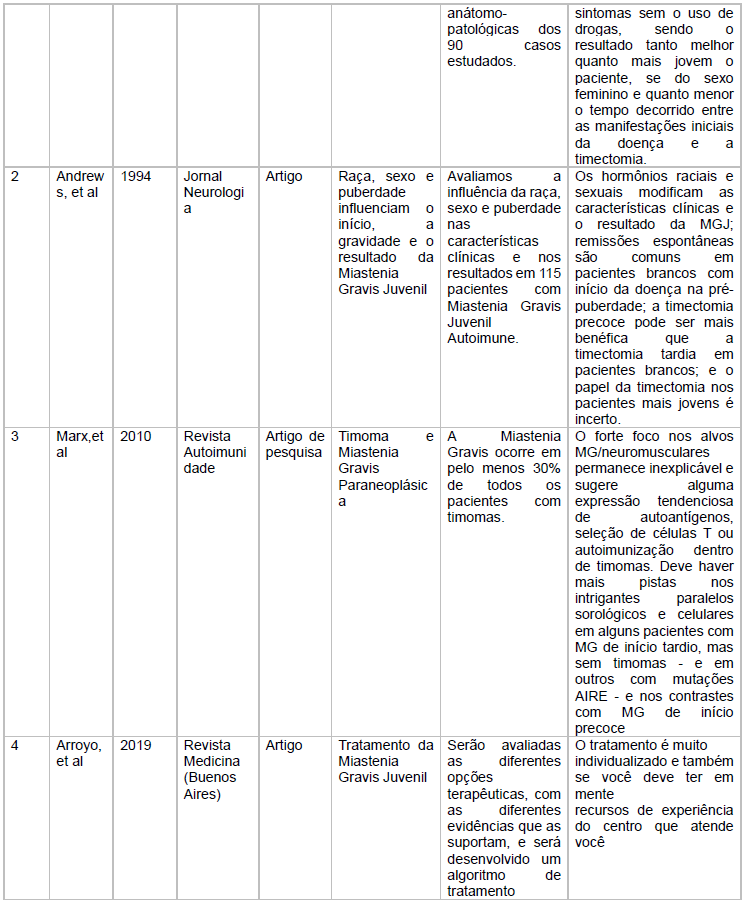
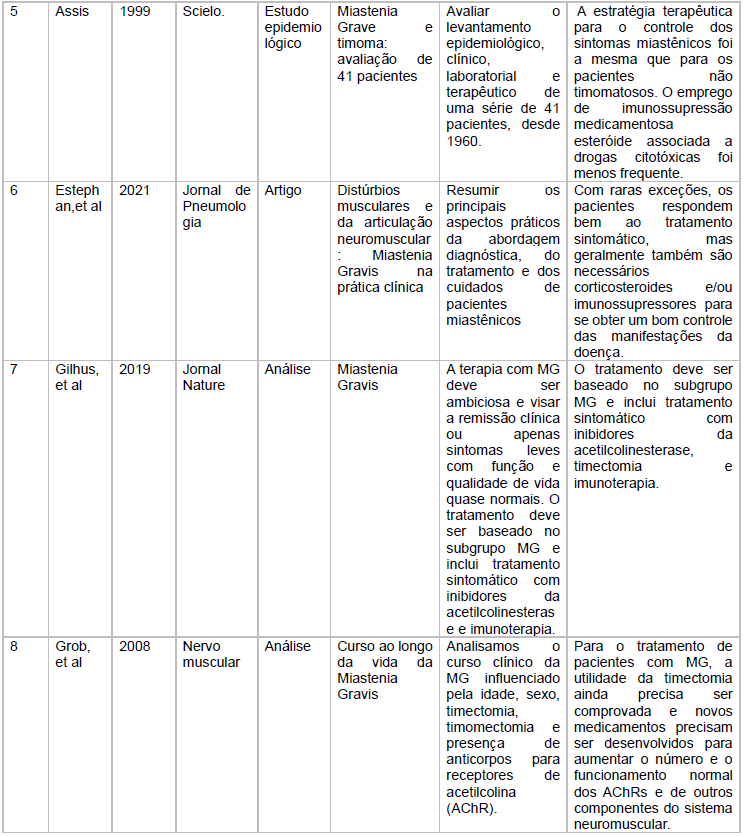
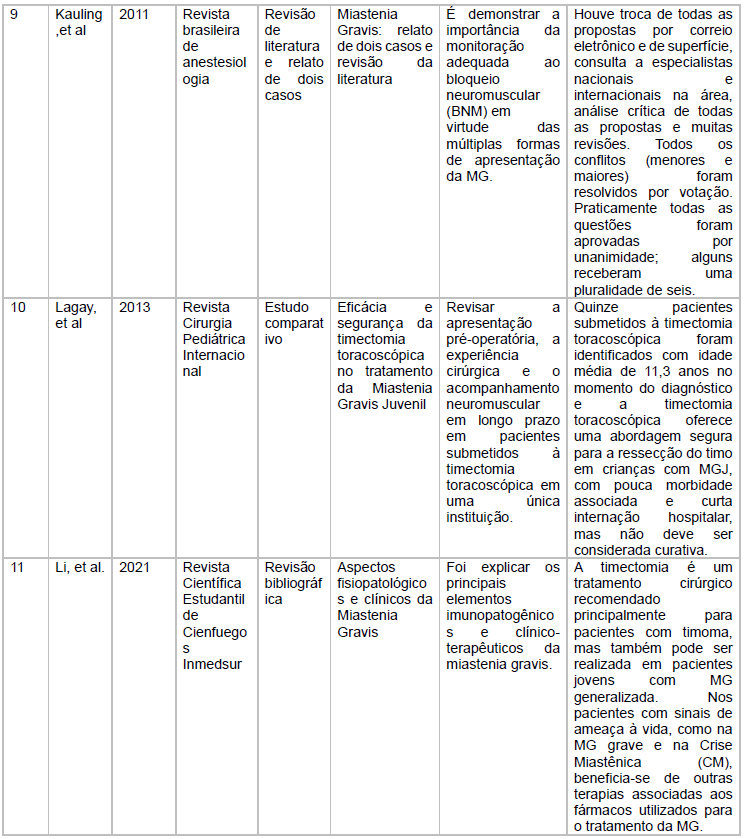
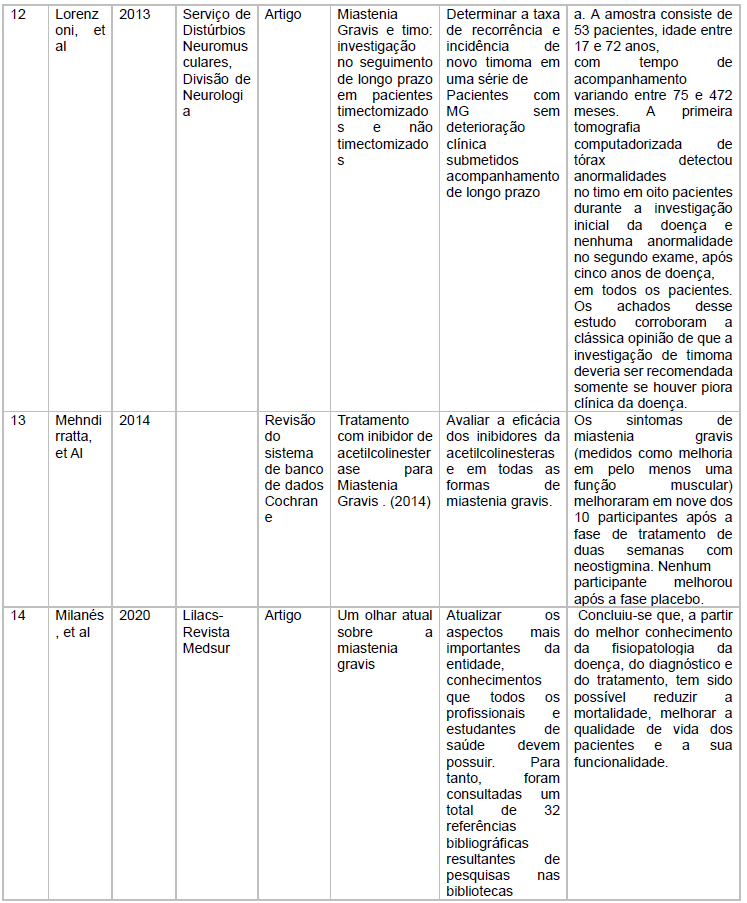
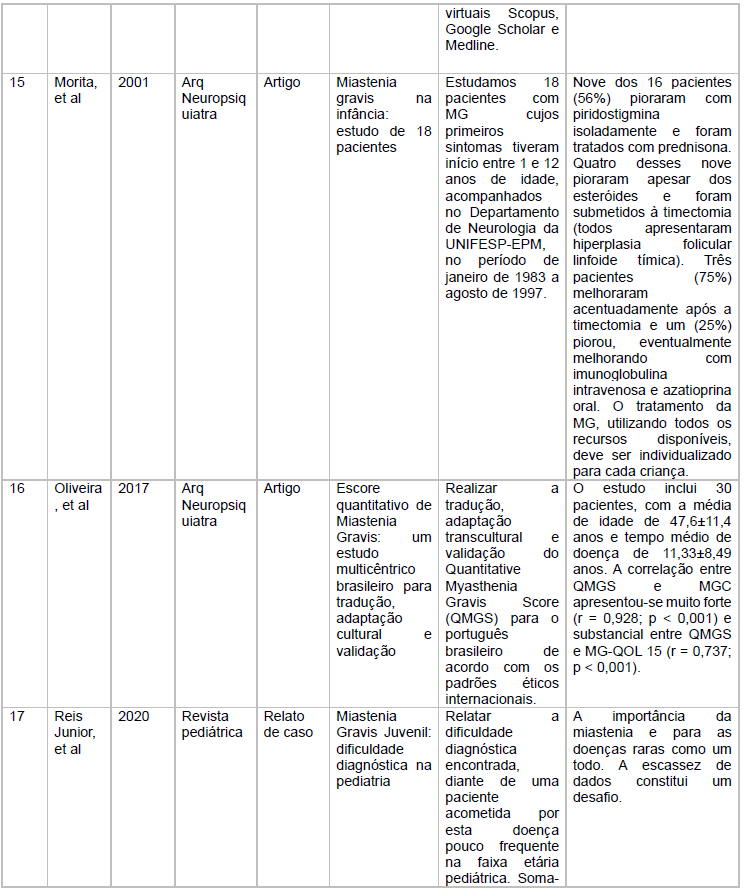
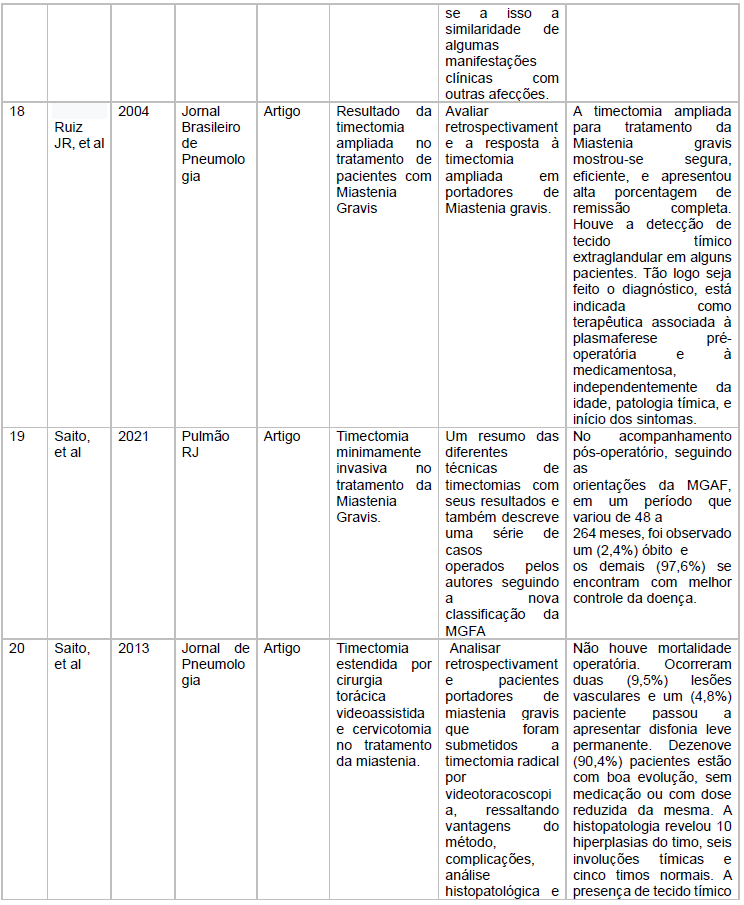
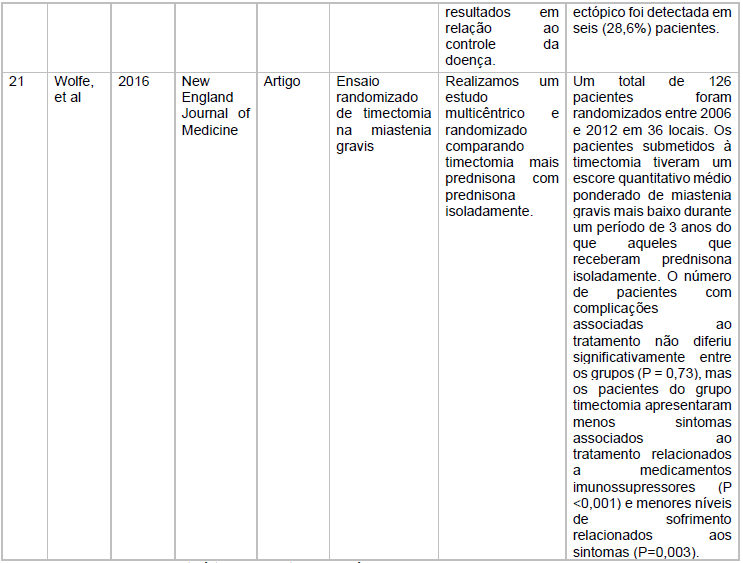
Fonte: Características dos estudos incluídos
Discussão
No estudo de análise de 90 casos tratados com timectomia verificou-se resultados promissores. Desses, 73 pacientes continuaram seguimento. Foram acompanhados pelo período de 3,7 anos.
A melhora clínica ocorreu em sua grande maioria. Em porcentagens, após a cirurgia 53,4% (39) dos pacientes apresentavam-se assintomáticos e 43,8% (32) tiveram melhora parcial dos sintomas e apenas 2,7% (2) não apresentavam melhora clínica.
Diante da remissão da doença, foi retirada a medicação em 23,3% (17) dos pacientes. Nos demais pacientes, 76,7 % (56) ainda era empregada a terapia medicamentosa, ainda que em doses menores quando comparada ao período pré-operatório.
Quanto ao artigo raça, sexo e puberdade que influenciam o início, a gravidade e o resultado da Miastenia Gravis Juvenil, foram avaliados 115 pacientes com Miastenia Gravis Juvenil Autoimune e conclui-se que as remissões espontâneas são comuns em pré púberes e pacientes e que a timectomia precoce é a medida mais benéfica.
Mehndirratta, em sua revisão do sistema de banco de dados Cochrane sobre o tratamento com inibidor de acetilcolinesterase, defendeu o uso de neostigmina a partir da análise de 9 dos 10 participantes após a fase de tratamento de duas semanas com neostigmina.
Arroyo, no artigo Tratamento da Miastenia Gravis Juvenil, avaliou a disponibilidade de terapêutica medicamentosa para tratamento da doença. Assim sendo, o autor concluiu que os inibidores os inibidores da acetilcolinesterase (IECAs) são a primeira linha de tratamento, todavia são ineficazes para fraqueza grave. Em crianças, sintomáticas mesmo com o uso de IECAS, pode-se introduzir os esteróides. Entretanto, o uso contínuo pode induzir ao aumento ponderal, hipertensão, mudanças comportamentais, intolerância à glicose, glaucoma, distúrbios do sono e hematomas e alterações cosméticas. As crianças muitas vezes apresentam atraso no crescimento e distúrbios ósseos.
Milanés em seu artigo um olhar sobre a Miastenia Gravis busca conscientizar e trazer conhecimento sobre o quadro clínico da patologia, fisiopatologia e tratamento. Concluindo que a maioria dos pacientes com miastenia gravis desenvolve progressão dos sintomas clínicos durante os primeiros 2 a 3 anos. A partir da análise de 32 estudos, finaliza o estudo relatando que a timectomia é mais eficaz que o tratamento conservador para miastenia gravis no que diz respeito aos resultados e à melhoria clínica.
Segundo Arroyo, a timectomia em crianças peripúberes e pós-púberes com Miastenia Gravis é uma proposta de tratamento viável diante da não resposta medicamentosa.
Estephan, em seu artigo de distúrbios musculares e da articulação, bem como Guilhus na análise Miastenia Gravis, concordam com Arroyo. Assim o tratamento sintomático deve ser realizado com inibidores da acetilcolinesterase, timectomia.
Saito publicou dois artigos sobre timectomia. A técnica minimamento invasiva e a estendida. Na primeira análise foram estudados 42 doentes submetidos à timectomia estendida (VATET). No seguimento, em um período que variou de 48 a 264 meses, foi observado um (2,4%) óbito e os demais (97,6%) se encontram com melhor controle da doença.
Na segunda análise, 21 pacientes miastênicos (18 do sexo feminino e três do sexo masculino, com idade variando de 17 a 51 anos). Não houve óbito, foram observadas duas complicações, sem duas (9,5%) lesões vasculares e um (4,8%) paciente passou a apresentar disfonia leve permanente. Os demais, 19 (90,4%) pacientes estão com boa evolução, sem medicação ou com dose reduzida.
A base diagnóstica da miastenia gravis deve sempre começar por história clínica compatível. Portanto, orienta-se que as seguintes etapas sejam dosagem dos testes AChR-Ab e MuSK-Ab com resultados positivos que corroboram para definição da patologia.( GILHUS NE et al., 2019).
Assis, no estudo epidemiológico que relacionou Miastenia Gravis e timoma trouxe a discussão sobre emprego de imunossupressão medicamentosa esteróide associada a drogas citotóxicas. Marx em seu artigo de pesquisa estabeleceu também demonstrou o vínculo entre Timoma e Miastenia Gravis Paraneoplásica evidenciando que o fato ocorria em pelo menos 30 % dos pacientes com timoma.
Grob na análise do curso ao longo da vida da Miastenia Gravis enfatiza que a timectomia precisa ser comprovada e que novos medicamentos precisam ser desenvolvidos.
Kauling, na revisão de literatura e relato de dois casos, analisa a monitorização como de suma importância no emprego de bloqueador neuromuscular em pacientes miastênicos.
Lagay, em seu estudo comparativo da eficácia e segurança da timectomia, Li, em sua revisão bibliográfica sobre os aspectos fisiopatológicos e clínicos da Miastenia Gravis, e Lorenzo, abordam a timectomia como um procedimento seguro. Lagay ressalva que a cirurgia não deve ser considerada curativa e Lorenzo recomenda a pesquisa de timoma antes e indicar timectomia.
Wolfe realizou um estudo multicêntrico e randomizado comparando timectomia mais prednisona com prednisona isoladamente. Foram selecionados 126 pacientes randomizados. Os doentes submetidos à timectomia tiveram um escore quantitativo médio mais baixo durante um período de 3 anos em comparação aos que receberam prednisona isoladamente. Ademias em comparação, o número de complicações não diferiu entre um grupo e outro.
Morita expressa suas estatísticas, sendo três pacientes (75%) os quais melhoraram acentuadamente após a timectomia e um (25%) piorou, eventualmente melhorando com imunoglobulina intravenosa e azatioprina oral.
Oliveira compara as escalas evolutiva Quantitative Myasthenia Gravis Score (QMGS) para o português e para o inglês. A tradução, e validação do QMGS para o português do Brasil foi realizada com sucesso.
A miastenia gravis (MG) é em grande parte uma doença tratável, mas pode resultar em morbidade significativa e até mortalidade, que geralmente pode ser evitada, ou amenizada, com diagnóstico precoce e tratamento adequado da doença. É uma doença heterogênea do ponto de vista fenotípico e patogenético. O sintoma central das síndromes miastênicas em geral é a fraqueza fatigante, que pode afetar praticamente qualquer músculo estriado. (ESTEPHAN, Eduardo e et al., 2022 ).
Esta é a doença mais comum que afeta as conexões neuromusculares. A patologia é caracterizada por fraqueza muscular flutuante que atenua em repouso e piora em esforço físico ou mental. (MINISTÉRIO DA SAÚDE, 2015).
O desenvolvimento clínico da doença, a idade, o envolvimento do antígeno leucocitário humano, a positividade para anticorpos contra receptores de nicotina das placas motoras e rianodina também ajudam na classificação da doença do timo e no prognóstico da progressão da doença. (KAULING ALC e et al., 2011).
Clinicamente para triagem de timoma há uma equivalência entre imagem de tomografia de mediastino e soropositividade de anticorpos estriacionais. (SUZUKI S, 2011).
Não se sabe se existe um fator desencadeante da miastenia gravis, mas em alguns casos a presença de infecção, trauma, gravidez, uso de antibióticos, estresse emocional e abordagem cirúrgica está associada ao aparecimento dos sintomas dessa doença. (GROB D et al., 2008)
Todos os pacientes com a patologia de miastenia gravis e timoma, devem ser submetidos a cirurgia para retirada do tumor, ressalvam-se raras exceções. O tratamento adicional do timoma será determinado pela classificação histológica e pelo grau de excisão cirúrgica (MARX A e et al., 2010).
Em geral, níveis elevados de anticorpos de ligação anti-AChR em pacientes com características clínicas consistentes também podem confirmar o diagnóstico de MG, mas os níveis são normais. A presença ou ausência de anticorpos não exclui o diagnóstico (ESTEPHAN, Eduardo e et al., 2022 ).
Os sintomas clínicos, o curso e o resultado da MG dependem da patologia do timo e da soropositividade dos anticorpos. O rastreio do timoma apenas deve ser recomendado se houver refratariedade sintomatológica mesmo diante do emprego de terapias amplamente recomendadas. No entanto, sugere-se que a detecção de anticorpos, dados associados à triagem por tomografia de mediastino podem potencialmente fornecer dados para controle, incluindo taxa de recorrência e possibilidade de novo timoma. (LORENZONI, PAULO JOSÉ et al., 2013).
Todos os pacientes devem ser examinados quanto a sintomas de crise miastênica, mesmo que não se queixem de fraqueza, porque a ventilação central por impulso geralmente está intacta durante as emergências. Portanto, embora a resposta da baixa ventilação ao CO2 seja fraca, a fatigabilidade geral pode mascarar os sinais habituais de dificuldades respiratórias. Os músculos das vias aéreas podem cansar-se repentinamente, causando rápido colapso das vias aéreas. (RABINSTEIN AA, WIJDICKS EF, 2003).
O desfecho do diagnóstico aliado a abordagem farmacológica adequada, sendo essa de acordo com os sintomas oscilatórios, crise miastênica e terapia modificadora da patologia melhora significativamente a morbidade gerando melhoria na qualidade de vida dos doentes. (ARMENGOL ARM, et al., 2020).
Para considerar a estabilidade da doença o paciente deve apresentar a sintomatologia mínima de acordo com critérios de classificação clínica da Fundação Americana de Miastenia Gravis. (JARETZKI et al, 2000).
Diante dos inúmeros estudos apresentados, é salutar a utilização de novas tecnologias médicas como a timectomia, que reduz a necessidade de poli terapias bem como seus efeitos colaterais refletindo na redução de hospitalizações.
Uma nova opção de tratamento para uma patologia ainda sem cura busca refletir em maior esperança e qualidade de vida para os doentes.
A videocirurgia torácica (VATS) trouxe uma nova opção de tratamento com ressecção menos radical sem esternotomia. Todavia, a análise dos resultados deve ser a longo prazo, pois alguns se recuperam quase imediatamente após a cirurgia e outros podem levar até 10 anos para se beneficiar do tratamento. (EDUARDO HARUO SAITO e et al., 2003).
Há um número significativo de pacientes com doenças do timo, mas conclui-se pela presença desses anticorpos de outras origens porque a timectomia melhora clinicamente os pacientes, mas não cura a doença. (NAGUIB M, BRULL SJ, 2009)
CONCLUSÃO OU CONSIDERAÇÕES FINAIS
O timo miastênico contém muitas células B e linfócitos tímicos que liberam anticorpos contra receptores de neurotransmissores de acetilcolina. Células mieloides tímicas são modificadas por estímulos desconhecidos que fazem com que o mecanismo de supressão de linfócitos T auxiliares falhe e prolifere anticorpos contra receptores colinérgicos (TAVARES JV e KAHWAGE AM, 2019).
A primeira linha de tratamento sintomático é feita com os inibidores da acetilcolinesterase. São exemplos a Neostigmina, brometo de piridostigmina e Ambenônio são exemplos de inibidores de AchE. (GILHUS NE, 2016). Em caso de refratariedade dos sintomas associa-se imunossupressores. Os mais comumente usados são os glicocorticosteróides, como a prednisolona, e a azatioprina, que é um inibidor da proliferação de células T e B envolvidas no processo de produção de anticorpos. (GILHUS NE, 2016; NETO VA, et al., 2020; SAITO EH, et al., 2021)
A timectomia é um tratamento cirúrgico para retirada do timo. Indicada formalmente para pacientes com timoma. A abordagem pode ser empregada em pacientes jovens com miastenia generalizada com o objetivo de tratar o processo subjacente. A operação é preferencialmente recomendada para pacientes que tenham de 3 a 5 anos desde o início do primeiro sintoma, abrangendo pacientes com idade entre 10 e 50 anos. Existem várias abordagens para implementação timectomia, como esternotomia total ou parcial, transcervical e toracoscopia. (PAL A, et al., 2020).
A taxa de remissão da condição miastênica é variável, podendo surpreender com a timectomia em até 50% caso a abordagem seja executada antes dos dois anos de início da doença (ASSIS,1999).
Conclui-se, portanto, que a timectomia em crianças com refratariedade sintomática é um tratamento extremamente promissor pela possibilidade de modificação do curso desta grave doença neuromuscular. O emprego da terapêutica deve ser precoce, haja vista que os benefícios do tratamento não são imediatos e podem levar meses ou até anos para o efetivo controle da doença. Dessa forma, o reconhecimento precoce da refratariedade farmacológica da desordem e a recorrência de crises é primordial para o manejo clínico dos casos e indicação cirúrgica.
REFERÊNCIAS
ALMEIDA, FÁBIO HENRIQUE SOUZA; OKANO, NELSON; VARGAS, EULÓGIO CORRALES; FERREIRA-SANTOS, RUY; SATO, TAKASSU; BARREIRA, AMILTON ANTUNES. Miastenia gravis análise de 90 casos tratados com timectomia myasthenia gravis. Trabalhos Complementares • Acta Cir. Bras. 15 (suppl 2) • 2000
A. MARX , N. WILLCOX , MI LEITE , W.-Y. CHUANG , B. SCHALKE , W. NIX & P. STRÖBEL.) TIMOMA E MIASTENIA GRAVIS PARANEOPLÁSICA, Autoimmunity, 43:56, 2010; 413-427.
ANDREWS PI, MASSEY JM, HOWARD JF, JR, SANDERS DB. RAÇA, SEXO E PUBERDADE INFLUENCIAM O INÍCIO, A GRAVIDADE E O RESULTADO DA MIASTENIA GRAVIS JUVENIL . Neurologia. 1994.
ARROYO, Hugo A. TRATAMIENTO DE LA MIASTENIA GRAVIS JUVENIL. Medicina.
Buenos Aires. 2019; Vol. 79 (Supl. III): 71-76.
ASSIS, J.L.A. MYASTHENIA GRAVIS AND THYMOMA. Arq. Neuropsiquiatry. 57 (1): 613,1999.
CHRISTISON-LAGAY E, DHARIA B, VAJSAR J, KIM PC. EFFICACY AND SAFETY OF THORACOSCOPIC THYMECTOMY IN THE TREATMENT OF JUVENILE MYASTHENIA GRAVIS. Pediatr Surg Int. 2013 Jun;29(6):583-6.
EDUARDO HARUO SAITO (TE SBCT), CLÁUDIO HIGA2 (TE SBCT), RODOLFO ACATAUASSU NUNES3 (TE SBCT), GÉRSON C. MAGALHÃES4, LUIZ CARLOS AGUIAR VAZ5, VICENTE FARIA CERVANT. EXTENDED THYMECTOMY THROUGH VIDEO ASSISTED THORACIC SURGERY AND CERVICOTOMY IN THE TREATMENT OF MYASTHENIA. J. Pneumologia 29 (5) • Out 2003.
ESTEPHAN, Eduardo de Paula; BAIMA, José Pedro Soares; ZAMBON, Antonio Alberto. MUSCLE AND NEURMUSCULAR JOINT DISORDERS: MYASTHENIA GRAVIS IN CLINICAL PRACTICE, Arq. Neuro-Psiquiatr., v. 80, maio 2022. (5 Suppl 1).
FINNIS, MARIA F; JAYAWANT, SANDEEP. JUVENILE MYASTHENIA GRAVIS: A PAEDIATRIC PERSPECTIVE. Doença Autoimune, 2011.
GILHUS NE, TZARTOS S, EVOLI A, PALACE J BRUNS TM, VERSCHUUREN JJGM. MIASTENIA GRAVE. Nat Rev Di Primers, 2019;5 (1).
GILHUS NE. MYASTHENIA GRAVIS. New England Journal of Medicine, 2016; 375: 2570-2581.
GROB D , BRUNNER N, NAMBA T ET AL. LIFETIME COURSE OF MYASTHENIA GRAVIS. Muscle Nerve, 2008;37:141-149.
JARETZKI A, BAROHN RJ, ERNSTOFF RM, ET AL. MIASTENIA GRAVIS: RECOMENDAÇÕES PARA PADRÕES DE PESQUISA CLÍNICA. Força Tarefa do Conselho Consultivo Científico Médico da Fundação Miastenia Gravis da América. Ann Thorac Surg 2000;70:327-33.4.
KAULING ALC, ALMEIDA MCS, LOCKS GF, BRUNHARO GM. MIASTENIA GRAVIS: RELATO DE DOIS CASOS E REVISÃO DA LITERATURA, Revista brasileira de anestesiologia, 2011; 61: 6: 748-763.
LI, JOEL DAVID MONZÓN; GONZÁLES, LISETTE MARÍA MARTÍNEZ; PERAZA, AMANDA ELENA CASTILLO; ROSELL, MARÍA CLARA ROIG. ASPECTOS FISIOPATOLÓGICOS Y CLÍNICOS DE LA MIASTENIA GRAVIS. Revista Científica Estudiantil de Cienfuegos Inmedsur, 2021; 4(1): 133.
LORENZONI, PAULO JOSÉ; AUGUSTO, LUCAS PIRES; KAY, CLÁUDIA SUEMI KAMOI; SCOLA, ROSANA HERMINIA; WERNECK, LINEU CÉSAR WERNECK. MIASTENIA GRAVIS E TIMO: INVESTIGAÇÃO NO SEGUIMENTO DE LONGO PRAZO EM PACIENTES TIMECTOMIZADOS E NÃO TIMECTOMIZADOS. Serviço de Distúrbios Neuromusculares, Divisão de Neurologia, Departamento de Clínica Médica, Hospital de Clínicas, UFPR, Curitiba PR, Brasil 2013.)
MEHNDIRATTA MM, PANDEY S, KUNTZER T. TRATAMENTO COM INIBIDOR DE ACETILCOLINESTERASE PARA MIASTENIA GRAVIS. Cochrane Database of Systematic Reviews. Pubmed, 2014.
MILANÉS ARMENGOL, ARMANDO RAFAEL; MOLINA CASTELLANOS, KATTIA; PINO, MAS JANETTE; MILANÉS MOLINA, MARLA; OJEDA LEAL, ÁNGEL MIGUEL. UNA MIRADA ACTUAL A LA MIASTENIA GRAVIS. Medisur, Cienfuegos , v. 18, n/. 5, p. 907-918, oct. 2020.
MINISTÉRIO DA SAÚDE (BR). APROVA O PROTOCOLO CLÍNICO E DIRETRIZES TERAPÊUTICAS DA INSUFICIÊNCIA ADRENAL CONGÊNITA. Secretaria de Atenção à Saúde. Portaria SAS/MS no 1170, de 19 de novembro de 2015: Seção 1: 83.
MINISTÉRIO DA SAÚDE. MIASTENIA GRAVIS. PORTARIA CONJUNTA SAES/SCTIE/MS. Nº 11, DE 23 DE MAIO DE 2022.
MORITA, MARIA DA PENHA A; GABBAI, ALBERTO A; OLIVEIRA, ACARY S. B, PENN, AUDREU S. MYASTHENIA GRAVIS IN CHILDREN: ANALYSIS OF 18 PATIENTS. Arq. Neuropsiquiatria 20001; 59 (3-B): 681-685.
NAGUIB M, BRULL SJ. UPDATE ON NEUROMUSCULAR PHARMACOLOGY. Curr Opin Anaesthesiol, 2009;22:483-490.
OLIVEIRA, Ezequiel Fernandes; VALÉRIO, Berenice Cataldo Oliveira; CAVALCANTE, Valéria; URBANO, Jessica Julioti; SILVA, Anderson Soares; POLARO, Melissa Nunes; NACIF, Sergio Roberto; OLIVEIRA, Claudia Santos; RESENDE, Maria Bernadete Dutra; OLIVEIRA, Acary Souza Bulle; OLIVEIRA, Luis Vicente Franco. QUANTITATIVE MYASTHENIA GRAVIS SCORE: A BRAZILIAN MULTICENTER STUDY FOR TRANSLATION, CULTURAL ADAPTATION AND VALIDATION / TESTE QUANTITATIVO PARA MIASTENIA GRAVIS: ESTUDO MULTICÊNTRICO BRASILEIRO PARA TRADUÇÃO, ADAPTAÇÃO CULTURAL E VALIDAÇÃO. Arq. neuropsiquiatr ; 75(7): 457463, July 2017.
PAL, ATISH; GOGIA,VIKAS; MEHRA, CHETAN. DESAFIOS PERIOPERATÓRIOS E PONTOS DE ATENÇÃO NO BLOQUEIO NEUROMUSCULAR DURANTE TIMECTOMIA ROBÓTICA PARA MIASTENIA GRAVIS. Brazilian Journal of Anesthesiology, 2020; 70(5): 549-552.
PALACE J, NEWSOM-DAVIS J, LECKY B. A RANDOMIZED DOUBLE-BLIND TRIAL OF PREDNISOLONE ALONE OR WITH AZATHIOPRINE IN MYASTHENIA GRAVIS. Neurology. 1998;50(6):1778-83.
RABINSTEIN AA, WIJDICKS EF. SINAIS DE ALERTA DE INSUFICIÊNCIA RESPIRATÓRIA IMINENTE EM PACIENTES NEUROLÓGICOS. Semin Neurol 2003;23:97-104.
RUIZ JR, RAUL LOPES; REIBSCHEID, SAMUEL MAREK; CATANEO, ANTONIO JOSÉ MARIA; REZENDE, LUIS ANTONIO DE LIMA. RESULTADO DA TIMECTOMIA AMPLIADA NO TRATAMENTO DE PACIENTES COM MIASTENIA GRAVIS. Jornal Brasileiro de Pneumologia, 2004; 30(2) 115-120.
SAITO, EDUARDO HARUO; HIGA, CLÁUDIO; NUNES, RODOLFO ACATAUASSU; MAGALHÃES, GÉRSON C; VAZ, LUIZ CARLOS AGUIAR; CERVANTE, VICENTE FARIA. TIMECTOMIA MINIMAMENTE INVASIVA NO TRATAMENTO DA MIASTENIA GRAVIS. Pulmão Rio de Janeiro, 2021;30(1): 23-31.
SOUZA AFH, SOUZA FH, OKANO N, VARGAS EC, SANTOS RF, SATO T ET AL. MIASTENIA GRAVIS: ANÁLISE DE 90 CASOS TRATADOS COM TIMECTOMIA. ACTA CIR BRÁS.2000.
SUZUKI S, UTSUGISAWA K, NAGANE Y, SUZUKI N. TRÊS TIPOS DE ANTICORPOS ESTRIACIONAIS NA MIASTENIA GRAVIS. Dis autoimune 2011;2011:740583.
TAVARES JV, KAHWAGE AM. SÍNDROME POLIGLANDULAR AUTOIMUNE TIPO III: UMA RARA ASSOCIAÇÃO ENTRE DOENÇA DE GRAVES, VITILIGO E MIASTENIA GRAVIS. Revista Eletrônica Acervo Saúde, 2019; 11(5): e245.
WOLFE GI, KAMINSKI HJ, ABAN IB, ET AL. RANDOMIZED TRIAL OF THYMECTOMY IN MYASTHENIA GRAVIS. N Engl J Med 2016;375: 511-22.
1Pediatra, residente de Neurologia Pediátrica do Hospital da Criança de Brasília (HCB)
2Neurologista Pediátrica do Hospital da Criança de Brasília (HCB)
3Cirurgião Torácico do Pediátrica do Hospital da Criança de Brasília (HCB)
