IMMUNOTHERAPEUTIC APPROACHES FOR THE TREATMENT OF ALZHEIMER’S DISEASE: A LITERATURE REVIEW
REGISTRO DOI: 10.5281/zenodo.10668875
Ana Julia Kuhn Zary1
Karine Cristine de Almeida2
Juliana Lilis da Silva2
Natália de Fátima Gonçalves Amâncio2
Resumo
A Doença de Alzheimer (DA) é a forma mais comum de demência, com origem em descobertas de Alois Alzheimer em 1906. A prevalência é alta, com 1,2 milhão de casos no Brasil e uma estimativa global de 50 milhões de afetados, podendo chegar a 131,5 milhões até 2050. A hipótese da cascata amiloide é central, sugerindo que placas neuronais causadas pela proteína precursora amiloide levam a danos cerebrais e demência. Terapias convencionais focam nos sintomas, e a imunoterapia se apresenta promissora ao focar na possível causa da doença, porém existem riscos e controvérsias envolvidos. Foi realizada uma revisão integrativa de literatura com a pergunta central focada nas abordagens imunoterapêuticas para a DA, com destaque para Aducanumabe, Lecanemab, Donanemab e Solanezumabe e os principais achados abordam os desafios e possibilidades desses novos tratamentos.
Palavras-chaves: Doença de Alzheimer. Imunoterapia. Tratamento. Anticorpos.
Abstract
Alzheimer’s Disease (AD) is the most common form of dementia, originating from discoveries by Alois Alzheimer in 1906. The prevalence is high, with 1.2 million cases in Brazil and a global estimate of 50 million affected individuals, potentially reaching 131.5 million by 2050. The amyloid cascade hypothesis is central, suggesting that neuronal plaques caused by amyloid precursor protein lead to brain damage and dementia. Conventional therapies focus on symptoms, and immunotherapy appears promising by targeting the possible cause of the disease, although there are risks and controversies involved. An integrative literature review was conducted with the central question focused on immunotherapeutic approaches to AD, highlighting Aducanumab, Lecanemab, Donanemab, and Solanezumab, and the main findings address the challenges and possibilities of these new treatments.
Key-words: Alzheimer’s desease. Immunotherapy. Treatment. Antibodies.
1. INTRODUÇÃO
A doença de Alzheimer (DA) é a variante mais prevalente de demência, representando mais de metade dos diagnósticos, ela progride gradualmente apresentando sintomas que se agravam ao longo do tempo (ALZHEIMER EUROPE, 2023). A origem da doença de Alzheimer está associada à descoberta da patologia por Alois Alzheimer em 1906 (ALVES, B; OPAS; OMS, 2023). À medida que as pessoas vivem por um período prolongado, essa enfermidade culmina em uma incapacitação total, e, finalmente, leva à morte decorrente de complicações associadas a uma acentuada deterioração cognitiva (LOUIS; MAYER; ROWLAND, 2018).
Por várias décadas, acreditou-se que a doença de Alzheimer fosse uma forma de demência pré-senil, afetando pessoas com sintomas que começavam antes dos 65 anos. No entanto, em meados do século XX, foi observado que as características clínicas, patológicas, estruturais e bioquímicas da doença de Alzheimer pré-senil eram semelhantes às encontradas em indivíduos com a forma mais comum de demência “senil” (acima dos 65 anos de idade). (LOUIS; MAYER; ROWLAND, 2018).
No território brasileiro, aproximadamente 1,2 milhão de indivíduos vivem com alguma forma de demência, e a cada ano são diagnosticados 100 mil novos casos (ALVES, B; OPAS; OMS, 2021). A escala global é ainda maior, atingindo 50 milhões de pessoas. Conforme as estimativas da Alzheimer’s Disease International, esses números podem aumentar para 74,7 milhões até 2030 e 131,5 milhões até 2050, devido ao envelhecimento da população. Este quadro demonstra que a doença representa uma crise global de saúde que necessita ser abordada (ALVES, B; OPAS; OMS, 2021).
Devido à grande epidemia da doença, a tentativa de encontrar uma causa comum foi de grande interesse para a comunidade científica. Eram notáveis os achados de imagem e clínicos, mas somente em 1992 surgiu a hipótese da cascata amiloide que baseia muitas linhas de tratamento atuais (BUDSON; SOLOMON, 2020). A hipótese afirma que a deposição de uma glicoproteína integral, denominada proteína precursora amiloide (APP), gera placas neuronais que são o agente causador da patologia de Alzheimer e que os emaranhados neurofibrilares, perda celular, dano vascular e demência seguem como resultado direto dessa deposição (HARDY; HIGGINS, 1992).
As placas senis são compostas por um tipo específico de proteína amiloide, comumente referido como beta-amiloide. Elas constituem estruturas extracelulares que incluem proteínas αβ, processos neuríticos danificados (axônios e dendritos), astrócitos e seus processos, e células da micróglia. (OLIVEIRA et al., 2019).
A lesão nas fibras nervosas e ramificações prejudica a comunicação entre os neurônios. Ao tentar eliminar a proteína amiloide, os axônios e dendritos restantes, as células da micróglia podem desencadear uma resposta inflamatória, resultando em mais danos. A análise por microscopia eletrônica indica que as placas senis exibem um centro “felpudo” cercado por uma estrutura irregular e compacta. Diversas classificações das placas senis foram propostas, incluindo as difusas e as neuríticas (ALVES; DAMIÃO; SIMIONI, 2023).
Mesmo após mais de cem anos da primeira descrição da DA, ainda não existe cura e as opções de tratamento disponíveis são limitadas. O tratamento, com medicamentos desenvolvidos disponíveis, não tem impedido a progressão lenta e gradual da doença, podendo ser utilizados apenas para a redução de sintomas. (FERREIRA et al., 2022) Com base no processo amiloidogênico, é viável identificar potenciais alvos para a terapia anti-amiloide, como: redução da produção de proteínas αβ por meio da inibição de enzimas responsáveis por sua formação, prevenção da agregação de αβ e facilitação da eliminação de αβ ou remoção dos depósitos de αβ via imunoterapia. (SEVIGNY et al., 2016).
Nesse sentido, muitos pesquisadores têm investido na pesquisa imunoterápica, objetivando eliminar as placas senis e obter uma cura de fato para a doença. Assim, podem ser destacadas duas vertentes: a imunização ativa, por meio de vacinação, que ainda não demonstrou melhora clínica significativa, e a imunização passiva, por meio de anticorpos monoclonais, que já apresenta estudos em fase três e se mostra promissora (FERREIRA, 2022). O atual arsenal de anticorpos anti-αβ difere em seletividade para variantes polimórficas e pode reconhecer epítopos com base em uma porção específica da sequência AB ou em uma das conformações AB multiméricas (CARDOSO et al., 2022).
Assim, o presente artigo se justifica pela relevância dada ao conhecimento de novas tecnologias e a perspectiva de avanços significativos que possibilitem o tratamento da causa da Doença de Alzheimer e não apenas de sintomas. Logo, esse trabalho objetiva apresentar um panorama da imunoterapia em pacientes com DA e explorar os anticorpos que se mostram mais promissores, como: aducanumabe, lecanemab, donanemab e solanezumabe.
2. METODOLOGIA
O presente estudo consiste em uma revisão exploratória integrativa de literatura. A revisão integrativa foi realizada em seis etapas: 1) identificação do tema e seleção da questão norteadora da pesquisa; 2) estabelecimento de critérios para inclusão e exclusão de estudos e busca na literatura; 3) definição das informações a serem extraídas dos estudos selecionados; 4) categorização dos estudos; 5) avaliação dos estudos incluídos na revisão integrativa e interpretação e 6) apresentação da revisão.
Na etapa inicial, para definição da questão de pesquisa utilizou-se da estratégia PICO (Acrômio para Patient, Intervention, Comparation e Outcome). Assim, definiu-se a seguinte questão central que orientou o estudo: “No tratamento da doença de Alzheimer, com foco na hipótese de proteínas beta amiloides, quais são as novas abordagens imunoterapêuticas que demonstram maior relevância na atualidade?” Nela, observa-se o P: Pacientes com Doença de Alzheimer; I: Imunoterapia; C: Não se aplica; O: Demonstram tratamento de relevância.
Para responder a esta pergunta, foi realizada a busca de artigos envolvendo o desfecho pretendido utilizando as terminologias cadastradas nos Descritores em Ciências da Saúde (DeCs) criados pela Biblioteca Virtual em Saúde, desenvolvido a partir do Medical Subject Headings da U.S. National Library of Medicine, que permite o uso da terminologia comum em português, inglês e espanhol. Os descritores utilizados foram: alzheimer ‘s disease, immunotherapy, amyloid, treatment, aducanumabe, lecanemab, donanemab, solanezumab. Para o cruzamento das palavras chaves utilizou-se os operadores booleanos “and”, “or” e “not”.
Realizou-se um levantamento bibliográfico por meio de buscas eletrônicas nas seguintes bases de dados: Google Scholar; Biblioteca Virtual de Saúde (BVS), Scientific Electronic Library Online (SciELO), National Library of Medicine (PubMed), EbscoHost.
A busca foi realizada no mês de setembro de 2023. Como critérios de inclusão, limitou-se a artigos escritos em inglês, português e espanhol publicados nos últimos 6 anos (2018 a 2023), que abordassem o tema pesquisado e que estivessem disponíveis eletronicamente em seu formato integral, foram excluídos os artigos em que o título e resumo não estivessem relacionados ao tema de pesquisa e pesquisas que não tiverem metodologia bem clara.
Após a etapa de levantamento das publicações, encontrou 44 artigos, dos quais foram realizados a leitura do título e resumo das publicações considerando o critério de inclusão e exclusão definidos. Em seguida, realizou a leitura na íntegra das publicações pré-selecionadas, atentando-se novamente aos critérios de inclusão e exclusão, sendo que 18 artigos não foram utilizados devido aos critérios de exclusão. Foram selecionados 25 artigos para análise final e construção da revisão.
Posteriormente à seleção dos artigos, realizou um fichamento das obras selecionadas a fim de selecionar a coleta e análise dos dados. Os dados coletados foram disponibilizados em um quadro, possibilitando ao leitor a avaliação da aplicabilidade da revisão integrativa elaborada, de forma a atingir o objetivo desse método.
A Figura 1 demonstra o processo de seleção dos artigos por meio das palavras-chaves de busca e da aplicação dos critérios de inclusão e exclusão citados na metodologia. O fluxograma leva em consideração os critérios elencados pela estratégia PRISMA (Page et al., 2021)
Figura 1 – Fluxograma da busca e inclusão dos artigos
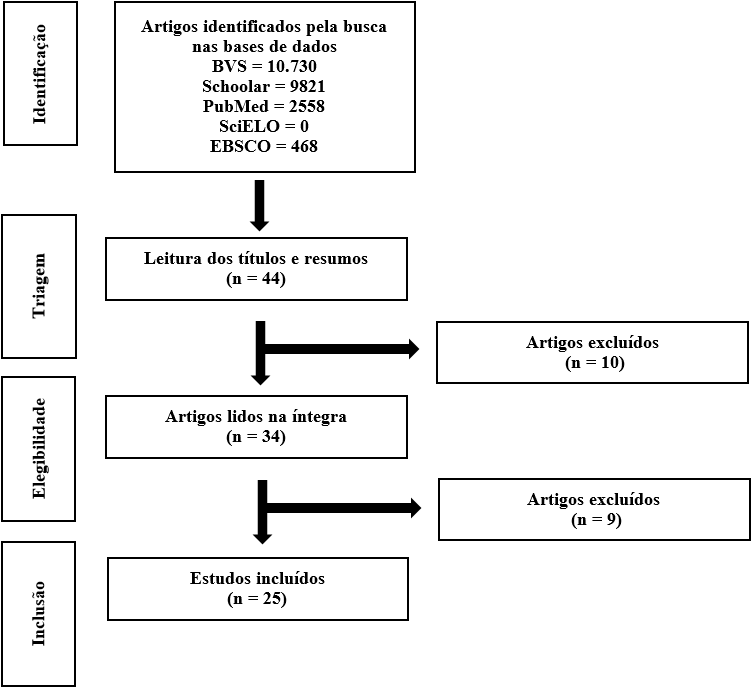
Fonte: Adaptado do Preferred Reporting Items for Systematic review and Meta-Analyses (PRISMA). Page et al., (2021).
3. RESULTADOS
Após a análise dos artigos selecionados a tabela a seguir foi elaborada constando os autores das obras, título e informações principais dos trabalhos.
Tabela 1 – Principais abordagens imunoterapêuticas no tratamento de Alzheimer.
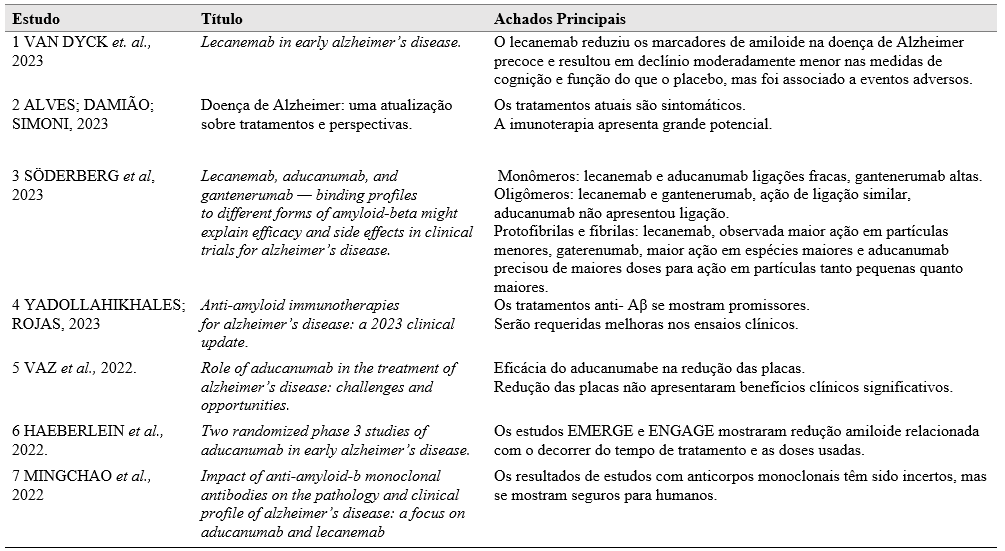
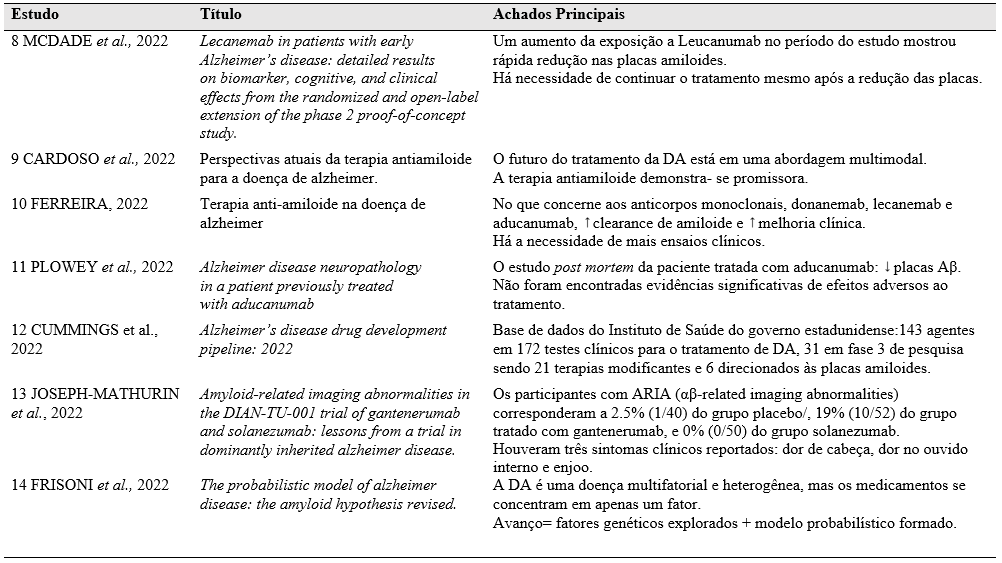
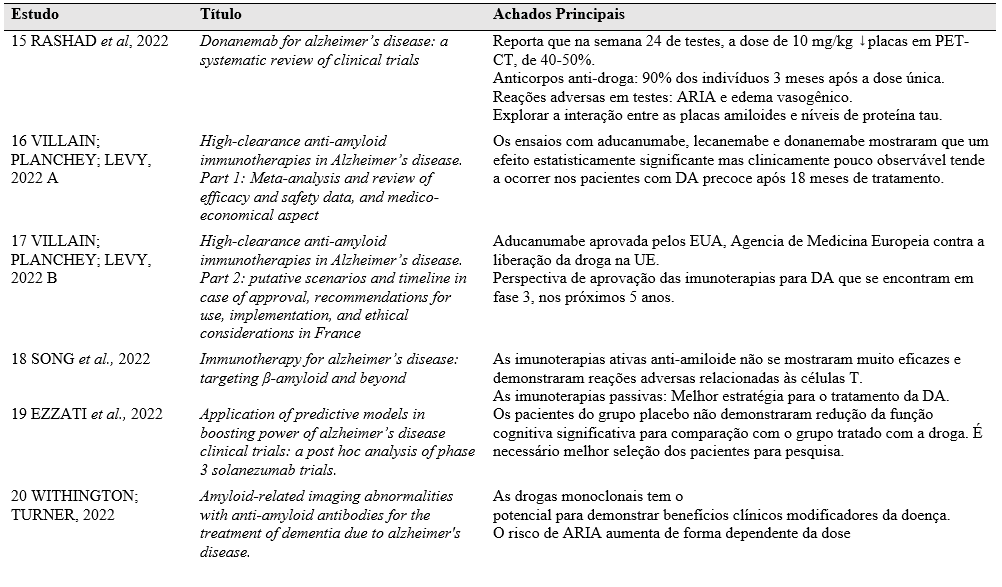

Fonte: autoria própria, 2023.
4. DISCUSSÃO
De acordo com os 25 artigos analisados, conclui-se que as terapias convencionais de tratamento para DA são focadas apenas na diminuição de sintomas como abordam os autores Alves; Damião; Simoni (2023), Breijyer e Karaman (2020). No ano de 2020, existiam apenas duas classes de medicamento aprovados para o tratamento da doença: inibidores da enzima colinesterase e antagonistas de N-metil d-aspartato (BREIJYER; KARAMAN, 2020) que buscavam apenas melhorar a qualidade de vida dos pacientes.
Hoje, a hipótese amiloide ganhou evidências de apoio com o desenvolvimento de tomografia por emissão de positrões (PET) amiloide que permite a detecção e quantificação do acúmulo de proteínas no cérebro in vivo (YADOLLAHIKHALES; ROJAS, 2023) e possibilita a testagem de drogas focadas nesse eixo. Além desse fator, Vanden e Chi, (2021), afirmam que após a descoberta de que os oligômeros fibrilares envolvidos em uma série de doenças degenerativas possuem um epítopo comum, a terapia direcionada a estes se tornou alvo de diversas pesquisas. Nesse sentido, as abordagens de maior relevância atual são as substâncias promotoras da depuração amiloide no tecido cerebral e a imunoterapia se mostra promissora, existindo duas técnicas: a ativa e a passiva (CARDOSO, 2022).
A imunoterapia ativa ocorre por vacinação, segundo a autora Ferreira (2022) as vacinas monoclonais têm a vantagem de necessitar apenas de administração periódica. Apesar desse fato, as vacinas testadas Affitope e acc-001 não demonstraram eficácia clínica comprovada e a cad-100 induziu uma resposta de anticorpos direcionada às placas de proteínas αβ, mas a eficácia clínica dos anticorpos igG anti-αβ produzidos não ficou explícita (FERREIRA, 2022). A pesquisa de Song et al., (2022) corrobora para essa afirmação ao destacar que as vacinas apresentam pouca reatividade, além de causarem reações adversas relacionadas às células T, portanto ainda não são viáveis por não serem passíveis de controle da resposta.
Dessa forma a imunoterapia passiva se apresenta como melhor alternativa, pois há uma maior constante no número de anticorpos e seu direcionamento (LOUREIRO et al., 2020). Nesse sentido, Cummings et al., (2022), realizaram uma pesquisa no banco de dados da Biblioteca Nacional de Medicina do Instituto Nacional de Saúde dos Estados Unidos (EUA) e encontraram que, dentre os agentes testados, havia inúmeros agentes monoclonais, sendo os que já se encontram em fase três de estudo os seguintes: Aducanumab, Lecanemab, Donanemab, Ganterenumab e Solanezumab.
Esses agentes diferem, dentre outros fatores, na capacidade de se ligar aos diversos níveis de organização das proteínas αβ, sendo na forma de monômeros, oligômeros, protofibrilas e fibrilas. Söderberg et al. (2023) analisaram as drogas lecanemab, aducnumab e gantenerumab quanto a esse quesito e encontraram que em relação aos monômeros: lecanemab e aducanumab apresentam ligações fracas e gantenerumab altas; em relação aos oligômeros: lecanemab e gantenerumab têm ação de ligação similar e aducanumab não apresentou ligação; já em relação a protofibrilas e fibrilas: lecanemab, apresentou maior ação em partículas menores, gaterenumab, maior ação em espécies maiores e aducanumab precisou de maiores doses para ação em partículas tanto pequenas quanto maiores.
4.1 ADUCANUMABE
A medicação Aduhelm (aducanumab) obteve aprovação para uso pela Food and Drug Administration (FDA) dos EUA no ano de 2021, e desde então, muitos autores têm discutido sobre seu uso. Villain, Planchey e Levy (2022) abordam em sua pesquisa que existe um embate sobre a relação risco/benefício da classe de drogas a qual o medicamento pertence, devido a relatos de ocorrência de anormalidades de imagem relacionadas à terapia amiloide (ARIA), o que levou a não aprovação da droga pela União Europeia. Entretanto, existem indícios promissores, como a demonstração da segurança do uso de anticorpos monoclonais em seres humanos (MINGCHAO et al., 2022).
Em contrapartida, muitos autores consideram o benefício do tratamento como fator principal a ser considerado. Vaz et al. (2022) afirmam que os estudos conduzidos mostraram significativa redução das placas com uso da medicação, sendo que a pesquisa Engage se mostrou mais eficaz com doses mais baixas e a Emerge mais altas. Haeberlein et al. (2022) também pactuam com o estudo anterior e afirmam que não ocorreram efeitos relacionados ao tratamento na pesquisa observada. Em defesa dos benefícios da utilização da droga Plowey et al., (2022) relatam que, no seu estudo post-mortem realizado com uma paciente previamente tratada com aducanumab no estudo Prime, obteve achados que colaboram com os dados obtidos em exames PET durante os últimos meses de vida da paciente que comprovam a diminuição das placas amiloides principalmente na porção profunda do córtex, além de melhora na micróglia.
4.2 LECANEMAB
Leqembi (lecanemab) obteve aprovação recente pela FDA no ano de 2023. Assim como no caso de aducanumab, a droga vem ganhando visibilidade e sofre críticas devido a sua aprovação acelerada. Van Dyck et al. (2023) afirmam que a diminuição de placas só foi passível de observação a partir de 18 meses de tratamento e como efeitos adversos foram observados ARIA e fibrilação atrial. McDade et al. (2022) também ressaltam a eficácia da terapia após 18 meses, mas aponta para o re-acúmulo gradual de biomarcadores patológicos após a descontinuação da medicação. Ambos afirmam que a eficácia é apontada em pacientes com DA inicial, mas incerta em estágios mais avançados da doença.
4.3 DONANEMAB
Rashad et al. (2022) e Mintun et al., (2021) apontam para a eficácia do tratamento com a droga. Rashad et al. (2022) relata que 90% dos indivíduos submetidos a dose única desenvolveram anticorpos antidroga, mas, às 24 semanas de tratamento foi possível observar em PET uma redução de até 50% nas placas. Mintun et al., (2021) alertam para edemas e derrames cerebrais (de maioria assintomáticos) que ocorreram durante a pesquisa, mas que eram facilmente revertidos após a descontinuação do tratamento. Withington e Turner (2022) afirmam que a ocorrência de ARIA aumenta conforme o aumento da dose a qual o paciente é submetido, logo, é necessário encontrar a dose ótima para diminuir as complicações citadas.
4.4 SOLANEZUMAB
No que tange o uso dessa terapia há divergência entre autores. Willis et al. (2018) evidenciam que nas pesquisas Expedition 1 e 2 foi observado uma diminuição dos fragmentos da proteína no líquido cefalorraquidiano dos pacientes, mas esse fato não foi observado em Expedition 3. Joseph-Mathurin et al. (2022) afirmam que a droga é capaz de atingir seu alvo de proteínas, mas que não houve observação de melhora cognitiva após o tratamento. Nesse sentido, Ezzati et al. (2022) discorrem sobre a escolha de pacientes para compor a pesquisa, pois segundo eles, os pacientes do grupo placebo não demonstraram redução da função cognitiva significativa para comparar com aqueles em tratamento, o que afeta a comprovação de eficácia da terapia.
5. CONCLUSÃO
Conclui-se com os dados apresentados que a imunoterapia apresenta um tratamento de possibilidade promissora. Como destacado por diversos autores, alguns pontos ainda precisam ser considerados, como as síndromes relacionadas ao tratamento e as doses ótimas para preveni-las sem interferir no processo de depuração das placas. Outro fator importante é a utilização de parâmetros padrões para avaliar os benefícios cognitivos após a diminuição das placas e garantir que a remoção da causa do problema esteja de fato causando impacto positivo.
Nesse sentido, foi possível observar que o maior benefício foi para os pacientes com DA precoce, logo, a terapia anti-amiloide deve ser acompanhada do desenvolvimento de métodos de rastreio eficazes para evitar que o avanço da doença cause danos não passiveis de reversão. Assim entende-se que, apesar de existirem riscos e necessidade de mais estudos em relação a imunoterapia, essas drogas representam a expectativa de que a doença de Alzheimer, que é uma grande promotora de declínio significativo na qualidade de vida daqueles acometidos, possa ser enfim controlada.
REFERÊNCIAS
ALVES, B.; OPAS; OMS. 21/9 – Dia Mundial da Doença de Alzheimer e Dia Nacional de Conscientização da Doença de Alzheimer | Biblioteca Virtual em Saúde MS. 2023. Disponível em: <https://bvsms.saude.gov.br/21-9-dia-mundial-da-doenca-de-alzheimer-e-dia-nacional-de-conscientizacao-da-doenca-de alzheimer/#:~:text=A%20doen%C3%A7a%2C%20descrita%20pela%20primeira>. Acesso em 01 nov 2023.
ALVES, B; OPAS; OMS. Conhecer a demência, conhecer o Alzheimer: o poder do conhecimento – Setembro, Mês Mundial do Alzheimer | Biblioteca Virtual em Saúde MS. 2021. Disponível em: <https://bvsms.saude.gov.br/conhecer-a-demencia-conhecer-o-alzheimer-o-poder-do-conhecimento-setembro-mes-mundial-do-alzheimer/>. Acesso em 14 ago, 2023.
ALVES, D. E.; DAMIÃO, B.; SIMIONI, P. U. Doença de alzheimer: uma atualização sobre tratamentos e perspectivas. Cadernos Acadêmicos, v. 9, n. 1, p. 87–100, 2023.
ALZHEIMER EUROPE. Alzheimer’s dementia. 2023. Disponível em: https://www.alzheimer-europe.org/dementia/alzheimers-dementia. Acesso em: 14 ago, 2023.
BREIJYER, Z.; KARAMAN, R. Comprehensive review on alzheimer’s disease: Causes and Treatment. Molecules, v. 8, n. 25, p.5789, 2020.
BUDSON, A. E; SOLOMON, P. R. Perda da Memória, Doença de Alzheimer e Demência, 2. Rio de Janeiro: Guanabara Koogan, 2020.
CARDOSO. et al. Perspectivas atuais da terapia antiamiloide para a Doença de Alzheimer, Revista Neurociencias, v. 30, p. 1–16, 2022.
CUMMINGS J. et al. Alzheimer’s disease drug development pipeline: 2022. Alzheimer’s & dementia v. 8, n.1, p. 12295, 2022.
EZZATI, A. et al. Application of predictive models in boosting power of alzheimer’s disease clinical trials: A post hoc analysis of phase 3 solanezumab trials. Alzheimer’s & dementia v. 8, n. 1, p. 12223, 2022.
FERREIRA, I. M. R. Terapia anti-amiloide na doença de Alzheimer. 2022. 72 p. Dissertação (Mestrado em Medicina) – Universidade Beira Interior. Covilhã, Portugal. 2022.
FRISONI, G. B. et al. The probabilistic model of alzheimer’s disease: the amyloid hypothesis revised. Nature reviews: neuroscience v. 23, n.1, p. 53–66, 2022.
HAEBERLEIN, B. S. et al. Two randomized phase 3 studies of aducanumab in early alzheimer’s disease. The journal of prevention of Alzheimer’s disease, v. 9, n. 2, p. 197-210, 2022.
HARDY, J. A.; HIGGINS, G. A. Alzheimer’s disease: the amyloid cascade hypothesis. Science, v. 256, n. 5054, p. 184–185, 1992.
JOSEPH-MATHURIN, N. et al. Amyloid-related imaging abnormalities in the dian-tu-001 trial of gantenerumab and solanezumab: Lessons from a Trial in Dominantly Inherited Alzheimer Disease. Annals of neurology, v. 92, n. 5, p. 729–744, 2022.
LOUIS, E. D.; MAYER, S. A.; ROWLAND, L. P. Merritt – Tratado de Neurologia, 13. ed. Rio de Janeiro: Guanabara Koogan, 2018.
LOUREIRO, J. C. et al. Passive antiamyloid immunotherapy for alzheimer’s disease. Current opinion in psychiatry, v. 33, n. 3, p. 284–291, 2020.
MCDADE, E. et al. Lecanemab in patients with early alzheimer’s disease: detailed results on biomarker, cognitive, and clinical effects from the randomized and open-label extension of the phase 2 proof-of-concept study. Alzheimer Research Therapy, v. 14, p. 191, 2022.
MINGCHAO, S. et al. Impact of Anti-amyloid-β Monoclonal Antibodies on the Pathology and Clinical Profile of Alzheimer’s Disease: A Focus on Aducanumab and Lecanemab. Frontiers in aging neuroscience, v. 14, p. 870517, 2022.
MINTUN, M. A. et. al. Donanemab in early alzheimer’s disease. The New England Journal of medicine, v. 384, n. 18, p. 1691–1704, 2021.
OLIVEIRA, I. A. G. et al. Revisão sistemática de avaliações econômicas acerca do uso da memantina isolada ou combinada com o donepezil para a doença de Alzheimer moderada a grave. Revista Brasileira de Geriatria Gerontologia, v. 22, n. 4, p. 190002, 2019.
PAGE, M. J. et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews.The BMJ, v. 372, n. 71, 2021.
PLOWEY, E. D. et al. Alzheimer disease neuropathology in a patient previously treated with aducanumab. Acta neuropathologica, v. 144, n. 1, p. 143–153, 2022.
RASHAD, A. et al. DONANEMAB FOR ALZHEIMER’S DISEASE: A Systematic Review of Clinical Trials. Healthcare, v. 11, n. 1, p. 32, 2022.
SEVIGNY, J. et al. The antibody aducanumab reduces Aβ plaques in Alzheimer’s disease. Nature, v. 537, n. 7618, p. 50–56, 2016.
SÖDERBERG, L. et al. Lecanemab, aducanumab, and gantenerumab: Binding Profiles to Different Forms of Amyloid-Beta Might Explain Efficacy and Side Effects in Clinical Trials for Alzheimer’s Disease. Neurotherapeutics: the journal of the American Society for Experimental NeuroTherapeutics, v. 20, n. 1, p. 195–206, 2023.
SONG, C. et al. Immunotherapy for alzheimer’s disease: targeting β-amyloid and beyond. Translational neurodegeneration, v. 11, n. 1, p. 18, 2022.
VAN DYCK, C. H. et al. Lecanemab in early Alzheimer’s disease. New England Journal of Medicine, v. 388, n. 1, p. 9-21, 2023.
VAZ, M. et al. Role of aducanumab in the treatment of alzheimer’s disease: Challenges and opportunities. Clinical interventions in aging, v. 17, p. 797-810, 2022.
VILLAIN, N.; PLANCHE, V.; LEVY R. High-clearance anti-amyloid immunotherapies in alzheimer’s disease, part 1: Meta-analysis and review of efficacy and safety data, and medico-economical aspects. Revue neurologique v. 178, n. 10, p. 1011–1030, 2022. A
VILLAIN, N.; PLANCHE, V.; LEVY, R. High-clearance anti-amyloid immunotherapies in alzheimer’s disease, part 2: putative scenarios and timeline in case of approval, recommendations for use, implementation, and ethical considerations in France. Revue neurologique v. 178, n. 10, p. 999–1010, 2022. B
WILLIS, B. A. et al. Central pharmacodynamic activity of solanezumab in mild alzheimer’s disease dementia. Alzheimer’s & dementia, v. 4, p. 652–660, 2018.
WITHINGTON, C. G.; TURNER, R. S. Amyloid-related imaging abnormalities with anti-amyloid antibodies for the treatment of dementia due to alzheimer’s disease. Frontiers in neurology, v. 13, p. 862369, 2022.
YADOLLAHIKHALES, G.; ROJAS, J. C. Anti-amyloid immunotherapies for alzheimer’s disease: A 2023 Clinical Update. Neurotherapeutics: the journal of the American Society for Experimental NeuroTherapeutics, v. 20, n. 4, p. 914–931, 2023.
ZANDEN, C. M. V.; CHI, E. Y. Passive Immunotherapies Targeting Amyloid Beta and Tau Oligomers in Alzheimer’s Disease. Journal of pharmaceutical sciences, v. 109, n. 1, p. 68–73, 2020.
1Discente do curso de Medicina do Centro Universitário de Patos de Minas -UNIPAM.
2Docente do Centro Universitário de Patos de Minas -UNIPAM.
