REGISTRO DOI: 10.5281/zenodo.10650465
1Rafael André Ferreira
2Ludmilla Ferreira de Assis
3Reinaldo Reis Pimentel
4Ana Clara Fernandes de Souza
5Pollyanne Nunes Bonfim Gouvêa
6Fabiane de Carvalho Silva
7Fabio Oliveira de Souza
8Geisiane Barbosa de Bastos
9Murillo Monteiro de Oliveira
10Ricardo Viana Velloso
Resumo: O presente trabalho explora características do antibiótico azitromicina (AZM) que é um macrolídeo amplamente utilizado, abordando particularidades desde sua síntese até seus mecanismos de ação e aplicações clínicas. Desenvolvido inicialmente por farmacêuticos croatas na PLIVA e posteriormente pelos Laboratórios de Química Farmacêutica da Pfizer, o medicamento é estruturalmente relacionado à família dos macrolídeos. Destaca-se a importância da AZM, prescrita anualmente para mais de 40 milhões de pacientes, devido à sua eficácia antibacteriana. Com mecanismo de ação baseado na inibição da síntese proteica bacteriana pela subunidade 50S do ribossomo, a AZM também apresenta capacidade de penetrar em vesículas extracelulares bacterianas, contribuindo para seu amplo espectro de ação. Além disso, a discussão abrange as indicações clínicas da vancomicina, um antibiótico glicopeptídico tricíclico, e comparações entre diferentes antibióticos. O estudo enfatiza a evolução da síntese da azitromicina desde suas primeiras aplicações, destacando seu papel crucial nas práticas médicas atuais. A farmacocinética da AZM é abordada, incluindo sua biodisponibilidade oral, metabolismo e eliminação. Efeitos adversos potenciais, como distúrbios gastrointestinais e arritmias cardiovasculares, são discutidos, proporcionando uma visão abrangente do perfil farmacológico do medicamento. A metodologia do estudo baseia-se em revisões bibliográficas realizadas durante o segundo semestre de 2023, utilizando fontes como livros, revistas científicas e os sites de busca Scielo, PubMed e Google Acadêmico. A busca de informações abrangeu a síntese de fármacos, princípios de ação antimicrobiana, indicações clínicas e componentes dos fármacos, bem como implicações clínicas. Além disso, o artigo explora novas perspectivas na formulação da AZM, como microesferas de liberação prolongada. Essa formulação oferece uma opção eficaz para o tratamento de infecções, proporcionando maior controle sobre a liberação do medicamento. A conclusão destaca a importância da AZM, isoladamente ou em combinação com outros antibióticos, no tratamento de diversas condições clínicas, enfatizando seu papel significativo na prática médica contemporânea.
Palavras-chave: azitromicina, antimicrobianos, antibacterianos, síntese de medicamentos.
Abstract: This study explores the characteristics of the antibiotic azithromycin (AZM), a widely used macrolide, addressing details from its synthesis to its mechanisms of action and clinical applications. Initially developed by Croatian pharmacists at PLIVA and later by the Pharmaceutical Chemistry Laboratories of Pfizer, the drug is structurally related to the macrolide family. The significance of AZM, prescribed annually for over 40 million patients due to its antibacterial efficacy, is highlighted. With a mechanism of action based on the inhibition of bacterial protein synthesis by the 50S ribosomal subunit, AZM also demonstrates the ability to penetrate bacterial extracellular vesicles, contributing to its broad spectrum of activity. Additionally, the discussion covers the clinical indications of vancomycin, a tricyclic glycopeptide antibiotic, and compares different antibiotics. The study emphasizes the evolution of azithromycin synthesis from its early applications, underscoring its crucial role in current medical practices. The pharmacokinetics of AZM are addressed, including its oral bioavailability, metabolism, and elimination. Potential adverse effects, such as gastrointestinal disturbances and cardiovascular arrhythmias, are discussed, providing a comprehensive overview of the drug’s pharmacological profile. The study’s methodology is based on literature reviews conducted during the second semester of 2023, utilizing sources such as books, scientific journals, and search engines like Scielo, PubMed, and Google Scholar. Information retrieval covered drug synthesis, antimicrobial action principles, clinical indications, and drug components, as well as clinical implications. Additionally, the article explores new perspectives in AZM formulation, such as extended-release microspheres. This formulation offers an effective option for infection treatment, providing greater control over drug release. The conclusion emphasizes the importance of AZM, either alone or in combination with other antibiotics, in treating various clinical conditions, underscoring its significant role in contemporary medical practice.
Keywords: azithromycin, antimicrobials, antibacterials, drug synthesis.
1 INTRODUÇÃO
O antibiótico macrolídeo azitromicina (AZM) foi desenvolvido por um grupo de farmacêuticos croatas na empresa PLIVA e chamado de Sumamed, levando em consideração uma das grandes conquistas na Croácia (TOMISIC Z., 2011).
Este antibiótico também foi desenvolvido sob o nome de Zithromax nos Laboratórios de Química Farmacêutica da Pfizer Central Research (RETSEMA J., et al. 1987). O AZM é prescrito anualmente para mais de 40 milhões de pacientes devido à sua atividade antibacteriana (MOSHOLDER A.D., et al., 2013). Conhecido antibiótico azalídeo, é estruturalmente relacionado à família dos macrolídeos e pode ser distribuído em várias tecidos e fluidos corporais (AMSDEN G.W. et al., 1996). Devido à interferência reversível da subunidade ribossomal 50S bacteriana, o AZM inibe a síntese de proteínas e impede o crescimento de bactérias. Além disso, ele pode penetrar nas vesículas extracelulares bacterianas, um tipo de sistema de defesa secretório (IMAMURA Y., et al. 2005; JELIĆ D., ANTOLOVIĆ R., 2016).
Nesse sentido se faz necessária a presente abordagem por situar os achados relevantes em relação à síntese do fármaco antimicrobiano azitromicina, os mecanismos de ação e aplicação clínica, e importantes aspectos farmacológicos de relevância desse medicamento sintético no cenário terapêutico, além dos avanços científicos convergentes com as possibilidades de melhorias nas tecnologias de produção de medicamentos antimicrobianos.
Destaque-se, por fim, a exploração da evolução da síntese da azitromicina desde sua introdução como parte das primeiras drogas antimicrobianas até os dias atuais. Discutiremos também a importância desse medicamento antimicrobiano o qual é um dos mais utilizados na prática clínica, focando na sua estrutura, função e características mais relevantes.
2 METODOLOGIA
O estudo foi elaborado a partir de dados obtidos por meio de revisões bibliográficas. A revisão da literatura foi realizada durante o segundo semestre de 2023 por meio de pesquisa em livros e revistas científicas e em sites de busca como Scielo, PubMed e Google Acadêmico. Ao todo foram selecionados 44 trabalhos para revisão sistemática os quais podem ser consultados no decorrer do texto ou na sessão “referências”. Foram realizadas buscas sobre o descritor “azitromicina” com ênfase em seus princípios de ação, características químicas, estruturais e farmacológicas, interações e principais indicações. Foram também destacadas informações como implicações clinicas e efeitos adversos.
3 REFERENCIAL TEÓRICO E DISCUSSÃO
3.1 Farmacodinâmica do azitromicina
O azitromicina é classificado como um antibiótico macrolídeo e tem a propriedade de ser ativamente absorvido por várias células, incluindo fibroblastos e leucócitos (IMAMURA Y., et al. 2005).
Este agente antibiótico atua in vitro contra muitas bactérias piogênicas (por exemplo, Neisseria gonorrhoeae [N. gonorrhoeae] e Moraxella catarrhalis [M. catarrhalis]) e bactérias resistentes à beta-lactamase (por exemplo,
Legionella e Chlamydia spp.) (JELIĆ D, ANTOLOVIĆ R.,2016).
O AZM possui efeitos imunomoduladores, anti-inflamatórios e antibacterianos; portanto, é benéfico para pacientes com diversas doenças inflamatórias do trato respiratório, por exemplo. O AZM também é eficaz em pacientes com COVID-19 e tem sido utilizado em ensaios clínicos para prevenir infecções bacterianas nesses pacientes (GLADUE R.P., SNIDER M.E., 1990; RAPP R.P., 1998; GAUTRET P., et al. 2020).
Foi relatado que o AZM em combinação com a hidroxicloroquina (HCQ) pode reduzir a carga viral do SARS-CoV-2 e possui eficácia na alta precoce de pacientes com COVID-19 quando tratados no início do curso da doença. Além disso, o AZM pode modular as características do sistema imunológico, reduzindo a produção de citocinas, mantendo a integridade das células epiteliais e prevenindo fibrose pulmonar, cujo tratamento envolve relativamente um curto período de tempo (HOROWITZ R.I., FREEMAN P.R., 2019).
De modo geral, o método de administração em adultos é 1500 mg de AZM de liberação imediata, ou seja, 500 mg uma vez ao dia por 3 dias, ou 500 mg no primeiro dia e 250 mg do segundo ao quinto dia. A maior dose oral aprovada foi de 2,0 g, sendo relacionada ao tratamento da uretrite gonocócica (LIU P., et al., 2007).
3.2 Estrutura do Medicamento
O AZM cuja fórmula química é C38H72N2O12, pertence a uma subclasse de antibióticos chamada azalidos, sendo o primeiro dessa categoria. Ela possui uma composição química distinta da eritromicina, sendo derivada da adição de um átomo de nitrogênio no anel lactona da eritromicina A. O nome químico da azitromicina é 9deoxi-9a-aza-9a-metil-9a-homoeritromicina A, e seu peso molecular é de 749,0.
(PADAYACHEE N., SCHELLACK N., 2021) (Figura 1).
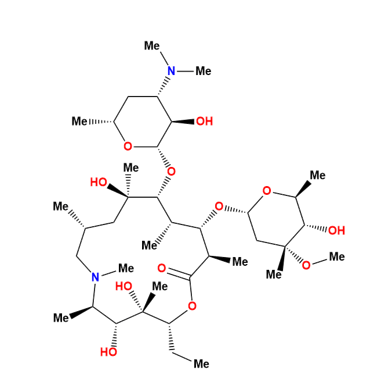
Figura 1: Estrutura química da azitromicina (disponível em https://go.drugb ank.com/drugs/DB00207 acesso em 01/11/2023).
3.3 Mecanismo de Ação
Similar a outros antibióticos macrolídeos, o principal objetivo do AZM é inibir a síntese de proteínas bacterianas, interagindo com a subunidade 50S do ribossomo bacteriano sensível (Figura 2). A redução na síntese de proteínas está correlacionada com o aumento na concentração de macrolídeo (CHAMPNEY W.S., BURDINE R.,
1998).
A taxa de passagem da forma não ionizada do AZM pela membrana é maior, e isso pode ser a razão por trás do aumento da atividade antimicrobiana do AZM em pH alcalino. O AZM se liga a um local próximo ao centro de transferência peptídica no rRNA 23S chamado túnel de saída de peptídeo nascente (que tem aproximadamente 100 Å de comprimento e 10-20 Å de largura) e o obstrui parcialmente (BAKHEIT A., AL-HADIYA B., ABD-ELGALIL A., 2014).
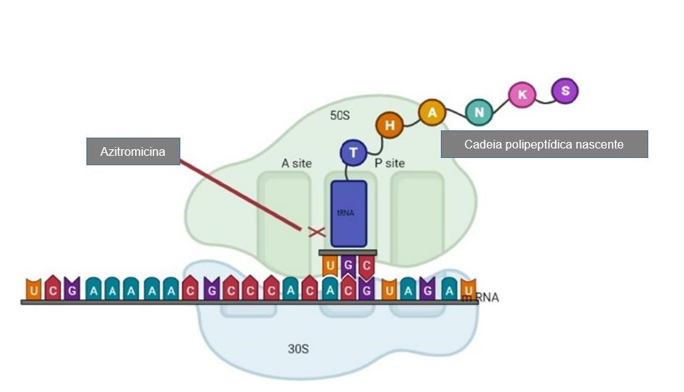
Figura 2: Visão esquematizada do mecanismo de inibição da tradução do mRNA pela Azitromicina por meio de sua interação com a subunidade 50S dos ribossomos bacterianos, impedindo a translocação da proteína em crescimento do local A do ribossomo para o local P (Adaptado de Heidary M. et al., 2022).
O processo de ligação do AZM é quase semelhante ao da eritromicina. A interação do eritromicina em uma superfície formada por três bases (U2611, A2058 e A2059), utilizando três grupos metil axiais pertencentes ao anel de lactona da droga, é a chave desse processo, conforme pesquisas em H. marismortui. Também existe uma ligação de hidrogênio entre o grupo 2′ OH do açúcar desosamina da eritromicina e o átomo N1 de A2058, que estabiliza a eritromicina em sua posição (VÁZQUEZLASLOP N., MANKIN A.S., 2018).
Essas interações resultam no movimento da base e na oclusão do túnel de saída de peptídeo nascente devido ao posicionamento das bases dentro do contato de van der Waals do grupo amino do tRNA do sítio P (PARNHAM M.J. et al., 2014).
Descobertas recentes mostram que no contexto do peptídeo nascente o AZM desempenha um papel importante em alterar a passagem desse pelo túnel de saída de peptídeo, ou seja, o AZM não obstrui completamente a passagem (embora o túnel de saída de peptídeo nascente tenha várias funções além de ser uma passagem normal para o citoplasma, como modular as funções do ribossomo em resposta a sequências do novo peptídeo e ambiente) (BULKLEY D. et al., 2010).
Esses eventos resultam na penetração mais rápida das membranas externas; portanto, tem efeitos na entrada nas bactérias e aumenta a atividade contra bactérias gram-negativas. O AZM também mostrou efeitos anti-inflamatórios em vários estudos; por exemplo, Cigana et al. (2007) demonstraram que o AZM reduz a expressão de mRNA de TNF-α, os níveis de proteína TNF-α e a atividade de ligação de DNA ao NFκB em linhas celulares de fibrose cística (CF) humana, após a confirmação de uma taxa mais alta de expressão de mRNA de TNF-α, níveis elevados de proteína TNF-α e atividade de ligação de DNA ao NF-κB em linhas celulares de CF em comparação com linhas celulares não-CF isogênicas (CIGANA C., ASSAEL B.M., MELOTTI P., 2007; AGHAI Z.H. et al., 2007).
A redução na atividade de ligação de DNA ao NF-κB está associada à inibição da degradação de IκBα, a proteína que inibe a translocação das subunidades ativas de NF-κB para o núcleo. A sinalização celular inflamatória é afetada pelo AZM, e esses impactos incluem uma diminuição no NF-κB (e subsequente produção de IL-6 e IL-8), como mencionado anteriormente, inibição da expressão induzida por LPS, que está envolvida na produção de citocinas e quimiocinas em macrófagos, neutrófilos e células endoteliais, assim como nas vias de sinalização celular que resultam na produção de ácido araquidônico e eicosanoides, e inibição da sinalização de AP-1 em neutrófilos isolados dos pulmões de camundongos induzidos por administração de LPS, o que consequentemente reduz as concentrações de IL-1b (VENDITTO V.J. et al.. 2021; VERLEDEN G.M., et al., 2006; ČULIĆ O., et al., 2002).
O AZM afeta diretamente e indiretamente os neutrófilos. As propriedades antiinflamatórias do AZM são a razão por trás dos efeitos indiretos do AZM sobre os neutrófilos. Os efeitos diretos incluem a redução na liberação de IL-8 e na infiltração de neutrófilos nas vias aéreas, desgranulação e degradação de mieloperoxidase extracelular, redução na explosão oxidativa de neutrófilos, e diminuição na produção de leucotrieno B4 (LTB4; um potente quimiotático de neutrófilos que estimula a liberação de IL-8 pelos neutrófilos) (WALES D., WOODHEAD M., 1999; KANNAN K., MANKIN A.S., 2011).
O AZM também ajuda os macrófagos a mudarem de um fenótipo do tipo M1 para um fenótipo alternativo do tipo M2 in vitro, inibindo a expressão de citocinas próinflamatórias (incluindo IL-12 e IL-6) e alterando a expressão de receptores de superfície (WALES D., WOODHEAD M., 1999).
3.4 Parâmetros Farmacocinéticos
A desmetilação é a principal via de metabolismo, e os metabólitos não parecem ter qualquer atividade antimicrobiana significativa. Como resultado da administração oral, a biodisponibilidade do AZM atinge 37%. A absorção do AZM pode ser reduzida em até 50% quando administrada junto às refeições (LODE H., 1991).
A coadministração de AZM com antiácidos contendo alumínio e magnésio pode reduzir as concentrações plasmáticas máximas em 24%, mas a taxa global da absorção não é alterado. A depuração média plasmática do AZM após uma única dose oral e intravenosa de 500 mg é de 630 ml/min (FOHNER A.E., et al., 2017).
A principal via de eliminação do AZM, especialmente como fármaco não alterado, é através da excreção biliar, e as fezes são uma rota proeminente de eliminação. Além disso, ao longo de uma semana, aproximadamente 6% da dose administrada é excretada como fármaco não alterado na urina; portanto, a excreção urinária do AZM parece ser uma rota de eliminação menos relevante. O AZM tem uma meia-vida de cerca de 35-40 horas em humanos após uma dose de 500 mg (DREW R.H., GALLIS H.A., 1992; SWAINSTON HARRISON T., KEAM S.J., 2007).
A meia-vida terminal é calculada como o tempo necessário para a concentração plasmática/sanguínea diminuir em 50% após o pseudo-equilíbrio de distribuição ter sido alcançado. A meia-vida de eliminação do AZM (o tempo para a concentração plasmática de fármaco diminuir apenas devido à eliminação do fármaco) é de aproximadamente 68 horas (NAHATA M.C., 1993).
Estudos de longo prazo demonstraram que o AZM não possui potencial carcinogênico e mutagênico em animais de laboratório padrão e testes. Os principais efeitos adversos possíveis relacionados ao AZM incluem distúrbios gastrointestinais, dor de cabeça, tontura, perda auditiva e arritmias cardiovasculares (MCMULLAN B.J., MOSTAGHIM M., 2015; CHANDRA R., et al., 2007).
Em casos raros, hepatotoxicidade foi relatada. Em pacientes com intervalo QT prolongado, função hepática prejudicada e taxa de filtração glomerular renal <10 ml/min, precauções devem ser tomadas ao administrar AZM (RAPP R.P., 1998).
3.5 Novas perspectivas na formulação do AZM
Uma nova formulação de AZM, projetada como microesfera com liberação de longo prazo para retardar a liberação do AZM, é liberada lentamente ao passar pelo trato gastrointestinal superior e após atingir sua parte inferior (SWAINSTON HARRISON T., KEAM S.J., 2007; LOZANO C., et al., 2020).
Neste método, alcalinizando a formulação, o aumento do pH da suspensão minimiza a liberação do medicamento das microesferas na boca e estômago e na matriz de microesferas. O AZM é solúvel, e essa característica ajuda a controlar a liberação do medicamento. Ele se espalha pelos poros formados no local das microesferas (ANGGANI H.S et al., 2021).
Esta formulação liberação de longo prazo não compromete significativamente a biodisponibilidade oral do AZM, embora abranja uma pequena parte do local de absorção no sistema gastrointestinal superior. Essa alcançou aproximadamente 83% de biodisponibilidade em relação à formulação de liberação imediata, permitindo que os pacientes tolerem bem um curso completo de AZM na dose de 2,0 g (HOROWITZ R.I. et al., 2020; ZHENG X. et al., 2020).
Esta formulação deve ser administrada de estômago vazio junto com antiácidos. Uma nova formulação de microesferas de liberação oral de AZM é o primeiro antibiótico aprovado nos EUA para pacientes adultos com sinusite bacteriana aguda ou pneumonia adquirida na comunidade de caráter leve a moderado (YUE C., SHEN W., HU L., et al., 2021).
A formulação mencionada de AZM é um pó oral que deve ser reconstituído com água e administrado em uma única dose de 2,0 g. A liberação contínua do medicamento é alcançada por difusão a partir das microesferas; o tempo para atingir uma concentração sérica máxima é de 5 horas. O AZM é bem absorvido pela liberação livre. A concentração sérica máxima média é de 0,82 μg/ml, e a AUC24 é cerca de 8,62 μg/ml. O AZM de liberação livre deve ser ingerido de estômago vazio para garantir absorção mais lenta (HOROWITZ R.I. et al., 2020; ZHENG X. et al., 2020).
O AZM é principalmente excretado inalterado nas fezes. A meia-vida final da secreção de AZM é de 59 horas. A entrega do medicamento ao local da infecção por fagócitos e fibroblastos é uma característica do AZM direcionado ao tecido, proporcionando tratamento de 5 dias uma vez ao dia para a maioria das infecções que respondem à terapia oral, e de 7 a 10 dias para infecções mais graves tratadas por via intravenosa (HOROWITZ R.I. et al., 2020; YUE C., SHEN W., HU L., et al., 2021).
O metabolismo ocorre por meio de vias hepáticas que não envolvem o citocromo P450, minimizando assim o risco de interações medicamentosas (ZHENG X. et al., 2020).
4 CONCLUSÃO
A Azitromicina é um macrolídeo semissintético que possui um efeito significativo sobre uma ampla gama de bactérias Gram-positivas e Gram-negativas. Tanto isoladamente quanto/ou em sinergia com outros antibióticos, o AZM tem sido usado com sucesso no tratamento de doenças respiratórias (como asma, bronquiolite, DPOC, fibrose cística e COVID-19), infecções entéricas, infecções periodontais e DSTs. No entanto, estudos farmacocinéticos/farmacodinâmicos demonstraram uma absorção incompleta deste antibiótico com baixa biodisponibilidade oral. Diferentes bactérias em diferentes países têm mostrado níveis diferentes de resistência ao AZM. Assim, se faz necessária uma constante abordagem dos achados relevantes em relação à síntese, os mecanismos de ação e aplicação clínica da azitromicina, bem como suas limitações.
Assim, podemos concluir que o azitromicina (AZM) emerge como um protagonista crucial na farmacoterapia contemporânea, destacando-se como um macrolídeo de amplo espectro com aplicação abrangente no tratamento de infecções bacterianas. Este estudo oferece uma análise abrangente desde a síntese inicial da AZM até suas aplicações clínicas e implicações farmacológicas. A importância da AZM é incontestável, evidenciada pela sua prescrição anual para milhões de pacientes, impulsionada por sua eficácia antimicrobiana.
Ao penetrar vesículas extracelulares bacterianas e inibir a síntese proteica pela subunidade 50S do ribossomo, a AZM apresenta uma abordagem multifacetada para combater infecções. Além disso, este estudo aborda a farmacocinética da AZM, incluindo seu perfil de biodisponibilidade oral, metabolismo e eliminação, bem como efeitos adversos potenciais.
O artigo não apenas destaca a evolução da síntese da AZM desde suas origens, mas também explora perspectivas inovadoras na formulação, como as microesferas de liberação prolongada. Essas formulações representam avanços significativos, proporcionando maior controle terapêutico e eficácia no tratamento de infecções.
Em resumo, a azitromicina, seja utilizada isoladamente ou em combinação com outros antibióticos, desempenha um papel fundamental no arsenal terapêutico, abordando diversas condições clínicas. Sua relevância é reforçada pela constante busca por melhorias na formulação e compreensão de seus mecanismos de ação, destacando-se como uma peça vital na prática médica contemporânea diante dos desafios crescentes associados a infecções bacterianas.
5 REFERÊNCIAS
- AGHAI Z.H., KODE A., SASLOW J.G., et al. Azithromycin suppresses activation of nuclear factor-kappa B and synthesis of pro-inflammatory cytokines in tracheal aspirate cells from premature infants. Pediatric Res. 2007;62:483-488.
- ALBERT R.K., CONNETT J., BAILEY W.C., et al. Azithromycin for prevention of exacerbations of COPD. N Engl J Med. 2011;365:689-698. doi:10.1056/NEJMoa1104623.
- AMSDEN G.W. Erythromycin, clarithromycin, and azithromycin: are the differences real? Clin Ther. 1996;18:56-72.
- ANGGANI H.S., PERDANA R.G., SIREGAR E., BACHTIAR E.W. The effect of coating chitosan on Porphyromonas gingivalis biofilm formation in the surface of orthodontic mini-implant. J Adv Pharm Technol Res. 2021;12:8488. doi:10.4103/japtr.JAPTR_95_20.
- BAKHEIT A., AL-HADIYA B., ABD-ELGALIL A. Azithromycin. Profiles Drug Subst Excip Relat Methodol. 2014;39:1-40.
- BULKLEY D., INNIS C.A., BLAHA G., STEITZ T.A. Revisiting the structures of several antibiotics bound to the bacterial ribosome. Proc Natl Acad Sci USA. 2010;107:17158-17163.
- CHAMPNEY W.S., BURDINE R. Azithromycin and clarithromycin inhibition of 50S ribosomal subunit formation in Staphylococcus aureus cells. Curr Microbiol. 1998;36:119-123.
- CHANDRA R., LIU P., BREEN J.D, et al. Clinical pharmacokinetics and gastrointestinal tolerability of a novel extended-release microsphere formulation of azithromycin. Clin Pharmacokinet. 2007;46:247- 259. doi:10.2165/00003088-200746030-00005.
- CIGANA C., ASSAEL B.M., MELOTTI P. Azithromycin selectively reduces tumor necrosis factor alpha levels in cystic fibrosis airway epithelial cells. Antimicrob Agents Chemother. 2007;51:975-981.
- ČULIĆ O., ERAKOVIĆ V., ČEPELAK I., et al. Azithromycin modulates neutrophil function and circulating inflammatory mediators in healthy human subjects. Eur J Pharmacol. 2002;450:277-289.
- DREW R.H., GALLIS H.A. Azithromycin—spectrum of activity, pharmacokinetics, and clinical applications. Pharmacother J Hum Pharmacol Drug Ther. 1992;12:161-173.
- FOHNER A.E., SPARREBOOM A., ALTMAN R.B., KLEIN T.E. PharmGKB summary: macrolide antibiotic pathway, pharmacokinetics/fármaco.dynamics. Pharm Genom. 2017;27:164.
- GAUTRET P., LAGIER J.C., PAROLA P., et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label nonrandomized clinical trial. Int J Antimicrob Agents. 2020;56:105949. doi:10.1016/j.ijantimicag.2020.105949.
- GLADUE R.P., SNIDER M.E. Intracellular accumulation of azithromycin by cultured human fibroblasts. Antimicrob Agents Chemother. 1990;34:1056.doi:10.1128/AAC.34.6.1056
- HARRISON T.S., KEAM S.J. Azithromycin extended release. Drugs. 2007;67:773-792. doi:10.2165/00003495-200767050-00010.
- HEIDARY M. et al., Mechanism of action, resistance, synergism, and clinical implications of azithromycin. J Clin Lab Anal. 2022 Jun;36(6):e24427. doi: 10.1002/jcla.24427. Epub 2022 Apr 21. PMID: 35447019; PMCID: PMC9169196.
- HOROWITZ R.I., FREEMAN P.R. Precision medicine: retrospective chart review and data analysis of 200 patients on dapsone combination therapy for chronic Lyme disease/post-treatment Lyme disease syndrome: part 1. Int J Gen Med. 2019;12:101-119. doi:10.2147/ ijgm.S193608.
- HOROWITZ R.I., MURALI K., GAUR G., FREEMAN P.R., SAPI E. Effect of dapsone alone and in combination with intracellular antibiotics against the biofilm form of B. burgdorferi. BMC Res Notes. 2020;13:455. doi:10.1186/s13104-020-05298-6.
- IMAMURA Y., HIGASHIYAMA Y., TOMONO K., et al. Azithromycin exhibits bactericidal effects on Pseudomonas aeruginosa through interaction with the outer membrane. Antimicrob Agents Chemother. 2005;49:1377-1380. doi:10.1128/aac.49.4.1377-1380.2005
- IMAMURA Y., HIGASHIYAMA Y., TOMONO K., et al. Azithromycin exhibits bactericidal effects on Pseudomonas aeruginosa through interaction with the outer membrane. Antimicrob Agents Chemother. 2005;49:1377-1380. doi:10.1128/aac.49.4.1377-1380.2005
- JELIĆ D, ANTOLOVIĆ R. From erythromycin to azithromycin and new potential ribosome-binding antimicrobials. Antibiotics. 2016;5:29. doi:10.3390/antibiotics5030029.
- JELIĆ D., ANTOLOVIĆ R. From erythromycin to azithromycin and new potential ribosome-binding antimicrobials. Antibiotics. 2016;5:29. doi:10.3390/antibiotics5030029.
- KANNAN K., MANKIN A.S. Macrolide antibiotics in the ribosome exit tunnel: species-specific binding and action. Ann N Y Acad Sci. 2011;1241:33-47.
- LIU P., ALLAUDEEN H., CHANDRA R., et al. Comparative pharmacokinetics of azithromycin in serum and white blood cells of healthy subjects receiving a single-dose extended-release regimen versus a 3-day immediate-release regimen. Antimicrob Agents Chemother. 2007;51:103. doi:10.1128/AAC.00852-06.
- LODE H. The pharmacokinetics of azithromycin and their clinical significance. Eur J Clin Microbiol Infect Dis. 1991;10:807-812.
- LOZANO C., LÓPEZ M., ROJO-BEZARES B., SÁENZ Y. Antimicrobial susceptibility testing in Pseudomonas aeruginosa biofilms: one step closer to a standardized method. Antibiotics. 2020;9:880. doi:10.3390/ antibiotics9120880.
- MCMULLAN B.J., MOSTAGHIM M. Prescribing azithromycin. Aust Prescr. 2015;38:87.
- MOSHOLDER A.D., MATHEW J., ALEXANDER J.J., SMITH H, NAMBIAR S. Cardiovascular risks with azithromycin and other antibacterial drugs. N Engl J Med. 2013;368:1665-1668. doi:10.1056/NEJMp 1302726
- NAHATA M.C., KORANYI K., GADGIL S., HILLIGOSS D., FOUDA H., GARDNER M. Pharmacokinetics of azithromycin in pediatric patients after oral administration of multiple doses of suspension. Antimicrob Agents Chemother. 1993;37:314-316.
- NELSON M.L. et al. “Brief Communication: Mass SpectroscopicCharacterization of Tetracycline in the Skeletal Remains of an Ancient Population from Sudanese Nubia 350–550 CE.” American Journal of Physical Anthropology 143 no. 1 (2010):151–154.
- PADAYACHEE N, SCHELLACK N. Focus on azithromycin. S Afr Gen Pract. 2021;2:6-8.
- PARNHAM M.J., HABER V.E., GIAMARELLOS-BOURBOULIS E.J., PERLETTI G., VERLEDEN G.M., VOS R. Azithromycin: mechanisms of action and their relevance for clinical applications. Pharmacol Ther. 2014;143:225-245.
- RAPP R.P. Pharmacokinetics and pharmacodynamics of intravenous and oral azithromycin: enhanced tissue activity and minimal drug interactions. Ann Pharmacother. 1998;32:785-793. doi:10.1345/ aph.17299.
- RAPP R.P. Pharmacokinetics and pharmacodynamics of intravenous and oral azithromycin: enhanced tissue activity and minimal drug interactions. Ann Pharmacother. 1998;32:785-793. doi:10.1345/ aph.17299.
- RETSEMA J., GIRARD A., SCHELKLY W., et al. Spectrum and mode of action of azithromycin (CP-62,993), a new 15-membered-ring macrolide with improved potency against gram-negative organisms. Antimicrob Agents Chemother. 1987;31:1939-1947. doi:10.1128/ aac.31.12.1939 3.
- SWAINSTON HARRISON T., KEAM S.J. Azithromycin extended release: a review of its use in the treatment of acute bacterial sinusitis and community-acquired pneumonia in the US. Drugs. 2007;67:773- 792.doi:10.2165/00003495-200767050-00010.
- TOMISIC Z. The story of azithromycin. Kem Ind J Chem Chem Eng. 2011;60:603-617.
- VÁZQUEZ-LASLOP N., MANKIN A.S. How macrolide antibiotics work. Trends Biochem Sci. 2018;43:668-684.
- VENDITTO V.J., HAYDAR D., ABDEL-LATIF A., et al. Immunomodulatory effects of azithromycin revisited: potential applications to COVID-19. Front Immunol. 2021;12:285.
- VERLEDEN G.M., VANAUDENAERDE B.M., DUPONT L.J., VAN RAEMDONCK D.E. Azithromycin reduces airway neutrophilia and interleukin-8 in patients with bronchiolitis obliterans syndrome. Am J Respir Crit Care Med. 2006;174:566-570.
- WAINWRIGHT V. “Moulds in Ancient and More Recent Medicine.”Mycologist 3 no. 1 (1989):21–23.
- WALES D., WOODHEAD M. The anti-inflammatory effects of macrolides. Thorax. 1999;54:S58.
- YUE C., SHEN W., HU L., et al. Effects of tigecycline combined with azithromycin against biofilms of multidrug-resistant Stenotrophomonas maltophilia isolates from a patient in China. Infect Drug Resist. 2021;14:775786. doi:10.2147/idr.S298274
- ZHENG X., MA X., LI T., SHI W., ZHANG Y. Effect of different drugs and drug combinations on killing stationary phase and biofilms recovered cells of Bartonella henselae in vitro. BMC Microbiol. 2020;20:87. doi:10.1186/s12866-020-01777-9.
1Biomédico pelo Centro Universitário UNA – MG, Mestre em Bioquímica e Imunologia pela Universidade Federal de Minas Gerais – UFMG, Doutorando em Educação pela Universidad Internacional Iberoamericana – Porto Rico (EUA), Especialista em Analises Clinicas e Microbiologia pela Faculdade Venda Nova do Imigrante – ES (FAVENI – ES);
2Biomédica pela Universidade Paulista (UNIP), Aluna do curso de Pós-Graduação Lato Sensu em Hematologia Clínica e Banco de Sangue, Hemoterapia e Terapia Celular pelo Instituto Monte Pascoal – GO;
3Biólogo pela Faculdade Araguaia – GO (UniAraguaia), Aluno do curso de Pós-Graduação Lato Sensu em Microbiologia Aplicada ao Laboratório Clínico pelo Instituto Monte Pascoal – GO;
4Enfermeira pela Faculdade Padrão – GO, Especialista em UTI e Urgência e Emergência pela Faculdade Afirmativo – MT;
5Acadêmica do curso de Nutrição pelo Centro Universitário Leonardo da Vinci (UNIASSELVI);
6Acadêmica do curso de Biomedicina pelo Centro Universitário Leonardo da Vinci (UNIASSELVI); Técnica em Enfermagem pelo Instituto de Técnologia e Educação de Goiás – GO (ITEG);
7Biomédico pela Pontifícia Católica de Goiás – GO (PUC-GO), Mestre em Genética Pontifícia Católica de Goiás – GO (PUC-GO); Especialista em Gestão e Biossegurança em Estética e Cosmética pela Universidade Estadual de Goiás – GO (UEG);
8Biomédica pela Universidade Paulista (UNIP), Aluna do curso de Pós-Graduação Lato Sensu em Hematologia Clínica e Bioinformática pela Faculdade Unyleya – DF;
9Biomédico pela Universidade Paulista (UNIP), Aluno do curso de Pós-Graduação Lato Sensu em Hematologia Clínica e Banco de Sangue, Hemoterapia e Terapia Celular pelo Instituto Monte Pascoal – GO;
10Licenciado em Letras pela Universidade Candido Mendes – RJ, Doutor em Educação pela Universidade São Francisco – SP (USF) Mestre em Educação pela Universidade Estadual de Minas Gerais – MG (UEMG), Especialista em Ensino da Língua Portuguesa pela Universidade Candido Mendes – RJ.
Instituição: 1,2,4,6,7,8Unidade de Pronto Atendimento 24 horas (UPA 24 horas) / Secretaria Municipal de Saúde do Município de Senador Canedo – GO; 2,3,9Instituto Monte Pascoal – GO; 1,5,6Centro Universitário Leonardo da Vinci (UNIASSELVI); 10Universidade Federal de Minas Gerais – MG (UFMG).
