REGISTRO DOI: 10.5281/zenodo.10569073
Heitor Kenzo Funatsu Coelho
RESUMO
Relato de caso de paciente de 50 anos, gênero feminino, com queixa de insônia caracterizada por latência prolongada. Evoluiu com piora progressiva passando a apresentar despertares frequentes e progressivamente mais prolongados no meio do ciclo.
No prosseguimento evolutivo foi possível identificar que o distúrbio do sono estava associado a um desconforto disestésico na região dorsal escapular e paramediana a esquerda, inicialmente descrito como prurido. Associadamente a piora da sensação na região do desconforto sensitivo passou a ser observada a alteração da pigmentação da pele. Pelo conjunto dos sinais e sintomas clínicos e na ausência de fatores causais identificáveis, a entidade notalgia parestética foi considerada.
A notalgia parestésica (NP) é uma neuropatia periférica sensitiva não rara mas frequentemente subdiagnosticada. É caracterizada pela parestesia e, por vezes, disestesia, em região dorsal escapular e torácica, habitualmente antecedendo o adormecer. Caracteristicamente não ocorrem alterações anatômicas de significância ou outras anormalidades associadas a topografia afetada. Os tratamentos sintomáticos cursam com resultados variados, geralmente insatisfatórios.
No caso, havia o antecedente de submissão a vários tipos de tratamentos clínicos, medicamentosos e alternativos, não tendo sido observado o sucesso sintomático desejado. Após o início do tratamento com o canabidiol em titulação progressiva, apresentação em concentração pura isolada, a paciente evoluiu com marcante completo controle sintomático na dose 30 mg/dia em duas tomadas.
Palavras chave: insônia, distúrbio do sono, notalgia parestésica, neuropatia periférica dorsal, canabidiol.
SUMMARY
Case report of a 50-year-old female patient complaining of insomnia characterized by prolonged latency. The patient progressively worsened and began to present frequent and progressively more prolonged awakenings in the middle of the cycle.
In the follow-up it was possible to identify that the sleep disorder was associated with dysesthetic discomfort in the dorsal scapular region and paramemedian region on the left, initially described as pruritus. Associated with the worsening of the sensation in the region of sensory discomfort, the alteration of the skin pigmentation began to be observed. Due to the set of clinical signs and symptoms and in the absence of identifiable causal factors, the entity paresthetica notalgia was considered.
Paresthetica notalgia (PN) is a not rare but often underdiagnosed sensory peripheral neuropathy. It is characterized by paresthesia and sometimes dysesthesia, in the dorsal scapular and thoracic region, usually preceding falling asleep. Characteristically there are no significant anatomical changes or other abnormalities associated with the affected topography. Symptomatic treatments have varied results, usually unsatisfactory.
In this case, there was a history of submission to various types of clinical, drug and alternative treatments, and the desired symptomatic success was not observed. After the beginning of treatment with cannabidiol in in pure concentration and progressive titration, the patient evolved turn up assymptomatic at the 30 mg/day/dose.
Keywords: insomnia, sleep disorder, notalgia paresthetica, dorsal peripheral neuropathy, cannabidiol.
I – RELATO DO CASO
PCB, 54 anos, gênero feminino, advogada e esportista. Altura 168 cm e 50 Kg.
Queixa principal: dificuldade para iniciar o sono há 4 anos.
História: a introdução a prejuízo do ciclo do sono teve início há 4 anos. A princípio a duração era variável, tendo havido registro do máximo de duas horas, mas após o qual, o sono transcorria sem interrupções, com despertar matinal agradável e associado à sensação de recuperação física. Com o passar dos meses, começou a apresentar despertares no meio da noite, inicialmente breves mas que progressivamente passaram a ser mais longos e mais frequentes, culminando na sonolência diurna, fadiga, queda no desempenho laborativo e irritabilidade chegando a influenciar relações interpessoais.
No inquérito ativo foi possível identificar que, embora a paciente houvesse apresentado a dificuldade para adormecer como queixa principal, o distúrbio do sono era secundário e decorrente de uma sensação de desconforto dorsal, predominando no lado esquerdo. A paciente relatava que a sensação estava presente independentemente do posicionamento do decúbito ou da inclinação do segmento cervical, mas inicialmente sempre associada a sonolência que antecedia o horário de dormir.
A sensação inicialmente era representada por formigamento, leve, não doloroso, que progressivamente passou a ser descrita como prurido, crescente em intensidade, muitas vezes levando a pequenas lesões locais pelo atrito do ato de coçar, muito embora essa ação não culminasse com alívio sintomático. Com a evolução, o simples contato dos tecidos da roupa ou do lençol passou a ser desconfortável. Observou também que houve a progressão na duração do desconforto, da área de abrangência e dos momentos de ocorrência, levando a despertares no meio no ciclo do sono e dificultando o reestabelecimento desse estado determinado pela permanência do incômodo. A sensação passou a ser notada também em momentos diurnos, quando em estado de maior quietude e não relacionada a sonolência e, em menor intensidade, na região em espelho a direita.
Não houve o estabelecimento da relação com fatores de piora como estresse ou esforço físico. Referiu uma melhora duvidosa quando em clima de temperatura mais baixa.
No registro dos antecedentes pessoais não houveram outras queixas.
Não havia o uso contínuo de medicamentos por outros distúrbios, de substâncias ilícitas ou recreativas.
Não apresentava antecedentes cirúrgico, infeccioso crônico ou acidentes com trauma que tenha necessitado de atendimento médico.
Apreciadora de esportes, apresentava atividades físicas regulares e com frequência mantinha como esporte preferencial o esqui na neve, habitualmente em declives leves e moderados.
Pelo desconforto, já havia peregrinado por diversas especialidades médicas (ortopedista, psiquiatra, acupunturista) e áreas correlatas (psicólogo, fisioterapeuta, massoterapeuta), não tendo ocorrido o sucesso terapêutico almejado. Nas diferentes fases evolutivas, foi orientada ao uso contínuo de medicamentos de variado espectro: indutores do sono, ansiolíticos, miorrelaxantes, antidepressivos, antiepilépticos, cremes).
No exame físico e neurológico demonstrou-se colaborativa.
Não ocorreu a identificação de sinais motores ou de reflexos localizatórios e deficitários.
À inspeção foi observada a presença de musculatura cervical e torácica delineadas e tonificadas, mas ausente do caráter hipertrófico. Não houve a identificação da alteração da textura da pele ou de outras anormalidades superficiais mas havia a presença da alteração da coloração da pele na região escapular, paravertebral e de linha médica a esquerda, também discretamente observada na região paramediana e borda escapular a direita (figura 1) entre os níveis de dermátomos C7-T4.
Houve a identificação da discreta redução na sensibilidade associada à disestesia ao toque superficial na região dorsal alta, correspondendo a área de hiperpigmentação.
Os exames laboratoriais, de imagem (raio-X de coluna torácica e cervical), ressonância magnética de coluna cervical e torácica) e neurofisiológico (eletroneuromiografia dos músculos dorsais e cintura escapular) apresentaramse dentro da normalidade.
Considerando a queixa clínica, os dados evolutivos, hábitos de vida e exames, clínico e complementares, foi estabelecido o diagnóstico de uma síndrome álgica com característica neuropática, especificamente, a notalgia parestésica.
DISCUSSÃO
A dor neuropática é uma condição comum na rotina clínica e causa prejuízos na qualidade de vida dos pacientes, podendo ser altamente debilitante. Comumente resultante da lesão de nervos periféricos decorrente de uma variedade de causas afetando as vias somatossensoriais aferentes, manifestando-se com vários sintomas, sendo os mais comuns a dor continua em queimação, a dor em choque e a alodínea mecânica.1 A maioria dos casos se enquadra em quatro grandes classes: 1- lesão nervosa periférica focal e/ou multifocal (traumática, isquêmica ou inflamatória); 2- polineuropatias periféricas generalizada (tóxicas, metabólicas, hereditárias ou inflamatória); 3- lesões do sistema nervoso central (acidente vascular cerebral, esclerose múltipla e lesão da coluna vertebral); 4- complexos distúrbios neuropáticos com envolvimento disautonômico (complexo da síndrome da dor regional – CSDR).1,2
Fisiologicamente as fibras finas pobremente mielinizadas Aδ e as fibras amielinizadas C, que são comumente chamadas de pequenas fibras formam uma população heterogênea com variada funcionalidade: regulação da sudorese e da pressão arterial e a condução de estímulos como temperatura, dor, prurido ou toque. O fibras Aδ compõem o trato neoespinotalâmico, são capazes de conduzir um potencial de ação em direção ao sistema nervoso central, caracterizando a dor aguda e bem localizada. As fibras axonais tipo C compõem o trato paleoespinotalamico, são mais lentas caracterizando a dor mal localizada e contínua.
As aferências nociceptivas periféricas entram no corno dorsal da medula espinhal. A substância gelatinosa, que consiste das laminas I e II, recebe mensagens de fibras mielinizadas Aδ e fibras amielinizadas C (principalmente da ultima). Em interneurônios da lamina II e em laminas mais profundas (III a V), chegam impulsos carreados por fibras mielinizadas de maior diâmetro, tipo Aβ, que em situação de normalidade não transmitem impulsos dolorosos. Os terminais de neurônios aferentes primários liberam neurotransmissores excitatórios, como o glutamato, a substância P e o peptídeo geneticamente relacionado a calcitonina (CGRP), para ativarem os neurônios de segunda ordem no corno dorsal da medula.
Neurônios das laminas I e V se projetam ao longo dos tratos espinotalâmicos e espino-reticulo-talâmicos, e são conduzidos até estruturas supraespinhais, como tronco cerebral, tálamo, córtex somatossensorial, córtex insular e córtex singular anterior. Após transitar pela medula espinhal, as informações nociceptivas chegam as estruturas nervosas supra-segmentares (bulbo, mesencéfalo, diencéfalo). Entre essas estruturas se encontram a formação reticular do tálamo, o hipotálamo, o sistema límbico e o córtex cerebral, regiões envolvidas nas compreensões sensitivas e afetivas do fenômeno doloroso.1,3
A hipótese mais provável da lesão de tais fibras culminar em sintoma álgico é o fato de as fibras finas remanescentes se tornarem mais suscetíveis a sofrer influência do seu meio, como aumento de citocinas álgicas e pró-inflamatórias.1,2
Outras considerações valorizam o envolvimento de mecanismos que reduzem o limiar para a dor ou a alteração da percepção de um estímulo: hiperalgesia (percepção de dor aumentada para estímulos nocivos), alodínia (designa a dor experimentada e interpretada em resposta deturpada e exacerbada a pequenos e diferentes estímulos inócuos) e dor espontânea (percepção sensitiva não necessariamente relacionada com um estímulo periférico identificável). Destes sintomas, a alodínia tátil (por exemplo, dor induzida por estimulação mecânica suave da pele) e dor espontânea são as mais prevalentes e debilitantes.3 Vários substratos celulares para estes sintomas têm sido propostos, mas não está clara a exata fisiopatologia:
– sensibilização periférica: a lesão do nervo periférico culminando com a apoptose no corno dorsal da medula espinhal (laminas I-III), os interneurônios contendo os transmissores GABA e glicina produzem inibição pré-sináptica e pós-sináptica. Após lesões parciais do nervo periférico, as IPSCs (células-tronco pluripotentes induzidas) aferentes evocadas nos neurônios da lâmina II são abolidas ou acentuadamente diminuídas como resultado de uma liberação présináptica reduzida de GABA. Com base na coincidência temporal da morte celular apoptótica e na redução das correntes inibitórias após lesão do nervo, temos a hipótese de que a apoptose dos interneurônios inibitórios leva a uma diminuição da inibição da coluna vertebral e, assim, à dor neuropática;4
– sensibilização central: ocorre quando a hiperexcitabilidade dos nociceptores periféricos causam mudanças secundárias no corno dorsal da medula espinhal, aumentando a atividade neuronal e consequente propagação dessa hiperexcitabilidade para os segmentos espinhais. Além de ativar sinais dolorosos na medula espinhal a partir de neurónios de baixo limiar como as fibras Aδ e Aβ. 3,4,5
O tratamento sintomático da dor neuropática na maioria dos pacientes é frustrante. Ocorre resposta insatisfatória às terapias farmacológicas e não farmacológicas para alívio do desconforto.
Faz parte do arsenal os sais analgésicos não hormonais e antiinflamatórios mas os fármacos antidepressivos tricíclicos e anticonvulsivantes representam os principais agentes de atuação, seja de origem periférica ou central. Os opioides agem nos receptores opióides (Mμ, Delta e Kappa) que se encontram estão localizados principalmente no sistema nervoso central, embora na presença de inflamação eles possam se expressar no sistema nervoso periférico, o que abre uma nova perspectiva para o uso tópico destes medicamentos. Consideração especial deve ser destinada a esse uso pelo risco de promover a depressão respiratória, e desenvolvimento da tolerância e da dependência física e psicológica.6,7,8
Propostas não farmacológicas tem sido descritas: o uso de estimulação magnética transcraniana no tratamento de alguns tipos de dor neuropática,visando a modulação dos sintomas dolorosos através da reorganização cortical induzida por esta técnica; e a estimulação sensitiva (TENS, estimulação medular, cerebral profunda) e neurocirúrgicos ablativos (simpatectomia, cordotomia, rizotomia, neurotomia periférica, tratotomia, nucleotratomia entre outros tantos) e não ablativos (estimulação elétrica da medula espinhal, das raízes posteriores e córtex cerebral cortical e profunda, implantes de sistemas de liberação de fármacos no sistema nervoso).9,10
A NOTALGIA PARESTÉSICA – NP foi descrita pela primeira vez em 1934. O termo foi derivado dos radicais linguagem notos (dorso) e algos (dor).11 É uma neuropatia sensitiva marcada por parestesia/disestesia, devido a lesões em sistema nervoso central – SNC e/ou pelo comprometimento dos ramos terminais dos nervos que emergem do plexo cervical e do plexo braquial: nervos supraescapular, escapular dorsal, e especialmente o ramo dorsal do nervo torácico longo ou tóraco-dorsal, os quais, topograficamente, podem ou não serem evidenciadas nos exames de imagem.11,12,13 As causas das lesões neurais variam e podem incluir trauma, compressão muscular (encarceramento), estiramento ou tração por movimento repetitivo, entre outros. Acometem especialmente a região torácica póstero-superior, predominando na região paramediana e borda escapular.12,13,14,15 A apresentação não é incomum, é possivelmente subdiagnosticada, e é mais frequentemente observada e referida no gênero feminino, na idade entre 50 e 60 anos, comumente afetando um dos lados embora existam também casos com comprometimento bilateral.16,17,18,19
Clinicamente é descrita como prurido na região dorsal peri-escapular, de variável intensidade, podendo também ser referida como uma sensação de calor, agulhadas, queimação ou formigamento de ocorrência ocasional mas mais frequentemente notada durante o repouso ou durante o período que antecede o sono. Paradoxalmente, ao toque superficial ocorre a alteração da percepção sensitiva superficial. A sensação é perturbadora, tradicionalmente culminando no ato reflexo de buscar o alívio incomodativo promovendo movimentos repetitivos de fricção local. Resulta na alteração epidérmica localizada e superficial caracterizada por marcante aumento da pigmentação e, por vezes, notável mudança da textura tecidual.12-19
A biópsia local evidencia que o ato de friccionar repetitivamente o local libera substâncias inflamatórias levando a proliferação epidérmica e hiperqueratose com infiltrado amiloidótico nas papilas dérmicas.11
O diagnóstico é eminentemente clínico, não obrigatoriamente evidenciando anormalidades outras além das alterações epidérmicas superficiais, mesmo nos exames complementares, laboratoriais, neurofisiológicos e de imagem.11-15
Seguindo o protocolo na busca ao alívio sintomático como das demais dores neuropáticas, são variadas as propostas terapêuticas, contudo, é comum o não registro do alívio sintomático satisfatório. Comumente o paciente tramita entre as terapias farmacológicas tradicionais, em uso contínuo, sistêmico e/ou local: anti-histamínicos, antiepilépticos, antidepressivos, miorelaxantes; creme e loção contendo anestésicos, substrato mentolado, capsaicina; atividade fisioterapêutica com readequação postural,20,21,22 alongamentos, técnicas de relaxamento mental; eletrofisiológicos (ultrassom, eletroestimulação),23,24 alternativos (acupuntura, massoterapia),25 e mais invasivos (infiltrações anestésicos, toxina botulínica, corticóide, descompressão do nervo cutâneo)26,27,28 e radiofrequência28.
O TRATAMENTO DA DOR NEUROPÁTICA COM O CANABIDIOL
Nos sistemas fisiológicos estamos contínua e simultaneamente interagindo com os múltiplos agentes: físico (objetos, pessoas, comportamental alimentos), ambiental (temperatura, condição geográfica, umidade, concentração dos gases aéreos), emocionais diversos (social, moral, laboral, pessoal, familiar, cultural). É intensa a exigência relativa às funções cerebrais corticais superiores: aprendizado, processamentos executivo, planejativo, atencional, aprendizado, perceptivo, motor, sensitivo-sensorial, comportamental e entre outros tantos diferentes domínios cognitivos.29
A rede celular: define os sistemas orgânicos que se integram mutua, intensa, dinâmica e continuamente, identificando e analisando as informações químicas e mecânicas, internas e externas, retornando comandos moleculares, tópicos e/ou sistêmicos, em alça reacional de retro-informação, sendo um dos mecanismos sinalizadores de demanda, de modo a proporcionar condições essenciais para a manutenção contínua da sensação prazerosa de bem estar físico e de compensação por adequação comportamental reacional e reflexas, condicionadas, conscientes e planejadas.
Essa interatividade multissistêmica é fisiológica, ininterrupta e fundamental para o reestabelecimento, deflagração, manutenção e/ou inibição dos eventos que podem ser pontuais, fásicos, contínuos ou condicionados.
A especificidade de cada sistema difere-se por suas características essenciais envoltas pela especificidade, complexidade funcional e morfológica, topografia e de inter-relação. Registram-se sistemas mais regionalizados e compartimentados, exercendo a função diretamente local (barreira mecânica/revestimento, sustentação) absorção, metabolismo. Existem os sistemas de distribuição mais difusa embora com diferentes densidades e funcionalidades regionais
Os transdutores químicos e receptores de membrana celular naqueles sistemas formados por células que contemplam a susceptibilidade a corrente iônica e gradientes de potenciais de ação, com a capacidade de sintetizar mensageiros (hormônios) ou serem transdutores de elementos químicos sinalizadores (neurotransmissores e ligantes). Os mensageiros e transdutores acoplam-se a órgãos alvo e receptores de membrana.
Os receptores podem ser: a) específicos e parciais, em padrão “chavefechadura”(ambos, agonistas positivos, antagonistas, agonistas negativos); b) inespecíficos por serem compostos por aglomerados de receptores (alostéricos) intermediados por proteína acopladora G (ɣ-gama).
Ambos, mensageiros, receptores e transdutores apresentam-se variáveis em especificidade, densidade funcional e distribuição topográfica. Aliada à formação do complexo mensageiro, transdutores e receptores deflagrando uma cascata de reações, definem e intensificam a importante variabilidade funcional e a especificidade tecidual.29
O SISTEMA ENDOCANABINÓIDE- SEC, à semelhança de outros sistemas, o SEC encontra-se com contínua ação, localizada, alternada e /ou difusa.
Somente nos anos 1990 foi comprovado a existência de vários receptores de membrana e de substâncias endógenas compondo um sistema endocanabinóide (SEC) relacionado também ao sistema nervoso.30,31 O reconhecimento da sua presença e importância e estudos prosseguem em constante evolução. 31,32
A sua função é essencialmente estabilizadora, equilibradora, moduladora e integradora dos vários sistemas orgânicos. Pode atuar com a estimulação ou a inibição de vias influenciando complementarmente. É ativada quando há sinais e sintomas clínicos decorrentes da falha da integração básica dos sistemas orgânicos que se evidenciam funcionalmente não capazes de suprir a demanda; encontram-se submetidos a uma requisição exacerbada e não acompanhada da apropriada compensação/recuperação e/ou com ruptura por natureza variada incluindo a degenerativa e/ou com deficiência essencial.33,34
O complexo de acoplamento ligantes-receptores do SEC promovem principalmente a ação reguladora inflamatória, hormonal e da liberação inadequada de uma série de neurotransmissores: gama-aminobutíricos (GABA), glutamatergico, serotoninérgico, noradrenérgico, acetilcolinérgico, dopaminérgico. Portanto, de maneira continuada, recorrente ou breve, influencia diversas funções orgânicas como os domínios da cognição, controle motor, adequação comportamental e emocional, limiar doloroso.31,32,33,34
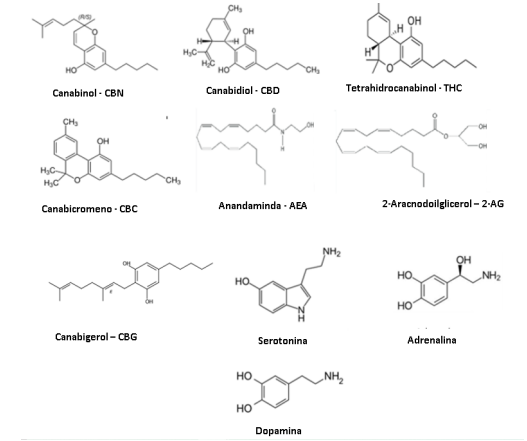
O SEC é composto por dois grupos: os ligantes endocanabinoides, denominados arachidonoylethanolamide (anadamida-AEA) e 2-aracnodoilglicerol (2-AG); os receptores específicos canabinoides CB1 e CB2 (específicos) e os receptores não canabinoides TRPV, 5HT, GPR e PPRỾ (inespecíficos).34,35,36,37
Os endocanabinoides anadamida-AEA e 2-aracnodoilglicerol (2-AG) referem-se a elementos químicos com base lipídica, agonistas dos receptores SEC. Deflagram a ação moduladora ativando a cascata de reações químicas consequentes do complexo ligante-receptor.31-37
São sintetizados somente quando necessários, atendendo a sinalizações moleculares, não permanecendo armazenados em compartimentos e, portanto, não são classificados como neurotransmissores. Apresentam pouca duração, ligação química de força variáveis aos receptores, específicos, parciais e alostéricos, sendo deslocados do espaço extracelular para o intracelular por transportadores canabinoides.30,31,32
Os agentes estimuladores na produção dos ligantes do SEC na realidade atuam elementos de insumo molecular endógeno desses agentes. São elementos, mutuamente, resultantes, de um processo inflamatório e/ou são liberados pela degradação celular secundariamente a ação de fatores de natureza lesional diversa tanto na etiologia como na extensão, intensidade e duração da agressão. São os sinalizadores atualmente considerados as prostaglandinas, leucina, tromboxano, histaminas devido a processos inflamatórios; ácidos graxos e fosfolípides, íons intracelulares liberados no processo ruptura celular e tecidual; alteração da concentração iônica e de radicais livre em interstício promovida por alterações no pH, temperatura corporal, concentração gasosa, hidratação.30,31,32,33
Os receptores específicos canabinoides apresentam-se distribuídos por todo o organismo, variando a concentração dos tipos de acordo com a especificidade funcional tecidual.(Figura 2)
Dependendo da concentração dos ligantes exercem ação agonista ou antagonista (acoplamento sem ativação) receptora devido a: 30,31,32,33
- decremento da transmissão dos impulsos neurais decorrente da elevação da concentração iônica intracelular, elevando o limiar de deflagração do potencial de ação;
- decremento da transmissão dos impulsos neurais decorrentes do bloqueio dos diferentes canais iônicos voltagem dependente. Agem como estabilizador de membrana, bloqueando a deflagração do potencial de ação por dificultar a alteração da concentração do influxo de cargas iônicas para o meio intracelular;
- elevar o influxo de cargas positiva intracelular por ativação dos canais de cálcio voltagem dependentes, prolongando o estado de repouso após um potencial de ação;
- ativação de enzimas que metabolizam mensageiros de ação excitatória;
- redução de enzimas que metabolizam mensageiros de ação inibitória.
Os receptores CB1 e CB2 são mais abundantes no cérebro, particularmente na substância negra, gânglios da base, sistema límbico, hipocampo e cerebelo. São também expressos no sistema nervoso periférico, fígado, tireoide, útero, ossos e tecido testicular.
Os receptores CB2 apresenta maior representação topográfica paralela ao sistema imunológico: acompanham as células de defesa, a imunidade humoral, baço e sistema gastrointestinal, células da glia no sistema nervoso.30,31,34
Os receptores canabinoides inespecíficos 5-HT (serotoninérgico) apresentam maior representação córtex pré-frontal, interneurônios GABAérgicos, hipocampo, amígdalas, gânglios da base, tálamo, sistema reticular ativador ascendente. Influenciam o humor, sono e estados de alerta, apetite, tônus muscular; o TRPV1 (receptor vaniloide de potencial transitório) apresentam maior representação nos ramos terminais de neurônios periféricos. São ativados por temperatura, pressão e elementos da inflamação. Presentes também na substância cinzenta periaquedutal do mesencéfalo, influenciando na transmissão da dor (nocicepção); o GPR (receptor alostérico ligado a proteína G) representam um relé entre o sistema imunitário, o sistema nervoso e o sistema endócrino. Estão distribuídos nas glândulas suprarrenais, no baço, no sistema digestivo (pâncreas), sistema ósseo e vastamente no sistema nervoso central: núcleo caudado, putâmen, hipocampo, tálamo, hipotálamo, córtex préfrontal, cerebelo. Dessa forma influencia as manifestações autonômicas como ritmo cardíaco, pressão arterial, controle motor automático e tônus, coordenação. Registram-se ação na homeostase glicêmica e controle da obesidade; 35,36 o receptor PPARɣ (receptor ativador peroxissoma gama) encontra-se intracelular. O peroxissoma faz parte da mitocôndria, influenciando o metabolismo celular e fatores de replicação gênica. Estudos tem demonstrado que é predominantemente expresso no tecido adiposo, e em tecidos insulinoresponsivos, tais como muscular esquelético e fígado. A ação agonistas do PPARγ influenciam o estoque e catabolismo de ácidos graxos livres37, resultando em modulação dos níveis glicêmicos mediados pela insulina e lipogênese.35,36,37
O complexo THC com os receptores, específicos e inespecíficos é, agonista na sua grande maioria. Modulam especialmente por ação inibitória os processos inflamatórios e das atividades celulares iônicas reverberantes e exacerbadas, modificando a dimensão da liberação de uma série de neurotransmissores: gama-aminobutíricos (GABA), glutamato, serotonina, noradrenalina, acetilcolina, dopamina. Dessa forma, de maneira continuada, recorrente ou breve, influencia diversas funções como a cognição, o controle motor, a adequação comportamental e emocional, o limiar doloroso.38
A integração do CBD com os receptores, específicos é, agonista na sua grande maioria e receptores, inespecíficos é agonista total e agonista parcial em doses maiores.
Como outros sistemas, desde que integro, o SEC se retroalimenta, tendo o seu desempenho com a estimulação modulada quando há a redução do gradiente do sinalizador-deflagrador e/ou quando ocorre a ativação da sua alça de inibitória por elevação da concentração dos componentes resultantes da degradação dos seus ligantes anandamida-AEA e 2-aracnodoilglicerol (2-AG).38,39
OS FITOCANABINOIDES são os de mais de 400 elementos químicos da Cannabis sp., sintetizados em concentrações variadas de ácidos lipídicos nas suas subespécies e segmentos diferentes da planta. Contudo, somente cerca de 60 desses fitocanabinoides configuram potencial para aplicação medicinal, especialmente quando aquecidos a diferentes temperaturas, passando por descarboxilação, transformando-se nos dois dos elementos principais aplicados medicinalmente. O primeiro composto isolado em forma pura da planta foi o canabinol em 1899. Contudo, o marco no prosseguimento de novas descobertas foi o registro inicial da ação do elemento CBD em humanos e ratos, realizada pelos cientistas Raphael Mechoulam e colaboradores em 1963 e o elemento de ação psicotrópica, tetrahidrocanabinol -THC em 1964.38,39,40,41
Tem destaque o delta-nove-tetra-hidrocanabinol (Δ9-THC), canabidiol (CBD), canabinol (CBN), canabicromeno (CBC) e o canabigerol (CBG). Curiosamente, CBD e THC apresentam idêntico peso e fórmula molecular (C21H30O2). Estruturalmente todas as moléculas reservam semelhanças entre si, aos endocanabinoides AEA e 2-AG e a alguns neurotransmissores (Figura 3), atuando portanto como complementos funcionais ao SEC e outros mensageiros endógenos.33,34 Não apresentam afinidade exclusiva aos receptores do SEC.
A aplicação clínica é complexa. Considerando a presença de um SEC íntegro, resultam em ação não linear, com efeitos finais em adição ou em contraposição quando aplicados isoladamente, associadamente ou dependendo da concentração aplicada. Esse intrigante comportamento farmacológico determina a dimensão do seu amplo espectro de atuação medicinal.38,39,40,41
Devido às suas propriedades lipofílicas, se acumula em alguns tecidos poucos vascularizados e de gordura corporal, e é capaz de atravessar a barreira hematoencefálica assim como a barreira placentária. Subsequentemente, ocorre metabolização, que ocorre principalmente na microssomal do fígado através de hidroxilação e oxidação catalizada por enzimas complexos de citocromo
P450.40,41 Finalmente, ácido THC é eliminado como metabolitos ácidos na urina (20-35%) e nas fezes (65-80%), 50% é excretada após 72 horas da administração e o restante pode demorar até semanas devido à acumulação nos tecidos adiposo.42,43,44,45
Também devido a sua lipofilia impõe grande influência na via de administração. A associação com substâncias gordurosas e solventes polar alcoólicos favorecem a absorção e o conteúdo líquido aquoso dificulta:41,42
– por via gástrica ocorre em 20-30% devido a intensos efeitos do metabolismo de primeira passagem. As concentrações plasmáticas máximas são alcançadas rapidamente (60 a 90 minutos). A duração dos efeitos oscila entre 6-8 horas;
- por via mucosa oral a absorção evita o metabolismo do primeiro turno, ocorre em 10 a 40% e a concentração plasmática máxima é alcançada entre 40 a 60 minutos. A duração dos efeitos oscila entre 6-8 horas;
- a administração transdérmica também evita o metabolismo do primeiro turno mas a biodisponibilidade sistêmica é muito variável devido ao teor hídrico tecidual;
- a administração dérmica é de ação tópica, não se considera a absorção sistêmica;
- por via inalatória ocorre em 20-65% e evita-se o metabolismo de primeira passagem. As concentrações plasmáticas máximas são alcançadas rapidamente (3-10 minutos). A duração dos efeitos oscila entre 2-4 horas;
- outras rotas de aplicação tópica ainda necessitam mais estudos: vias retal e oftalmológica.
Havendo a absorção a distribuição é imediata para órgãos bem vascularizados (pulmão, coração, cérebro, fígado). Por via inalatória a distribuição se equipara à administração por via endovenosa. É afetada pela idade, tamanho e composição adiposa corporal, sendo acumulada com o uso crônico. Atravessa a placenta e é excretado no leite materno humano.41,43,45
O metabolismo é predominantemente hepático enzimático, via citocromo P450 (CYP 450) incluindo os tecidos extra-hepáticos que expressam CYP450: intestino delgado e o cérebro. Existe um potencial mútuo de influência farmacocinética entre THC e CBD mas também com outros sais, pela inibição e/ou indução de enzimas e transportadores.46
Caracerísticas gerais dos canabinoides:46,47
- são metabolizados por CYPs 2C9, 2C19, 3A4 1A2, e P2D6. Fármacos em uso associado e que exerçam a inibição ou indução dessas enzimas podem alterar a concentração sérica dos canabinoides;
- o CBD é um potente inibidor da enzima CYP2C19. Os fármacos e outras substâncias em associação e que apresentem a metabolização por essa enzima podem ter a elevação da concentração sérica pelo canabinoide;
- CBD e THC são indutores da CYP1A2. Os fármacos e outras substâncias em associação e que apresentem a metabolização por essa enzima podem ter a redução da concentração sérica pelo canabinoide;
- ainda em definição o potencial de atividade farmacológica dos seus metabólitos. Estudos sugerem a capacidade de prolongar os efeitos do complexo ligante-receptor;
- a meia vida por via oral varia entre 1 a 5 dias em administração crônica e de 1,97 horas após administração oral única;
- a excreção é predominantemente renal.
A dose letal não é conhecida. Não há relatos de morte pelos fitoelementos. Não houve a identificação de receptores endocanabinoides no centro respiratório do tronco cerebral.43,44,45
A aplicação clínica segue uma peculiar complexidade. Em diferentes doses promovem diferentes ações e quando aplicado em associação (efeito comitiva ou entourage),nas diferentes proporções, refletem distintos efeitos clínicos, somatórios, equalizatórios ou opositores. O registro dos efeitos também são influenciados pela integridade ou não do SEC, dos fatores que modificam o tempo de absorção, das características individuais de metabolização e da escolha da via de administração. Ainda, a idade, o índice adiposo corporal, outros medicamentos em uso e doenças associadas. Sujeitos às mesmas variáveis, os efeitos não desejados também podem ser registrados. 46,47,48
O uso crônico não aponta para um risco de adição ou ao abuso e tolerância. Opostamente ao observado nos endocanabinoides, as altas concentrações podem levar à dessensibilização/internalização de receptores CB1, resultando em resposta clínica menos efetiva.43-46
O complexo CBD-receptor: a aplicação segura não tem efeito tóxico e por não alcançar a dose letal, não há a determinação da dose máxima. O CBD é, na sua grande maioria, agonista parcial dos receptores específicos, ativandoos e deflagrando a ação inibitória. Sobre os receptores inespecíficos é agonista em doses baixas, podendo exercer ação ansiogênica. É agonista inverso/antagonista em doses elevadas (dose superior a 40 mg). Outro mecanismo consta da inibição da enzima que degrada AEA, permitindo maior disponibilidade em tempo e concentração desse endocanabinoide.
O complexo THC-receptor: ação agonista nos receptores endocanabinoides específicos e não específicos, com grande afinidade aos receptores relacionados com o sistema nervoso central. Nas doses baixas (inferior a 7 mg) exercem efeitos ansiolíticos; nas doses intermediárias (entre 7 e 18 mg) exercem efeitos analgésico, antieméticos e de modulação motora (movimentos involuntários anormais e hipertonia).
O complexo CBD/THC-receptor: quando aplicados isoladamente, a ordem temporal da administração dos elementos CBD e THC interfere na resultante: a oferta do CBD antecedendo o THC exerce ação potencializadora do primeiro elemento; administrados simultaneamente e em proporções semelhantes ocorre ação integradora dos comportamentos individuais, potencializadora CBD e atenuadora dos efeitos adversos do THC.
O complexo CBN-receptor e CBG-receptor, apresentam perfis de ação semelhantes ao THC, somam efeito de maneira mais tênue, sem a ação psicoativa
O elemento CBC-receptor, de modo ainda mais fisiológico, tem a contribuição elevando a concentração dos endocanabinoides.
NA DOR NEUROPÁTICA os efeitos da Cannabis sativa começaram a ganhar legitimidade quando isoladamente os seus compostos, o seu mecanismo de ação e seus receptores foram estudados. O primeiro dos compostos a ser isolado foi o canabinol em 1895, seguido do canabidiol em 1934, e por fim o THC em 1964. Em 1983 a Nabilona (análogo do THC sintético) foi comercializada e liberada para prescrições no Reino Unido, e é desde 1985 que cápsulas de THC sintético (Dronabinol) foram disponibilizadas ao uso médico restrito em EUA. 49
Ao longo dos anos muitos estudos vêm sido feitos baseados nessas descobertas com o objetivo de os aperfeiçoar e reconhecer os seus benefícios. Provou-se, então, que o CB 1 e o CB 2 desempenham um papel importante na nocicepção periférica, espinhal e supra-espinhal, e os canabinoides são analgésicos eficazes e representam um benefício na dor neuropática.48,49
Especialmente nesse distúrbio, com resposta terapêutica a opiodes não superior a 50% dos pacientes, apresenta os agonistas dos receptores canabinoides como uma nova opção no tratamento, baseado em algumas hipóteses, tal como na presença de receptores canabinoides nas fibra Aδ, nas fibras amielinizadas C aferente e região periaquedutal mesencefálica, local que exerce um papel na modulação descendente da dor e no comportamento defensivo.49,50,51,52,53.
COMENTÁRIOS FINAIS
Considerando que a dor crônica é uma ocorrência de grande influência na qualidade de vida, com potencial de repercutir de modo limitador, frequentemente incapacitante, em uma série de desempenhos físicos. Sobreposto à necessidade do uso contínuo de medicamento, pode amplificar o desequilíbrio na homeostase multissistêmica.
Considerando o caso acima, o distúrbio do sono, não primário, foi decorrente de uma manifestação, inicialmente disestésica de intensidade e comprometimento crescentes, passando a associar um distúrbio parestésico, também de piora progressiva e comprometedora, não associada a fator causal anatômico identificado. Contudo, seguindo as descrições em literatura, foram considerados como potenciais fatores: o criptogênico, a alteração hormonal fisiológica relativa a idade e os movimentos repetitivos dos membros superiores para alavancar e direcionar os movimentos através das pás de esqui na neve, seu esporte preferido e habitual. Apresentando um bom delineamento da musculatura cervical e torácica, o diagnóstico anatômico e etiológico foi inferido como o encarceramento das fibras nervosas terminais pelos músculos regionais.
No decorrer dos anos a paciente foi submetida aos tratamentos preconizados tópicos e sistêmicos, aplicados nas diferentes doses, combinações e fases, direcionados ao sono e à queixa sensitiva. Não houve a repercussão em significativo alívio sintomático. Houve a melhora, mas não a resolução, da latência do sono e da frequência e duração dos despertares noturnos. Contudo, os tratamentos medicamentosos foram interrompidos, por agravarem a sonolência diurna e não tolerância a outros efeitos colaterais (epigastralgia, tontura, alteração no humor). Os tratamentos complementares não farmacológicos como a eletroestimulação, ultrassom e acupuntura também foram ausentes do impacto positivo.
Tendo em vista a preservação e piora sintomática, foi iniciada a terapia com o canabidiol, componente isolado, na dosagem inicial de 5 mg/dia. As titulações ocorreram semanalmente, com acréscimos de 5 mg na dose anterior, tendo atingido o sucesso terapêutico na dose de 30 mg/dia divididas em duas tomadas. Não houve o relato de efeitos indesejados tendo observado também melhora do humor e do desempenho laborativo, possivelmente pela melhora do conjunto de fatores: sono reparador pela resolução do desconforto parestésico também de ocorrência diurna.
Os fitocanabinoides, sendo elementos quimicamente semelhantes aos endocanabinoides, são capazes de atuar de modo mais fisiológico, através da elevação da concentração dos elementos endógenos (AEA) aliado ao comportamento semelhante a esses ligantes aos receptores do SEC, recentemente descoberto.
De modo importante os estudos para várias doenças prosseguem em crescente e continuada evolução. Evidenciando que a terapia com os elementos derivados da Cannabis sp representam mais uma opção no armamento terapêutico, têm revelado serem interessantes e de influência significativa na variedade de ações na homeostase, modulando e integrando com outros sistemas orgânicos, especialmente nos domínios relacionados aos distúrbios comportamental, álgico, motor e imunológico.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Barros, G.A.M., Colhado, O.C.., Giublin, M.L. – Clinical presentation and diagnosis of neuropathic pain. Quadro clínico e diagnóstico da dor neuropática. ARTIGO DE REVISÃO – Rev Dor., 2016;17(S1):S15-9 Rev Dor. São Paulo, 2016;17(Suppl 1):S15-9.
2. Baron, R. Mechanisms of Disease: neuropathic pain—a clinical perspective.Nature Clinical Practice Neurology, 2006; 2(2):95-106, 2006. http://www.nature.com/nrneurol/journal/v2/n2/full/ncpneuro0113.html
3. Keller, A.F., Beggs,S.M., Salter, M.W., Konik, Y. – Transformation of the output of spinal lamina I neurons after nerve injury and microglia stimulation underlying neuropathic pain. Molecular Pain, 2007; 3: 27:1-11
4. Scholz, J et al., Blocking Caspase Activity Prevents Transsynaptic Neuronal Apoptosis and the Loss of Inhibition in Lamina II of the Dorsal Horn after Peripheral Nerve Injury. Journal of Neuroscience, 2005;25,(32):7317- 7323. Disponível em:< http://www.jneurosci.org/content/25/32/7317.long
5. Kraychet, D.C., Gozzani, J.L., , Kraychet,A.C. – Dor Neuropática – Aspectos Neuroquímicos – Neuropathic Pain – Neurochemical Aspects. Artigos de Revisão • Rev. Bras. Anestesiol., 2008; 58 (5):492-505. – https://doi.org/10.1590/S0034-70942008000500008
6. Schestatsky, P.- Definição, diagnostic e tratamento da dor neuropática. Ver HCPA., 2008; 28 (3):177-87.
7. Ribeiro, S.; Schmidt, A.P.; Schmidt, S.R.G. – O uso de opioides no tratamento da dor crônica não oncológica: o papel da metadona. Rev Bras Anestesio, 2002; 52(5): 644-651. http://www.scielo.br/pdf/%0D/rba/v52n5/v52n5a15.pdf
8. Schestatsky, P. et al. – Promising treatments for neuropathic pain. Arq.Neuro-Psiquiatr., 2014;11(72):881-888 – http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0004-282X2014001100881&lng=en&nrm=iso
9. Oliveira, A.S.; Torres H. – O papel dos bloqueios anestésicos no tratamento da dor de origem cancerosa. Rev Bras Anestesiol., 2003;53 (5): 664-662. – http://www.scielo.br/pdf/%0D/rba/v53n5/v53n5a13.pdf
10. Oliveira Júnior, J.O., Corrêa, C.F., Ferreira, J.A. -Invasive treatment to control neuropathic pain Tratamento invasivo para o controle da dor neuropática Artigo de revisão – Rev Dor,2016;17(Suppl 1):S98-10.
11. Mülkoğlu, C; Nacır, B. – Notalgia paresthetica: clinical features, radiological evaluation, and a novel therapeutic option. BMC Neurol, 2020; 20 (1):1 -8.
12. Ellis C. Notalgia paresthetica: the unreachable itch. Dermatology practical & conceptual, 2013; 3(1). Doi 10.5826/dpc.0301a02.
13. Howard M, Sahhar L, Andrews F, Bergman R, Gin D. Notalgia paresthetica: a review for dermatologists. Intern J Dermatol, 2017;57(4), 388-392. Doi 10.1111/ijd.13853.
14. Situm, M., KoliC, M., Franceschi, N., Pećina, M.. – Notalgia paresthetica. Acta Clin Croat, 2018; 57:721-725.
15. Şenel, E., Holt, S., Sabancılar, E., Sabancılar,Z., Şenel, S.D. – The etiology of notalgia paresthetica: a descriptive study of 117 patients. Irish Journal of Medical Science, 2020; 189:1311–1316. https://doi.org/10.1007/s11845-019-02133-1
16. Springall, D.R., Kranth, S.S., Kirkham,N., Darley, C.R., Polak, J.M. – Symptoms of notalgia paresthetica may be explained by increased dermal innervation. J Invest Dermatol, 1991; 97: 555-56.
17. Satoh, T., Yokozeki, H.; Murota, H,, Tokura, Y., Kabashima, K., Takamori, K., Shiohara, T., Morita, E., Aiba, S., Aoyama, Y., Hashimoto, T., Katayama, I. – 2020 guidelines for the diagnosis and treatment of cutaneous pruritus. J Dermatol, 2021; 48 (9):e399-413.
18. Layton AM, Cotterill JA. Notalgia paraesthetica–report of three cases and their treatment. Clin Exp Dermatol. 1991; 16(3):197-8. Doi 10.1111/j.1365-2230.1991.tb00345.x
19. Tuerk, M.J., Koo, B.J. – A practical review and update on the management of pruritus sine matéria. Cutis, 2008;82:187-194.
20. Savk E, Bolukbasi O, Akyol A, Karaman G. Open pilot study on oxcarbazepine for the treatment of notalgia paresthetica. J Am Acad Dermatol. 2001;45(4):630-2. Doi 10.1067/mjd.2001.116228.
21. Ansari,A., Weinstein,D., Sami, N. – Review article. Notalgia paresthetica: treatment review and algorithmic approach. J. derm treat,2020; 31(4): 424–432 https://doi.org/10.1080/09546634.2019.1603360.
22. Yeo B; Tey H.L. – Effective treatment of notalgia paresthetica with amitriptyline – Dermatol Ther, 2020; 33 (4):505-6.
23. Fleischer, A.B., Meade, T.J.- Notalgia Paresthetica: Successful Treatment with Exercises. Acta Derm Venereol, 2011; 91 (3):356-7.
24. Krajewski, P; Szepietowski, J.C. – Notalgia paresthetica treated with low dose of gabapentin: Case report and literature review. Dermatol Ther, 2020; 33 (2):1-3.
25. Martina, E., Diotallevi, F., Radi, G., Campanati, A., Offidani, A. – Review Therapeutic use of botulinum neurotoxins in dermatology: Systematic Review. Toxins, 2021; 13 (2):1-34.
26. Özcan,D., Seçkin, D., Kibaroglu, S., Bernhard, J.D. – Intralesional triamcinolone acetonide in notalgia paresthetica: Treatment outcomes in five patients. Dermatol Ther, 2020; 33 (4): 424-32.
27. Weinfeld, P.K. – Successful treatment of notalgia paresthetica with botulinum toxin type A – Archives of dermatology, 2007; 146 (11):980-4.
28. Mülkoğlu, C; Nacır, B. – Notalgia paresthetica: clinical features, radiological evaluation, and a novel therapeutic option. BMC Neurol, 2020; 20 (1):1 -8.
29. Teixeira, D. A -Principais conceitos da fisiologia humana: introdução, conceito de homeostasia, fisiologia celular, transporte celular, transporte passivo e transporte ativo. In: Fisiologia humana, Capítulo I: 7-13. SBN: 978-65-992205-4-8, 2021.
30. Pertwee, R.G.- Review – The pharmacology of cannabinoid receptors and their ligands: an overview. International Journal of Obesity , 2006; 30:S13–S18. doi:10.1038/sj.ijo.0803272
31. Crocq, Marc-Antoine – History of cannabis and the endocannabinoid system. Dialogues in clinical neuroscience, 2020; Vol 22 (3):223-28.
32. Suero- Garcia, C., Martins-Banderas, L., Holgado, M.A. – Efecto neuroprotector de los cannabinoides en las enfermidades neurodegenerativas. Ars Pharm, 2015; 56 (2): 77-87 http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S23409894201500 0200002&lang=p
33. Pertwee, R.G. -The diverse CB1 and CB2 receptor pharmacology of three plant cannabinoids: Δ9-tetrahydrocannabinol, cannabidiol and Δ9- tetrahydrocannabivarin. Br J Pharmacol, 2008; 153 (2):199-215. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2219532
34. Honório, K.M. – Aspectos terapêuticos de compostos da planta Cannabis sativa, – Quim. Nova,2006; 29(2): 318-325.
35. Tavares, V., Hirata, M.H., Hirata, R.D.C. – Receptor Ativado por Proliferadores de Peroxissoma Gama (PPARγ): Estudo Molecular na Homeostase da Glicose, Metabolismo de Lipídeos e Abordagem Terapêutica. – Arq Bras Endocrinol Metab 2007;51 (4): 526-533.
36. Shi, Q., Yang, L., Shi, W., Wang,L., Zhou, S., Guan, S., Zhao,M., Yang, Q. The novel cannabinoid receptor GPR55 mediates anxiolytic-like effects in the medial orbital cortex of mice with acute stress. – Molecular Brain, 2017; 10:1-12.
37. Valléé, A., Lecarpentier,Y., Guillevin,R., Vallée, J-N. – Review. Effects of cannabidiol interactions with Wnt/β-catenin pathway and PPARγ on oxidative stress and neuroinflammation in Alzheimer’s disease – Acta Biochim Biophys Sin, 2017, 49(10), 853–866. doi: 10.1093/abbs/gmx07
38. McGilveray. I.J.- Pharmacokinetics of cannabinoids – Review. Pain Res Manage, 2005; 10 (A):15A-22 A.
39. Atakan, Z. Review – Cannabis, a complex plant: different compounds and different effects on individuals. Ther Adv Psychopharmacol., 2012: 2(6) 241– 254 DOI: 10.1177/ 2045125312457586
40.Millar, S. A., Stone, N.L., Yates , A. S., O’Sullivan, S.E. – A systematic review on the pharmacokinetics of cannabidiol in humans – Frontiers in pharmacology, 2018; 9:1-13.
41. Lucas, C.J., Galettis, P., Schneider, J. – Review- Themed Issue – The pharmacokinetics and the pharmacodynamics of cannabinoids. Br J Clin Pharmacol, 2018; 84: 2477–2482
42. Zuurman,L., Ippel, A. E., Moin, E., van Gerven, J. M. A – Biomarkers for the effects of cannabis and THC in healthy volunteers. – J Clin Pharmacol, 2008; 67 (1): 5–21
43. Bergamaschi, M.M., Queiroz, R.H.Q., Crippa, J.A.S., Zuardi, A.W. – Safety and side effects of cannabidiol, a cannabis sativa constituent. Current Drug Safety, 2011; 6 (4): 1-13
44. Gonçalves, J. – Review . Cannabis and its secondary metabolites: their use as therapeutic drugs, toxicological aspects, and analytical determination. – Medicines, 2019; 6 (31):2 -47. doi:10.3390
45. Casadiego-Mesa, A.F.,Lastra-Bello,S.M. – Cannabis sintético: aspectos toxicológicos, usos clínicos y droga de diseño. rev.fac.med.,2015;63
(3):501-510. http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-00112015000300018&lang=pt
46. Brown, J.D., Winterstein, A.G. – Review -Potential adverse drug Events and drug–drug Interactions with medical and consumer cannabidiol (CBD) Use. -J. Clin. Med., 2019; 8: 989-1003. doi:10.3390/jcm8070989
47. Ionova, Y., Ashenhurst, J., Zhan, J., Nhan, H., Kosinski, C., Tamraz, B., Chubb, A.- CYP2C19 Allele Frequencies in Over 2.2 Million DirecttoConsumer Genetics Research Participants and the Potential Implication for Prescriptions in a Large Health System – Clin Transl Sci, 2020; 13: 1298–1306.
48. Costa, J. Efeitos terapêuticos da Cannabis sativa no sistema nervoso central. 2012. (Disciplina Neurofisiologia do Curso de Fisioterapia do Centro de Ciências Biológicas e da Saúde) – Universidade da Amazônia, Belém, 2012. http://docslide.com.br/documents/Cannabissativa–no–tratamento–de– dorneuropatica.
49. Manzanares, J; Julian, M.D., Carrascosa, A. – Role of the Cannabinoid System in Pain Control and Therapeutic Implications for the Management of Acute and Chronic Pain Episodes. Curr Neuropharmacol., 2006; 4(3): 239- 257.
50. Robson, P. – Therapeutic aspects of Cannabis and cannabinoids. The British Journal of Psychiatry, 2017;178 (2):107-115. http://bjp.rcpsych.org/content/178/2/107.
51.Morin, C.B., Raef, H.S., Elmariah, S.B. – Neuropathic itch treated with oral cannabinoids: A case series. JAAD Case Reports, 2021;17:38-42.
52. Tóth B.I., Bíró, T.B. – TRP Channels and Pruritus. The Open Pain Journal, 2013, 6(S18):62-80.
53. Carranza,R.R.Los productos de Cannabis sativa: situación actual y perspectivas en medicina. Salud Ment, 2012;35 (3):247-256. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0185-33252012000300009&lng=es&nrm=isso
Figura 1 – Paciente PB. Hiperpigmentação peri-escapilar esquerda e para mediana bilteral mais predominando a esquerda, correspondendo à área do desconforto.
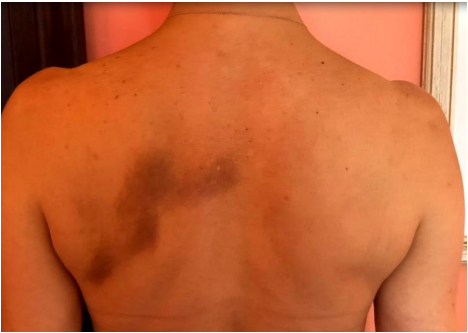
Figura 2 – Representação os sistema endocanabinoide e seus receptores, específicos ( CB1 e CB2) e inespecíficos (TRPV e GPR). O receptor PPRƔ é microssomal.
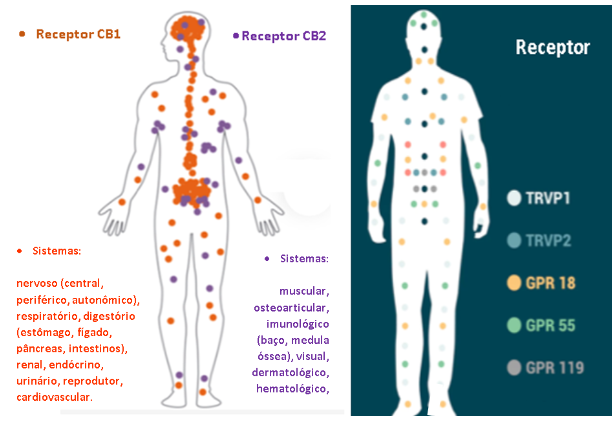
Figura 3 – Semelhança das estruturas moleculares entre endocanabinoides, fitocanabinoides e alguns neurotransmissores.
LISTA DE SIGLAS
α1 – receptor alfa adrenérgico 1
α2 – receptor alfa adrenérgico 2
AEA – endocanabinoide araquinodoiletanol amida (anandamida)
AINH – antiinflamatório não hormonal
CB1 – receptor canabinoide 1
CB2 – receptor canabinoide 2
CBD – fitocanabinoide canabidiol
CBN- fitocanabinoide canabinol
CBG- fitocanabinoide canabigerol
CBC – fitocanabinoide canabicromeno
CGRP – receptor proliferador o gene da calcitonina
CSDR – complexo da síndrome da dor regional
GABA – ácido gama amino butírico
IPSCs (células-tronco pluripotentes induzidas
NP – notalgia parestésica
PPR Ɣ – receptor ativador por proliferador de peroxissoma gama
SEC – sistema endocanabinoide
SNC – sistema nervoso central
SNP – sistema nervoso periférico
THC – fitocanabinoide tetrahidrocanabinol
TRPV – receptor transitório vaniloide
2AG – endocanabinoide araquinodoil etanol amida
