REGISTRO DOI: 10.5281/zenodo.10150774
Eliesio Ramos Chagas¹
José Marcio de Souza¹
Marcelo Gomes de Almeida¹
Silas Nascimento Ronchi²
RESUMO
A validação no processo de sanitização é crucial para garantir a eficácia da limpeza dos equipamentos, tais como reatores e envasadoras, empregados na produção. Este estudo propõe validar um método para garantir a sanitização dos equipamentos utilizados na produção de cosméticos capilares numa indústria de cosméticos localizada no município de Vila Velha/ES. Essa necessidade surgiu devido à ampla variedade de produtos na indústria cosmética em questão. Essa necessidade também foi levantada pelos órgãos de vigilância sanitária de forma a garantir que não houvesse contaminação cruzada em seu ambiente. A metodologia escolhida foi a de “pior caso”, sendo que este processo de validação foi executado entre agosto de 2021 e janeiro de 2022. Foi realizado um plano de amostragem com objetivo de garantir o tempo de 72 horas para sanitização satisfatória dos equipamentos conforme estabelecido no protocolo para validação de sanitização de equipamentos. Durante este período, foram realizadas análises de swabs de áreas críticas e o produto escolhido como “pior caso” foi uma máscara matizadora. Estas análises estavam em alinhamento com os procedimentos de limpeza de equipamentos, utensílios de produção e sistema de água. Os critérios para aprovação foram parâmetros microbiológicos realizados em uma empresa terceirizada. A aplicabilidade deste processo resultou em ações conclusivas para o processo fabril, atestando a eficiência e segurança do método utilizado. Essa validação é importante pois confirma que os processos de limpeza das áreas críticas se mantiveram dentro de padrões aceitáveis, mesmo quando analisando o produto e os pontos mais críticos do processo.
PALAVRASCHAVE: validação, limpeza, sanitização, indústria cosmética, pior caso
1. INTRODUÇÃO
A indústria de cosméticos desempenha um papel crucial na economia global, com milhões de produtos sendo fabricados, distribuídos e utilizados diariamente. Com isso, a importância de trabalhar em grandes volumes, existe o risco inerente de contaminação (REYGAERT E REYNHOUT, 2020). No âmbito da indústria cosmética, a segurança, qualidade e eficácia dos produtos são de suma importância, sendo críticas para a confiança do consumidor e a reputação da marca (PINTO et al. 2015). A complexidade das formulações, aliada à demanda contínua por inovações, torna imperativo que os equipamentos utilizados na produção estejam não apenas em conformidade com os padrões, mas também sejam limpos e higienizados (FDA, 2011).
A contaminação microbiológica na indústria de cosméticos é um desafio cada vez mais preocupante, uma vez que compromete a qualidade dos produtos e representa um risco à saúde dos consumidores. Diversos fatores podem contribuir para a presença de microrganismos em cosméticos, tais como matérias-primas contaminadas e processos de fabricação inadequados (ANVISA, 2017)
A necessidade de protocolos robustos e abrangentes para a validação do processo de limpeza tanto de áreas comuns como de equipamentos é amplamente reconhecida. Os desafios encontrados em assegurar a adequação desses processos são críticos e envolvem uma combinação de conhecimento técnico, práticas recomendadas e adesão aos padrões necessários a cada indústria (LAURO D’MORETTO, 2016). Os agentes de limpeza, como o Álcool 70%, têm sido amplamente reconhecidos por sua eficácia para validação dos métodos de sanitização em indústrias cosméticas e farmacêuticas (ANDRADE, 2012), no entanto, sua seleção e aplicação exigem certificação de forma a garantir que sejam apropriados aos microrganismos específicos da área estudada e as superfícies a serem tratadas.
Assim, esse estudo tem como objetivo abordar um método de validação da sanitização de equipamentos na indústria cosmética, buscando aprimorar a eficácia da limpeza, se adaptar as necessidades da planta fabril com os diferentes tipos de produtos e atender as possíveis adequações solicitadas pelos órgãos fiscalizadores afim de reduzir o risco de contaminação cruzada e garantir a qualidade das mercadorias produzidos (ANVISA, 2019).
2. REFERENCIAL TEÓRICO
A importância em validação da limpeza em equipamentos cosméticos não é apenas uma exigência regulatória, mas um imperativo ético e de segurança. Ela se tornou um pilar central na garantia da qualidade dos produtos cosméticos. Com a globalização da cadeia de fornecimento e o aumento da complexidade dos processos de fabricação, a integridade do produto e a segurança do consumidor nunca foram tão dependentes de protocolos de limpeza (ANVISA, 2019). As diretrizes regulatórias têm evoluído para refletir essa realidade. Por exemplo, entidades reguladoras estaduais, têm enfatizado a necessidade de uma abordagem baseada em risco para a validação da limpeza, que vai além do simples cumprimento e busca uma compreensão profunda e científica da produção e dos processos de limpeza.
A tecnologia também tem desempenhado um papel crucial nessa evolução. De acordo com SHERMAN (2015), avanços na análise de resíduos, como a cromatografia líquida entre outros métodos da espectrometria, estão redefinindo o que é possível em termos de detecção e quantificação de impurezas, permitindo que as empresas de cosméticos atinjam níveis sem precedentes de sanitização e segurança.
Contudo, apesar desses avanços, a validação da sanitização continua a ser um desafio devido à produção de cosméticos biológicos e personalizados em instalações de uso múltiplo, que apresentam riscos únicos e exigem estratégias de validação de limpeza adaptadas à realidade de cada produto. (RAMIRES; NOBREGA, 2014)
2.1. IMPORTANCIA DA VALIDAÇÃO DE LIMPEZA EM AMBIENTES NA INDUSTRIA COSMETICA:
O processo de validação ou método de validação de sanitização de equipamentos não é obrigatório, contudo, sem ela, surge um ambiente crítico, onde existe uma ampla variedade de produção, possibilitando maior risco de contaminação cruzada e microbiológica. Neste contexto há a necessidade de validação de limpeza dos equipamentos, atendendo não só as áreas críticas suscetíveis a contaminação microbiológica, mas também exigência regulatória imposta por órgãos regulatórios.
A validação de limpeza na indústria cosmética é uma etapa fundamental para garantir a qualidade e segurança dos produtos, enquanto em muitas indústrias a validação pode ser vista primordialmente como uma medida proativa, na indústria cosmética, especialmente em empresas que produzem uma variedade ampla de produtos em uma única planta FABRIL, essa validação torna-se crucial devido aos riscos associados de contaminação cruzada (LAURO D’MORETTO, 2016).
Os fabricantes, neste contexto, têm a responsabilidade não apenas ética, mas também regulatória, de demonstrar de maneira transparente e reproduzível que seus processos de limpeza são eficazes em eliminar resíduos a níveis aceitáveis e seguros (SOUZA et al. 2022). Dada a complexidade associada à produção de múltiplos produtos em um único local, os órgãos de vigilância, particularmente em âmbitos estaduais, podem estipular métodos de validação críticos para garantir a integridade do processo (ANVISA, 2013).
Assim, a validação de limpeza não é apenas uma formalidade, mas um imperativo para garantir que cada produto esteja livre de contaminações oriundas de processos anteriores, assegurando sua qualidade e segurança (WHO, 2020).
O processo de validação envolve várias etapas, é essencial definir os critérios de aceitação. Isso envolve a identificação de todos os resíduos potenciais de contaminação e determinação de limites seguros para sua presença. Os métodos analíticos são frequentemente usados para detectar e quantificar resíduos, garantindo que os níveis estejam dentro dos limites aceitáveis (SHERMAN, 2015).
A importância da validação de limpeza em ambientes que lidam com produtos cosméticos é enfatizada por sua direta influência na qualidade do produto final. Neste sentido a validação e seus protocolos de limpeza devem ser estabelecidos, abrangendo não apenas equipamentos, mas também espaços de trabalho e quaisquer superfícies que possam estar em contato direto com os produtos. Esses protocolos implicam procedimentos de higienização, podendo serem realizados de diversas formas (ANVISA, 2019). A eficácia desses métodos, no entanto, não depende apenas de sua execução correta, mas também da constante verificação de sua eficiência e da requalificação regular dos funcionários responsáveis, garantindo assim que os padrões de limpeza e sanitização sejam mantidos em níveis ótimos (ANVISA, 2019).
A evolução no mundo dos produtos cosméticos demanda uma validação crítica e atualizada. Alinhado a esta perspectiva, observa-se que o cenário regulatório, como destacado por (SHABIR, 2010), está em constante mudança, com autoridades estabelecendo padrões cada vez mais exigentes para as indústrias cosméticas. Com isso, é imperativo que essas empresas permaneçam ágeis, atualizando seus protocolos de validação de limpeza para atender a estas novas diretrizes.
Atestar conformidade com as legislações atuais não apenas cumpre com as regulamentações, apontam, também impulsiona a melhoria contínua, levando à produção de cosméticos mais seguros e eficazes para os clientes. A dedicação da indústria cosmética à excelência e responsabilidade social é evidenciada pelo compromisso com uma validação de limpeza crítica, uma visão compartilhada (LAURO D’MORETTO, 2016).
2.2. METODOS E TECNOLOGIAS UTILIZADOS NA VALIDAÇÃO DA LIMPEZA:
A validação da limpeza em instalações da indústria de cosmético é um processo que requer o emprego de métodos específicos para assegurar que todos os equipamentos, superfícies e ambientes de produção estejam livres de contaminantes, resíduos de produtos que anteriormente foi processado nos equipamentos e quaisquer outras substâncias que interferir a qualidade do produto final ou a segurança do cliente (SHABIR, 2010).
Um dos métodos primários utilizados é a amostragem por swab, que envolve a utilização de swabs estéreis para coletar amostras de superfícies internas e externas dos equipamentos de produção com o objetivo de analisar os resultados microbiológicos destes testes. Esta técnica é altamente eficaz para obter amostras diretas de resíduos ou contaminantes e é frequentemente utilizada em conjunto com métodos analíticos, como a cromatografia líquida de alta performance (HPLC), para analisar as amostras recolhidas e identificar quaisquer contaminantes presentes (RAMIRES; NOBREGA, 2014)
Outro método comum é a amostragem por raspagem, que, embora semelhante AO MÉTODO ANTERIOR, é geralmente reservada para situações onde os contaminantes são mais difíceis de coletar e podem estar aderidos às superfícies dos equipamentos. A amostragem por raspagem é mais agressiva ao equipamento de produção, pode ser mais eficaz na recolha de resíduos incrustados, mas quando não executada dentro dos padrões danifica os equipamentos (HEALTH SCIENCES AUTHORITY, 2008).
A amostragem rinse, onde uma solução (geralmente água ou um solvente apropriado) é usada para enxaguar uma superfície ou equipamento, também é amplamente empregada. A solução de enxágue é então coletada e analisada para a presença de contaminantes. Este método é particularmente útil em situações onde a amostragem por swab ou raspagem é tecnicamente impraticável, como em equipamentos intrincados ou de difícil acesso (HEALTH SCIENCES AUTHORITY, 2008).
Em termos de tecnologia, várias formas de análises espectroscópicas e cromatográficas são utilizadas para a detecção e identificação de contaminantes nas amostras coletadas. Por exemplo, a espectroscopia de infravermelho (IR) e a espectroscopia de massa (MS) podem ser utilizadas para identificar compostos específicos, enquanto técnicas como a cromatografia líquida (LC) e a cromatografia gasosa (GC) são empregadas para separar, identificar e quantificar os resíduos de produtos químicos ou fármacos (SHABIR, 2010).
As tecnologias de visualização, incluindo microscopia eletrônica de varredura (SEM) e microscopia de força atômica (AFM), também são ocasionalmente aplicadas para examinar as superfícies em escalas microscópicas e nanoscópicas, permitindo uma análise detalhada da eficácia dos procedimentos de limpeza (FERREIRA E YAMANAKA, 2006).
No entanto, apesar da eficácia desses métodos e tecnologias, é crucial que eles sejam complementados por protocolos robustos de validação de limpeza. Isso inclui a definição de critérios aceitáveis de limpeza, a realização de testes de validação periódicos e a documentação meticulosa de todos os procedimentos e resultados de validação. Tais medidas não só asseguram a conformidade com as regulamentações governamentais, mas também reforçam a confiança no quesito segurança ao tempo que atestam a qualidade dos produtos cosméticos produzidos (ANVISA, 2019).
2.3. IMPORTANCIA E IMPACTOS DA NÃO CONFORMIDADE NA VALIDAÇAO DE LIMPEZA:
A aderência estrita aos protocolos de validação de limpeza não é apenas uma exigência regulatória, mas também uma necessidade comercial e ética para as empresas cosméticas. A falha em manter padrões de limpeza pode ter várias repercussões negativas, que vão desde a contaminação do produto e recalls custosos até danos à saúde do cliente e possíveis ações judiciais (SHABIR, 2010).
A contaminação cruzada está entre uma das preocupações na produção de cosméticos, onde os resíduos de um produto fabricado anteriormente podem afetar a qualidade e a segurança de outro produto subsequente. Isso é particularmente crítico quando os produtos envolvem substâncias altamente reativas no produto final, onde mesmo traços minúsculos podem ter efeitos significativos. A contaminação pode resultar em produtos ineficazes ou, pior, em produtos que causam efeitos adversos aos consumidores, levando a problemas de saúde e, em casos extremos, a morte (ANDRADE, 2012).
2.4. VERIFICAÇÃO E MONITORAMENTO:
Após a determinação dos critérios de aceitação e limites, é essencial implementar procedimentos de verificação e monitoramento. Esses procedimentos podem incluir swabs de superfícies, testes de rinsagem e métodos analíticos, como HPLC ou espectrometria de massas, para confirmar que os resíduos estão dentro dos limites aceitáveis acesso e uso de (ANVISA 2017).
Os critérios de aceitação e os limites na validação de limpeza são, portanto, componentes vitais para assegurar a fabricação de produtos cosméticos seguros e de alta qualidade. Eles necessitam ser definidos, monitorados e adaptados conforme necessário, com base nas características do produto, nas regulamentações (PINTO et al. 2015).
2.5. METODOS DE SANITIZAÇÃO NA INDUSTRIA COSMETICA E A ESCOLHA DO “PIOR CASO”:
A sanitização na indústria cosmética é um processo crucial que visa eliminar a contaminação microbiana e cruzada, garantindo a segurança e a eficácia dos produtos cosméticos. Diferentes métodos de sanitização são empregados, e a seleção do “pior caso” para validação é fundamental para assegurar uma limpeza eficaz sob as condições mais desafiadoras. Incluem calor seco, vapor saturado (autoclaves) e radiação (UV e gama). O calor é um método eficaz para destruir microrganismos e é frequentemente usado em instrumentos reutilizáveis e superfícies de produção (ANVISA, 2010). A radiação, especialmente a UV, é útil para áreas de difícil acesso e materiais sensíveis ao calor.
Envolve o uso de desinfetantes, como alvejantes, álcoois, fenóis, quaternários de amônio e peróxidos. Estes agentes químicos são eficazes contra uma variedade de microrganismos e são utilizados com base na compatibilidade com os materiais de superfície e eficácia contra os microrganismos específicos encontrados no ambiente de produção (ANVISA, 2019).
Existem métodos de sanitização por gás. Este método é particularmente eficaz para equipamentos sensíveis ao calor e locais de difícil acesso. No entanto, o tempo de exposição prolongado e a garantia de segurança para os operadores são considerações essenciais (ANVISA 2010).
A escolha do método de validação é fundamental e deve refletir as necessidades específicas da produção. No contexto da indústria cosmética, onde há uma ampla variabilidade de produtos, a utilização do método de “pior caso” torna-se particularmente relevante. O método de “pior caso” refere-se à escolha de um produto ou condição de processamento que seja o mais difícil de limpar ou desinfetar (SHABIR, 2010). Ao validar a eficácia da sanitização para o “pior caso”, garante-se que outros produtos ou condições menos críticas também serão adequadamente limpos. Dada a diversidade de produtos na indústria cosmética, que podem variar em composição, viscosidade, e propriedades físico-químicas, a adoção deste método torna-se uma abordagem prudente (ANVISA, 2019).
Ressaltamos que as indústrias cosméticas enfrentam desafios únicos, pois muitos produtos contêm ingredientes naturais, óleos e extratos que podem apresentar desafios na sanitização. Validar a limpeza para o “pior caso” assegura que todas as formulações, inclusive as mais complexas, possam ser adequadamente tratadas, minimizando riscos de contaminação cruzada. Além disso (ANDRADE, 2012) argumentam, em seu estudo que a adoção do método de “pior caso” é não apenas uma abordagem eficiente, mas também econômica. Ao concentrar esforços na validação de limpeza para as condições mais críticas, evita- se a necessidade de validar individualmente cada produto, economizando recursos e tempo.
Dessa forma, em uma indústria cosmética com ampla variabilidade de produtos, como a escolhida para este estudo, a adoção do método de “pior caso” para validação de sanitização de equipamentos é não apenas apropriada, mas também estrategicamente vantajosa, garantindo a produção de cosméticos seguros e de alta qualidade. A estratégia de “pior caso” na sanitização assegura que, independentemente das variações no processo de produção, o método de sanitização escolhido será robusto o suficiente para garantir a segurança do produto e a conformidade exigida pelos órgãos reguladores da atividade (ANVISA, 2019).
3. MÉTODO APLICADO
3.1. EQUIPAMENTO “PIOR CASO”
A avaliação do equipamento “Pior-Caso” teve por base a frequência de produção, em que o equipamento mais utilizado e com maior variedade de produtos seria o escolhido em detrimento dos demais. Também foram levados em consideração os pontos críticos dos equipamentos, tais como a conformação das várias partes e peças constituintes (SOUZA et al. 2012). O equipamento que poderá ser considerado como “Pior-Caso” será aquele que revelar ter características de geometria e de design que dificultam o processo de limpeza eficaz (WHO, 2020). Desta forma, se o equipamento considerado como “Pior-Caso” for devidamente validado na limpeza, quaisquer outros que se encontrem no mesmo grupo, estarão validados, visto a sua limpeza ser mais difícil e com maiores complicações do que os demais equipamentos utilizados. Para realizar a essa análise de risco os equipamentos foram agrupados e categorizados conforme tabelas de número 1, 2, 3, 4, 5 e 8 apresentadas no anexo A desse estudo.
3.2. PRODUTO “PIOR CASO”
Essa classificação foi realizada baseando-se também nas experiências dos operadores que realizam as atividades de limpeza, e nas propriedades físico- química dos produtos para então, através de critérios específicos a depender dos tipos de produtos e planta fabril, escolher o produto “pior caso”. A metodologia aplicada foi baseada no critério de análise de escolha do produto mais crítico conforme conta nas tabelas 6, 7 e 9 do anexo A desse estudo. O produto eleito como “pior caso”, representa aquele que resulta na melhor combinação das seguintes propriedades:
3.3. AMOSTRAGEM
A coleta eficaz em superfícies irregulares é crucial para obter resultados precisos em ensaios microbiológicos. Para tal procedimento são utilizados swabs estéreis que, de acordo com as recomendações, a embalagem contida com o swab deve ser aberta no momento da coleta e seu recipiente estéril utilizado uma técnica asséptica (RAMIRES; NOBREGA, 2014). A amostragem deu-se por coleta de swab em área de equipamento e produto que foram classificados como “pior caso”. Finalizada a coleta, as amostras foram encaminhadas para laboratório terceirizado para efetuar as devidas análises. Para efeito de registro da coleta dos swabs para análise microbiológica criaram-se registros (tabelas descritivas em anexo B) que demonstram a região de coleta, o coletor, data e hora da coleta e esses dados foram mantidos em arquivo do setor de garantia da qualidade da empresa estudada. Caso haja crescimento de fungos e/ou bacteriano, refazer a limpeza e sanitização da superfície que se deseja refazer o teste (SHERMAN, 2015). Contudo caso haja crescimento novamente, há necessidade de revisão das técnicas de limpeza empregadas e este protocolo deverá ser repetido.
3.4. PLANO DE AMOSTRAGEM E VALIDAÇÃO DO TEMPO DE ESPERA (HOLD TIME)
Para garantir a eficácia e a precisão da validação de limpeza, a indústria de cosméticos adota uma abordagem sistemática e abrangente (Smith & Jones, 2016). Inicialmente, é realizada a fabricação de três lotes do produto identificado como o pior caso, devido a seus componentes, complexidade de formulação ou outros fatores determinantes (MIGORANCE J, 2005). Este produto é usado como referência, já que, ao validar a limpeza para o “pior caso”, garante-se que a limpeza para outros produtos também seja eficaz (SOUZA et al. 2012).
A amostragem é executada nos equipamentos que foram selecionados através de uma análise de risco conforme recomenda-se o cenário do pior caso (ANDRADE, 2012). identificando áreas e componentes que possam ser mais suscetíveis à contaminação ou que sejam mais críticas para a limpeza. A coleta de amostras é, assim, direcionada para os locais que receberam pontuações mais altas durante essa análise, reconhecidos como pontos críticos (ANDRADE, 2012).
Um dos elementos centrais deste plano de amostragem é a validação do tempo de espera (Hold Time) de um equipamento após a limpeza (SHABIR, 2010). O objetivo é determinar quanto tempo o equipamento pode permanecer inativo após a limpeza sem comprometer a eficácia do processo de sanitização. Para avaliar isso, um dos três lotes é especificamente amostrado após uma pausa de 72 horas entre o momento da limpeza e o da coleta (ANDRADE, 2012). Esta abordagem simula condições mais extremas e é projetada para estressar o processo de limpeza.
Além disso, para garantir que o processo de limpeza seja avaliado, é criada um a situação de pior caso (SHERMAN, 2015). Neste cenário, o equipamento é limpo somente 72 horas após a conclusão da produção. Esta é uma abordagem deliberada para testar os limites do procedimento de limpeza (ANDRADE, 2012).
3.5. DETERMINAÇÃO DA ATIVIDADE MICROBIANA
A análise microbiológica foi realizada em laboratório terceirizado com métodos já validados seguindo os parâmetros que se encontram na Tabela 10 do Anexo A.
4. RESULTADOS E DISCUSSÕES
O método de “pior caso” elaborado e aplicado na indústria de cosméticos em questão foi suficiente para a validação dos procedimentos de sanitização foram realizados em conformidade e que os mesmos são capazes de garantir a segurança microbiológica do produto preparado.
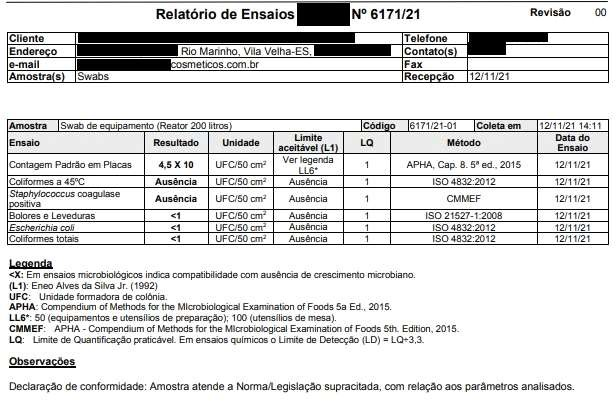
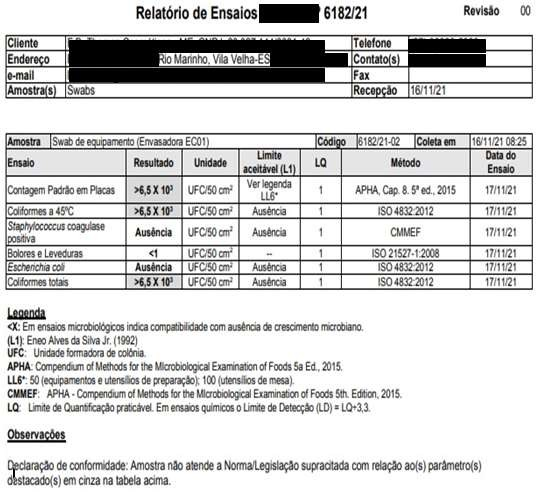
A escolha do equipamento de “pior caso” é definida através da maior pontuação diante dos critérios definidos (ALENCAR et al., 2005). Dentre eles: classificação da capacidade de equipamento (tabela 1 do anexo A), frequência de uso do equipamento (tabela 2 do anexo A), especificidade de uso (tabela 3 do anexo A) e pontos críticos (tabela 4 do anexo A). Com base nos critérios mencionados, vários áreas dos equipamentos foram identificadas como prontos críticos conforme tabelas do anexo A. Sendo para amostragem: Reator 01, Hélice do Reator 01 e Envasadora 01. Entretanto para a Envasadora 01, houve á necessidade de repetir o procedimento em virtude do crescimento de microorganismo apresentado em laudo. Com a revisão dos procedimentos de limpeza, á analise foi refeita e o resultado apresentou-se satisfatório conforme anexo C com código 6915/21-01.
Para validação de limpeza, foi elaborado um plano de amostragem e foi executado de forma sistemática, com amostras representativas coletadas de equipamentos e áreas identificadas como pontos críticos durante a análise de risco. A importância de uma estratégia de amostragem robusta é enfatizada na literatura, pois ajuda a garantir que todos os locais e equipamentos sejam avaliados adequadamente para resíduos ou contaminação (SHERMAN, 2015).
O tempo de espera (“Hold Time”) para equipamentos limpos é outro componente vital da validação de limpeza, referindo-se ao tempo máximo que um equipamento pode ficar sem uso após a limpeza e ainda manter a integridade do processo realizado (ANVISA, 2019). A validação adequada dessa etapa é essencial para prevenir a contaminação e garantir a qualidade do produto a ser comercializado evitando danos a integridade física do consumidor. Estudos recentes e orientações regulatórias destacam a importância de estabelecer e validar um período de Hold Time baseado em dados científicos sólidos. O plano de amostragem foi elaborado para dois equipamentos: o Reator 03 e a envasadora 01.
Para o Reator 03, no LOTE 1, após esvaziamento, há uma limpeza e amostragem, seguidas de uma inspeção visual depois da sanitização e secagem. A rinsagem é feita com a última água da lavagem e o swab abrange Conexão, Válvula, Mangueira, Hélice, propelidor e âncora. No LOTE 2, a limpeza ocorre imediatamente após o esvaziamento, com amostragem feita 72 horas depois, seguindo o padrão anterior para inspeção visual, rinsagem e swab. Para o LOTE 3, a limpeza é realizada 72 horas após o esvaziamento, e a amostragem é imediata, mantendo-se o padrão dos lotes anteriores. Em relação à Envasadora 01, no LOTE 1, depois do esvaziamento, ela é limpa e amostrada, com uma inspeção visual após a limpeza, sanitização e secagem. A rinsagem usa a última água de lavagem e o swab é efetuado na Conexão entre a mangueira e a envasadora. No LOTE 2, a limpeza é feita logo após o esvaziamento, e a amostragem ocorre 72 horas depois, mantendo o padrão do LOTE 1. Já no LOTE 3, a limpeza é feita 72 horas depois do esvaziamento com amostragem imediata, seguindo os procedimentos dos lotes anteriores.
Este plano precisa fornecer instruções claras sobre quando e como amostrar, realizar inspeções visuais, procedimentos de rinsagem e onde realizar swabs para garantir a limpeza e higienização dos equipamentos mencionados (SHABIR, 2010). Também foram pontuados diversos critérios que constam em tabelas que constam nos anexos desse trabalho. Destes, citamos: capacidade do equipamento (tabela 01), frequência de uso (tabela 02), especificidade de uso do equipamento (tabela 03), classificação dos pontos críticos (tabela 04), escolha dos equipamentos (tabela 05), solubilidade (tabela 06), remoção do produto (tabela 07) e frequência produtiva (tabela 08). Somada estas pontuações, conforme consta na tabela 09 dos anexos, ficou definido o produto “pior caso”, como: máscaras matizadoras.
Para análise dos pontos mais escuros e de difícil acesso será utilizada uma lanterna previamente sanitizada com álcool a 70°. A inspeção visual é um componente integral da validação de limpeza, especialmente para a identificação de resíduos ou contaminação em áreas que são visualmente obscuras ou de difícil acesso (ANVISA, 2019). Em muitos casos, equipamentos especializados são necessários para facilitar essa inspeção. O uso de lanternas ou outras fontes de luz portáteis é uma prática comum para melhorar a visibilidade durante a inspeção visual (BROWN, 2020).
É crucial que qualquer equipamento utilizado na inspeção, incluindo lanternas, seja devidamente limpo e sanitizado para evitar a introdução de contaminantes no ambiente de produção. O álcool a 70° é amplamente reconhecido por sua eficácia na sanitização de superfícies e equipamentos, devido à sua capacidade comprovada de desativar microrganismos através da desnaturação de proteínas (RAMIRES; NOBREGA, 2014).
Portanto, a prática de utilizar uma lanterna previamente sanitizada com álcool a 70° para a inspeção de áreas de difícil acesso é consistente com as diretrizes da indústria e práticas recomendadas de validação de limpeza (ANVISA 2010).
Ao final deste processo de validação, espera-se que todos os lotes, sem exceção, atendam às especificações previamente estabelecidas (ANVISA, 2019), garantindo assim a confiabilidade e a eficácia dos processos de limpeza na indústria de cosméticos.
Por fim, deve-se ressaltar que a revalidação ou revalidação parcial do sistema de limpeza deverá ocorrer impreterivelmente caso haja alteração total ou parcial do procedimento de limpeza e sanitização dos equipamentos como mudança na frequência e/ou especificações/classes dos sanitizantes utilizados. A cada 5 anos após cada validação/revalidação, a empresa deve realizar uma análise crítica com emissão de parecer técnico de todas as ocorrências referentes ao seu procedimento de limpeza e sanitização de equipamentos afim de verificar a necessidade ou não de revalidação periódica.
Em caso de troca e/ou aquisição de novos equipamentos e/ou implementação de novos produtos deve ser registrada uma análise com a classificação de risco dos novos equipamentos e/ou produtos, caso a pontuação atingida seja maior que dos equipamentos e produtos relatados neste protocolo, uma revalidação do processo tornar-se-á obrigatória. Os registros de análise serão arquivados juntamente com o relatório de validação.
5. CONSIDERAÇÕES FINAIS
Através deste estudo, confirmou-se que o método de “pior caso” foi suficiente para confirmar que os procedimentos de limpeza são realizados em conformidade e que os mesmos são capazes de garantir a segurança microbiológica do produto preparado. A elaboração desses protocolos assegura que resíduos de produtos anteriores, agentes de limpeza e resíduos microbianos são removidos de maneira eficaz até níveis pré-determinados evitando assim a possibilidade de contaminação cruzada, mesmo em um cenário aonde há uma diversidade de produtos.
Tendo adotado a metodologia de “pior caso”, e após submissão para análises em uma empresa especializada, concluiu-se que a validação da limpeza dos equipamentos foi bem-sucedida, determinando um intervalo de 72 horas entre as limpezas. Esta validação, posteriormente reconhecida por um órgão de vigilância estadual, fortalece a confiabilidade do processo, assegurando que os equipamentos na linha de produção operem sob padrões aceitáveis. Com a validação deste processo, conclui-se que este método pode ser usado para outras indústrias que buscam validação junto aos órgãos de vigilâncias sanitárias.
Esta validação, também foi reconhecida por um órgão de vigilância estadual, o que fortalece a confiabilidade do processo, assegurando que os equipamentos na linha de produção operem sob padrões aceitáveis. Este estudo pode ser utilizado por outras indústrias do segmento que estejam tendo os mesmos problemas com as agencias de controle sanitário e/ou deseja validar seu processo. Por fim, deve-se levar em conta que o método de “pior caso”, precisa ser estruturado conforme as necessidades e particulares da empresa.
A obtenção da validação positiva do método de “pior caso” representou um marco significativo para a indústria no que diz respeito à relação com os órgãos de vigilância sanitária. A aceitação e o reconhecimento deste método pelos reguladores não só reforçaram a posição de conformidade da empresa perante as normativas mais criticas como também estabeleceram um novo padrão para futuras auditorias e avaliações. A interação bem-sucedida com essas agências reguladoras melhorou o diálogo e abre caminhos para uma colaboração mais estreita, facilitando o lançamento de novos produtos e agilizando processos de certificação e liberação de linhas de produção.
Este resultado positivo também impulsionou a empresa a se antecipar às tendências regulatórias, adotando práticas proativas para assegurar a conformidade contínua. A validação tornou-se parte integrante da cultura corporativa, conduzindo a uma revisão e melhoria constantes dos protocolos de limpeza. Isso não apenas solidificou a confiança dos órgãos de vigilância na empresa, mas também preparou o terreno para uma liderança no setor em termos de práticas de segurança e sanitização.
REFERÊNCIAS:
Agência Nacional de Vigilância Sanitária (ANVISA). Resolução da Diretoria Colegiada (RDC) nº 17, de 16 de abril de 2010. Dispõe sobre as Boas Práticas de Fabricação de Medicamentos. Brasília, DF, [2010]. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2010/res0017_16_04_2010.html.
Agência Nacional de Vigilância Sanitária (ANVISA). Guia de Validação de Limpezapara Farmoquímicas. 2013. Disponível em: https://www.gov.br/anvisa/ptr/centraisconteudo/publicsados/medicsados/publicsa- sobre-medicamentos/. Acesso em: 20 de outubro de 2023.
Agência Nacional de Vigilância Sanitária (ANVISA). Portaria de Consolidação doMinistério da Saúde no 5, de 28 de setembro de 2017. Disponível em: http://www.gov.br/saude/pt-br/composicao/sectics/farmacia- popular20old/legislacao/prc-5-portaria-de-consolida-o-n-5-de-28-de-setembro-de- 2017.pdf/view. Acesso em: 22 de outubro de 2023.
Agência Nacional de Vigilância Sanitária (ANVISA). Diretoria Colegiada. InstruçãoNormativa IN nº 47, de 21 de Agosto de 2019. Dispõe sobre as Boas Práticas de Fabricação complementares às atividades de qualificação e validação. Brasília, DF, [2019]. Disponível em: http://www.in.gov.br/en/web/-/-instrucao-normativa-in-n-n-47- de-21-de-agosto-de-2019-211914011. Acesso em: 22 de outubro de 2023.
ANDRADE, S. C. I. Validação de limpeza de equipamentos para o farmacêutico. Em 2012. Instituto Politécnico de Leiria, Escola Superior de Turismo e Tecnologia do Mar, Portugal. Disponível em: https://iconline.ipleiria.pt/bitstream/10400.8/743/1/Mestrado% 20GQSAlimentar_Ines_Andrade.pdf. Acesso em: 18 de outubro de 2023.
Department of health and human services food and drug administration (FDA). Orientação para a validação do processo industrial: Princípios e PráticasGerais. U.S.A., 2011. Disponível em: https://www.fda.gov/files/drugs/published/Process-Validation–General-Principles-and Practices.pdf. Acesso em: 08 de outubro de 2023.
FERREIRA, A. A. P.; YAMANAKA, H. Microscopia de força atômica aplicada em imuno ensaios. Química Nova, v. 29, n. 1, p. 137-140, 2006. Acesso em: 18 deoutubro de 2023.
LAURO D’MORETTO (São Paulo). Sindusfarma. Guia de Qualificação e Validação.17. ed. São Paulo: Câmara Brasileira do Livro, 2016.
PINTO, T. J. A.; KANEKO, T. M.; PINTO, A. F. Controle biológico de qualidade deprodutos farmacêuticos, correlatos e cosméticos. 4. ed. São Paulo: Manole, 2015.
RAMIREZ, C. M.; NOBREGA, A. W. Determinação simultânea de resíduos deetinilestradiol e gestodeno em superfícies de equipamentos de produção. Revista de Ciências Farmacêuticas Básica e Aplicada, v. 35, n. 1, p. 97-103, 2014.
REYGAERT, Wanda C.; REYNHOUT, Donald R. Microbiological Contamination inCosmetics:Riskand ControlStrategies. Journal of Cosmetic Science, v. 71, n. 6, p. 323-340, 2020. Disponível em: https://library.scconline.org/v071n06/. Acesso em: 18 de outubro de 2023.
SOUZA, M.M.S. (UTFPR); ROSSO, D. (PRATI-DONADUZZI); ROSA, M.F. (UNIOESTE). Validação na Indústria Farmacêutica: desafios e oportunidades no novo marco regulatório. ACQs e PCPs, p. 14-18, novembro de 2022. Disponível em: https://www.abq.org.br/cbq/2022/trabalhos/4/280-239. Acesso em: 17 de setembro de 2023.
SOUZA, Aline Mirelly Ferreira; OLIVEIRA, Antônio Diogenes Pereira; GRANJEIRO JÚNIOR, Severino; SANTANA, Davi Pereira; SILVA, José de ALEXSANDRO. (2012) Validação de limpeza de equipamentos multipropósitos da linha de manipulação de comprimidos por granulação úmida: caso da furosemida.
Revista de Ciências Farmacêuticas Básica e Aplicada, 33(2):299-306. Disponível em: https://rcfba.fcfar.unesp.br/index.php/ojs/article/download/301/299. Acesso em: 22 de outubro de 2023.
SHABIR, G. A. (2010). Validação de Métodos de Cromatografia Líquida de AltaEficiência para Análise Farmacêutica: Entendendo as Diferenças e Semelhanças entre Requisitos de Validação da FDA dos EUA, USP e Conferência Internacional de Harmonização. Journal of Chromatography A, 1217(25), 5353-5368
SHERMAN, M. (2015). Técnicas Analíticas Modernas na Detecção eQuantificação de Resíduos de Agentes de Limpeza em Equipamentos deFabricaçãoFarmacêutica. Tendências em Química Analítica, 68, 135-142.
WHO. (2020). Limpeza e Desinfecção de Superfícies Ambientais no Contexto da COVID-19. World Health Organization. Disponível em: https://iris.paho.org/handle/10665.2/53212. Acesso em 02 de setembro de 2023.
ANEXO A – Scores para a determinação do produto e equipamento “pior caso”
Tabela 01- Classificação da capacidade do equipamento. TERMO DESCRITIVO CAPACIDADE (L) PONTUAÇÃO Alta Reatores de 500 L 15 Média Reatores entre 200 – 300 L 10 Baixa Reatores de 50 L 5 Tabela 02- Classificação de frequência de uso do equipamento. TERMO DESCRITIVO FREQUÊNCIA PONTUAÇÃO Alta Alta- produção acima de 5 lotes por mês 15 Média Média – produção entre 3-5 lotes por mês 10 Baixa Baixa- produção de 1-2 lotes por mês 5 Tabela 03- Classificação de especificidade de uso do equipamento. TERMO DESCRITIVO ESPECIFICIDADE PONTUAÇÃO Não dedicado Utilizado para quaisquer tipos de produtos 15 Parcialmente Com poucas variações de produtos 10 Totalmente Dedicado a apenas um tipo de produto 5 Tabela 04- Classificação de pontos críticos. TERMO DESCRITIVO CRITICIDADE PONTUAÇÃO Hélice (propelidor e âncora) Difícil higienização 15 Conexões, Bicos de envasadora Moderadamente fácil higienização 10 Válvula Fácil higienização 5 Tabela 05- Pontuação dos Reatores Equipamento Capacidade Frequência Especificidade Criticidade Total Reator 1 500L Baixa Não dedicado Conexões, hélice e válvulas Pontuação 15 5 15 30 65 Reator 2 300L Alta Não dedicado Conexões, hélice e válvulas Pontuação 10 15 15 30 70 Reator 3 200L Alta Não dedicado Conexões, hélice e válvulas Pontuação 10 15 15 30 70 Reator 4 50L Alta Não dedicado Conexões, hélice e válvulas Pontuação 5 15 15 30 65 Tabela 06 – Classificação de solubilidade. TERMO DESCRITIVO SOLUBILIDADE PONTUAÇÃO Insolúvel Levemente solúvel ou praticamente insolúvel 15 pontos Média solubilidade Solúvel e quase solúvel 10 pontos Solúvel Muito solúvel e livremente solúvel 5 pontos Tabela 07 – Classificação de remoção do produto. TERMO DESCRITIVO REMOÇAO PONTUAÇÃO Difícil Difícil de ser removido 15 pontos Médio Dificuldade de remoção moderada 10 pontos Fácil Fácil de ser removido 5 pontos Tabela 08 – Classificação de frequência produtiva. TERMO DESCRITIVO FREQUÊNCIA PONTUAÇÃO Alta Alta- produção acima de 5 lotes por ano 15 Média Média – produção entre 3-5 lotes por ano 10 Baixa Baixa- produção de 1-2 lotes por ano 5 Tabela 09 – Pontuação do produto de pior caso. PRODUTO FREQ. SOLUB. REMOÇÃO TOTAL CONDICIONADORES/MÁSCARAS MATIZADORAS Alta Média solubilidade Difícil Pontuação 15 10 15 40 HIDRÓXIDO DE CÁLCIO Média Média solubilidade Difícil Pontuação 15 10 15 35 EMULSÃO OXIGENADA Alta Solúvel Fácil Pontuação 15 5 5 25 SHAMPOOS E SABONETES LÍQUIDOS DIVERSOS Alta Solúvel Fácil Pontuação 15 5 5 25 CONDICIONADORES DIVERSOS Alta Solúvel Fácil Pontuação 15 5 5 25 SHAMPOOS MATIZADORES Alta Solúvel Fácil Pontuação 15 5 5 25 ATIVADOR DE GUANIDINA Alta Solúvel Fácil Pontuação 15 5 5 25 Tabela 10 – Parâmetros Análise microbiológica PARÂMETROS UNIDADE MÁX. PERMITIDO METODOLOGIA Microrganismos Mesófilos totais Aeróbicos UFC/g 500 Guia ABC de Microbiologia 5ª Edição Staphylococcusaureus UFC/g Ausência em 1 g Guia ABC de Microbiologia 5ª Edição Coliformes Totais e Fecais UFC/g Ausência em 1 g Guia ABC de Microbiologia 5ª Edição EscherichiaColi UFC/g Ausência em 1 g Guia ABC de Microbiologia 5ª Edição Bolores e Leveduras UFC/g 100 Guia ABC de Microbiologia 5ª Edição
ANEXOS B – Registros em Sistema de garantia da qualidade
Registros das Análises do Processo de Validação de Limpeza dos Equipamentos Equipamento/Utensílio:Reator 200 LT – LOTE 01 Lote do Produto:50452102 Nome do Produto:MÁSCARA CAPILAR MATIZADORA
DataeHoradeFabricação
Data e Hora daLimpezaVerificação do daetiquetadelimpeza(conformeounão conforme) Verificação Visual(conforme ou nãoconforme)
Realizadopor
DataeHora12/11/2021 – 10H00 12/11/2021 – 14H00 Conforme Conforme Funcionário 1 12/11/2021 – 14h03
pH da água pré-produção (brancoanalítico)
cor da água pré-produção (brancoanalítico)Odor daágua pré-produção(branco analítico)
pH daágua derinsagem
cor da águaderinsagem
Odor daágua derinsagem
Realizadopor
DataeHora6,37 Conforme Conforme 6,44 Conforme Conforme Funcionário 1 12/11/2021 – 14h05 Microorganismos MesófilosTotais Staphylococcus aureus Coliformes Totais EscherichiaColi BoloreseLeveduras Realizadopor DataeHora 4,5 X 10 Ausência <1 <1 <1 Empresa Terceirizada 12/11/21 – 14h11 Registros das Análises do Processo de Validação de Limpeza dos Equipamentos Equipamento/Utensílio: Envasadora EC 01 – LOTE 01 LotedoProduto:50452102 NomedoProduto:MÁSCARA CAPILAR MATIZADORA
Data e Hora deFabricação
Data e Hora daLimpezaVerificação do daetiqueta de limpeza(conformeounão conforme) Verificação Visual(conforme ou nãoconforme)
Realizadopor
Data eHora12/11/2021 – 10H00 12/11/2021 – 14H05 Conforme Conforme Funcionário 1 12/11/2021 – 14h15
pH da água pré-produção (brancoanalítico)
cor da água pré-produção (brancoanalítico)Odor daágua pré-produção(branco analítico)
pH daágua derinsagem
cor da águaderinsagem
Odor daágua derinsagem
Realizadopor
DataeHora6,37 Conforme Conforme 6,59 Conforme Conforme Funcionário 1 12/11/2021 – 14h17 Microorganismos MesófilosTotais Staphylococcus aureus Coliformes Totais EscherichiaColi BoloreseLeveduras Realizadopor DataeHora <1 Ausência <1 <1 <1 Empresa Terceirizada 12/11/21 – 14h25 Registros das Análises do Processo de Validação de Limpeza dos Equipamentos Equipamento/Utensílio:Reator 200 LT – LOTE 02 LotedoProduto:50452102 NomedoProduto:MÁSCARA CAPILAR MATIZADORA
Data e Hora deFabricação
Data e HoradaLimpezaVerificação do daetiqueta de limpeza(conformeounão conforme) Verificação Visual(conforme ou nãoconforme)
Realizadopor
Data eHora12/11/2021 – 10H00 12/11/2021 – 14H05 Conforme Conforme Funcionário 1 16/11/2021 – 08H00 pH da água pré-produção (brancoanalítico) cor da água pré-produção (brancoanalítico) Odor da águapré-produção(branco analítico) pH da águaderinsagem
cor da águaderinsagemOdor daágua derinsagem
Realizadopor
DataeHora6,31 Conforme Conforme 7,02 Conforme Conforme Funcionário 1 16/11/2021 – 08H05 Microorganismos MesófilosTotais Staphylococcus aureus Coliformes Totais EscherichiaColi BoloreseLeveduras Realizadopor DataeHora <1 Ausência Ausência Ausência <1 Empresa Terceirizada 16/11/2021 – 08H20 Registros das Análises do Processo de Validação de Limpeza dos Equipamentos Equipamento/ Utensílio: Envasadora EC 01 – LOTE 02 NomedoProduto:MÁSCARA CAPILAR MATIZADORA LotedoProduto: 50452102
Data e HoradaLimpezaVerificação do daetiqueta de limpeza(conformeounão conforme) Verificação Visual(conforme ou nãoconforme)
Realizadopor
Data eHoraData e Hora de Fabricação 12/11/2021 – 14H05 Conforme Conforme Funcionário 1 16/11/2021 – 08H03
12/11/2021 – 10H00
cor da água pré-produção (brancoanalítico)Odor daágua pré-produção(branco analítico)
pH daágua derinsagem
cor da águaderinsagem
Odor daágua derinsagem
Realizadopor
DataeHorapH da água pré-produção (brancoanalítico)
Conforme
Conforme
6,88
Conforme
Conforme
Amanda16/11/2021 – 08H05 6,31 Staphylococcus aureus Coliformes Totais EscherichiaColi BoloreseLeveduras Realizadopor DataeHora Microorganismos MesófilosTotais Ausência >6,5 X 103 Ausência <1 Empresa Terceirizada 16/11/2021 – 08H25 >6,5 X 103 Registros das Análises do Processo de Validação de Limpeza dos Equipamentos Equipamento/Utensílio:Reator 200 LT – LOTE 03 LotedoProduto:10482108 NomedoProduto:MÁSCARA CAPILAR MATIZADORA
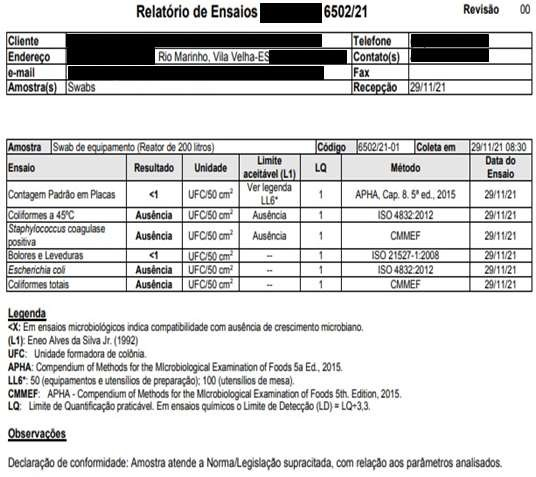
Data e Hora deFabricação
Data e Hora daLimpezaVerificação do daetiqueta de limpeza(conformeounão conforme) Verificação Visual(conforme ou nãoconforme)
Realizadopor
Data eHora26/11/2021 – 14h00 29/11/2021 – 08H05 Conforme Conforme Funcionário 1 29/11/2021 pH da água pré-produção (brancoanalítico) cor da água pré-produção (brancoanalítico) Odor da águapré-produção(branco analítico) pH da águaderinsagem
cor da águaderinsagemOdor daágua derinsagem
Realizadopor
DataeHora6,78 Conforme Conforme 6,91 Conforme Conforme Funcionário 1 29/11/2021 Microorganismos MesófilosTotais Staphylococcus aureus Coliformes Totais EscherichiaColi Bolorese Leveduras Realizadopor DataeHora Registros das Análises do Processo de Validação de Limpeza dos Equipamentos Equipamento/Utensílio: Envasadora EC 01 – LOTE 03 LotedoProduto:10482108 NomedoProduto:MÁSCARA CAPILAR MATIZADORA
Data e Hora deFabricação
Data e Hora daLimpezaVerificação do daetiqueta de limpeza(conformeounão conforme) Verificação Visual(conforme ou nãoconforme)
Realizadopor
Data eHora26/11/2021 – 14h00 29/11/2021 – 08H05 Conforme Conforme Funcionário 1 29/11/2021
pH da água pré-produção(brancoanalítico)cor da águapré-produção(brancoanalítico) Odor daágua pré-produção(branco analítico)
pH daágua derinsagem
cordaágua derinsagem
Odor daágua derinsagem
Realizadopor
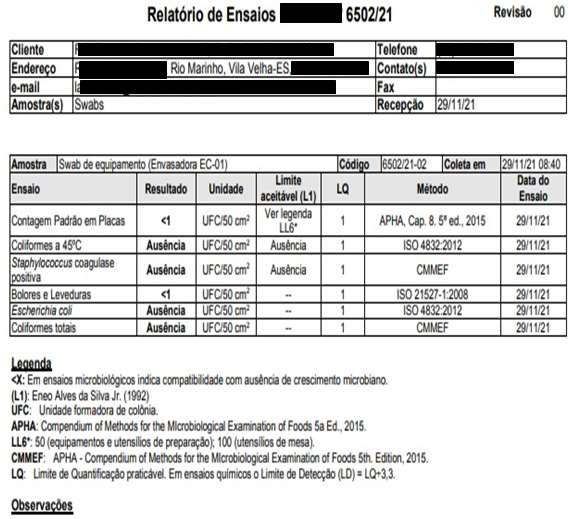
Data eHora6,78 Conforme Conforme 6,91 Conforme Conforme Funcionário 1 29/11/2021 Microorganismos MesófilosTotais Staphylococcus aureus Coliformes Totais Escherichia Coli Bolorese Leveduras Realizado por Datae Hora <1 Ausência Ausência Ausência <1 Empresa Terceirizada 29/11/2021 Registros das Análises do Processo de Validação de Limpeza dos Equipamentos Equipamento/Utensílio:Envasadora EC 01 – LOTE 02 – AnáliserefeitadeacordocomRNCAnexada LotedoProduto:10482108 NomedoProduto:MÁSCARA CAPILAR MATIZADORA
Data e Hora deFabricação
Data e HoradaLimpezaVerificação do daetiqueta de limpeza(conformeounão conforme) Verificação Visual(conforme ou nãoconforme)
Realizadopor
Data eHora17//12//2021 17/12/2021 Conforme Conforme Funcionária 1 20/12/2021- 08:10h
pH da água pré-produção (brancoanalítico)
cor da água pré-produção (brancoanalítico)Odor daágua pré-produção(branco analítico)
pH daágua derinsagem
cor da águaderinsagem
Odor daágua derinsagem
Realizadopor
DataeHora6,89 Conforme Conforme 6,88 Conforme Conforme Funcionária 1 20/12/2021 – 08h13 Microorganismos MesófilosTotais Staphylococcus aureus Coliformes Totais EscherichiaColi BoloreseLeveduras Realizado por DataeHora 4,4 X 10 Ausência Ausência Ausência <1 Empresa Terceirizada 20/12/2021 – 10:15
ANEXO C – Resultados dos testes microbiológicos dos “piores casos” .Resultados Microbiológicos Empresa Terceirizada



¹Acadêmico do curso de Farmácia
²Mestre em Ciências Farmacêuticas
Doutor em Ciências Fisiológicas
Docente Multivix – Cariacica/ES
