THE INFLUENCE OF TELOMERES ON THE SENESCENCE PROCESS
REGISTRO DOI: 10.5281/zenodo.10149222
Tábata Ap. Amadeu Marques Eleotério¹
João Paulo de Sousa Ferreira²
RESUMO
Os telômeros são estruturas núcleo protéicas heterocromáticas de comprimento variável, presentes nas extremidades dos cromossomos. Sua principal função é a proteção das extremidades dos cromossomos, contra uma eventual fusão ou degradação prematura da molécula de DNA, regulação da síntese de DNA telomérico e regulação/manutenção do comprimento do telômero. Os telômeros, conjuntamente com a telomerase, permitem ultrapassar a limitação replicativa dos segmentos terminais de DNA que se verifica na maioria das células humanas somáticas e que está associada à diminuição do comprimento do DNA telomérico em cada divisão celular. Seu comprimento atua como marcador de envelhecimento celular, isso porque diminui com a idade e tem sido associado há algumas doenças relacionadas ao processo de envelhecimento, contudo existem fatores ambientais, como estilo de vida e dieta que afetam diretamente a taxa de encurtamento dos telômeros e que podem ser revertidas pela telomerase. Esse estudo tem como objetivo analisar o processo de senescência celular ligado aos telômeros comparado a outros marcadores como radicais livres, bem como atividade da telomerase durante o processo.
Palavra-chave: senescência, envelhecimento, telômeros, telomerase, replicação, antioxidantes, envelhecimento cutâneo, radicais livres.
ABSTRACT
Telomeres are heterochromatic protein nucleus structures of variable length, present at the ends of chromosomes. The main function is to protect the ends of chromosomes against eventual fusion or premature degradation of the DNA molecule, regulation of telomeric DNA synthesis and regulation/maintenance of telomere length. Telomeres, together with telomerase, make it possible to overcome the replicative limitation of terminal DNA segments that occurs in most somatic human cells and is associated with a decrease in the length of telomeric DNA with each cell division. Telomere length act as a marker of cellular aging, because it decreases with age and has been associated with some diseases related to the aging process, however there are environmental factors, such as lifestyle and diet, that directly affect the rate of telomere shortening and which can be reversed by telomerase. This study aims to analyze the process of cellular senescence linked to telomeres compared to other markers such as free radicals, as well as telomerase activity during the process.
Keywords: senescence, aging, telomeres, telomerase, replication, antioxidants, cutaneous aging and free radicals.
INTRODUÇÃO
No início dos anos 70, A. Olovnikov descobriu que os cromossomos não tinham habilidade de replicarem suas porções finais de forma completa. Essa ideia foi complementada pela teoria do limite da divisão celular, de L. Hayflick. Ambos cientistas concluíram que sequências de DNA são perdidas a cada divisão celular e quando essa perda atinge um nível crítico, a célula não mais se divide. Em outras palavras, eles haviam identificado os telômeros e o “end-replication-problem”. Foi quando Elizabeth Blackburn e seu time, identificaram a incomum estrutura telomérica da repetição da sequência de DNA – TTAGGG, os telômeros e a enzima telomerase, que são os responsáveis por proteger os cromossomos. Com essa descoberta, o estudo da biologia dos telômeros passou a ser focado no desencadeamento da senescência celular, levando ao envelhecimento. A etiologia do envelhecimento é um processo, no qual ocorrem alterações morfológicas, funcionais, bioquímicas e psicológicas que reduzem a capacidade de adaptação ao meio ambiente.
Desta forma o envelhecimento é definido, como: uma série de modificações que ocorrem no organismo ao longo do tempo vivido, as quais reduzem as funções fisiológicas do ser humano o tornando mais suscetível a uma série de doenças e a morte.
JUSTIFICATIVA
Este trabalho vem esclarecer as possíveis causas do processo de envelhecimento e atuação dos telômeros em sua prevenção, que se mostrou de suma importância, durante a análise dos estudos evidenciando impactos positivos no processo de retardo do envelhecimento, bem como o impacto na longevidade.
METODOLOGIA
O presente estudo trata-se de uma revisão literária, para tal, foram analisados 22 artigos publicados no período que compreende de 2000 a 2022; através de pesquisas em plataformas, como a ScientificEletronicLibraryOnline(SciELO), PubMed, NationalLibraryofMedicine(Medline), BMC Biology. Cell Reports, visando a triagem do conteúdo com base na pesquisa de palavras-chaves, como: senescência, envelhecimento celular, telômeros, telomerase, replicação, antioxidantes, envelhecimento cutâneo e radicais livres.
OBJETIVO
O respectivo trabalho tem como principal objetivo avaliar o impacto dos telômeros durante o processo de senescência celular, comparado a outros marcadores, bem como os radicais livres e seu impacto no processo de envelhecimento.
DISCUSSÃO
O envelhecimento é um processo biológico, universal, com caráter progressivo. Suas alterações morfológicas são decorrentes, não apenas do aspecto estrutural e fisiológico, mas também do impacto, causado pelo comportamento do indivíduo e relação com meio ambiente. Sabendo disto, é certo correto dizer, que as células se tornam senescentes quando perdem sua capacidade de replicação, que inibe sua metabolização e por consequência geram danos moleculares ao longo de alguns ciclos celulares, comprometendo assim sua funcionalidade e desencadeando o processo de senescência celular.
A senescência nada mais é, que uma resposta, projetada pelo nosso organismo, para eliminar células danificadas.
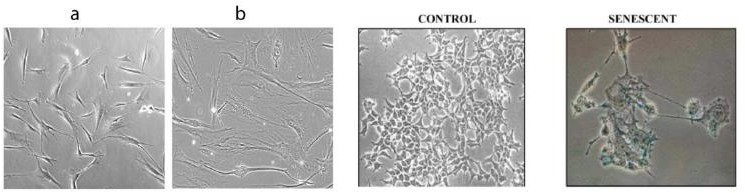
Imagem: Hayflick e Moorhead, 1961.
Esse mecanismo de controle de proliferação celular, pode ser identificado, através do fenótipo senescente do gene CDKN1A (P21), que é caracterizado pelo aumento em sua transcrição e pela atividade da enzima β-galactosidase (β-gal). Podemos citar ainda, as citocinas que são capazes de contribuir para um estado de inflamação crônico, observado em doenças relacionadas à aceleração do envelhecimento.
Desta maneira, podemos dizer que o envelhecimento não é um fenômeno biológico isolado e sim um conjunto, que está associado a diversos marcadores, dos quais podemos listar, como primários – associados ao encurtamento dos telômeros, instabilidade genômica, perda da proteostase e alterações epigenéticas. Que atuam em consequências fisiológicas, como senescência celular, disfunção mitocondrial e a desregulação da sinalização de nutrientes, bem como os marcadores integrativos, que dizem respeito a exaustão dos compartimentos troncos e da comunicação intercelular, que dependendo do contexto podem atuar de forma benéfica ou deletéria, comprometendo a função tecidual.
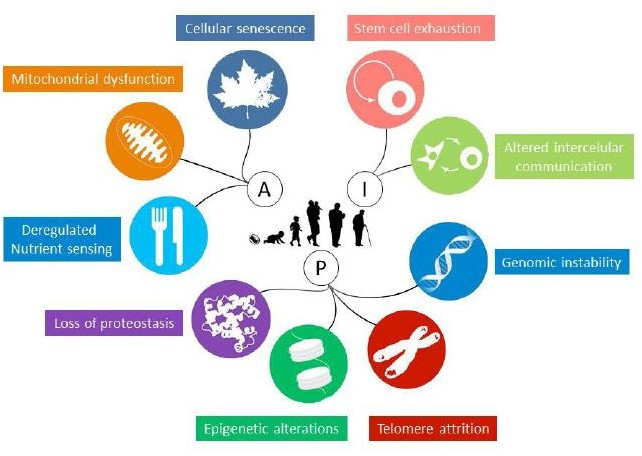
Imagem: Adaptado de López- Otín et al. 2013; A figura acima representa os nove marcadores celulares e moleculares, organizados em 3 grupos, sendo P: marcadores primários; A: marcadores antagonistas; I: marcadores integrativos. Que apresentam a progressão do envelhecimento.
O envelhecimento celular é um processo biológico, responsável por alterações estruturais e funcionais no organismo, que ocorre através de mecanismos determinados geneticamente, como os telômeros curtos. A etiologia do envelhecimento é única, pode ser causada por um gene ou pelo declínio de um sistema fisiológico, progressivamente substituído por um processo multifatorial, que resulta da interação de mecanismos moleculares, celulares e sistêmico.
Telômeros
Telômeros (do grego “telos”, final, e do grego “meros”, partes), estruturas terminais que fazem parte da extremidade dos cromossomos. Cromossomos em tradução livre ‘corpos coloridos’ (do grego “chroma”, cor e “soma”, corpo) este é responsável por abrigar todo nosso material genético, composto basicamente de DNA e proteínas associadas. Já os telômeros são formados por uma região de dsDNA e uma saliência de fita simples na extremidade 3’OH, rica em guanina (Blackburn et al. 2015), nas extremidades dos cromossomos, que são constituídos por repetições de proteínas e DNA não codificante responsáveis pela formação desta extremidade protetora.
Sua principal função é evitar o desgaste do material genético e manter a estabilidade da estrutura do cromossomo. Estes atuam como capas que protegem as regiões internas dos cromossomos e que se desgastam à medida que ocorre cada ciclo de replicação de DNA.
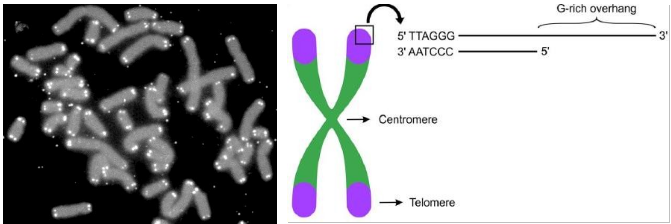
Figura 1 – Khan Academy: telômeros aparecem como pontos brilhantes nas extremidades de cada cromossomo na figura mostrada acima. Crédito da imagem: “Capas de telômeros,” by U.S. Department of Energy Human Genome Program (public domain). Figura 2 – Os telômeros (porção violeta) estão localizados nas extremidades dos cromossomos e consistem em uma sequência de DNA de fita dupla e uma saliência de DNA de fita simples com a repetição da sequência TTAGGG na extremidade 3’OH. (Adaptado de Grun et al., 2019).
Em suma, como descrito por Xin et al., em Genome Biology em 2008, ‘os telômeros são estruturas de nucleoproteínas nas extremidades dos cromossomos eucarióticos’. São essas estruturas que auxiliam na manutenção e integridade do genoma eucariótico, evitando assim rearranjos cromossômicos ou a fusão dos cromossomos entre si e permitindo a replicação completa das extremidades das moléculas lineares de DNA.
Envolvidos em diversas funções, dentre as quais podemos citar: a proteção dos cromossomos de recombinações e fusões das sequências finais com outros cromossomos; reconhecer danificações no DNA; estabelecer mecanismos para replicações dos cromossomos; contribuir na organização funcional cromossômica no interior do núcleo; participar na regulação da expressão genética, e servir à maquinaria molecular como um “relógio” que controla a capacidade replicativa de células humanas e a entrada destas em senescência celular (LIBERTINI; FERRARA, 2016).
O DNA telomérico é composto por uma série de repetições de sequência que termina em uma saliência de DNA de fita simples 3 ‘(ss). A cada rodada de replicação do DNA, o DNA telomérico torna-se mais curto, mas pode ser regenerado pela enzima telomerase, uma DNA polimerase contendo RNA. Os telômeros e a telomerase desempenham papéis fundamentais na manutenção da integridade dos cromossomos no processo de envelhecimento e no câncer.
Durante o processo de envelhecimento cronológico, ocorre uma modificação do material genético e a proliferação celular diminui, o que resulta na perda de elasticidade e na capacidade de regular o metabolismo e a replicação do tecido, tornando este menos eficiente. Em células normais, uma série de mecanismos de feedback mantém o equilíbrio entre o encurtamento e o alongamento, promovendo um equilíbrio dinâmico dos telômeros em humanos. Apenas alguns telômeros curtos, já são suficientes, para formar associações terminais, comunicando um sinal de dano ao DNA; o que resulta em senescência replicativa, ou seja, uma perda do crescimento celular. E nessa ausência de verificação do ciclo celular, as células contornam a senescência e os telômeros se encurtam, resultando em uma crise.
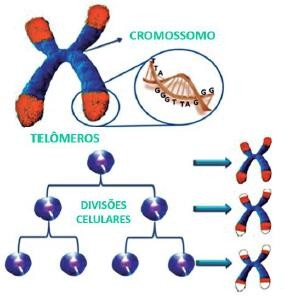
Figura 1 – Encurtamento dos telômeros em função dos ciclos de replicação/divisão celular (MUSUMECI et al., 2015).
Essa crise é caracterizada pela extremidade cromossômica, como ‘desprotegido’, o que pode desencadear: fusões finais, ciclos de pontes de fusão com quebra de cromossomos, catástrofe mitótica e o aumento de uma fração de células apoptóticas.
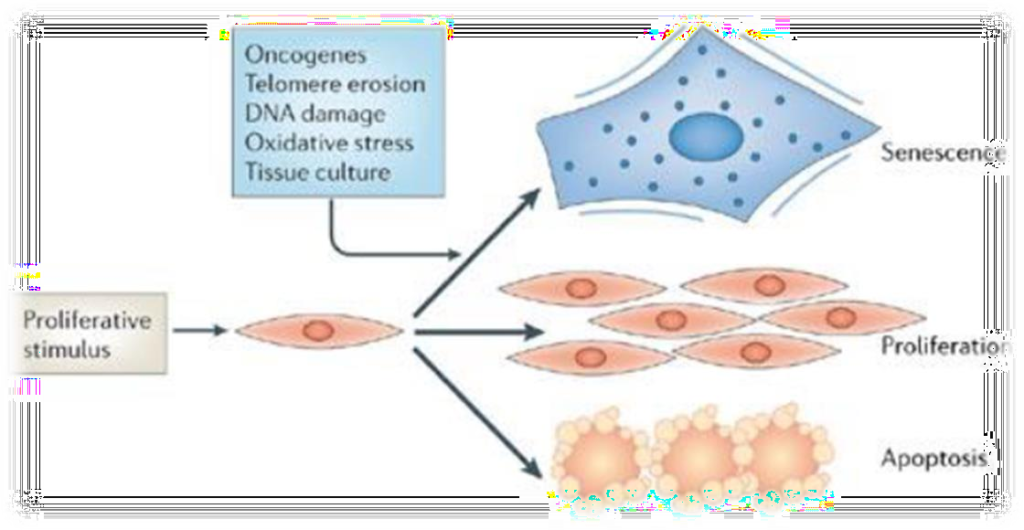
Imagem: Nature Publishing Group, Natura Reviews | Molecular Cell Biology, copyright 2006.
Telomerase
A telomerase é uma enzima ribonucleoproteica, que mantém as estruturas protetoras nas extremidades dos cromossomos eucarióticos, chamados telômeros. Sua descoberta data do início da década de 1970 e sua principal função é repor os telômeros nas extremidades cromossômicas, adicionando nucleotídeos a eles a cada ciclo de divisão celular, uma vez que sua expressão é reprimida e os telômeros se encurtam progressivamente a cada divisão; assim promovendo o alongamento a partir da extremidade 3’ do cromossomo, enquanto a sequência da cadeia complementar é completada por ação da DNA polimerase.
Seu núcleo catalítico é um complexo de riboproteínas, composto por uma subunidade polipeptídica denominada Transcriptase Reversa da Telomerase (TERT) e um componente de RNA da Telomerase (TERC) que pertence à família de RNAs não codificantes (Rubtsova et al. 2012). Sua estrutura é formada por um complexo ribonucleoproteico conhecido por RNA telomerase (TER, Telomerase RNA). Onde em seu centro atua a atividade de transcriptase reserva (TERT, Telomerase reverse transcriptase), e RNA (TR – Telomerase RNA, TER-Telomerase RNA ou TERC – Telomerase RNA component), que representa a sequência molde para o alongamento do DNA telomérico. A TERT possui sequências de aminoácidos semelhantes a outras transcriptases reversas, as quais são responsáveis pela ação catalítica, ligação ao DNA e reconhecimento de nucleotídeos. Desde a descoberta, foram identificadas mais de 40 proteínas TERT em eucariotos, que na sua maioria, compartilham a mesma organização estrutural (LIU; XING, 2016).
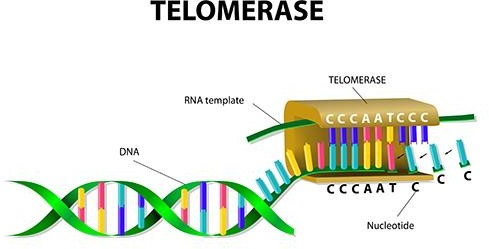
Imagem: Key DNA Elements for Replication but Tricky Drug Targets.
Em suma a telomerase possui uma atividade de transcriptase reversa, sendo o principal mecanismo fisiológico pelo qual as células de mamíferos estendem os telômeros (Blackburn et al. 2015), é única entre as transcriptases reversas que por conter um RNA não codificante (RNA telomerase -TER) inclui um modelo curto, que é usado para a síntese de repetições de DNA telomérico, rico em G nas extremidades 3′ na maioria dos cromossomos eucarióticos. Esta é a responsável por manter a integridade do gene e a sua atividade ou desregulação, são determinantes para longevidade humana e renovação celular. Isso porque equilibra o encurtamento dos telômeros que ocorre durante a divisão celular, adicionando repetições de telômeros nas extremidades dos cromossomos, criando com base em sua própria sequência bioquímica e assim restaurando o DNA perdido durante as divisões celulares.
Embora a enzima exista em níveis muito baixos nas células somáticas normais, ela é continuamente expressa em 80-95% dos tumores, atuando para alongar continuamente os telômeros e conferindo uma espécie de imortalidade às células que se dividem rapidamente com as divisões celulares repetidas, até atingir um tamanho crítico, no qual célula entra em senescência. Quando por quaisquer motivos, essa divisão ocorre de forma errônea, o resultado é um envelhecimento prematuro, que é a principal condição para o dano oxidativo. Que pode estar associada a uma inflamação, causada por um estilo de vida não saudável, que gera o estresse físico, biológico e químico exógenos, considerados como fatores de risco.
Radicais Livres
A pele é um órgão complexo que é constituído por tipos de células interdependentes que atuam na manutenção de sua estrutura; na qual interações celulares e moleculares são reguladas de acordo com as agressões sofridas em relação ao meio ambiente. Tendo em vista sua regulação, o impacto sofrido com envelhecimento cronológico cutâneo, passa por modificações em sua genética, em função de enzimas e alterações proteicas, que diminuem a proliferação celular. A associação entre os radicais livres e o envelhecimento, se dá pelos efeitos nocivos provocados pelo acúmulo de dano e a capacidade do organismo lidar com os danos celulares induzidos.
Os radicais livres foram mencionados pela primeira vez, em 1956, pelo médico norte- americano Denham Harman, que afirmava que o processo de envelhecimento dependia da produção de radicais livres, o que levava a danos oxidativos e perda da função de moléculas, como ácidos nucléicos, proteínas e lipídios (Finkel; Holbrook, 2000). Em sua definição, são moléculas químicas, constituídas por um átomo ou associação dele, que possuem um elétron disperso em sua órbita externa, o que os obriga a doar ou retirar elétron de outra molécula, para que se mantenha estável. A esse processo de formação, damos o nome de estresse oxidativo, que tem início com uma reação em cadeia, modificando proteínas extracelulares. Estes são produzidos em processos normais e patológicos e atuam como agentes ou suspeitos de danos aos tecidos que podem ocorrer por: radiação, danos causados por produtos químicos ambientais e envelhecimento. Esse processo ocorre em função das oxidações químicas e enzimáticas, que envolvem a formação dos radicais livres, que aceleram o estresse oxidativo, cujo dano é a peroxidação dos ácidos graxos da dupla camada lipídica, que pode levar à morte celular.
Esse envelhecimento ocorre, devido a senescência celular, decorrente de danos moleculares causados por radicais livres e à perda de ADN telomérico. Isso porque a enzima telomerase tem a função de evitar esse processo, impedindo que ocorra o encurtamento dos telômeros. Esta teoria pode ainda estar relacionada aos efeitos prejudiciais causados pelos danos oxidativos dos radicais livres que matam as células e apressam o encurtamento dos telômeros (PORTH; MATFIN, 2010).
As reações radicais podem causar mutações, inativação ou diminuição da renovação do DNA mitocondrial que é mais vulnerável que o genoma nuclear ao ataque de agentes mutagênicos, atuando também como fonte contínua de fatores iniciais e/ou promotores do processo carcinogênico. As células somáticas tornam-se senescentes porque durante a divisão celular perdem os mecanismos de alongamento dos telômeros. A telomerase evita o encurtamento dos telômeros nas células neoplásicas e, portanto, as torna imortais. Paradoxalmente, a proteção dos telômeros é exatamente o que deve ser evitado no caso das células tumorais. Recentemente, a demonstração de que a telomerase nem sempre está envolvida na restauração do comprimento dos telômeros mostra a complexidade dos problemas ligados à causa da senescência.
Com o envelhecimento, há um declínio na fidelidade da expressão genética, que resulta no auto amplificação de erros na síntese proteica. O acúmulo desses erros provoca o “erro catástrofe” que faz com que os danos moleculares se acumulem principalmente no DNA. Assim o metabolismo oxidativo produz radicais livres altamente reativos que, subsequentemente, causam danos nos lipídios, nas proteínas e no mtDNA, tornando o acúmulo de AGEs nas proteínas da matriz extracelular, causando consequências deletérias que contribuem para o envelhecimento.
A teoria mais significativa, que se baseia nos efeitos prejudiciais causados pelos radicais livres que consideram essas espécies químicas, produzidas pelo metabolismo mitocondrial, como as responsáveis pelo envelhecimento devido às lesões nas estruturas celulares e ao DNA, causadas pelo estresse oxidativo, como sendo um resultado nocivo do excesso de radicais livres no corpo (GUILLAUMET et al., 2017).
E quanto maior a taxa de respiração mitocondrial, maior é a taxa de formação dos radicais livres, que para neutralizá-los as células usam antioxidantes, porém, quando há o desequilíbrio entre eles ocorre o processo de estresse oxidativo e como consequência, acontece a oxidação de biomoléculas levando ao desequilíbrio da homeostase e a ocorrência de danos oxidativos no organismo, que conduzem ao envelhecimento celular (POLJSAK, 2010).
CONSIDERAÇÕES FINAIS
Os hábitos e estilos de vida, interferem no processo de senescência replicativa e envelhecimento celular, pois estes são associados à ausência da atividade da enzima telomerase sobre o telômero, que é o principal fator de envelhecimento. Este processo não está ligado apenas a etapa química, biológica e fisiológica, mas também ao ambiente. Uma vez que comportamentos advindos de experiências exógenas, podem ter impactos benéficos e/ou deletérios e influenciam o tamanho dos telômeros. Estes impactos se relacionam diretamente com: o cuidado mental (entende-se pensamentos), uma vez que pensamentos negativos, atuam como microtoxinas no organismo e sua saúde celular reflete o bem-estar da sua mente e do seu corpo, que são essenciais para manutenção dos telômeros. A alimentação saudável, que é essencial, através do consumo de alimentos integrais e ricos em ômega-3 e a prática de atividade física, que é responsável por aumentar o fluxo sanguíneo para o coração e para cérebro, tonificando os músculos e fortificando os ossos. Fazendo com que seus efeitos sejam sentidos a longo prazo, isto é, se realizados em uma intensidade moderada, podem melhorar o equilíbrio entre os antioxidantes e o os radicais livres. Assim uma vida longa, com boa saúde e bem-estar, passa por um estilo de vida saudável com saúde mental. Dito isto podemos pensar no meio ambiente como um software, que tem o poder de reprogramar nossos telômeros e nós somos os programadores do epigenoma; desta forma o futuro da saúde está em nossas mãos e nós podemos medir parte desse futuro em pares de bases de telômeros.
REFERÊNCIAIS
- Armanios, M., Blackbum, E. H. (2012). The telomere syndromes. Nature Reviews Genetics 13:693-704.
- Aladjem M.I. (2007) Replication in context: dynamic regulation of DNA replication patterns in metazoans. Nature Reviews Genetics 8:588-600.
- Biologia do envelhecimento: teorias, mecanismos e perspectivas. Biology of aging: theories, mechanisms, and perspectives. Ilka Nicéia D’Aquino Oliveira Teixeira e Maria Elena Guarient.
- Maiara Kaim, Luana Taís Hartmann Backes. Envelhecimento Celular: Teorias e Mecanismos. Revista de Saúde Integrada v. 12, n. 23 (2019) – ISSN 2447-7079.
- Hirata Lilian Lúcio; Mayumi Eliza Otsuka Sato e Cid Aimbiré de Moraes Santos. Radicais Livres e o Envelhecimento Cutâneo.
- SHAWI, M.; AUTEXIER, C. (2008) Telomerase, senescence and ageing. Mechanisms of Ageing and Development. Vol. 129, pp 3 – 10.
- Kaszubowska, L. (2008) Telomere shortening and ageing of the immune system. Journal of Physiology and Pharmacology, 59, Suppl 9, 169-186.
- Greider CW, Blackburn EH. A telomeric sequence in the RNA of Tetrahymena telomerase required for telomere repeat synthesis. Nature. 1989;337(6205):331–7.
- Contribuição dos telômeros e da telomerase no surgimento de neoplasias e no processo de envelhecimento. Daniela Moura Parente Ferrer, Elton Brito Sousa,
- Martinez, P. & Blasco, MA Papéis teloméricos e extrateloméricos para a telomerase e as proteínas de ligação aos telômeros. Nat. Rev. Câncer 11, 161–176 (2011).
- Chiodi, I. & Mondello, C. Funções independentes de telômeros da telomerase em núcleos, citoplasma e mitocôndrias. Frente. Oncol. 2, 133 (2012).
- Lin, J. et al. A localização nucleolar do TERT não está relacionada à função da telomerase nas células humanas. J. Célula. Ciência. 121, 2169–2176 (2008).
- Forsythe, HL, Elmore, LW, Jensen, KO, Landon, MR & Holt, SE – A expressão da telomerase mediada por retrovírus em células humanas normais proporciona uma vantagem de crescimento seletivo. Internacional J. Oncol. 20, 1137–1143 (2002).
- Yao Ele, Yaqiang Wang, Baocheng Liu, Cristina Helmling, Lucas Sušac , Ryan Cheng , Z. Hong Zhou e Juli Feigo – Estruturas da telomerase em várias etapas da síntese de repetições de telômeros. Páginas 454–459 (2021).
- Patrícia F. Fitzpatrick Dimond Ph.D. Editor Técnico da Clinical OMICs. Regra dos Telômeros.
- Xue, W.; Zender, L.; Miething C.; Dickins, R.A.; Krizhanovsky V.; Cordoncardo, C.; Lowe S.W. Senescence and tumour clearance is triggered by p53 restoration in murine liver carcinomas. Nature. Vol. 129, pp 3 – 10. 4 – (2007. Vol. 445, nº 7128, pp 656-660.
- Y., Wang, Y., Liu, B. et al. Estruturas da telomerase em várias etapas da síntese de repetições dos telômeros. Natureza 593, 454–459 (2021).
- Armstrong, C.A., and Tomita, K. (2017). Fundamental mechanisms of telomerase action in yeasts and mammals: understanding telomeres and telomerase in cancer cells. Open Biol. 7, 160338.
- Baumann, P., and Cech, T.R. (2000). Protection of telomeres by the Ku protein in fission yeast. Mol. Biol. Cell 11, 3265–3275.
- Gilson, E., Géli, V. Como os telômeros são replicados. Nat Rev Mol Cell Biol 8, 825–838 (2007). Doi:10.1038/nrm2259.
- Balk, B., Maicher, A., Dees, M., Klermund, J., Luke-Glaser, S., Bender, K., and Luke, B. (2013). Telomeric RNA-DNA hybrids affect telomere-length dynamics and senescence. Nat. Struct. Mol. Biol. 20, 1199–1205.
- Guh, CY., Shen, HJ., Chen, LW et al. XPF ativa a síntese de telômeros induzida por quebra. Nat Commun 13, 5781 (2022). Doi:10.1038/s41467-022-33428-0.
1 Graduanda do curso de Biomedicina do Centro Universitário das Faculdades Metropolitanas Unidas – FMU, Brasil.
2 Biomédico, Docente de Biomedicina do Centro Universitário Anhanguera – Anhanguera, Brasil.
Centro Universitário Faculdades Metropolitanas Unidas – FMU Av. Santo Amaro, 1239 – Vila Nova Conceição, São Paulo SP, CEP 04505-002.
