REGISTRO DOI: 10.5281/zenodo.10080755
Rênia Thalita da Silva1
Cristiane Sandra Silva2
Sandra Regina Afonso Cardoso3
RESUMO
As hemoparasitoses consistem em um conjunto de enfermidades ocasionadas por patógenos que se propagam na corrente sanguínea (Erlichia canis, Babesia canis e Anaplasma marginale), sendo capazes de lesionar ou alterar o desempenho das células sanguíneas, contribuindo para um crescente problema na rotina da clínica médica de pequenos animais. Estas possuem grande importância clínica e epidemiológica devido ao potencial zoonótico e ao quadro patológico que geram. O objetivo do trabalho foi verificar quais dos testes utilizados para detecção das hemoparasitoses se apresenta mais eficaz dentro da clínica de pequenos animais. Participaram deste estudo 43 animais que foram submetidos aos testes e que testaram negativo e/ou positivo nos testes e realizada a comparação com os exames hemoparasitológicos. A análise dos dados revelou a importância dos testes rápidos associados ao exame Hemoparasitológico no sentido de tornar mais fidedigno o diagnóstico, pois evita tanto resultados falsos-positivos quanto falsos-negativos, proporcionando ao clínico maior segurança em relação ao diagnóstico definitivo.
Palavras chave: Hemoparasitoses, Testes, Diagnósticos.
ABSTRACT
Hemoparasitosis consists of a set of illnesses caused by pathogens that spread in the bloodstream (Erlichia canis, Babesia canis and Anaplasma marginale), being capable of damaging or altering the performance of blood cells, contributing to a growing problem in the routine of medical clinics. of small animals. These have great clinical and epidemiological importance due to their zoonotic potential and the pathological condition they generate. The objective of the work was to verify which of the tests used to detect hemoparasitosis are most effective within the small animal clinic. 43 animals participated in this study that were subjected to tests and that tested negative and/or positive in the tests and comparison with hemoparasitological tests was carried out. Data analysis revealed the importance of rapid tests associated with the Hemoparasitological examination in order to make the diagnosis more reliable, as it avoids both false-positive and false-negative results, providing the clinician with greater security in relation to the definitive diagnosis.
Keywords: Hemoparasitoses, Tests, Diagnostics.
1. INTRODUÇÃO
Ultimamente é evidente o crescente número de animais de estimação, principalmente cães, que têm sido adquiridos, não só no Brasil, mas também no mundo. Com essa constatação de proximidade vem a preocupação com a saúde pública e a possível transmissão de doenças para o homem. Nesse contexto, observa-se na rotina clínica que boa parte das enfermidades presentes nesses animais são originadas por infecções hemoparasitárias (SILVEIRA, et al., 2019).
A presença dos pets no cotidiano das pessoas traz vários benefícios para ambos, como: melhorias nas relações interpessoais, combatendo a ansiedade, depressão, estresse, síndromes entre outros malefícios havendo assim, a necessidade de se monitorar a saúde e o bem-estar desses animais, os quais comumente são acometidos por ectoparasitos hematófagos como pulgas e carrapatos e outros vetores transmissores de microrganismos patogênicos (BRUM e CARVALHO, 2022).
As hemoparasitoses consistem em um conjunto de enfermidades ocasionadas por patógenos que se propagam na corrente sanguínea (Erlichia canis, Babesia canis e Anaplasma marginale), sendo capazes de lesionar ou alterar o desempenho das células sanguíneas, contribuindo para um crescente problema na rotina da clínica médica de pequenos animais, onde os mesmos expressam sinais clínicos inespecíficos que limitam o diagnóstico preciso, tornando mínima as possibilidades de recuperação do paciente (HOLANDA, et al., 2019).
A ocorrência de tais parasitos se justifica devido a sua ampla distribuição geográfica, tanto em ambientes rurais quanto urbanos, principalmente em regiões de clima tropical cujos vetores principais são carrapatos e mosquitos. Em se tratando de cães e gatos tais doenças assumem grande importância clínica e epidemiológica devido ao potencial zoonótico e o quadro patológico que geram (SILVEIRA, et al., 2019).
O objetivo do presente trabalho é verificar quais dos testes utilizados para detecção das hemoparasitoses se apresenta maior eficácia dentro da clínica de pequenos animais (IMUNOCROMATOGRAFIA, ELISA e CITOLÓGICO).
A escolha do tema é justificada pela alta prevalência de hemoparasitoses na clínica de pequenos animais, evidenciado ao se utilizar os testes rápidos considerados mais qualificados dentro do mercado pet, que em alguns casos os resultados negativos apresentaram se falsos após suas respectivas amostras serem submetidas ao teste de esfregaço sanguíneo, onde foi evidenciado a presença da bactéria ou protozóarios. As hemoparasitoses vêm trazendo uma grande preocupação dentro da clínica, visto que, na maioria dos pacientes é observado a fase crônica da doença levando a suspeita de que os testes podem estar apresentando uma falha ao não detectar essa fase induzindo um resultado falso negativo.
Sendo assim, essa pesquisa se propôs a fazer a contraprova das amostras utilizadas em testes rápidos submetendo-os ao esfregaço sanguineo, onde é possivel visualizar a presença da bactéria ou protozóario dentro da célula sanguinea.
2. MATERIAL E MÉTODOS
Para a realização desta pesquisa foram analisadas amostras de pacientes caninos submetidos a consulta veterinária com a suspeita de algum tipo de hemoparasitose utilizando os testes citados como exame diferencial para a detecção das diferentes hemoparasitoses. As amostras utilizadas foram de uma clínica de pequenos animais situada na cidade de Patos de Minas. O trabalho foi submetido a avaliação do CEUA (Comitê de Ética de uso de Animais) 43 animais sendo aprovado para dar início a pesquisa. A coleta dos dados ocorreu de janeiro de até o final de agosto de 2023. Para inclusão na pesquisa foram levados em consideração os sintomas, sinais clínicos e também as alterações em hemograma de cada paciente suspeito de hemoparasitose.
Após a realização dos testes rápidos as mesmas amostras foram submetidas a confecção de lâminas para uma contra prova afim de evidenciar possiveis falsos negativos como também avaliar a acurácia do exame citológico.
Um dos testes rápidos utilizados foi o Snap 4dx Plus Test (Tecnologia ELISA) (Figura 1), diagnóstico in vitro para a detecção do antígeno de Dirofilaria immitis e dos anticorpos de Anaplasma phagocytophilum, Borrelia burgdorferi, Ehrlichia canis e Ehrlichia ewingii em soro, plasma ou sangue total caninos. Para a realização do teste, utilizou-se 3 gotas de amostra sanguínea e 4 gotas do reagente específico do laboratório, após 10 minutos o teste pode ser interpretado tendo o resultado positivo ou não para as hemoparasitoses especificas, o teste dispõe também de um aparelho de leitura Snap pró onde é feito a leitura automaticamente sendo o impresso o resultado ou disponibilizado em tela para visualização.
Figura 1: Teste e leitor IDEXX

Fonte: IDEXX
O segundo teste utilizado na pesquisa foi o teste rápido específico apenas na detecção de Ehrlichia Canis, Erlichia Ab ECO Vet (Figura 2). Este teste conta com o ensaio imunocromatográfico para a detecção qualitativa de anticorpos IgG contra Ehrlichia canis. Para a realização do mesmo foi utilizado amostra sanguínea, sendo 10 ul de sangue e duas gotas de reagente próprio, o exame deve ser interpretado após 10 minutos de sua execução.
Figura 2:Teste de Imunocromatografia
Fonte: Eco Vet. 2021
O terceiro exame utilizado para a pesquisa foi a técnica de esfregaço sanguíneo, ou seja, a citologia, onde o mesmo utilizou-se a amostra sanguínea do paciente para a confecção das lâminas. Para a realização utilizamos o auxílio de um tubo capilar para capturar uma quantidade de amostra contendo Edta ou a amostra diretamente do paciente após coleta, o sangue foi posto em uma lâmina limpa e com uma segunda lamina realizamos a técnica do esfregaço sanguíneo percorrendo toda a lâmina, após, deixamos a mesma em repouso para secagem, e logo após alguns minutos começamos a coloração.
Para corar as lâminas foram utilizadas os corantes panópticos (Figura 3), sendo eles três etapas na qual o esfregaço fica mergulhado em cada etapa por 40 segundos, feito isto na última etapa, enxaguamos a lâmina em agua corrente e em seguida deixamos descansar para secagem em posição vertical para que não houvesse acumulo ou presença de agua no momento da interpretação. Após a devida secagem, levamos as lâminas já prontas para o microscópio e com o auxílio do óleo de imersão visualizamos na objetiva de 100 as células alvo.
O exame é utilizado devido a seu potencial em detectar as variadas alterações a nível celular, visto que o principal é a qualificação do veterinário patologista responsável por tal interpretação, sendo assim levando em consideração as hemoparasitoses, é possível detectar Ehrlichia canis, Anaplasma spp, Hepatozoon spp, Babesia spp, Dirofilariose spp, entre outras.
Figura 3: Materiais utilizados na confecção de lâminas

Fonte: Autoria própria 2023
Ao desenvolver o trabalho obtivemos um N final de 43 amostras, onde as mesmas foram submetidos tanto a realização de testes rápidos quanto ao esfregaço sanguíneo para analise parasitária, os resultados foram classificados de acordo com a idade e raça, sendo os números separados em tabelas, as quais descrevem a acurácia de cada teste positivo ou negativo na detecção de hemoparasitoses.
3. RESULTADOS E DISCUSSÃO
3.1. Hemoparasitoses Caninas: considerações gerais
As hemoparasitoses caninas constituem um grupo de doenças causadas por parasitos sanguíneos transmitidos por vetores invertebrados, sendo responsáveis por manifestações clínicas que variam, desde imperceptíveis até quadros clínicos mais graves, sem chance recuperação do animal, vindo assim ao óbito. As hemoparasitoses como anaplasmose, babesiose, erliquiose e hepatozoonose são as principais doenças que acometem os cães de todo o mundo e os carrapatos do complexo Rhipicephalus sanguineus são os principais vetores (VALENTE, 2014).
O diagnóstico das infecções hemoparasitárias é caracterizada como um grande desafio, devido aos diferentes tipos de agentes que podem provocar sintomatologias semelhantes. Os animais podem estar ou serem infectados por um ou mais agentes ao mesmo tempo, principalmente em regiões endêmicas. Assim, a complexa interação entre o agente infeccioso, o vetor e a resposta imunológica gerada pelo indivíduo irão determinar os riscos de infecção e a gravidade dos sinais clínicos gerados por essas hemoparasitoses (ARAÚJO et al., 2022).
As hemoparasitoses possuem capacidade de alterar ou lesionar a função das células sanguíneas, onde apresentam um crescente problema na rotina clínica de pequenos animais, por expressarem sinais clínicos inespecíficos o que minimiza as possibilidades de recuperação devido a limitação do diagnóstico preciso e consequentemente comprometendo a instituição de um tratamento eficaz e uma taxa considerável de cura (HOLANDA et al., 2019).
O esfregaço sanguíneo é frequentemente utilizado na rotina clínica para o diagnóstico das hemoparasitoses por se tratar de uma técnica de rápida execução, simples e de baixo custo. É considerado um método de alta especificidade, no entanto com baixa sensibilidade. Além disso, existe maior probabilidade de visualização dos hemoparasitos durante a fase aguda, podendo haver falsos negativos na fase de baixa parasitemia (FERRAZ et al., 2021).
O diagnóstico definitivo desses patógenos geralmente é realizado pela observação de alterações clínicas e hematológicas encontradas, em associação com a pesquisa parasitológica direta, detecção de anticorpos nos exames sorológicos e testes moleculares (PADILHA, 2020).
A utilização do esfregaço sanguíneo, corado por azul de metileno ou Giemsa que é o método mais comum. Por esse método pode ser observado inclusões de células basófilas nas plaquetas apresentando formatos variados (redondo, oval ou em forma feijão), envoltos por uma membrana dupla. Entretanto, a identificação dos parasitos ao microscópio ótico apresenta baixa sensibilidade, já que a parasitemia, além de cíclica, pode se desenvolver com baixo número de agentes, tornando difícil a identificação das células parasitadas ((ARAÚJO et al., 2022).
Os agentes etiológicos das hemoparasitoses podem ser encontrados nas fases subclínicas, hiperagudas, agudas, crônicas ou atípicas, contudo, as que são mais relevantes são as fases agudas e crônicas. Os animais infectados podem também atuar como reservatórios dos patógenos, que em alguns casos possuem potencial zoonótico (BRUM e CARVALHO, 2022).
Diversos testes sorológicos estão disponíveis para o diagnóstico de anaplasmose, como fixação do complemento, Reação de Imunofluorescência Indireta (RIFI) e Ensaio Imuno Enzimático (ELISA), e métodos moleculares, como a reação em cadeia da polimerase (PCR), possibilitando a detecção direta do DNA de microrganismos do gênero Anaplasma sp em amostras de sangue e tecido, carrapatos ou outros (ARAÚJO et al., 2022).
Em cães, temos como destaque a Trombocitopenia Cíclica e a Erliquiose Monocitica, respectivamente causadas pelos agentes intracelulares obrigatórios Ehrlichia canis e Anaplasma platys, representando duas das mais frequentes hemoparasitoses em cães (HOLANDA et al., 2019).
A Erliquiose monocítica canina e a Trombocitopenia cíclica canina são doenças causadas, principalmente, pelas bactérias Ehrlichia canis e Anaplasma platys. Esses parasitos pertencem à família Anaplasmataceae. Além disso, são consideradas parasitas intracelulares obrigatórias de células sanguíneas de mamíferos, sendo a primeira de leucócitos e a segunda de plaquetas (AE et al., 2021).
As manifestações clínicas, além de incomuns, são também inespecíficos, como febre, apatia, anorexia, mucosas pálidas, linfonodos aumentados, secreção nasal, anemia e trombocitopenia. Os vetores no Brasil de ambos os parasitos são carrapatos Rhipicephalus sanguineus, o que pode colaborar para a coinfecção. Outra forma de se transmitir a babesia além da picada do carrapato seria verticalmente, através da via transplacentária, mordeduras durante brigas e transfusão sanguínea (FERRAZ et al., 2021).
Os vetores nesse caso os carrapatos, ectoparasitas que pertencem ao Reino
Animalia, Filo Arthropoda, Classe Arachnida, Subclasse Acarina, Superordem, Parasitiformes, Ordem Acari, Subordem Ixodida, com duas principais Famílias, Ixodidae e Argasidae, onde a primeira apresenta várias espécies de interesse na avaliação diagnóstica das hemoparasitoses em cães, grande parte pertencente aos gêneros Amblyomma, Dermacentor, Ixodes, Haemaphysalis e Rhipicephalus. Esses ectoparasitas invertebrados possuem diferentes hospedeiros vertebrados, e algumas espécies, tem grande afinidade por seres humanos, onde de maneira geral apresentam um extenso período de alimentação, em certas situações sua picada ser inicialmente indolor e não ser percebida por horas ou mesmo por dias.
São encontrados em diferentes locais, infestando os cães tanto no ambiente rural como no urbano. (FOURNIER,2018)
Figura 4: Ciclo de vida do carrapato Rhipicephalus sanguineus
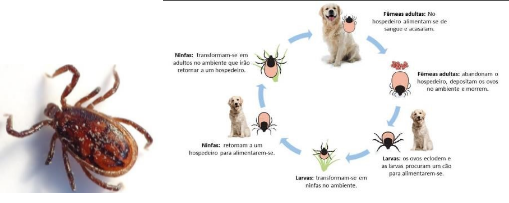
Fonte: Santos (2021)
Entre as espécies principais, a Rhipicephalus sanguineus (Figura 4) possui maior importância quando a infestação de cães é em ambiente urbano. Tal espécie possui um ciclo do tipo trioxeno, ou seja, necessita de três hospedeiros para desenvolver seu ciclo completo, que e compreendido em fases de ovo, larva, ninfa e adultos com dimorfismo sexual ou seja é quando o macho e a fêmea de uma mesma espécie são diferentes externamente (SANTOS et al., 2022)
A babesiose em cães é uma enfermidade parasitária que acomete as células sanguíneas, especificamente os eritrócitos, causada por protozoários do gênero Babesia sp. As espécies que podem infectar cães domésticos e silvestres existentes no Brasil, são a B. gibsoni e B. canis. Possuem uma extensa distribuição geográfica, e a gravidade dos sinais clínicos está relacionada a imunidade idade do animal, grau de parasitismo e a espécie de protozoário, o cão pode não apresentar sintomatologia, mas caso apresente ele apresente os sintomas podem ser: apatia, febre, icterícia, mucosas pálidas e esplenomegalia, podendo haver uma evolução para casos mais graves, e até na morte do animal. Porém, a infecção subclínica se apresenta na maioria dos casos, na presença de coinfecção, o que pode levar à piora do quadro (FERRAZ et al., 2021).
O diagnóstico da Erliquiose Monocitica Canina (EMC), como das demais hemoparasitoses citadas a cima, tem seu diagnóstico preciso por meio da anamnese, manifestações clínicas e resultados de exames laboratoriais como, Imunofluorescência direta (RIFI),Ensaio de Imunoabsorção Enzimática( ELISA), esfregaço sanguíneo e Reação em Cadeia da Polimerase (PCR), sendo o PCR o mais indicado na detecção de infecção sanguínea ativa no decorrer da fase clínica da infecção (ARAÚJO et al., 2022).
Os antibióticos utilizados no tratamento da erlichia temos a doxiciclina da classe das tetraciclinas. Devido a sua boa absorção intestinal e alcançar alta concentração celular esse medicamento é muito utilizado na rotina clínica, mostrando-se positivo, pois a Ehrlichia é uma bactéria intracelular. Não há um tempo estimado que determine a duração do tratamento, porém alguns autores indicam que a administraçao seja instituída na dose de 10 mg/kg por 21 – 28 dias, havendo intervalos de 12 ou 24 horas (STIVAL 2021).
Segundo (STIVAL 2021) ainda não se tem um protocolo vacinal disponível para prevenção da E. canis, então recomenda-se o uso de antiparasitários tanto no animal quanto no ambiente em que o mesmo habita, em períodos críticos onde os animais ficam mais expostos a esses ectoparasitas. Os antiparasitários utilizado de forma correta interrompe o ciclo evolutivo do carrapato, que tem seu estágio evolutivo no cão seu hospedeiro definitivo, assim como a E. canis outros agentes patogênicos não completarão seu ciclo, nem infectará outros cães.
Para a prevenção podem ser utilizados amitraz, fibronile piretrinas, já no controle de indivíduos acometidos pelo parasito recomenda-se o tratamento terapêutico com tetraciclinas, pois ela possui resultados satisfatórios fármaco profilático tanto para infecção em primeiro contato quanto para casos de reinfecção, fazendo a administração via oral na dose de 6,6 mg/kg/dia (STIVAL 2021).
3.1. AVALIAÇÃO DOS MÉTODOS DE DIAGNÓSTICO DAS HEMOPARASITOSES
No geral, as formas de diagnósticos possuem semelhança para todas as hemoparasitoses, porém com suas particularidades e limitações também, podendo ser falhos, com possíveis reações cruzadas, resultados falsos negativos ou falso positivo. De acordo com métodos mais utilizados, podemos citar, exame microscópico direto, testes sorológicos como RIFI e ELISA, exames hematológicos como o hemograma e bioquímicos, além de técnicas moleculares como o PCR (ARAÚJO et al., 2022).
As pesquisas parasitológicas diretas e os testes sorológicos são mais simples e também mais utilizados. Porém, há um elevado número de animais com resultados que dão falsos negativos pela baixa parasitemia, a presença de reações cruzadas com outros patógenos, a dificuldade de diferenciar a exposição prévia de infecção presente, entre outras. Tornando assim, um método que não passa tanta confiança, o que torna questionável os resultados obtidos (VALENTE, 2014).
Na erliquiose, apesar de a detecção direta atualmente realizada por meio de esfregaços sanguíneos ser a técnica-padrão mais utilizada, em virtude de sua rapidez, ela se mantém como técnica de baixa sensibilidade, visto o pequeno número de células com o parasita, considerando quadros comumente caracterizados por leucopenia e a dependência do microscopista, devido ao cansaço do observador, decorrente do número de esfregaços e células examinados (OLIVEIRA, 2015).
3.1.1. EXAMES HEMATOLÓGICOS
Os critérios hematológicos de maneira isolada não permitem a execução do diagnóstico de hemoparasitoses, pois não possibilitam a identificação do agente. Pois, indivíduos infectados podem apresentar ou não diferentes alterações em seus resultados. Porém, quando manifestadas, as alterações observadas no hemograma são: anemia em diferentes graus (normocítica normocrômica, normocítica hipocrômica, microcítica hipocrômica), policromasia, anisocitose, leucocitose ou leucopenia, eosinopenia, trombocitoponia e desvio nuclear de neutrófilos para a esquerda (WAGNER DE MATOS; BEATRIZ; ROCHA-LIMA, 2021)
As principais alterações hematológicas observadas em casos de erliquiose monocítica canina (EMC), incluem trombocitopenia variável, anemia e leucopenia discretas durante a fase aguda, trombocitopenia discreta na fase subclínica, e pancitopenia durante a fase crônica (GUIMARÃES ,2022).
Nos exames bioquímicos, alterações como no número de proteínas plasmáticas e elevação de ALT (alanina aminotransferase) e FA (fosfatase alcalina) são as mais descritas. Alterações nas concentrações séricas de albumina e globulina são comuns nas hemoparasitoses, que explica o quadro de hipoalbuminemia, quando há o extravasamento da proteína para o interstício e a redução da ingestão de proteínas, apresentando também uma resposta autoimune secundária aos componentes das células lesadas dos hospedeiros (DORIA,2016).
Vale ressaltar que a fase da doença e a resposta imunológica que o animal apresenta influenciam de maneira direta nesses achados laboratoriais. Na maioria dos casos, a alta ocorrência dessas enfermidades em certas regiões, o histórico do animal de já ter sido parasitado por carrapatos, e a identificação, principalmente, de trombocitopenia no hemograma (FIGURA 5), é o que leva comumente as suspeitas clínicas para as hemoparasitoses. Por maior coincidência que haja entre essas informações, elas não são suficientes para se determinar um diagnóstico final (ARAÚJO et al., 2022).
Os sinais clínicos vão variar. Principalmente de acordo com o grau da infecção, sendo elas subclínica, superaguda, aguda, crônica e atípica. Os cães jovens são os mais acometidos e apresentam a forma aguda da doença. No geral as características clínicas incluem febre, perda de peso, anorexia, hematúria e icterícia (BRUM e CARVALHO, 2022).
No entanto, a redução do número de plaquetas em cães que vivem áreas consideradas endêmicas pode atuar como ferramenta indispensável com intuito de orientar novos métodos de diagnósticos (ARAÚJO et al., 2022).
Figura 5: Hemograma indicando alterações competentes ao teste de Imunocromatografia

Fonte: Autoria própria 2023
3.1.2. EXAME MICROSCÓPICO DIRETO
Com o decorrer dos anos, a análise das sequências, têm representado métodos precisos de identificação das espécies, utilizados para o diagnóstico individual e para estudos epidemiológicos das babesioses em cães. As abordagens recentes no campo da biologia molecular têm aumentado a utilização de técnicas moleculares, tornando essas ferramentas apropriadas para estudos taxonômicos e caracterização filogenética, o que tem resultado em novas descobertas e no surgimento de novos grupos, com diversas sugestões para alterações taxonômicas (OLIVEIRA, 2015).
Os testes disponíveis para diagnosticar a doença têm por base identificar antígenos circulantes através de teste de ELISA e na identificação de microfilárias circulantes por meio do exame direto de sangue a fresco ou por métodos de concentração (PADILHA,2020).
O esfregaço sanguíneo é o exame microscópico direto (FIGURA 6) que é realizado para verificar a presença ou não dos agentes infecciosos no sangue, realizado de três maneiras: sangue de ponta de orelha o mais recomendável, sangue proveniente de vasos mais calibrosos (jugular, cefálica ou safena) ou também capa leucocitária, que é extraído dos sangue dos vasos calibrosos, sendo essa forma a última que apresenta melhores resultados, o que sugere o crescente número de Anaplasma platys obtidos pelo esfregaço sanguíneo, confeccionado a partir da capa leucocitária (WEBSIX, 2020).
Figura 6: Varredura de lâmina para pesquisa de hemoparasitas.

Fonte: Autoria própria 2023
3.1.3. TESTES SOROLÓGICOS
O ELISA, é uma sorologia de caráter qualitativa, que é muito utilizada na rotina clínica devido a sua rápida e fácil realização, como por exemplo, o teste rápido Canine Snap 4Dx® Plus, diagnóstico rápido baseado na metodologia ELISA que detecta anticorpos contra diferentes agentes (E. canis, Anaplasma spp., Dirofilaria immitis e Borrelia burgdorferi). Apesar de serem bastante úteis, o baixo número de anticorpos no início da infecção torna-se um fator desafiador, evidenciando que um resultado negativo neste teste não descarta a possibilidade de um animal estar contaminado (ARAÚJO et al., 2022).
A avaliação sorológica associada a métodos laboratoriais pode permitir a caracterização do estágio da infecção. Esta avaliação é essencial na caracterização das hemoparasitoses em cães, agregando valor e permitindo uma efetiva consolidação do diagnóstico relacionado a essas enfermidades. A disponibilidade de testes sorológicos rápidos permite ao veterinário a instituição da terapêutica mais adequada em tempo hábil (HOLANDA, et al., 2019).
Dentre os testes sorológicos disponíveis, os mais utilizados para diagnóstico de hemoparasitoses são o ELISA (FIGURA 7) e RIFI, ambos de grande importância clínica, principalmente durante as fases subclínica e crônica da doença, já que a baixa parasitemia dificulta a detecção do agente no exame direto. Estes testes detectam anticorpos precoces em até sete dias após infecção, no entanto, a maioria dos animais é soropositiva apenas após vinte e oito dias de infecção (ALVES,2022).
Figura 7: Materiais utilizados para realização do teste de ELISA.

Fonte: Autoria própria 2023
3.1.4. TESTES MOLECULARES
Consiste em um método de diagnóstico molecular de alta sensibilidade, a reação em cadeia de polimerase (PCR) (FIGURA 8), tem sua precisão principalmente em infecções agudas, sendo o mais indicado para a detecção do agente etiológico nas fases crônicas da doença, e possibilita a identificação de cada espécie e subespécie do patógeno envolvido (BITTENCOURT., 2022).
Este diagnóstico é um desafio a ser verificado pelo médico veterinário, pois ele vai encontrar pela frente as diferentes fases de infecção e a variedade de manifestações clínicas. O conhecimento do comportamento do agente e da sensibilidade e especificidade de cada exame, bem como da fase de evolução clínica da doença, é importante no momento de escolha do método diagnóstico. Utiliza-se os exames de E.L.I.S.A. e RIFI ou ainda molecular, com o uso de PCR para um diagnóstico mais preciso (BRUM e CARVALHO, 2022).
Diferentes técnicas foram desenvolvidas com o intuito de aumentar a eficácia deste teste molecular (PCR) como, por exemplo, a PCR em tempo real (qPCR), sendo utilizados com maior frequência para diagnósticos clínicos e experimentos laboratoriais devido sua alta capacidade em obter resultados quantitativos. Outro tipo de protocolo que tem sido amplamente empregado na detecção e discriminação de hemoparasitoses em cães, são os protocolos de ensaios de PCR convencional, nested-PCR e qPCR (ARAÚJO et al., 2022).
Figura 8: Exame PCR (Reação em Cadeia Polimerase
Fonte: Aguiar 2007
A Tabela 1 mostra que 25,6% dos animais foram positivos tanto no teste ELISA (4dx), quanto no exame parasitológico de sangue.
É possível observar que 30,5% dos animais adultos se mostraram positivos tanto no teste ELISA (4dx) quanto no exame parasitológico de sangue.
Nessa mesma tabela observa-se que no exame Hemoparasitológico existe reação cruzada no teste de ELISA (4dx) em relação aos hemoparasitos. Em alguns casos o teste se mostrou positivo para erlichia e no exame citológico pôde ser encontrado tanto anaplasma quanto babesia ou a identificação de um ou mais parasitos, ressalta-se que a Babesiose pode ser encontrada somente no exame hemoparasitologico, pois ainda não há um teste especifico para o agente patológico.
TABELA 1 – Número de animais adultos e filhotes positivos no teste ELISA (4dx) e no exame Hemoparasitológico.
IDADE NÚMERO DE ANIMAIS TESTE 4DX ELISA HEMOPARASITOLÓGICO POSITIVOS POSITIVOS ADULTOS (2 A 15 a) 36 10 10 FILHOTES (0 a 12 m) 07 01 01 TOTAL 43 11 11
Fonte: Aguiar 2007
Na tabela 2, observa-se que dos 16 animais submetidos ao teste de Imunocromatografia 13 deles são adultos, 3 deles se mostraram positivos tanto no teste Imunocromatografico quanto no hemoparasitologico. Em relação aos filhotes nenhum se apresentou positivo em ambos os testes.
O teste imunocromatografico é utilizado para detecção de apenas um tipo de hemoparasitose (Erlichia Canis) o que reforça a necessidade de associar mais de um tipo de teste, onde o exame hemoparasitológico é capaz de identificar inúmeras hemoparasitoses que se encontram no interior das células, por se tratar de um teste qualitativo o mesmo faz a ligação de antígeno e anticorpo detectando se o paciente foi exposto ou não ao patógeno.
Já no exame Hemoparasitológico, observa-se que além de identificar o parasito pesquisado, também pode ser identificado outros tipos de agentes patológicos como: Babesia, Anaplasma, Doença de Lyme, Dirofilariose e Hepatozoon se mostrando mais eficaz quando associado a outros métodos de diagnóstico.
TABELA 2 – Número de animais adultos e filhotes positivos no teste imunocromatografia e no exame hemoparasitológico.
IDADE NÚMERO DE ANIMAIS TESTE IMUNOCROMATOGRAFIA HEMOPARASITOL ÓGICO POSITIVOS POSITIVOS ADULTOS (2 A 15 a) 13 03 03 FILHOTES (0 a 12 m) 03 0 0 TOTAL 43 03 03
A tabela 3 mostra que 11 Animais foram negativos no teste ELISA (4dx) somando adultos e filhotes porém, foram positivos no exame hemoparasitológico de sangue indicando a importância do mesmo como teste confirmatório sugerindo que muitas vezes ocorre reações falso negativas, portanto conclui-se que o exame parasitológico, nessa pesquisa mostrou-se superior ao teste ELISA (4dx).
TABELA 3 – Número de animais (adultos e filhotes) negativos no teste ELISA(4dx) e positivos no exame hemoparasitológico.
IDADE NÚMERO DE ANIMAIS TESTE 4DX ELISA HEMOPARASITOLÓGICO NEGATIVOS POSITIVOS ADULTOS (2 A 15 a) 36 08 08 FILHOTES (0 a 12 m) 07 03 03 TOTAL 43 11 11
A tabela 4 mostra que dos 16 animais submetidos ao teste de Imunocromatografia e hemoparasitológico, 13 adultos se mostraram positivos para imunocromatografia enquanto 10 animais foram negativos no exame hemoparasitológico, e somente 3 animais adultos se mostraram positivos em ambos os testes, sugerindo um possível resultado falso positivo do teste Imunocromatografia.
Observa-se ainda que 32,6% dos animais testados foram positivos no teste Imunocromatografia, enquanto 25,6% dos animais se mostraram negativos no exame hemoparasitologico.
TABELA 4 – Número de animais (adultos e filhotes) negativos no teste Imunocromatografia e positivos no exame hemoparasitológico.
IDADE NÚMERO DE ANIMAIS TESTE IMUNOCROMATOGRAFIA HEMOPARASITOLÓGICO POSITIVO NEGATIVO ADULTOS (2 A 15 a) 16 13 10 FILHOTES (0 a 12 m) 03 01 01 TOTAL 43 14 11
4. TÍTULO ou (SUBTÍTULOS DOS ARTIGO) o que é aqui???
Segundo a pesquisa de FERNANDES (2017), a anemia é uma doença clínica e alteração de laboratório com múltiplas causas subjacentes. Por diversas razões, acredita-se que os hemoparasitas sejam a raiz da anemia. O autor fez a ousada afirmação de que Ehrlichia canis, Babesia spp., Anaplasma platys e Hepatozoon spp.
foram encontrados em animais anêmicos atendidos no Hospital Veterinário da UFPB. Para fins de detecção de Ehrlichia canis, Babesia spp., Anaplasma platys e Hepatozoon spp., FERNADADES (2017) utilizou 95 amostras de animais anêmicos, que foram submetidas à extração de DNA e análise de reação em cadeia polimerase (PCR), foram encontrados em 67,3% dos animais, E. canis esteve em 31,6%, A. platys esteve em 10,5% dos animais e Babesia spp. Em 45,3%. Nas infecções, podem ser observados dois hemoparasitas, sendo que 16,8% dos animais tiveram infecções simultâneas por três hemoparasitas. A autora conclui que a investigação direta de hemoparasitas apresentou resultados falso-negativos e falso – positivos em relação à PCR, que o uso da PCR é fundamental porque auxilia no diagnóstico definitivo de casos de hemoparasitoses em animais.
Já na atual pesquisa, observou-se que os testes analisados Elisa e Imunocromatrografia apresentaram falsos negativos e falsos positivos devido a exposição ao agente patológico, sendo assim fez-se muito necessário realizar a contraprova utilizando o hemoparasitológico. Na lâmina foi possível detectar a presença do patógeno intracelular e também a associação de mais de um parasito presente na mesma amostra assim como a conclusão da autora acima citada.
Segundo Bittencourt (2022), as doenças hemoparasitárias possuem significativa importância na clínica de pequenos animais devido à sua alta prevalência e ampla distribuição no território brasileiro. Os principais agentes responsáveis pelas infecções caninas incluem Babesia sp., Ehrlichia canis e Hepatozoon canis. Os animais infectados são assintomáticos ou apresentam sinais clínicos vagos, sendo necessária a utilização de testes diagnósticos para identificar o agente etiológico e fornecer um diagnóstico confiável.
Segundo o autor, o objetivo do estudo foi identificar a presença desses microrganismos em cães naturalmente infectados residentes nos municípios de Vila Velha e Anchieta, no Espírito Santo, por meio de diversos métodos de detecção , incluindo reação em cadeia da polimerase por transcrição reversa ( PCR ),sorologia para detecção de anticorpos contra Ehrlichia canis e hematozoários em esfregaço sanguíneo.
Bittencourt (2022) examinou 65 amostras de sangue obtidas por punção venosa de veia cefálica. No teste PCR, 4,62% dos animais testaram positivo para Babesia vogeli e 1,54% testaram positivo para Ehrlichia canis, sendo negativo para Hepatozoon canis. Os animais testaram positivo para presença de anticorpos, e no estudo dos fatores de coagulação sanguínea, 3% das amostras testaram positivo para outros hemoparasitas.
Os resultados mostram que esses hemoparasitas estão disseminados na população canina da região de estudo, mas ainda há concordância. O teste PCR mostrou- se o mais preciso, sendo Babesia vogeli o agente mais frequentemente observado.
Os hemoparasitas mais frequentemente transmitidos via carrapatos, de acordo com Alves (2020) encontrados durante procedimentos clínicos de rotina, embora haja poucas descrições de coinfecção simultânea com esses agentes em hemogramas. Diante do exposto, o objetivo deste estudo foi descrever os casos de quatro caninos atendidos no Hospital Veterinário Adalio Santos de Azevedo (HV -ASA) do Instituto Federal de Educação, Ciência e Tecnologia do Paraguai (IFPB), campus Sousa, que foi diagnosticado com coinfecção por Ehrlichia spp. e Hepatozoon canis.
Foi relatado que os pacientes apresentavam carrapatos, hiporexia, oligodipsia no momento da avaliação clínica. Posteriormente foram realizados, hemogramas e todos os animais apresentaram anemia leve a moderada. Adicionalmente, notou-se que os animais 2 e 3 apresentavam neutrofilia, enquanto o animal 1 apresentava trombocitopenia ALVES (2022). Infecção por H. canis e E. spp. foi visto na amostra dos quatro animais.
Dessa forma, essa história ilustrou a importância de usar o hemograma e investigar os agentes responsáveis pelas hemoparasitoses através de um esfregaço sanguíneo. Deve-se enfatizar que o teste em lâmina, embora seja um método pouco confiável e de baixa sensibilidade, pode e deve ser usado rotineiramente porque é uma técnica fácil, rápida, acessível, minimamente invasiva e de diagnóstica conclusivo. ALVES (2022).
Assim como Alves (2022), a atual pesquisa também foi capaz de observar a importância da realização da lâmina que apesar de apresentar baixa sensibilidade, é capaz de descartar os resultados tanto falso negativo quanto positivo, essa baixa sensibilidade deve-se ao fato de o exame não identificar a presença de anticorpos mais sim, de fato a presença do agente causador.
Em seu trabalho, FERRAZ (2021) observa que por ser rápido, fácil e de preço razoável, o exame microscópico direto de fluorescência sanguínea é frequentemente utilizado no diagnóstico hemoparasitológico de rotina. O método tem um alto grau de especificidade, mas um baixo grau de sensibilidade. Isso é porque o hemoparasita tem sua visualização mais provável de ocorrer nos estágios finais, quando a parasitemia é menor, tornando mais provável a ocorrência de resultados falsos negativos. O autor também descreveu o caso de um cão infectado com espécies de Babesia e Anaplasma platys, determinadas por técnicas microscópicas e de biologia molecular, respectivamente.
Sendo assim, mais uma vez a atual pesquisa se encaixa com o desenvolvimento de outros autores que, também puderam observar que o exame microscópico pode ajudar o clínico a chegar a um diagnóstico definitivo dando continuidade ao tratamento do paciente, visto que, a clínica sendo soberana deve ser conciliada com outros exames e sintomatologias apresentadas. Ao mesmo passo que ao desenvolver a parte prática da pesquisa observamos que quanto mais sintomas estavam aparentes, mais resultados positivos foram visualizados, principalmente quando se tratava da presença de Anaplasma e Babesia, sendo assim faz-se necessário investir e investigar a real acurácia do exame hemoparasitológico, visto que pode ser que ele auxilia no estágio agudo das patologias aqui descritas.
5. CONSIDERAÇÕES FINAIS
Visto que os protozóarios Anaplasma e Babesia são patógenos comuns em espécies Bovinas e Equinas, podemos levantar duas hipóteses a respeito de sua presença na clínica de pequenos animais. A primeira deve-se a expansão do meio urbano para o meio rural facilitando o contato direto com o agente etiológico. A segunda hipótese sugere-se que com o passar dos anos os pets tornam-se membros da família, sendo assim, estão presentes em viagens, visitas a sítios, fazendas e até mesmo em hotéis.
Para evitar este repasse do patógeno pelo hospedeiro intermediário faz-se necessário os métodos profiláticos.
Em relação aos testes rápidos e o exame hemoparasitológico, ao desenvolver a pesquisa tanto teórica quanto prática, observamos a importância da associação do teste rápido seja ELISA ou imunocromatografia com o hemoparasitológico, para se evitar tanto falsos-positivos quanto falsos-negativos, chegando a um diagnóstico definitivo mais claro e fidedigno.
REFERÊNCIAS
MOURA AGUIAR, D. et al. Ciência Rural, v.37, n.3, mai-jun. Ciência Rural, n. 3, p. 796–802, 2007. https://www.scielo.br/j/cr/a/7YQwjSV7GzLFGSmQrQwVK8g/?format=pdf&lang=pt
ALVES, M. DE M. et al. DIAGNÓSTICO HEMATOLÓGICO DE COINFECÇÃO POR Ehrlichia spp. E Hepatozoon canis EM CÃES NO SEMIÁRIDO DA PARAÍBA. Ciência Animal, v. 32, n. 4, p. 188–197, 25 dez. 2022.https://revistas.uece.br/index.php/cienciaanimal/article/view/9965/8215
BITTENCOURT, J. et al. A OCORRÊNCIA DE Babesia sp., Ehrlichia canis E Hepatozoon canis EM CÃES DOMICILIADOS, EM DOIS MUNICÍPIOS DO ESTADO DO ESPÍRITO SANTO – BRASIL. Veterinária e Zootecnia, v. 29, p. 1–9, 15 mar. 2022. https://rvz.emnuvens.com.br/rvz/article/view/611.
DÓRIA, R. G. S. et al. Investigação clínica e comparação do esfregaço sanguíneo e PCR para diagnóstico de hemoparasitas em equinos de esporte e tração (carroceiros). Pesquisa Veterinária Brasileira, v. 36, n. 8, p. 724–730, ago. 2016. https://www.scielo.br/j/pvb/a/F3J3zXhBLJWHnx9frg4LgRG/?lang=pt
FERNANDES, M. IDENTIFICAÇÃO MOLECULAR DA EHRLICHIA CANIS, BABESIA SPP., ANAPLASMA PLATYS E HEPATOZOON SPP. EM CÃES ANÊMICOS ATENDIDOS NO HOSPITAL VETERINÁRIO DA UFPB. Disponível em: <https://repositorio.ufpb.br/jspui/handle/123456789/1967?locale=pt_BR>. Acesso em: 25 out. 2023. https://repositorio.ufpb.br/jspui/handle/123456789/1967?locale=pt_BR
FERRAZ, A. et al. Coinfecção por Babesia spp. e Anaplasma platys em canino doméstico, relato de caso. Scire Salutis, v. 11, n. 1, p. 1–6, 2021. https://sustenere.co/index.php/sciresalutis/article/view/CBPC2236-9600.2021.001.0001
FOURNIER, P.-E. European Society for Coxiellosis, Chlamydioses, Anaplasmoses and Rickettsioses – American Society for Rickettsiology joint meeting 2017. New Microbes and New Infections, v. 23, p. 6, maio 2018. https://www.sciencedirect.com/science/article/pii/S2052297518300076?via%3Dihub.
ALVES, M. DE M. et al. DIAGNÓSTICO HEMATOLÓGICO DE COINFECÇÃO POR Ehrlichia spp. E Hepatozoon canis EM CÃES NO SEMIÁRIDO DA PARAÍBA. Ciência Animal, v. 32, n. 4, p. 188–197, 25 dez. 2022. https://revistas.uece.br/index.php/cienciaanimal/article/view/9965
HOLANDA, L. C. DE et al. ACHADOS HEMATOLÓGICOS EM SANGUE E MEDULA ÓSSEA DE CÃES NATURALMENTE INFECTADOS POR Ehrlichia spp. E Anaplasma spp. Ciência Animal Brasileira, v. 20, 2019. https://www.scielo.br/j/cab/a/5STCxcjNGyqmNzRBzTTm7yK/
OLIVEIRA, A. C. DE. Diagnóstico das hemoparasitoses caninas por biologia molecular, alterações hematológicas e centrifugação por gradiente. www.locus.ufv.br, 27 fev. 2015. https://www.locus.ufv.br/handle/123456789/6514
PADILHA, V. M. et al. Erliquiose monocítica canina recidivante: relato de caso. Pubvet, v. 14, n. 5, p. 1–7, maio 2020. https://ojs.pubvet.com.br/index.php/revista/article/view/584
SANTOS, G. C. M. DOS. Perfil farmacocinético e eficácia contra Ctenocephalides felis felis e Rhipicephalus sanguineus do fipronil administrado pela via oral em cães. tede.ufrrj.br, 27 ago. 2021. https://tede.ufrrj.br/jspui/handle/jspui/6489
SILVEIRA, A. DE M. et al. Levantamento de hemoparasitoses em cães e gatos no Hospital Veterinário Dr. Vicente Borelli – Aracaju – Sergipe. Pubvet, v. 13, n. 1, p. 1–5, jan. 2019. http://ojs.pubvet.com.br/index.php/revista/article/view/940
SOUSA, E. J. N. et al. Coinfecção de anaplasmose e erliquiose: Relato de caso. Pubvet, v. 15, n. 5, p. 1–6, maio 2021. https://ojs.pubvet.com.br/index.php/revista/article/view/255
STIVAL, C. et al. Erliquiose monocitotrópica canina: Revisão. Pubvet, v. 15, n. 1, p. 1–7, jan. 2021. https://ojs.pubvet.com.br/index.php/revista/article/view/649#:~:text=%C3%89%20uma%20pandemia%2C%20que%20tem,normoc%C3%ADtica%20normocr%C3%B4mica%2C%20leucopenia%20e%20trombocitopenia.
VALENTE, P. C. L. G. Avaliação dos métodos diagnósticos e dos parâmetros hematológicos nas hemoparasitoses caninas no estado de Minas Gerais. repositorio.ufmg.br, 28 abr. 2014. https://repositorio.ufmg.br/handle/1843/SMOC-9SQFD5
WEBSIX. Atena Editora. Disponível em: <https://www.atenaeditora.com.br/catalogo/post/tecnicas-de-esfregacos-sanguineos-na-pesquisa-de-ehrlichia-spp-em-caes-assintomaticos>. Acesso em: 26 out. 2023. https://www.atenaeditora.com.br/catalogo/post/tecnicas-de-esfregacos-sanguineos-na-pesquisa-de-ehrlichia-spp-em-caes-assintomaticos
GUIMARÃES, G. DE M. et al. Principais alterações no hemograma de cães domésticos do Município de Formiga-MG de 2017 a 2019 / Main changes in the blood count of domestic dogs in the Municipality of Formiga-MG from 2017 to 2019. Brazilian Journal of Development, v. 8, n. 5, p. 36373–36380, 11 maio 2022. https://ojs.brazilianjournals.com.br/ojs/index.php/BRJD/article/view/47871
WAGNER DE MATOS, R.; BEATRIZ, A.; ROCHA-LIMA, C. Alterações hematológicas em cães diagnosticados com Erliquiose Monocítica Canina Hematological disorders in diagnosed dogs with Canine Monocytic Ehrlichiosis. J Health Sci Inst, v. 39, n. 1, p. 24–32, 2021. https://repositorio.unip.br/wp-content/uploads/tainacan-items/34088/78541/04V39_n1_2021_p24a28.pdf
AE, S. et al. ASPECTOS EPIDEMIOLÓGICOS E HEMATOLÓGICOS DE CÃES INFECTADOS COM EHRLICHIA SP E ANAPLASMA SP EM JATAÍ-GO, BRASIL. [s.l: s.n.]. Disponível em: <https://rvz.emnuvens.com.br/rvz/article/download/526/309/2391>. Acesso em: 26 out. 2023.https://rvz.emnuvens.com.br/rvz/article/download/526/309/2391
SANTOS, J. C. DOS et al. Avaliação da ocorrência de carrapatos (Acari:Ixodidae) em cães domésticos no Município de Soure- Marajó/PA/Evaluation of the occurrence of ticks (Acari:Ixodidae) in domestic dogs in the municipality of Soure-Marajó/PA. Brazilian Journal of Development, v. 8, n. 4, p. 31439–31448, 27 abr. 2022. https://ojs.brazilianjournals.com.br/ojs/index.php/BRJD/article/view/47165
Casa – IDEXX Brasil. Disponível em: <https://www.idexx.com.br/pt-br/>. Acesso em: 26 out. 2023. https://www.idexx.com.br/pt-br/
1 Graduanda em Medicina Veterinária, FPM – 2023.
E-mail: renia11147@alunofpm.com.br
2 Professora Especialista da Graduação, FPM 2023.
E-mail: cristiane.silva@faculdadepatosdeminas.edu.br
3 Professora Doutora da Graduação e Pós-graduação, FPM – 2023.
E-mail: sandra.cardoso@faculdadepatosdeminas.edu.br
