SEROLOGICAL DETECTION OF HCV IN HEMOTHERAPY PRODUCTIONS AFTER NAT DEPLOYMENT.
REGISTRO DOI: 10.5281/zenodo.10079012
Caroline Tavares Martins de Almeida1
Larissa Morais Leitão2
Leticia Pereira Coelho3
Roberta Sayuri Mascia4
Angélica Aragon Spinelli5
RESUMO
O teste do ácido nucleico (NAT) é capaz de identificar a presença de material genético (RNA viral) de agentes infecciosos virais que não são detectáveis em testes sorológicos convencionais através da amplificação do vírus na amostra de sangue do doador, essa tecnologia possibilitou a redução da janela imunológica do HCV de 49-70 dias para 10-12 dias. Diagnosticar a hepatite C (HCV) é desafiador, visto que geralmente ocorre durante a fase crônica, uma vez que a doença é frequentemente assintomática, elevando assim o risco de contaminação por vias de transfusão sanguíneas. A combinação do NAT com testes sorológicos é fundamental para minimizar esse risco, visto que possibilita a detecção da presença viral nos estágios iniciais logo após a infecção, enquanto os testes sorológicos detectam os antígenos e anticorpos, minimizando o risco infeccioso das transfusões e garantindo a segurança do receptor de sangue e hemoderivados. A construção do artigo partiu da hipótese de que a implementação do NAT poderia resultar em um aumento na detecção de bolsas contaminadas com HCV, porém as análises de dados revelaram que, a partir de 2014, houve apenas uma pequena variação dos números, considerando assim que não houve mudança significativa. Nesse contexto, o presente artigo considera que o principal benefício do NAT é a redução da janela imunológica, uma vez que a pesquisa do RNA viral possibilita a entrega de resultados confiáveis devido à maior sensibilidade do teste quando comparado ao período anterior à sua implementação.
Palavras-chave: NAT, hepatite C, Transfusão.
Abstract
The nucleic acid test (NAT) is capable of identifying the presence of genetic material (viral RNA) of viral infectious agents that are not detectable in conventional serological tests through the amplification of the virus in the donor’s blood sample. from the HCV immunological window of 49-70 days to 10-12 days. Diagnosing hepatitis C (HCV) is challenging, as it generally occurs during the chronic phase, as the disease is often asymptomatic, thus increasing the risk of contamination via blood transfusion routes. The combination of NAT with serological tests is essential to minimize this risk, as it makes it possible to detect viral presence in the early stages immediately after infection, while serological tests detect antigens and antibodies, minimizing the infectious risk of transfusions and ensuring safety recipient of blood and blood products. The construction of the article was based on the hypothesis that the implementation of NAT could result in an increase in the detection of bags contaminated with HCV, however data analyzes revealed that, from 2014 onwards, there was only a small variation in the numbers, thus considering that there was no significant change. In this context, this article considers that the main benefit of NAT is the reduction of the immunological window, since viral RNA research allows the delivery of reliable results due to the greater sensitivity of the test when compared to the period prior to its implementation.
Keywords: NAT, hepatitis C, Transfusion.
1. INTRODUÇÃO
Durante muito tempo, a hepatite C foi negligenciada no âmbito da saúde pública decorrente da sua natureza silenciosa e progressão lenta, sendo comum em muitas doenças crônicas (Brasil, 2023a). Inserido nesse cenário, a transmissão de patógenos por transfusão sanguínea nos bancos de sangue, representava a problemática de expor ao risco os receptores de bolsas de sangue. Portanto, visando a segurança transfusional nos hemocentros nacionais, foi instituído a obrigatoriedade da realização de testes sorológicos para a hepatite C, regulamentado através da portaria de nº 1.376, de 19 de novembro de 1993 (Brasil, 1993b).
Com abrangência geral, a portaria de n° 158 de 4 de fevereiro de 2016 (Brasil, 2016c) regulamenta a obrigatoriedade da coleta de tubos destinado a testagem sorológica, sendo submetidos a tecnologia de imunocromatografia de fluxo lateral, possibilitando a detecção, caso presente, do anticorpo anti-HCV (Brasil, 2019d). Entretanto, o período de janela imunológica do HCV, ou seja, intervalo entre a infecção até a detecção de anticorpos contra o agente infeccioso, é de 33 a 129 dias (Brasil, 2018e), oferecendo risco de transmissão via parenteral através da transfusão. Objetivando minimizar a contaminação durante o período de janela imunológica, foi implantado na rede hemoterápica pública de saúde o Teste do Ácido Nucleico (NAT), o qual possibilita a amplificação e detecção do material genético do vírus da hepatite C previamente a produção de anticorpos detectáveis em testes sorológicos, reduzindo, portanto, o período de janela imunológica para até 12 dias (Fiocruz, 2022).
A relevância e aplicabilidade do NAT nos bancos de sangue, após a obrigatoriedade de implantação determinada a partir de 2014, serão discutidas no presente artigo. Para isso, foram utilizados dados dos boletins hemoterápicos e os cadernos de informação do sangue e derivados, visando validar a hipótese de que houve um aumento da detecção de bolsas contaminadas com hepatite C a partir da implantação do NAT devido maior sensibilidade do teste.
2. FUNDAMENTAÇÃO TEÓRICA
2.1. O vírus da hepatite C
Descoberto em 1989 por Choo e colaboradores, o vírus da hepatite C era anteriormente denominado de “hepatite Não A Não B”. A principal forma de transmissão é via parenteral, e dentre a população de risco encontram-se indivíduos que receberam transfusão de sangue e/ou hemoderivados anteriormente a 1993, quando foi implantado a testagem sorológica para o HCV nos hemocentros nacionais. A progressão crônica da doença é observada em aproximadamente 70% a 85% dos casos, com uma média de um quarto e um terço destes pacientes desenvolvendo formas histológicas graves ou cirrose (Brasil, 2018e).
O HCV foi o membro inicial do gênero Hepacivirus, da família Flaviviridae, sua partícula viral contém um envelope lipoproteico com duas glicoproteínas de envelope (E1 e E2) e um capsídeo proteico que envolve o genoma viral, constituído por uma molécula de RNA, conforme figura 1.
Figura 1: estrutura da partícula do vírus da hepatite C
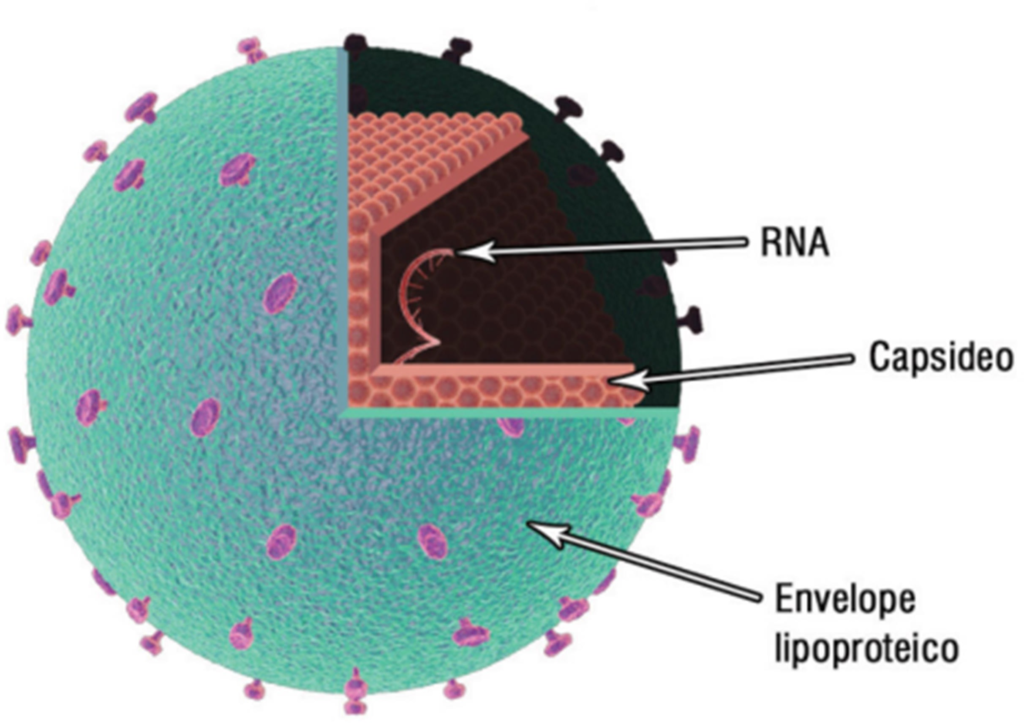
Fonte: Brasil (2018e, p.74)
A maneira como o HCV adentra nas células é um processo complexo que envolve várias proteínas do hospedeiro, como glicosaminoglicanas (GAG), receptor de lipoproteína de baixa densidade (LDLR), receptor de lipoproteína de alta densidade SR-BI, CD81, claudina-1 (CLDN1) e ocludina (OCLN). Essas proteínas são utilizadas sequencialmente pelo vírion para entrar na célula. A replicação do genoma do HCV ocorre no retículo endoplasmático rugoso, onde uma poliproteína precursora é traduzida a partir de um modelo de RNA positivo. Essa poliproteína é processada por proteases celulares e virais para gerar as dez proteínas virais do HCV: core, E1 e E2, p7, NS2, NS3, NS4A, NS4B, NS5A e NS5B. Os estágios finais do ciclo de vida do HCV envolvem a montagem e liberação das partículas virais, portanto, o core do vírus se realoca na membrana do retículo endoplasmático, onde se combina com gotículas de lipídios. Acredita-se que o RNA viral seja trazido para o core pela NS5B, e há uma interação com a proteína NS5A, sendo que a interação entre NS5A e o core leva à formação do nucleocapsídeo. As partículas virais recém-formadas são liberadas do retículo endoplasmático em um processo relacionado à síntese de VLDL (lipoproteínas de muito baixa densidade) e requer a participação de várias enzimas do hospedeiro (Brasil, 2018e).
Entre 2000 e 2022 foram identificados no Brasil 85.486 óbitos associados às hepatites virais, correspondendo a 76,1% consequente da hepatite C; 21.5% à hepatite B; 1,5% à hepatite A e 0,9% à hepatite D (Brasil, 2023a). Sendo a hepatite mais letal nos últimos anos, devido à alta taxa de casos assintomáticos, que chega a cerca de 80%, o diagnóstico da hepatite C é desafiador e costuma ocorrer tipicamente durante a fase crônica. Além disso, indivíduos que contraíram o HCV através de transfusão sanguínea, desenvolveram mais frequentemente a forma crônica em comparação àqueles infectados por outras vias (Brasil, 2018e). Diante disso, é de suma importância a implantação de medidas que garantam a minimização do risco de transmissão via parenteral através da transfusão de sangue, garantindo maior segurança para o receptor.
2.2. Teste convencional do HCV no banco de sangue
Anteriormente, para detecção do HCV em bolsas de sangue utilizava-se inicialmente os testes rápidos (TR), que poderiam ser coletados através da polpa digital. O teste baseia-se no método imunocromotográfico, determinando de forma qualitativa, ou seja, positivo ou negativo, o anticorpo anti-HCV através da utilização de antígenos sintéticos e recombinantes imobilizados na membrana para identificação seletiva de anti-HCV em amostra mínima de soro ou sangue. Para um TR ser considerado válido, é necessário a presença de uma linha ou ponto na região C que indica controle no dispositivo teste, na ausência da linha controle, o teste referido deve ser desconsiderado e realizado novamente em novo dispositivo. Caso o resultado permaneça inválido, é necessário coletar uma punção venosa e encaminhar ao laboratório para ser realizado o método Elisa. Para resultado não reagente, mas, com suspeita de contaminação, é recomendado repetir o teste após 30 dias.
Em relação as amostras com resultados reagentes, é imprescindível a coleta de uma nova amostra, na qual será encaminhada para realização do teste confirmatório, o Elisa (Brasil, 2015f). O método Elisa consiste em um imunoensaio capaz de detectar a infecção pelo HCV, porém não distingue doença ativa e contato anterior com o vírus, indicando apenas a exposição ao vírus (Carboni et al., 2020).
Obtido resultado positivo no Elisa, a amostra é submetida a um segundo teste confirmatório, o Imunoblot (também conhecido como RIBA). A técnica consiste na utilização de eletroforese em gel visando a detecção de anticorpos anti-HCV (Cepac, 2023), caso presente. Entretanto, o período de janela imunológica, isto é, o tempo entre o contato do vírus com o organismo até a produção de anticorpos em níveis detectáveis, varia de 33 a 129 dias (Brasil, 2018e), fomentando o desenvolvimento de testes que garantam maior segurança transfusional. A partir disso, surge o teste do ácido nucleico (NAT) reduzindo o período de janela imunológica para até 12 dias (Carboni et al., 2020).
2.3. O teste do ácido nucleico (NAT)
O NAT (teste do ácido nucleico) é uma tecnologia desenvolvida para a detecção do RNA e DNA de agentes infecciosos virais que não são detectáveis em testes sorológicos convencionais. O primeiro país a utilizar o NAT em serviços de hemoterapia foi a Alemanha em 1997, após confirmação da sua eficácia na rotina de triagem, em 1998 e 1999, o teste começou a ser disseminado em outros países desenvolvidos, estima-se que em 2010, cerca de 33 países já tinham incorporado essa tecnologia nos serviços hemoterápicos (Roth et al., 2012).
Em 2002 o Ministério da Saúde recomendou pela legislação brasileira através de duas portarias – n° 262 de 05/02/2002 e n° 1407 de 01/08/2002) a utilização do teste nos bancos de sangue do país com o objetivo de reduzir, em um prazo de seis meses, a transmissão de doenças contagiosas via transfusão (vírus da AIDS e da Hepatite C) na rotina de testagem de sangue. A Portaria nº 262 foi revogada pela Portaria MS/GM nº 1.407, de 01 de agosto de 2002, postergando a inclusão do NAT pelos bancos de sangue do país por mais seis meses, e em 31 de janeiro de 2003 houve mais 12 meses de ampliação. Finalmente, a Portaria nº 112, de 29 de janeiro de 2004, estabeleceu que a implantação do NAT deveria ocorrer em etapas e de forma gradativa, sem definição de prazo para a sua adoção por todos os serviços de hemoterapia (Brasil, 2004). Essa decisão do Ministério da Saúde se deu de forma associada a uma consulta ao laboratório de biotecnologia oficial do MS o Instituto de Tecnologia em Imunobiológicos, Bio-Manguinhos, ligado à Fiocruz para verificar se o país seria capaz de produzir uma versão local do NAT em escala industrial.
As portarias constituíram a garantia de qualidade em todo o seu processo para ser considerados obrigatório, no âmbito da Hemorrede Nacional a inclusão nos Serviços de Hemoterapia públicos, filantrópicos e/ou privados contratados pelo SUS, e privados, os testes de amplificação e detecção de ácidos nucléicos – NAT, para o vírus da Hepatite C – HCV, em todas as amostras de sangue de doadores (Brasil, 2002).
O teste do ácido nucleico (NAT) consiste em uma técnica de biologia molecular capaz de identificar a presença de material genético (RNA viral) através da amplificação do vírus na amostra de sangue do doador, com isso, uma partícula viral origina outras milhões de cópias idênticas. (Silva, 2021). O NAT atua como complemento dos testes sorológicos, nos quais juntos tem o propósito de reduzir a transmissão do HCV por meio de transfusões sanguíneas, assegurando a segurança dos receptores de sangue e hemoderivados. Isso se torna crucial, uma vez que os testes do NAT podem identificar de forma precoce a presença viral nos estágios iniciais após a infecção. Além disso, os testes sorológicos são eficazes na detecção de antígenos e anticorpos, o que minimiza o risco de infecção durante as transfusões.
Nesse cenário, quando o teste sorológico é positivo e o NAT é negativo, é necessário realizar uma repetição do teste, se o resultado continuar positivo em um ou nos dois testes, a bolsa de sangue deve ser descartada, no entanto, se ambos os testes apresentarem resultado negativo, a bolsa poderá ser liberada para transfusão. A mesma diretriz se aplica quando tanto os testes sorológicos quanto o NAT são reagentes, o que também requer o descarte da bolsa. Por fim, no caso de ambos os testes não reagentes, a bolsa é liberada para transfusão (Brasil, 2016c).
Com a redução da janela imunológica o tempo que se leva para detectar o HCV, caiu de 49-70 dias através dos testes sorológicos, tempo esse que vai desde a contaminação até a detecção do anticorpo, para 10-12 dias prazo de detecção por biologia molecular (NAT), sendo essa uma grande vantagem, pois é possível detectar o RNA viral com antecedência, quando comparamos ele com outros testes que fazem a pesquisa de anticorpos presentes na amostra. Ressaltando que existem situações em que o NAT será negativo e a sorologia positiva, como em casos de viremia onde o organismo tem o anticorpo e contraria onde tem a presença do mesmo, o que é fundamental para selecionar na bolsa de sangue, mas não a localização do vírus como RNA e DNA, sendo assim naturalmente o teste de biologia molecular pode ser negativo.
O Kit NAT PLUS brasileiro, vide figura 2, é um ensaio baseado na técnica de PCR que faz a na amplificação do RNA e DNA por Reação em Cadeia de Polimerase – PCR em tempo real, sendo necessário utilizar um software (BioLaudos) para a geração do Laudo, contemplando um ensaio triplex discriminatório, com alto grau de automação, alta capacidade de processamento e sensibilidade, que consiste em 3 equipamentos que atuam em etapas consecutivas do teste, conforme figura 3: preparo das amostras em mini-pool de 6, extração de ácidos nucléicos e amplificação/detecção do ácido nucleico.
Figura 2: Kit NAT Brasileiro HIV/HCV/HBV
Fonte: Fiocruz, 2022.
Quando ocorrer resultado detectável para o pool, há o desmembramento e é realizado o teste individual das 6 reações que compõe o pool (Fiocruz, 2022), além disso é um teste que possui alta sensibilidade na detecção de janela imunológica, sendo para o HCV => 11UI/mL.
Figura 3: fluxo metodológico do kit NAT HIV/HCV/HBV – Biomanguinhos
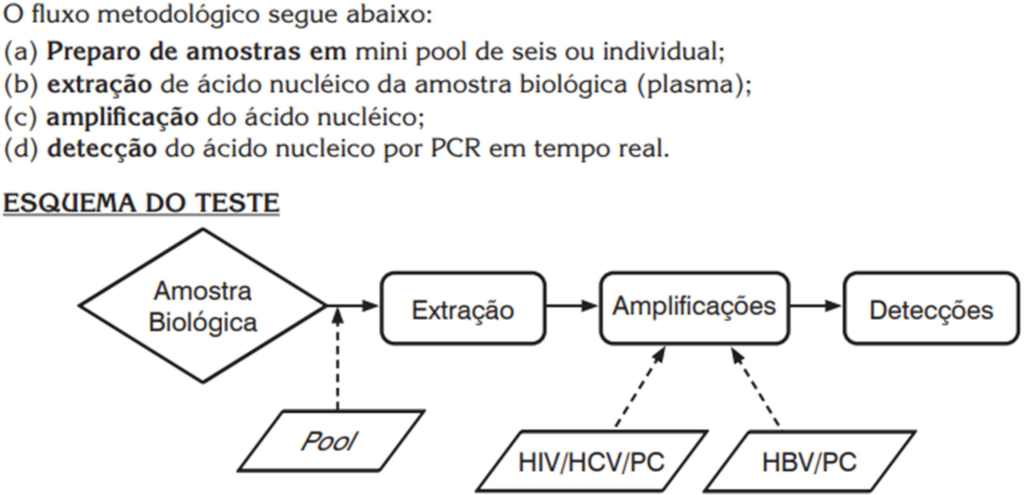
Fonte: Fiocruz (2022, p. 02).
3. METODOLOGIA
Para levantamento dos dados foram utilizados os boletins hemoterápicos do período de 2010 a 2020, nos quais foram extraídas as informações referentes as porcentagens de bolsas detectadas com o vírus da hepatite C. Os dados de quantidade de coletas, bolsas transfundidas e inaptidão foram obtidos através dos cadernos de informação do sangue e derivados lançados de 2010 a 2016, correspondente à última edição, após esse período os referidos dados foram utilizados dos boletins hemoterápicos, pois foram adicionados apenas nas últimas edições.
4. RESULTADOS E DISCUSSÕES
Para análise dos dados foram utilizados 3 fatores: total de coletas realizadas, percentual de bolsas inaptas e percentual de bolsas inaptas por hepatite C. Portanto, após a construção do banco de dados obtidos dos boletins hemoterápicos e cadernos de informação do sangue e derivados, foi aplicado o Teste Buishand Range, que consiste em um método estatístico usado para detectar um ponto de mudança em uma série temporal de dados normalmente distribuídos. Sendo este teste particularmente útil para identificar mudanças abruptas na média de uma variável ao longo do tempo (Buishand, 1982).
A lógica por trás do teste de intervalo de Buishand é comparar os intervalos de duas subséries consecutivas nos dados da série temporal. Se existir um ponto de mudança significativo, espera-se que o intervalo da subsérie após o ponto de mudança seja visivelmente diferente do intervalo da subsérie antes do ponto de mudança. Através de simulações de Monte Carlo, o p-valor é calculado e, caso seja menor que 0,05, consideramos que há um ponto de mudança estatisticamente significativa (Verstraeten et.al, 2006).
4.1. Total de coletas realizadas
O gráfico 1 aborda o total de coletas realizadas do período de 2010 a 2020, sendo os dados de 2010 a 2016 extraídos dos cadernos de informação de sangue e derivados e 2016 a 2020 dos boletins hemoterápicos. A linha vermelha marca a o ano de interesse: 2015, considerando 1 ano após a obrigatoriedade de implantação do NAT no banco de sangue.
Gráfico 1: total de coletas realizadas
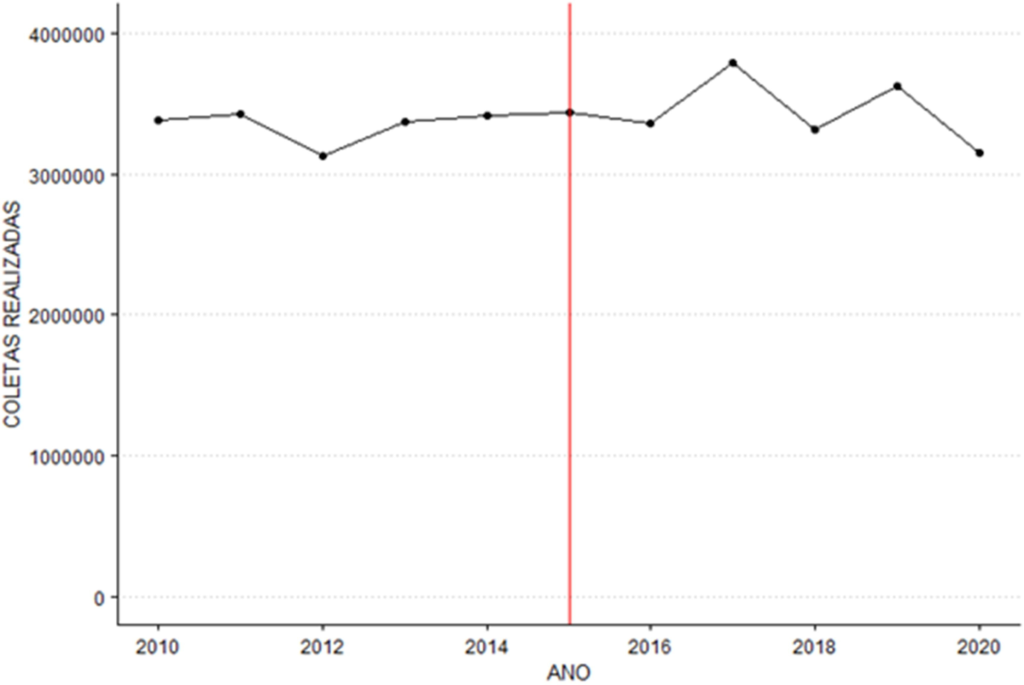
Aplicando o teste de Buishand Range, observa-se uma estatística do teste R / sqrt(n) = 0.868 para uma série temporal de tamanho n = 11. Através de 2000 reamostragens, obteve-se um p-valor de 0.66, indicando, dessa forma, que não há ponto de mudança estatisticamente significativo.
4.2. Percentual de bolsas inaptas
Para embasamento da análise, também foram obtidos o percentual de bolsas inaptas conforme gráfico 2, sendo utilizados os dados dos cadernos de informação de sangue e derivados de 2010 a 2016 e os anos posteriores até 2020 dos boletins hemoterápicos.
Gráfico 2: percentual de bolsas inaptas
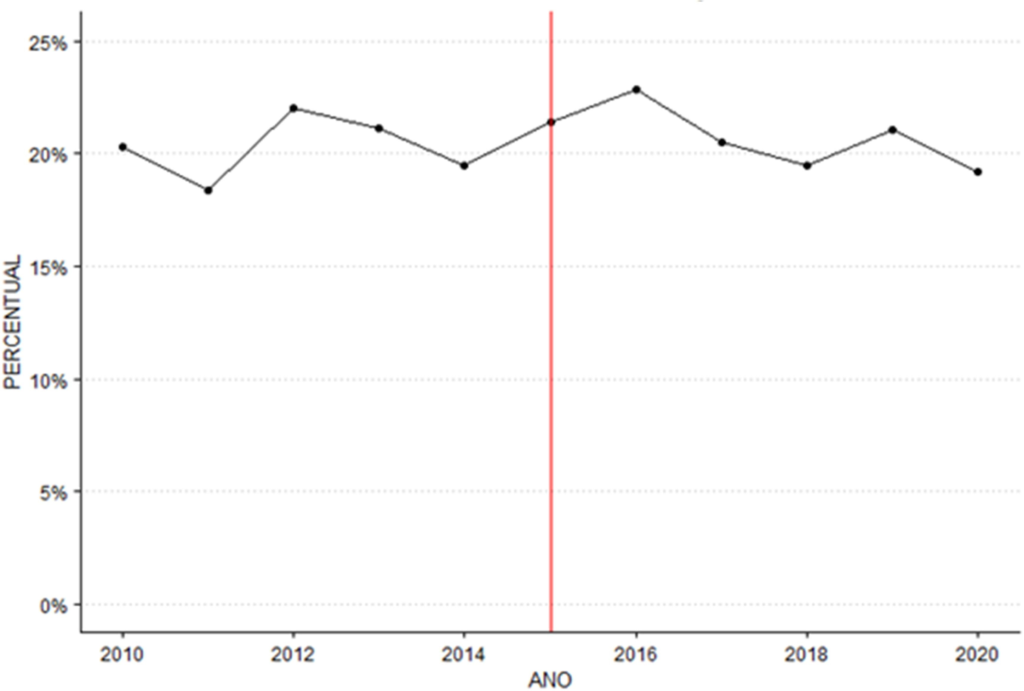
Através do teste de Buishand Range, verifica-se uma estatística do teste R / sqrt(n) = 0.961 para uma série temporal de tamanho n = 11. Por meio de 2000 reamostragens, obteve-se um p-valor de 0.478, indicando, novamente que não há ponto de mudança estatisticamente significativo.
4.3. Percentual de bolsas inaptas por hepatite C
Analisando os boletins hemoterápicos dos anos de 2010 a 2020 foram obtidos os percentuais de inaptidão por hepatite C, podendo ser visualizados no gráfico 3.
Gráfico 3: percentual de bolsas inaptas por hepatite C
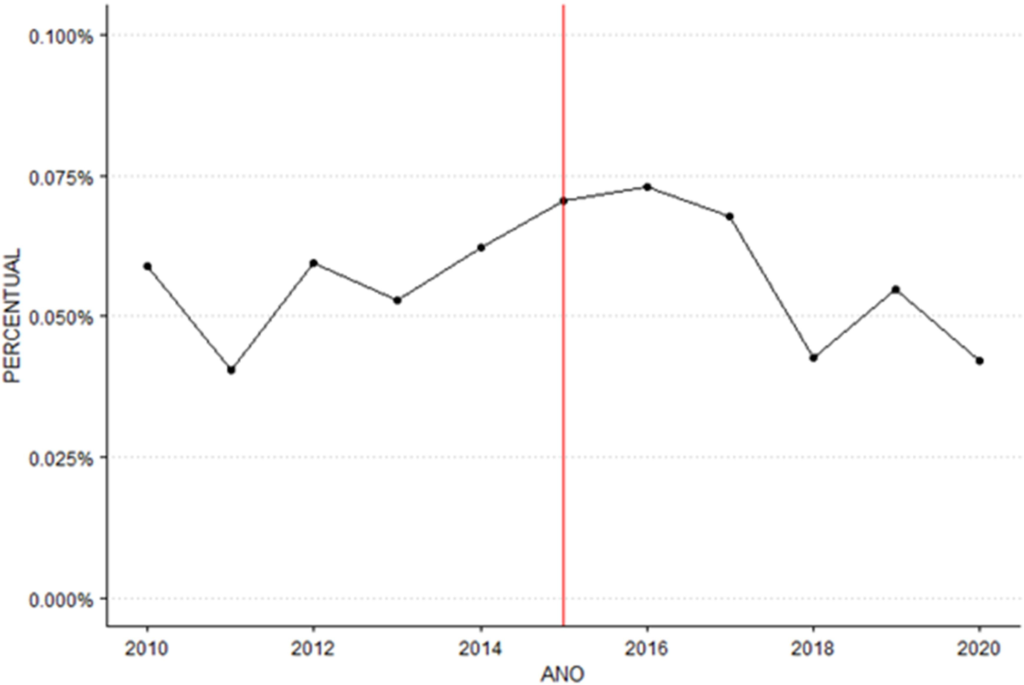
Por meio do teste de Buishand Range, uma estatística do teste R / sqrt(n) de 1.222 foi encontrada para uma série temporal com um tamanho n de 11. Após a realização de 2000 reamostragens, um p-valor de 0.099 foi obtido, o que sugere que não há evidência estatisticamente significativa de um ponto de mudança.
5. CONSIDERAÇÕES FINAIS
O desenvolvimento deste artigo foi baseado em dados disponibilizados pelo ministério da saúde, que não foram atualizados desde 2020, portanto, a análise abrangeu apenas os seis anos após a implementação obrigatória do NAT nos bancos de sangue. Assim, a hipótese inicial de uma correlação entre o aumento da detecção de bolsas contaminadas com hepatite C após a implementação do NAT, devido à maior sensibilidade do teste, não foi confirmada pela análise estatística realizada através do banco de dados divulgado.
No entanto, é importante observar que a hepatite C é frequentemente diagnosticada tardiamente devido à alta taxa de cronificação. Como mencionado previamente, indivíduos que contraíram o HCV por transfusão sanguínea desenvolveram mais frequentemente a forma crônica quando comparados àqueles infectados por outras vias. Dessa forma, compreende-se a importância do investimento em tecnologias que minimizem o risco de transmissão da doença via transfusão sanguínea.
Embora a hipótese inicial não tenha sido confirmada, é importante destacar que o teste NAT é amplamente reconhecido por sua eficácia. Uma de suas principais contribuições consiste na redução significativa da janela imunológica, especialmente no caso da hepatite C, onde esse período foi reduzido de 49-70 dias para apenas 12 dias. Isso é possível graças à detecção direta do RNA viral, no qual independe da resposta imunológica do doador. Essa tecnologia complementa os testes sorológicos, aumentando a sensibilidade e eficácia na triagem sorológica.
REFERÊNCIAS
BRASIL. Ministério da Saúde. Boletim Epidemiológico – Hepatites Virais 2023. Brasília: 2023a. Disponível em: < https://www.gov.br/saude/pt-br/centrais-de- conteudo/publicacoes/boletins/epidemiologicos/especiais/2023/boletim-epidemiologico-de- hepatites-numero-especial-jul.2023/view>.Acesso em: 19 de set. de 2023.
BRASIL. Ministério da Saúde. Manual técnico para o diagnóstico de hepatites virais. Brasília: 2018e. Disponível em:<https://bvsms.saude.gov.br/bvs/publicacoes/manual_tecnico_diagnostico_hepatites_virais.pd f>. Acesso em: 21 de maio de 2023.
BRASIL. Ministério da Saúde. Manual técnico para o diagnóstico das hepatites virais. Brasília: 2015f. Disponível em:<https://www.cevs.rs.gov.br/upload/arquivos/201701/04162030-manual-diagnostico-das- hepatites-virais-ms-2015.pdf > Acesso em: 06 de out. 2023.
BRASIL. Ministério da Saúde. Portaria No 1.376, de 19 de novembro de 1993. Aprova alterações na Portaria nº 721/GM, de 09.08.89, que aprova Normas Técnicas para coleta, processamento e transfusão de sangue, componentes e derivados, e dá outras providências. Brasil, 1993b. Disponível em: <http://redsang.ial.sp.gov.br/site/docs_leis/ps/ps29.pdf>. Acesso em: 16 de maio de 2023.
BRASIL. Ministério da Saúde. Portaria nº 158, de 4 de fevereiro de 2016. Redefine o regulamento técnico de procedimentos hemoterápicos. Brasil, 2016c. Disponível em:< https://bvsms.saude.gov.br/bvs/saudelegis/gm/2016/prt0158_04_02_2016.html >. Acesso em: 01 de set. de 2023.
BRASIL. Ministério da Saúde. Portaria nº 262, de 5 de fevereiro de 2002. Publicada no Diário Oficial da União em 05/02/2002. Brasil, 2002. Disponível em:<https://bvsms.saude.gov.br/bvs/saudelegis/gm/2002/prt0262_05_02_2002.html>. Acesso em 07 set 2023.
BRASIL. Ministério da Saúde. Portaria nº 112, de 29 de janeiro de 2004. Dispõe sobre a implantação, no âmbito da Hemorrede Nacional, da realização dos testes de amplificação e detecção de ácidos nucléicos (NAT), para HIV e HCV. Brasil, 2004. Disponível em:<https://bvsms.saude.gov.br/bvs/saudelegis/gm/2004/prt0112_29_01_2004.html#:~:text=Gabi nete%20do%20Ministro%20PORTARIA%20N%C2%BA%20112%2C%20DE%2029,87%2C%20par%C3%A1grafo%20%C3%BAnico%2C%20inciso%20II%2C%20da%20Constitui% C3%A7%C3%A3o%2C%20e>. Acesso em: 12 de set. de 2023.
BRASIL. Ministério da Saúde. Teste de amplificação de ácidos nucléicos (NAT) para detecção dos vírus da imunodeficiência humana (HIV) e da hepatite C (HCV).Disponível em:<http://antigoconitec.saude.gov.br/images/Incorporados/TesteAmplificacaoAcidosNucleico- NAT final.pdf>. Acesso em 10 set 2023.
BRASIL. SUS – Secretaria de Vigilância em Saúde: SISTEMA TELELAB – Educação Permanente – Biossegurança – Laboratórios de DST, Aids e Hepatites Virais. Teste rápido para o diagnóstico da hepatite C-HCV. Brasil, 2019d. Disponível em: <https://telelab.aids.gov.br/index.php/component/joomdle/course/9-diagnostico-de-hepatites- virais?aula=4 >. Acesso em: 30 de abr. 2023.
BUISHAND, T. A. Some methods for testing the homogeneity of rainfall records. Journal of Hydrology, v. 58, p. 11–27, 1982. Disponível em: < https://www.sciencedirect.com/science/article/abs/pii/002216948290066X>.Acesso em: 10 de out. 2023.
CARBONI, Gabriela; BOEHM, Renata Eliane; DORO, Claudete Mistura; TIECHER, Caroline; EHRHARDT, Alexandre. Análise comparativa de métodos para triagem de HCV em serviços de hemoterapia. Infarma – ciências farmacêuticas, 2020. Disponível em: < https://www.researchgate.net/profile/AlexandreEhrhardt/publication/347459939_ANALISE_ COMPARATIVA_DE_METODOS_PARA_TRIAGEM_DE_HCV_EM_SERVICOS_DE_HEMOTERAPIA/links/60214aa9299bf1cc26b11708/Analise-comparativa-de-metodos-para- triagem-de-HCV-em-servicos-de-hemoterapia.pdf>. Acesso em: 06 de out. 2023.
CEPAC. Anticorpos ANTI-HCV- Cepac, medicina laboratorial. Brasil: 2023. Disponível em: < https://www.cepaclab.com.br/anticorpos-anti- hcv#:~:text=Os%20exames%20a%20seguir%20s%C3%A3o,devem%20ser%20confirmados%20pelo%20imunoblot >. Acesso em: 06 de out. 2023.
Kit NAT HIV/HCV/HBV. [Bula]. Rio de Janeiro: Instituto de Tecnologia em Imuno biológicos – Bio- Manguinhos/ FIOCRUZ. Disponível em: <bm-bul-110-04-r-sn– nat-hiv-hcv-hbv–controle-cr–.pdf (fiocruz.br) >. Acesso em 14 maio. 2023.
PORTELLA, Bernardo. Bio-Manguinhos – Instituto Tecnológico em Imunobiológicos, KITNATHIV/HCV/HBV. Disponível em: <https://www.arca.fiocruz.br/handle/icict/15005>. Acesso em 07 set 2023.
ROCHA, Hermano. TesteRápido:HepatiteC. Medscape: 2023. Disponível em: < https://portugues.medscape.com/verartigo/6509871_3?form=fpf > Acesso em: 06 de out. 2023.
ROCHA, D. R. et al. KitNATPLUSHIV/HBV/HCV/MaláriaBio-Manguinhos: innovation and technological upgrade for NAT as say. In: INTERNATIONAL SYMPOSIUM ON IMMUNOBIOLOGICALS, 7., 2023. Disponível em: <https://www.arca.fiocruz.br/handle/icict/57983>. Acesso em: 12 de set. de 2023.
SILVA, Suely Gonçalves Cordeiro da. NAT : – Testes de Ácidos Nucléicos . Rio de Janeiro. 2021. Power Point. 20 slides. color.
VERSTRAETEN, G. et al. Long‐term (105 years) variability in rain erosivity as derived from 10‐minrain fall depth data for Ukkel (Brussels,Belgium): Implications for assessing soilerosionrates. Journal of geophysical research, v. 111, n. D22, 2006. Disponível em: <https://agupubs.onlinelibrary.wiley.com/doi/10.1029/2006JD007169>. Acesso em: 20 de out. 2023.
1 Discente do Curso Superior de Biomedicina da Universidade Anhembi Morumbi Campus Mooca e-mail: carolinetmartins@outlook.com
2 Discente do Curso Superior de Biomedicina da Universidade Anhembi Morumbi Campus Mooca e-mail: larissamorais125@outlook.com
3 Discente do Curso Superior de Biomedicina da Universidade Anhembi Morumbi Campus Mooca e-mail: pereiraleticia.c@gmail.com
4 Discente do Curso Superior de Biomedicina da Universidade Anhembi Morumbi Campus Mooca e-mail: rsayuri0@gmail.com
5 Docente do Curso Superior de Biomedicina da Universidade Anhembi Morumbi Campus Mooca. Especialista em Análises clínicas e-mail: angelica.spinelli@animaeducacao.com.br
