REGISTRO DOI: 10.5281/zenodo.10068028
Carolina Bastos Gimenes;
Giulia Caixalós Rodrigues da Silva;
Nicole Kondo dos Santos;
Orientador: Jonathan dos Santos Cavalcante
Resumo
As células CAR-T – células T com receptor de antígeno quimérico – são uma importante e promissora terapia imunológica usada no tratamento de alguns tipos de câncer. Essa terapêutica consiste na modificação genética das células T do paciente para o reconhecimento e ataque às células cancerígenas. O processo inicia-se com a retirada de linfócitos T do paciente através da leucaférese e após, há a modificação genética dessas células em laboratório. São introduzidos receptores de antígenos quiméricos (CAR) projetados para se ligarem a um antígeno característico de células tumorais, reconhecendo e atacando-as. Posteriormente ao processo de modificação, as células CAR-T são cultivadas para que se multipliquem e sejam reinfundidas no paciente, de modo que já iniciem a caça as células cancerígenas que expressam o antígeno alvo, ligando-se à eles e desencadeando uma resposta imunológica. Muitas vezes essa resposta imunológica pode ocorrer de uma forma intensa, acarretando efeitos adversos graves como a Síndrome de Liberação de Citocinas, neurotoxicidade e a Doença do Enxerto Contra o Hospedeiro, os quais podem ser controlados com a administração de medicamentos específicos. Esse tipo de tratamento vem mostrando resultados promissores principalmente em neoplasias hematológicas, evidenciando a necessidade do avanço da pesquisa na área da imunoterapia para aprimorar a eficiência e segurança dessa técnica, além de ampliar o tratamento para outros tipos de neoplasias.
Palavras Chaves: CAR-T Cell; modificação genética; imunoterapia; neoplasia.
Abstract
CAR-T cells – chimeric antigen receptor T cells – are an important and promising immunological therapy used in the treatment of some types of cancer. This therapy consists of genetically modifying the patient’s T cells to recognize and attack cancer cells. The process begins with the removal of T lymphocytes from the patient through leukapheresis and then there is the genetic modification of these cells in the laboratory. Chimeric antigen receptors (CAR) designed to bind to an antigen characteristic of tumor cells are introduced, recognizing and attacking them. After the modification process, the CAR-T cells are cultivated so that they multiply and are reinfused into the patient, so that they already start hunting the cancer cells that express the target antigen, binding to them and triggering an immune response. This immune response can often occur intensely, causing serious adverse effects such as Cytokine Release Syndrome, neurotoxicity and Graft-versus-Host Disease, which can be controlled with the administration of specific medications. This type of treatment has shown promising results, especially in hematologic malignancies, highlighting the need for research to advance in the area of immunotherapy to improve the efficiency and safety of this technique, in addition to expanding treatment to other types of neoplasms.
Keywords: CAR-T Cell; genetic modification; imunotherapy; neoplasia.
Introdução
Os Linfomas Não-Hodgkin (LNH) são um grupo heterogêneo de neoplasias originado de células sanguíneas de linhagem linfoide. É caracterizado pela proliferação desenfreada de células malignas em diferentes estágios de maturação, tais como linfócitos B, linfócitos T e células Natural Killer (NK)[1]. Existem variados tipos de LNH, classificados de acordo com seu padrão de crescimento e agressividade. Os linfomas de alto grau – agressivos – apresentam progressão rápida, requerem um tratamento sistêmico e possuem alta probabilidade de cura. Já os linfomas de baixo grau – indolentes – apresentam progressão lenta e baixa probabilidade de cura com terapias convencionais, podendo transformar-se em um linfoma de alto grau caso haja alguma alteração genética[2].
O subtipo mais comum de LNH é o linfoma difuso de grandes células B (LDGCB), responsável por 80% dos casos mais agressivos e 30 a 40% de todos os casos nos países emergentes, sendo predominante a incidência em adultos acima de 70 anos do sexo masculino[3]. Alguns fatores contribuem para o surgimento e avanço do LDGCB, sendo eles ambientais – exposição à radiação ultravioleta -, genéticos – síndromes linfoproliferativas, imunossupressão e doenças inflamatórias crônicas -, ocupacionais – uso de pesticidas e agentes químicos – e alimentícios[3].
A linfadenopatia é a principal manifestação clínica, porém a investigação da doença deve ser realizada de um modo mais abrangente, analisando a história clínica do paciente, antecedentes profissionais, sexuais, viagens recentes, medicamentos e/ou drogas imunossupressoras, exposição à radiação ionizante e a presença de hepatoesplenomegalia[3]. No exame físico os linfonodos estão endurecidos, aderentes e pouco dolorosos, e na maior parte dos casos, há febre, sudorese noturna, perda de peso, fraqueza e mal-estar[3]. O desenvolvimento extralinfático pode ocorrer em qualquer órgão do corpo, sobretudo no trato gastrointestinal, fígado, medula óssea e no sistema nervoso central (SNC) com os sintomas variando dependendo da localidade[2,3].
A fisiopatologia do Linfoma Não Hodgkin é caracterizada pelo crescimento e proliferação descontrolada de células linfáticas anormais, as quais surgem durante as diferentes etapas do desenvolvimento de células B. Os linfócitos B, responsáveis pela defesa do organismo, surgem de tecidos linfóides primários (medula óssea e timo) e se diferenciam nos tecidos linfoides secundários (linfonodos, baço e amigdalas)[4,5].
Para a formação da resposta imune, as modificações no DNA dessas células são essenciais. Entretanto, essas mutações podem contribuir para a ativação de proto-oncogenes – genes normais que se tornam um oncogene (encarregados de controlarem a proliferação das células) – predispondo às anormalidades genéticas e levando ao desenvolvimento do linfoma[3,4,5].
A formação de células B na medula óssea é iniciada pela recombinação de segmentos gênicos que codificam as regiões variáveis (V) de cadeias leve (IgL) e pesada (IgH) dos anticorpos para formar o receptor de células B (BCR), processo conhecido como Recombinação V(D)J (ou somática). Nesse processo, genes codificadores de recombinação (RAG1 e RAG2) codificam enzimas responsáveis pela quebra da cadeia dupla do DNA. Os processos de reparo da dupla fita são ativados em células saudáveis, porém no linfoma essas quebras de filamento podem contribuir para translocações cromossômicas[5,6]. A ativação das células B é realizada no centro germinativo dos linfonodos através de estímulos feitos por antígenos em conjunto com linfócitos T. No centro germinativo, essas células passam por modificações que alteram seu receptor, são elas: recombinação de troca de classe (a cadeia pesada da imunoglobulina muda de IgM para IgG, IgA ou IgE) e hipermutação somática (a cadeia leve (variável) da imunoglobulina é alterada, modificando a afinidade de células B à um antígeno específico). Esses mecanismos são importantes para uma boa resposta imunológica, no entanto o dano ao DNA pode tornar-se patológico[4,5,6].
A imunoterapia vem se mostrando eficaz em alguns tipos de câncer. Ela consiste em estimular o sistema imunológico fazendo com que ele tenha impacto em doenças específicas. Neste caso iremos abranger a respeito do sistema linfohematopoético em que a terapia com células CAR-T teve um avanço na última década. O câncer hematológico é designado através das células de linhagem hematopoiética e em cada uma das etapas de maturação dessas células, pode haver algum tipo de mutação que irá dar início ao câncer[7].
O tratamento de câncer envolvendo CAR-T é realizado em células que possuem o marcador CD19 (alvo), o qual está presente em duas abrangentes categorias de doenças: os linfomas de origem B e nas leucemias linfoblásticas agudas. Especificamente, os resultados têm se mostrado favoráveis em células B refratárias em quatro linhas de tratamento, e as células em que o tratamento pode ser utilizado são os Linfomas de célula B, Leucemias linfoblásticas B e Mielomas múltiplos[8].
Os receptores de células T são proteínas que expressam marcadores específicos capazes de atravessar a membrana celular. Através dele, há o reconhecimento de estruturas presentes na superfície de outras células no organismo[9]. Em sua porção intracelular, ativam uma resposta citotóxica através de uma ligação com seu antígeno específico que desencadeia na morte celular[10].
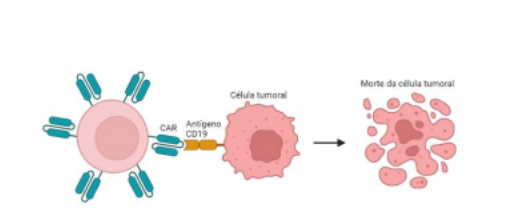
Figura 1. Mecanismo de Ação – Célula CAR-T
Legenda. A célula CART-T se liga com o antígeno CD19, presente na célula tumoral que ocasionam a morte celular.
Fonte. Autoria própria do grupo, feito pelo BioRender.
Justificativa
Sabe-se que o corpo humano é dividido em sistemas, e cada sistema tem uma função específica. O sistema imunológico, ou sistema imune, é um conjunto de órgãos, tecidos e células responsáveis pelo combate e proteção contra qualquer microrganismo invasor, impedindo assim, o desenvolvimento de doenças.
Entretanto, quando ocorre essa invasão, as células do sistema imune são ativadas e atuam de maneira coordenada, identificando o patógeno e ativando mecanismos de defesa com o objetivo de combater esse agente intruso.
É composto por dois tipos de respostas principais: a resposta inata (natural) e a resposta adaptativa (adquirida).
A resposta inata está presente desde o nascimento e assim que o organismo é invadido, ela é estimulada primeiro, agindo rapidamente e facilitando a eliminação do patógeno, porém ela não é tão específica. Quando a imunidade inata não é o suficiente, a adaptativa é estimulada;
A resposta adaptativa é a segunda linha de defesa, no entanto, possui grande importância uma vez que é através dela que são geradas as células de memória. As células de memória, como o nome já diz, evita que infecções pelo mesmo microrganismo ocorram, mas caso ocorra, a infecção será mais leve. Apesar de mais lenta, é mais específica, pois consegue identificar características singulares de cada patógeno, conduzindo assim a resposta imune[11].
A imunoterapia é um tipo de tratamento que causa reação estimulante no sistema imunológico através de meios que modificam a resposta natural biológica para potencializar a reação do corpo de enfrentar possíveis diagnósticos.
Atualmente, os remédios imunoterápicos agem de diversas maneiras. De acordo com as substâncias utilizadas e os mecanismos presentes, a imunoterapia pode ser classificada em passiva e ativa.
Na ativa, são utilizadas substâncias estimulantes projetadas para realizar a restauração da função imunológica (imunoterapia inespecífica) e com vacinas (imunoterapia específica) a fim de intensificar a resposta imune.
Na imunoterapia passiva ou adaptativa, são utilizados anticorpos antitumorais, anticorpos monoclonais e imunoterapêuticos/imunobiológicos que possuem o objetivo de favorecer a capacidade imunológica[12].
A necessidade de acelerar o tratamento de diversos pacientes com as CAR-T cells é de extrema importância no contexto da sociedade brasileira, onde 60% dos casos estudados foram efetivos em cânceres difíceis de serem tratados, como as malignidades de célula B e leucemias linfoblásticas agudas. É também uma opção utilizada principalmente em pacientes que não tiveram respostas favoráveis a tratamentos alternativos anteriores. O tratamento é realizado normalmente em doenças refratárias e não de primeira linha.
A terapia consiste em um medicamento preparado com os linfócitos T, os quais são extraídos e reprojetados geneticamente. A modificação realizada faz com que as células tenham o antígeno CD19 como alvo para atacar as células cancerígenas, desta forma, a célula T que carrega o receptor quimérico irá gerar a morte apenas das células que expressarem o antígeno correspondente. Uma vez que as células já modificadas são introduzidas no paciente, estas continuam a se expandir e se ligam às células neoplásicas malignas por meio do receptor CAR[10].
Para a manipulação das células ser realizada, a coleta de Linfócitos T ou de células marcadas com CD3 é feita através de um procedimento de aférese. O paciente é conectado, por meio de dois acessos venosos, à uma máquina composta por um sistema de centrífuga que processa o sangue e separa as células que serão utilizadas, devolvendo o restante ao paciente[13].
Após o procedimento de coleta, o material é enviado para um centro de manufatura onde é manipulado geneticamente. As células T retiradas do paciente são transduzidas com vetores virais que contém os genes para expressão de CAR[14]. A ligação do antígeno é projetada para ser específica em antígenos nas células tumorais do paciente.
Os vetores virais mais utilizados na terapia CAR-T são da família Retroviridae (Retrovírus e Lentivírus), pois possuem a capacidade de fazer com que o genoma viral seja substituído pelos transgenes e também integrado de maneira estável todo o material genético ao genoma do hospedeiro.
Após o processo de modificação, as células CAR-T são multiplicadas em uma dose adequada ao paciente. Posteriormente as células são colhidas e infundidas no paciente e então ao reconhecerem o alvo, as células CAR-T se tornam ativadas facilitando a destruição de células cancerígenas. A destruição pode ser realizada através de diversos mecanismos, incluindo a proliferação citotóxica[15].
Métodos
Este estudo configura-se como um artigo experimental de caráter exploratório descritivo e qualitativo. O levantamento de dados foi realizado por meio de artigos científicos do Pubmed, Scielo, Science e sites governamentais.
Considerações Gerais
Realizamos um extenso levantamento de dados através da análise de pesquisas e artigos científicos com a finalidade de ressaltar a importância do avanço dessa terapia imunológica direcionada à pacientes que não tinham mais expectativa de cura no tratamento oncológico.
Considerações Finais
No decorrer desse trabalho concluímos que a utilização de CAR T CELL no tratamento de cânceres hematológicos é inovadora e muito importante, já que devolve a esperança para pessoas que não respondiam mais a outros tipos de tratamento.
Referências Bibliográficas
1. Matasar, M. J., & Zelenetz, A. D. (2008). Overview of Lymphoma Diagnosis and Management. Radiologic Clinics of North America, 46(2), 175–198. doi:10.1016/j.rcl.2008.03.005
2. Barroso-Sousa R, Fernandes G. Oncologia: princípios e prática clínica. [Santana de Parnaíba]: Editora Manole; 2023.
3. Rodrigues AB, Martin LGR, Moraes MWD. Oncologia Multiprofissional: Patologias, Assistência e Gerenciamento. [Barueri]: Editora Manole; 2016.
4. Nogai, H., Dörken, B., & Lenz, G. (2011). Pathogenesis of Non-Hodgkin’s Lymphoma. Journal of Clinical Oncology, 29(14), 1803–1811. doi:10.1200/jco.2010.33.3252
5. Shankland, K. R., Armitage, J. O., & Hancock, B. W. (2012). Non-Hodgkin lymphoma. The Lancet, 380(9844), 848–857. doi:10.1016/s0140-6736(12)60605-9
6. Lenz, G., & Staudt, L. M. (2010). Aggressive Lymphomas. New England Journal of Medicine, 362(15), 1417–1429. doi:10.1056/nejmra0807082
7. Bupha-Intr O, Haeusler G, Chee L, Thursky K, Slavin M, Teh B. CAR-T cell therapy and infection: a review. Expert RevAntiInfectTher. 2021 Jun;19(6):749-758. doi: 10.1080/14787210.2021.1855143. Epub 2020 Dec 31. PMID: 33249873.
8. Zhang X, Zhu L, Zhang H, Chen S, Xiao Y. CAR-T Cell Therapy in Hematological Malignancies: Current Opportunities and Challenges. Front Immunol. 2022 Jun10;13:927153. doi: 10.3389/fimmu.2022.927153. PMID: 35757715; PMCID: PMC9226391.
9. Reportagem REVISTA FAPESP. Disponível em: http://agencia.fapesp.br/celulas-do proprio-paciente-sao-usadas-em-tratamentoinovador-contra-o-cancer/31656/
10. Kochenderfer JN et al. Eradication of B-lineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19. Blood (2010) 116 (20): 4099-4102. Disponível em: https://doi.org/10.1182/blood-2010-04- 281931
11. Martínez AC, Mon MA, et al. O sistema imunológico I: conceitos gerais, adaptação ao exercício físico e implicações clínicas [Internet]. Lazzoli JK, et al., translators. [place unknown]; 2011 Apr 19 [cited 2023 May 24]. Available from: https://www.scielo.br/j/rbme/a/KzSkBYkSszWjrzwzDtsdnwg/
12. Donátová K, Nováková E, Šupolíková M. Immunotherapy for cancertreatment. Klin Onkol. 2022 Summer;35(4):284-289. English. doi: 10.48095/ccko2022284. PMID: 35989085.
13. Roxanne N. Real World’ Data onCostsWith CAR-T CellTherapy. Apresentação em congresso 2019 Transplantation&CellularTherapy Meeting: Abstract 500, Abstract 501. PresentedFebruary 23, 2019. Disponível em: https://www.medscape.com/viewarticle/910242#vp_1
14. Ciuffi A. Mechanisms governing lentivirus integration site selection. Curr Gene Ther. 2008;8(6):419-429.
15. Nelapu S et al. Chimeric antigen receptor T-cell therapy — assessment and management of toxicities. Nature Review 2017, September. Disponível em: https://www.nature.com/articles/nrclinonc.2017.148
