REGISTRO DOI: 10.5281/zenodo.10047388
Andréa Medeiros da Costa
Maria Francisca de Jesus Nogueira Cavalcante
Waldilene de Souza Vieira
Orientador: Prof. MSc. Gabriel de Oliveira Rezende
RESUMO
Introdução: O câncer de colo uterino é uma das neoplasias malignas que mais afetam mulheres em todo mundo, estando à frente do câncer de mama, colorretal e pulmão. Outra difícil identificação é a progressão da doença, a mesma só pode ser identificada por meio de biomarcadores. O biomarcador em estudo que auxilia nessa identificação é a proteína p16. Objetivo: Associar a eficiência do biomarcador p16 na detecção, por meio da sua alta sensibilizada ao predizer o risco oncogênico. Metodologia: O presente estudo é de caráter exploratório e descritivo, o levantamento bibliográfico foi realizado pelo uso de plataformas públicas e virtuais de busca de textos científicos, disponíveis em bancos de dados como: google acadêmico, BVS, Scielo. Resultados: A imunohistoquímica do p16INK4A é uma técnica laboratorial que se baseia na detecção da proteína p16INK4A em amostras de tecido, geralmente obtidas de biópsias ou cirurgia. A proteína p16 desempenha um papel fundamental no controle do ciclo celular, atuando como regulador negativo da via pRb/E2F. No início das fases G0 e G1, o pRb forma complexos com fatores de transcrição E2F, impedindo a expressão de genes associados à proliferação. Conclusão: No entanto, é importante destacar que a interpretação dos resultados da imunohistoquímica do p16INK4A requer experiência e deve ser realizada por patologistas qualificados. A positividade para p16INK4A não é específica para o câncer de colo uterino, e resultados falso-positivos podem ocorrer em outras condições benignas. Portanto, a combinação de informações clínicas, citológicas e de imagem é essencial para um diagnóstico completo e preciso.
Palavras-Chaves: Neoplasia intraepitelial cervical, Imunohistoquímica, Biomarcadores, Inibidor de quinase dependente de ciclina p16.
ABSTRACT
Introduction: Cervical cancer is one of the malignant neoplasms that most affect women worldwide, ahead of breast, colorectal and lung cancer. The progression of the disease is also difficult to identify, and it can only be identified through biomarkers. The biomarker under study that assists in this identification is the p16 protein. Objective: To associate the efficiency of the p16 biomarker in detection, through its high sensitization in predicting oncogenic risk. Methodology: The present study is exploratory and descriptive, the bibliographic survey was carried out by the use of public and virtual platforms for searching for scientific texts, available in databases such as: google academic, VHL, Scielo. Results: Immunohistochemistry of p16INK4A is a laboratory technique that is based on the detection of the p16INK4A protein in tissue samples, usually obtained from biopsies or surgery. The p16 protein plays a key role in cell cycle control, acting as a negative regulator of the pRb/E2F pathway. At the beginning of the G0 and G1 phases, pRb forms complexes with E2F transcription factors, preventing the expression of genes associated with proliferation. Conclusion: However, it is important to highlight that the interpretation of p16INK4A immunohistochemistry results requires experience and should be performed by qualified pathologists. Positivity for p16INK4A is not specific for cervical cancer, and false-positive results may occur in other benign conditions. Therefore, the combination of clinical, cytological, and imaging information is essential for a complete and accurate diagnosis.
Key words: Cervical intraepithelial neoplasm, I munohistochemistry, Biomarkers, Icyclin-dependent kinase nibiser p16.
1 INTRODUÇÃO
O câncer de colo útero (CCU) é uma das neoplasias malignas que afetam com mais frequência mulheres em todo o mundo, estando à frente do câncer de mama, colorretal e pulmão (Girianelli et al., 2014). O mesmo é precedido de uma extensa fase de doença pré-invasiva, intitulada de neoplasia intraepitelial cervical (NIC). A NIC é descrita em graus I, II e III, sendo o grau I e II os mais graves, mostrando uma grande espessura do epitélio de células variadas que se multiplicam de maneira desordenada, comprometendo tecidos, órgãos próximos ou distantes (Miranda, 2013).
O agente infeccioso do CCU é o subtipo oncogênico do Papilomavírus Humano (HPV), transmitido sexualmente (Egawa, 2023). Porém, a transmissão sexual não é o suficiente para o desenvolvimento do CCU. Para ocorrer o desenvolvimento da neoplasia em questão é necessária uma infecção persistente e avaliar o fator genético e imunológico do paciente, além da influência de outros fatores externos como a idade, tabagismo, alcoolismo e uso de anticoncepcionais orais para que assim se inicie as alterações celulares (INCA, 2021).
Dentre os subtipos de alto risco oncogênico, estão os tipos HPV-16 e 18, os mesmos estão presentes em 70% dos casos de cânceres cervicais no Brasil (Ribeiro et al., 2019). A maior incidência ocorre na Região Norte (23,97/100 mil habitantes), Centro Oeste (20,72/100 mil habitantes) e Nordeste (19,49/100 mil habitantes). Na maior parte dos casos, surge em mulheres a partir de 30 anos, tendo um pico etário de 50 a 60 anos (Mendonça et al., 2020).
Desde a criação de um Programa Nacional de Combate ao Câncer de Colo do Útero (PNCCU), desenvolvido pelo Ministério da Saúde (MS), em 1998, estratégias e estabelecimento de informações para o monitoramento de ações voltadas à captação de mulheres para realização dos exames citopatológicos com o objetivo de fortalecer a prevenção de câncer de colo de útero vêm sendo aprimoradas (Carvalho et al., 2015).
Em maio de 2018, o Diretor-Geral da Organização Mundial da Saúde (OMS) lançou um apelo global para enfrentar o câncer do colo do útero como um desafio à saúde pública. Foram delineadas estratégias e planos de ação com o objetivo de atingir essa meta global. Os principais pilares da prevenção do câncer do colo do útero incluem a vacinação contra o HPV, o rastreamento e o tratamento de lesões pré-cancerosas, bem como o gerenciamento adequado do câncer. Metas específicas foram estabelecidas para avaliar o progresso na eliminação do câncer do colo do útero durante o período de 2020 a 2030 (Wang et al., 2023).
Contudo, é importante ressaltar que o CCU tem tratamento/cura, dependendo do caso clínico da paciente muda o tratamento que pode vir a abranger cirurgias oncológicas, quimioterapia, braquiterapia, radioterapia e reabilitação multiprofissional que visa restabelecer funcionalidades físico-orgânicas causadas pela doença (Girianelli et al., 2014).
As técnicas utilizadas para diagnósticos são: Papanicolau, inspeção com ácido acético a 5%, colposcopia, biópsia, teste de hibridização molecular, captura híbrida, reação em cadeia de polimerase (PCR), hibridização in situ e Southern Blot (Ferreira et al., 2021).
Na área da oncologia, os biomarcadores abrangem uma variedade de elementos, como genes, moléculas de DNA e RNA, proteínas, enzimas, antígenos e produtos celulares, que podem ser identificados em diferentes fases da formação do câncer. Isso desempenham um papel crucial na detecção, monitoramento da resposta à terapia e são amplamente discutidos em revisões e artigos recentes sobre a carcinogênese, lesões pré-cancerosas e câncer cervical. Esses marcadores fornecem informações valiosas para entender e combater essa doença (Volkova et al., 2021).
Segundo Almeida e Ayla (2014), a proteína p16 tem sido estudada como principal biomarcador para lesões cervicais, por se tratar de uma proteína de supressão tumoral. Normalmente a p16 é produzida para parar o ciclo celular quando a célula aponta algum tipo de alteração e direcioná-la para apoptose, porém em caso de câncer de colo do útero, ela indica o grau da lesão, por sua expressão ser controlada por outras proteínas, que automaticamente deixam de ser produzidas quando o DNA do vírus HPV se envolve ao genoma do hospedeiro.
Com isso, o trabalho tem o intuito de abordar a importância do estudo da proteína p16, pois a incidência desta doença é uma questão de saúde pública e o aprofundamento no estudo desta proteína pode auxiliar a identificar um subgrupo com risco aumentado para progressão histológica da lesão, sendo usada como ferramenta de rastreamento, auxiliando no diagnóstico molecular e a indicar risco de progressão do HPV.
2 OBJETIVOS
2.1 Objetivo Geral
Caracterizar o papel da proteína p16INK4A, como potencial biomarcador no diagnóstico do câncer de colo uterino.
2.2 Objetivos Específicos
• Identificar na literatura a cerca da utilidade clínica da proteína p16INK4A como biomarcador no diagnóstico do câncer de colo uterino, considerando suas vantagens e limitações, destacando lacunas de conhecimento que merecem futuras investigações.
• Descrever os métodos de detecção da proteína p16INK4A e sua aplicabilidade clínica.
• Sintetizar as informações encontradas sobre a relação entre os níveis de expressão da proteína p16INK4A e as diferentes etapas de progressão do câncer de colo uterino, incluindo lesões pré-cancerígenas.
3 MATERIAIS E MÉTODOS
3.1 Tipo de estudo
O presente estudo é de caráter exploratório e descritivo com o propósito de proporcionar uma maior familiaridade com o problema em questão, visando torná lo mais explícito e elaborar hipóteses que contribuam para uma compreensão mais aprofundada, assim como descrever o papel proteína p16INK4A e os mecanismos relacionados para a sua aplicabilidade no diagnóstico do CCU.
3.1 Bases de dados consultadas
O levantamento bibliográfico foi realizado pelo uso de plataformas públicas e virtuais de busca de textos científicos, disponíveis em bancos de dados como: Google Acadêmico, para teses e dissertações e para artigos científicos: Pubmed e Portal
Regional da Biblioteca Virtual da Saúde (BVS), Scientific Electronic Library Online (SCIELO), também foram utilizados sites que oferecessem acesso a dados epidemiológicos voltados à saúde, como Organização Mundial da Saúde (OMS) e Ministério da Saúde (MS).
3.2 Fontes Bibliográficas
Após o levantamento de dados, foram pesquisados um total de 251 artigos, sendo descartados 200 artigos e incluídos 51 artigos. As palavras-chaves utilizadas para seleção dos artigos científicos foram: Neoplasias do colo do útero; imunohistoquímica; inibidor de quinase dependente de cíclica p16 para o Portal BVS e Google Acadêmico. E os termos em inglês: cervical intraepithelial neoplasia; immunohistochemistry; biomarkers; cyclin dependent kinase inhibitor p16 para o Pubmed.
3.3 Critérios de inclusão
Os critérios de inclusão para este estudo, incluíram artigos originais, ensaios clínicos, estudos de coorte, revisões sistemáticas e meta-análises desde que abordem diretamente a relação da proteína p16INK4A com o HPV e o diagnóstico do CCU. Também priorizaram-se artigos publicados em português, inglês ou espanhol. Assim como, os critérios de exclusão foram: artigos incompletos e inacessíveis para a análise adequada.
3.4 Coleta de Dados
A coleta foi realizada, entre os meses de fevereiro a novembro de 2023 através de levantamento de obras literárias já publicadas, prevalecendo os artigos que expunham a respeito da proteína p16INK4A, assim como seus mecanismos e sua aplicabilidade no diagnóstico do CCU.
3.5 Análise de Dados
Após a etapa de identificação das fontes, foi necessário analisar o material a ser descrito neste artigo, ocasionando uma seleção de ideias autorais, como também, observando e destacando o material necessário.
4 REFERENCIAL TEÓRICO
4.1 Câncer do colo do útero (CCU)
O CCU é causado predominantemente por infecção persistente pelo vírus do HPV. Dos 200 tipos de HPV identificados, 12 foram designados como cancerígenos pela Agência Internacional de Investigação do Cancro, sendo o HPV-16 responsável por 50% e o HPV-18 por 10% dos casos de cancro do colo do útero. A infecção por uma dessas duas cepas de HPV são responsáveis por um aumento de 435 vezes e 248 vezes no risco de câncer, respectivamente, em comparação com um indivíduo não infectado (Shayan et al., 2023).
O mesmo é transmitido sexualmente, e mesmo tendo uma alta frequência de contágio não costuma causar a doença, porém em alguns casos ocorrem alterações celulares que posteriormente podem evoluir para o CCU (Inca, 2023).
O câncer de colo uterino se desenvolve na ectocérvice, região denominada colo, onde ocorrem cerca de 90% dos casos que originam o câncer de células escamosas, pois se trata de uma zona de transformação, local onde o epitélio colunar ao ser exposto a determinadas condições fisiológicas da mulher sofre a transformação, sendo substituído pelo epitélio escamoso metaplásico (Meireles, 2021).
Segundo Inca (2023), há duas principais categorias de carcinomas invasores do colo do útero, dependendo da origem do epitélio comprometido: o carcinoma epidermoide, tipo mais incidente e que acomete o epitélio escamoso (representa cerca de 90% dos casos), e o adenocarcinoma, tipo mais raro e que acomete o epitélio glandular (cerca de 10% dos casos).
A Classificação de Tumores Genitais Femininos da OMS, parte da quinta edição da série sobre tumores humanos, passou por uma revisão significativa em 2020, incorporando novos dados histomorfológicos e de patologia molecular. Ela distingue várias variantes do adenocarcinoma in situ (AIS) associados ou não associados ao HPV, adotando uma nomenclatura uniforme semelhante à classificação de carcinomas vulvares e vaginais. Além disso, a OMS adotou a “Classificação Internacional do Adenocarcinoma Endocervical” (IECC) para essa (Hodgson et al., 2019).
De acordo com a imagem 1
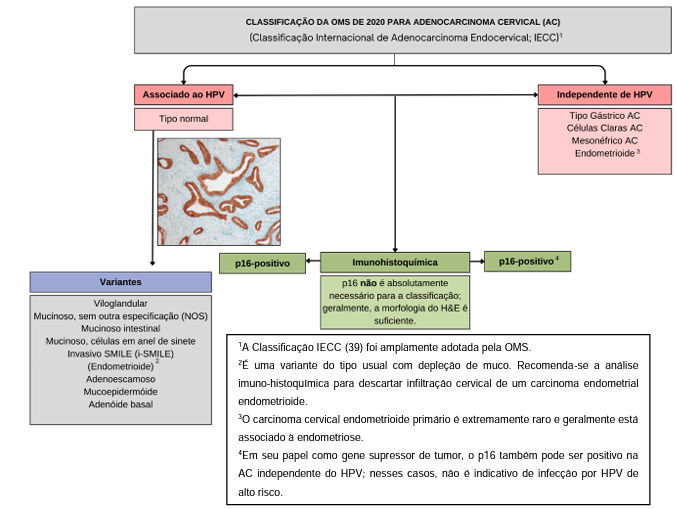
Figura 1 : Classificação do adenocarcinoma do colo do útero de acordo com a classificação da OMS de 2020.
Fonte: Adaptado de Hohn et al., (2021).
Quando a infecção por HPV oncogênico persiste, pode ocorrer o desenvolvimento de lesões contínuas, na qual a identificação e tratamento adequado previnem a progressão para um câncer cervical mais invasivo. O risco de progressão de câncer invasivo em 30 anos é de 30% a 50% para doença cervical de alto grau não tratada (Darragh et al., 2012).
Atualmente, a classificação das lesões intraepiteliais escamosas (LSIL, NIC1, NIC2 e NIC3) está evoluindo. As LSILs são vistas como replicação viral benigna e tratadas conservadoramente, enquanto a NIC3 é considerada um precursor pré-invasivo com potencial cancerígeno. A NIC2 permanece menos compreendida, mas estudos sugerem uma alta taxa de regressão espontânea, especialmente em mulheres jovens. Embora existam diferenças no curso clínico entre NIC2 e NIC3, a classificação mais recente da OMS de 2014 as agrupa como lesões intraepiteliais escamosas de alto grau (HSIL). Isso marca uma evolução na compreensão dessas lesões e pode influenciar o manejo clínico (Tainio et al., 2018; Massad et al., 2012).
A classificação tem como base a espessura do epitélio anormal, o grau da NIC aumenta conforme o andamento das células anormais chegam na membrana basal e seguem até a camada superior de células (Heise; Lima, 2016). De acordo com a figura 2.
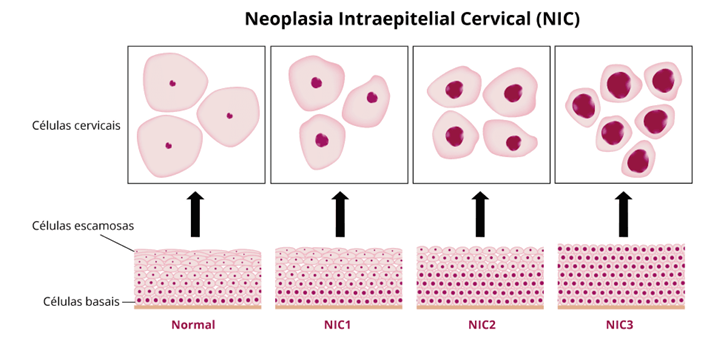
Figura 2: Citopatologia: A técnica de Papanicolau.
Disponível em: https://kasvi.com.br/papanicolau-citopatologia/. Acesso em: 25 set. 2023.
Em geral, é válido ressaltar que as lesões provocadas pela infecção não causam sintomas como corrimento, sangramento, prurido ou ardor, por esta razão são detectadas apenas por exames médicos (Micali, 2017). No Brasil, em 2023, são esperados 17.010 casos novos, o que representa uma taxa ajustada de incidência de 13,25 casos a cada 100 mil mulheres. É a terceira localização primária de incidência e a quarta de mortalidade por câncer em mulheres no país, sem considerar tumores de pele não melanoma (Inca, 2023).
Em 2020, ocorreram 6.627 óbitos por esta neoplasia, representando uma taxa ajustada de mortalidade por este câncer de 4,60/100 mil mulheres (Inca, 2021). A maior incidência do câncer de colo uterino ocorre na Região Norte (23,97/100 mil habitantes), Centro-Oeste (20,72/100 mil habitantes) e Nordeste (19,49/100 mil habitantes). No entanto, a região Sul (12,60/100 mil) e Sudeste (8,61/100 mil) apresentam o menor índice de incidência comparada às outras regiões (Inca, 2021).
Na maior parte dos casos, surge em mulheres a partir de 30 anos, tendo um pico etário de 50 a 60 anos (Queiroz et al., 2023). Globalmente, a idade média no diagnóstico do cancro do colo do útero foi de 53 anos, e a idade média global no momento da morte foi de 59 anos. O fator que corroborou para que não houvesse índices tão altos de casos de CCU, seria a introdução das vacinas contra o HPV, campanhas governamentais etc (Johnson et al., 2019).
A estratégia global da Organização Mundial de Saúde (OMS) para a eliminação do cancro do colo do útero até 2030 descreve os três pilares principais para a eliminação do cancro do colo do útero, que são a prevenção, o rastreio e o tratamento (Buskofie et al., 2020).
4.2 Papiloma vírus Humano (HPV)
Os tipos de HPV de alto risco (HR-HPV) estão incluídos nos tipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 e 68, mas os mais comuns de Câncer Cervical são atribuídos aos HPVs 16 ou 18 (Fani et al., 2020).
O HPV 18 é o segundo mais frequente, sendo responsável por até 65% de todos os casos de câncer cervical invasivo em todo o mundo. Estudos relataram que o HPV 18 está intimamente associado ao desenvolvimento de lesões glandulares e adenocarcinoma (ADC) em comparação ao carcinoma espinocelular (CEC). Esse achado indica que o HPV 18 compartilha características filogenéticas que favorecem o desenvolvimento de adenocarcinoma em comparação com outros genótipos de HPV (Santos et al., 2023).
O genótipo viral HPV 16 é o mais prevalente no câncer cervical e é considerado um agente carcinogênico do Grupo 1 para humanos pela Agência Internacional de Pesquisa do Câncer. (17)
O genoma do HPV16 tem uma extensão de 7,9 kb. Esse genoma é encapsulado em uma estrutura icosaédrica dividida em três regiões distintas. A primeira região, conhecida como região inicial (E), engloba várias proteínas precursoras, incluindo E1, E2, E4, E5, E6 e E7. Essas proteínas desempenham papéis cruciais nos estágios iniciais da infecção e estão intimamente ligadas à replicação do DNA viral, ao controle do ciclo celular e à oncogénese. Há também duas proteínas estruturais, L1 e L2, compõem o capsídeo viral (Bhattacharjee et al., 2022; Villiers et al., 2004). segundo a Tabela 1.
A transição das células epiteliais infectadas pelo HPV para o estágio de câncer invasivo é um processo de evolução gradual, caracterizado pelo acúmulo de modificações no DNA das células hospedeiras. Essas modificações englobam tanto as alterações epigenéticas quanto as genéticas que afetam oncogenes e genes supressores de tumor (Balasubramaniam et al., 2019).
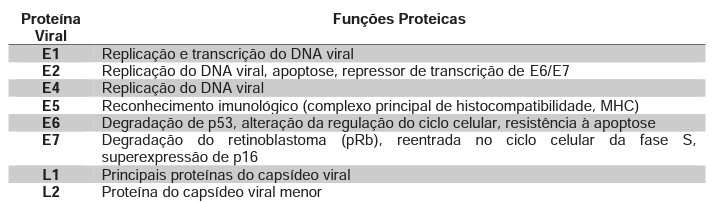
Tabela 1: Lista de proteínas virais do papilomavírus humano (hpv) e suas principais funções. Fonte: Bhattacharjee et al., 2022; Villiers et al., 2004.
Práticas sexuais de alto risco resultam em infecção pelo HPV. O HPV tem a capacidade de integrar seu DNA nas células basais da junção colunar, localizada na zona de transformação do colo do útero. Isso resulta na produção de proteínas E6 e E7, as quais, em última instância, podem causar displasia. A displasia do epitélio cervical é também denominada neoplasia intraepitelial cervical (NIC). Embora seja importante notar que a NIC tem o potencial de regredir sem evoluir para câncer cervical, a possibilidade de progressão para câncer não pode ser completamente descartada. As taxas de progressão para câncer variam entre os estudos, o que destaca a complexidade desse processo (Jain; Limaien, 2022).
O exame de Papanicolau é uma ferramenta comum para a detecção dessas lesões na maioria dos casos, no entanto, deve-se ter em mente que ocasionalmente podem ocorrer resultados falsos negativos. Introduzir o teste de DNA do HPV no processo de triagem, devido à sua alta sensibilidade, minimiza significativamente a probabilidade de deixar de detectar uma lesão de alto grau. No entanto, é importante observar que o teste de HPV também pode identificar a presença do vírus quando ele está latente e inativo, mesmo na ausência de lesões visíveis (Emile, 2021).
Notavelmente, em locais anatômicos diferentes do colo uterino, os carcinomas associados ao HPV têm mostrado consistentemente um melhor prognóstico do que os tumores independentes do HPV (Nicolás et al., 2019). A relevância dessa ligação também foi destacada é evidenciada na última classificação da OMS, que reconheceu a importância biológica e clínica da distinção entre os cânceres associados ao HPV e aqueles que não são (Park et al., 2021).
A super expressão imuno-histoquímica da proteína p16 tem sido considerada uma alternativa eficaz para identificar a infecção pelo HPV. A coloração difusa e intensa de p16 é consistentemente observada na maioria dos cânceres associados ao HPV, enquanto os tumores independentes do vírus geralmente não apresentam essa marcação (Carozzi et al., 2008). No entanto, há escassez de informações sobre a frequência real e as implicações clínicas relacionadas à ausência de expressão de p16 em cânceres cervicais associados ao HPV.
4.3 Técnicas auxiliares em citologia cervical e biomarcadores
A citologia cervical, especialmente o teste de Papanicolaou, é um método eficaz de rastreamento do câncer cervical que reduziu significativamente a incidência e mortalidade dessa doença desde a década de 1950 (Smith et al., 2018). A citologia em base líquida (LBC) substituiu em grande parte o método convencional devido à sua sensibilidade aprimorada. A incorporação do teste de alto risco para o HPV (hrHPV) em protocolos de rastreamento também se mostrou eficaz. No entanto, o hrHPV tem limitações na diferenciação entre infecções transitórias e persistentes, levando a colposcopias desnecessárias. Para abordar isso, várias estratégias de triagem foram sugeridas, incluindo genotipagem do HPV, coloração dupla p16/Ki-67 e ensaios de metilação (Olivas et al., 2023).
Nos últimos anos, os biomarcadores têm ganhado destaque como aliados essenciais na identificação de lesões intraepiteliais escamosas de alto grau. Atualmente, há um consenso consolidado em relação à sua aplicação na prática da histopatologia, especialmente no que diz respeito à redução do sobre diagnóstico de NIC2 na coloração H&E e à clarificação do seu significado clínico. Isso envolve a diferenciação entre diagnósticos de NIC2 benigna, que podem regredir ou não progredir, e diagnósticos de NIC2 que indicam a presença de anomalias cervicais de alto grau, requerendo tratamento para reduzir o risco de câncer (Castle et al., 2020).
Dentre as diversas proteínas que têm sido associadas aos mecanismos subjacentes à carcinogênese cervical, destacam-se a p16INK4a, uma proteína supressora de tumor, e o marcador de proliferação celular Ki-67, bem como p53 e pRb, todas elas promissoras como potenciais biomarcadores da doença (Melo; Utagawa, 2021; Nayar; Wilbur, 2015).
4.4 O gene p16
O gene P16, também é chamado de INK4 ou INK4A porque é o membro protótipo dos inibidores de quinase dependentes de ciclina INK4. Os membros desta família (p16 INK4a, p15 INK4b, p18 INK4c, p19 INK4d) são inibidores de CDK4 e de CDK6 (Kim; S
Esta proteína é produzida a partir da transcrição do mRNA alfa do gene p16. Este gene, localizado no cromossomo 9p21, possui dois promotores, gera diversas variantes de transcrição que diferem em seus primeiros éxons, ele também sofre frequentemente mutação ou deleção em uma ampla variedade de tumores e é conhecido por ser um importante gene supressor de tumor. Usando éxons alternativos, o gene p16 gera quatro variantes transcricionais: p16INK4A, um inibidor de quinase dependente de ciclina, p14ARF (quadro de leitura alternativo), que se liga a MDM2, p12 e p16γ (Brister et al., 2015; Yarbrough et al., 1999).
A estrutura do gene p16 inclui os exons E1β, E1α, E2, E2γ e E3. O éxon E1α está localizado na região 5’ do gene p16. E2γ é um éxon de splicing alternativo presente entre o éxon E1α e E2. O splicing alternativo de E1α versus E1β para um éxon adicional compartilhado presente no gene INK4A produz mRNAs que resultam em sequências E2 com dois quadros de leitura diversos. A transcrição com E1α codifica p16INK4A enquanto a transcrição com E1β codifica p14ARF usando um AUG alternativo presente no éxon E1β. Assim, o splicing do éxon E1α nos éxons E2 e E3 gera o supressor tumoral p16INK4A (Serra; Chetty, 2018).
A proteína p16 bloqueia as CDK4 e CDK6, medidas pela fosforilação da proteína retinoblastoma (pRb), causando a inibição da transcrição E2F dependente e, consequentemente inibindo a progressão do ciclo celular (Mauren et al., 2010). Sendo assim, a desregulação da via pPb contribui para a iniciação de câncer (Poomsawat et al., 2011).
4.4.1 Proteína p16 INK4A
A proteína p16 possui quatro repetições de anquirina (AR), que são motivos helicoidais com cerca de 31 a 34 resíduos. Esses ARs estão interconectados por loops de diferentes comprimentos, e quando a p16 se liga ao CDK6, expõe a fenda catalítica do CDK6 a ela, resultando em uma interação que reduz a atividade da quinase. Mutações relacionadas ao câncer no resíduo D84 da p16 eliminam essa inibição, permitindo a proliferação celular descontrolada. Além disso, a p16 pode impedir a ação do CDK4/6 comprometendo sua interação com a ciclina D, sendo os principais resíduos envolvidos nessa interação localizados no segundo e terceiro ARs e na alça que os conecta (Serra; Chetty, 2018).
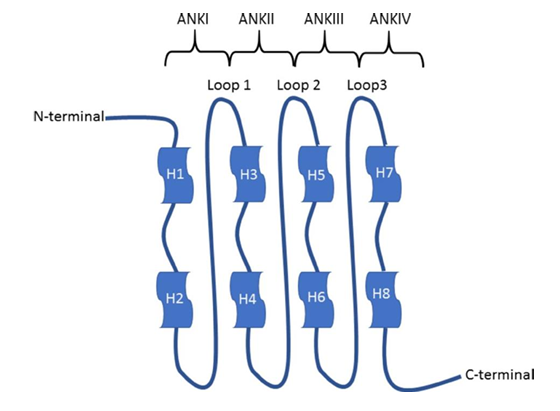
Figura 3 – Representação esquemática da proteína p16. Cada repetição de anquirina consiste em uma estrutura hélice-volta-hélice (HTH). Os quatro motivos HTH são conectados por três loops na estrutura de voltas beta e gama.
Fonte: Serra et al. 2018
5.4.2 Função de p16 INK4A
A proteína p16 desempenha um papel fundamental no controle do ciclo celular, atuando como regulador negativo da via pRb/E2F. No início das fases G0 e G1, o pRb forma complexos com fatores de transcrição E2F, impedindo a expressão de genes associados à proliferação. Quando a célula se prepara para proliferar, o pRb é hiperfosforilado por CDK4 e CDK6, permitindo a progressão para a fase S. P16 regula negativamente CDK4 e CDK6, mantendo o pRb hipofosforilado e interrompendo a progressão do ciclo celular na fronteira G1/S. Além disso, p16 interage com proteínas como GRIM-19, potencializando seu efeito supressor. Além da via pRb/E2F, p16 também influencia a regulação da transcrição e a atividade de quinases, contribuindo para o controle do ciclo celular de maneiras independentes e alternativas (Li et al., 2011). Também foi relatado em outros estudos que a senescência ocorre com a inativação de elementos supressores levando ao aumento da expressão de p16 (Rayess et al., 2012).
4.5 Imunohistoquímica do p16 INK4A no diagnóstico
A imunohistoquímica do p16INK4A é uma técnica laboratorial que se baseia na detecção da proteína p16INK4A em amostras de tecido, geralmente obtidas de biópsias ou cirurgias. E desempenha um papel importante no diagnóstico e na avaliação de diversas condições, principalmente em oncologia e patologia (Crisóstomo et al., 2016).
A imunohistoquímica do p16INK4A é frequentemente usada para auxiliar no diagnóstico de câncer. Visto que a detecção de alta expressão de p16INK4A em amostras de tecido pode ser indicativa de lesões pré-cancerosas ou cânceres, como o carcinoma de colo de útero (Albuquerque, 2016).
A imunohistoquímica do p16INK4A é especialmente útil em amostras de tecido cervical, a expressão elevada de p16INK4A é um marcador confiável de lesões cervicais graves, como as associadas HPV de alto risco (Crisóstomo et al., 2016).
O resultado da imuno histoquímica do p16INK4A é geralmente interpretado por um patologista. A positividade para p16INK4A, quando vista em células cervicais, pode ser uma indicação de transformação maligna. Entretanto, a interpretação exige experiência, pois a positividade não é específica para câncer e pode ser observada em outras condições (Nascimento et al., 2023).
É importante observar que a positividade para p16INK4A não é definitiva para o diagnóstico de câncer. Outros fatores clínicos e resultados de testes adicionais geralmente são necessários para um diagnóstico completo (Albuquerque, 2016).
5 CONCLUSÃO
O presente estudo possibilitou analisar a p16INK4A desempenha um papel vital como potencial biomarcador para o diagnóstico do câncer de colo uterino. Seu uso tem revolucionado a forma como abordamos as lesões cervicais, fornecendo informações valiosas para o diagnóstico precoce e o tratamento da doença. A descoberta do papel da p16INK4A na patogênese do câncer de colo uterino trouxe uma nova perspectiva para o diagnóstico e acompanhamento de lesões cervicais. Sua expressão elevada está intimamente ligada a infecções por tipos oncogênicos do HPV de alto risco, os principais agentes causadores do câncer cervical. Isso a torna uma ferramenta valiosa na identificação de lesões pré-cancerosas e malignas.
A principal aplicação da p16INK4A na prática clínica é a detecção de lesões cervicais graves, como a neoplasia intraepitelial cervical (NIC) de alto grau. Sua expressão elevada nessas lesões é um indicador fundamental de risco para o desenvolvimento do câncer de colo uterino. Além disso, a positividade para p16INK4A pode ser um marcador útil para identificar casos que necessitam de acompanhamento mais rigoroso ou tratamento.
A utilização de p16INK4A na triagem e diagnóstico do câncer de colo uterino tem a vantagem de ser uma técnica acessível e amplamente disponível, contribuindo para a detecção precoce e redução da incidência da doença. Além disso, seu uso está associado à diminuição na necessidade de procedimentos invasivos, como a colposcopia, em casos de lesões cervicais de baixo grau.
No entanto, é importante destacar que a interpretação dos resultados da imunohistoquímica do p16INK4A requer experiência e deve ser realizada por patologistas qualificados. A positividade para p16INK4A não é específica para o câncer de colo uterino, e resultados falso-positivos podem ocorrer em outras condições benignas. Portanto, a combinação de informações clínicas, citológicas e de imagem é essencial para um diagnóstico completo e preciso.
6 REFERÊNCIAS
ALBUQUERQUE, Giwellington Silva. Avaliação imunohistoquímica da oncoproteína E6, P16INK4a, MMP-3 E TIMP-2 nas lesões precursoras e câncer cervical de mulheres infectadas pelo HPV de alto risco oncogênico. 2016. Dissertação (Mestre em Patologia) – Universidade Federal de Pernambuco.
ALMEIDA, Ayla Carolina; OLIVEIRA, Karen Brajão. Câncer de Colo Uterino: desenvolvimento, diagnóstico, tratamento e marcadores moleculares. Saúde e Pesquisa, v. 7, n. 1, 2014.
BALASUBRAMANIAM, Shandra Devi et al. Key molecular events in cervical cancer development. Medicina, v. 55, n. 7, p. 384, 2019.
BHATTACHARJEE, Rahul et al. Mechanistic role of HPV-associated early proteins in cervical cancer: Molecular pathways and targeted therapeutic strategies. Critical reviews in oncology/hematology, v. 174, p. 103675, 2022.
BRISTER, J. Rodney et al. NCBI viral genomes resource. Nucleic acids research, v. 43, n. D1, p. D571-D577, 2015.
BUSKWOFIE, Ama; DAVID-WEST, Gizelka; CLARE, Camille A. A review of cervical cancer: incidence and disparities. Journal of the National Medical Association, v. 112, n. 2, p. 229-232, 2020.
BYEON, In-Ja L. et al. Tumor suppressor p16INK4A: determination of solution structure and analyses of its interaction with cyclin-dependent kinase 4. Molecular cell, v. 1, n. 3, p. 421-431, 1998.
CAROZZI, Francesca et al. Use of p16-INK4A overexpression to increase the specificity of human papillomavirus testing: a nested substudy of the NTCC randomised controlled trial. The lancet oncology, v. 9, n. 10, p. 937-945, 2008.
CARVALHO, Brígida Gimenez et al. Integralidade do cuidado no Programa de Controle do Câncer de Colo Uterino: visão das usuárias com alteração na citologia oncótica. Saúde em Debate, v. 39, p. 707-717, 2015.
CASTLE, Philip E. et al. Relationships of p16 immunohistochemistry and other biomarkers with diagnoses of cervical abnormalities: implications for LAST terminology. Archives of pathology & laboratory medicine, v. 144, n. 6, p. 725734, 2020.
CRISÓSTOMO, Catharine; MELO-JÚNIOR, Mario Ribeiro; DE MEDEIROS, Adrya Lúcia Peres Bezerra. Marcadores moleculares como ferramenta auxiliar no diagnóstico citológico de anormalidades cervicais. Saúde e Pesquisa, v. 9, n. 1, p. 163-172, 2016.
DARRAGH, Teresa M. et al. The lower anogenital squamous terminology standardization project for HPV-associated lesions: background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology. Archives of pathology & laboratory medicine, v. 136, n. 10, p. 1266-1297, 2012.
EGAWA, Nagayasu. Papillomaviruses and cancer: commonalities and differences in HPV carcinogenesis at different sites of the body. International Journal of Clinical Oncology, p. 1-9, 2023.
ÉMILE, Carole. Infections à papillomavirus: actualités sur le dépistage et la vaccination. Option/Bio, v. 32, n. 635-636, p. 21-23, 2021.
FANI, Mona et al. Correlation of human papillomavirus 16 and 18 with cervical cancer and their diagnosis methods in Iranian women: A systematic review and metaanalysis. Current problems in cancer, v. 44, n. 1, p. 100493, 2020.
FERREIRA, Andressa Kelly et al. Diagnóstico do HPV em homens: uma revisão sistemática. Research, Society and Development, v. 10, n. 12, p. e329101220064e329101220064, 2021.
GIRIANELLI, Vania Reis et al. Disparities in cervical and breast cancer mortality in Brazil. Revista de saúde pública, v. 48, p. 459-467, 2014.
HEISE, Amanda; LIMA, Ana Paula Weinfurter. Citopatologia convencional e citologia em meio líquido: uma revisão integrativa. Revista Saúde e Desenvolvimento, v. 10, n. 5, p. 208-221, 2016.
HODGSON, Anjelica et al. International Endocervical Adenocarcinoma Criteria and Classification (IECC): correlation with adverse clinicopathological features and patient outcome. Journal of clinical pathology, v. 72, n. 5, p. 347-353, 2019.
HÖHN, Anne Kathrin et al. 2020 WHO classification of female genital tumors. Geburtshilfe und Frauenheilkunde, v. 81, n. 10, p. 1145-1153, 2021.
INSTITUTO NACIONAL DE CÂNCER JOSÉ ALENCAR GOMES DA SILVA. Detecção precoce do câncer. Rio de Janeiro: INCA, 2021. Disponível em: https://www.inca.gov.br/publicacoes/livros/deteccao-precoce-do-cancer (abre em nova janela). Acesso em: 17 out. 2021.
INSTITUTO NACIONAL DE CÂNCER JOSÉ ALENCAR GOMES DA SILVA. Estimativa de 2023: incidência do Câncer no Brasil. Rio de Janeiro: INCA, 2022. Disponível em:https://www.gov.br/inca/pt-br/assuntos/cancer/numeros/estimativa. Acesso em: Acesso em: 17 out. 2021.
JAIN, Manisha A.; LIMAIEM, Faten. Cervical Squamous Cell Carcinoma. National Center for Biotechnology Information: Bethesda, MD, USA, 2022.
JOHNSON, Cynae A. et al. Cervical cancer: an overview of pathophysiology and management. In: Seminars in oncology nursing. WB Saunders, 2019. p. 166-174.
KIM, William Y.; SHARPLESS, Norman E. The regulation of INK4/ARF in cancer and aging. Cell, v. 127, n. 2, p. 265-275, 2006.
LI, Junan; POI, Ming Jye; TSAI, Ming-Daw. Regulatory mechanisms of tumor suppressor P16INK4A and their relevance to cancer. Biochemistry, v. 50, n. 25, p. 5566-5582, 2011.
MARTINS, Luís Felipe Leite et al. Human Papillomavirus 16 lineage D is associated with high risk of cervical cancer in the Brazilian Northeast region. Revista Brasileira de Ginecologia e Obstetricia, v. 45, n. 08, p. e474-e479, 2023.
MASSAD, L. Stewart et al. 2012 updated consensus guidelines for the management of abnormal cervical cancer screening tests and cancer precursors. Journal of lower genital tract disease, v. 17, p. S1-S27, 2013.
MEIRELES, Meireles José Jesus Rodrigues. Correlação entre infecção por Papilomavírus humano e diagnóstico de câncer no colo uterino: uma revisão da literatura. 2021. Monografia (Bacharel em Farmácia) – Centro Universitário AGES, Paripiranga, 2021.
MELO, Cesar Augusto Ferreira; UTAGAWA, Maria Lucia. Expressão imuno-histoquímica dos biomarcadores p16 e Ki-67 na lesão intraepitelial cervical de alto grau: revisão de estudos. Revista Brasileira de Análises Clínicas agora é Online, p. 228-231, 2021.
MENDONÇA, Flávia Daspett et al. Região Norte do Brasil e a pandemia de COVID19: análise socioeconômica e epidemiológica. Journal Health NPEPS, v. 5, n. 1, p. 20-37, 2020.
MICALI, Giuseppe et al. Distúrbios dermatológicos da vulva: Diagnóstico e tratamento baseados na apresentação de sinais clínicos. São Paulo, SP: Thieme Revinter Publicações LTDA, 2017.
MIRANDA, Shirley Aviz de. Autocuidado de mulheres residentes no município de Benevides/PA na prevenção e controle de HPV: participação da(o) enfermeira(o). 2013. 116 f. Dissertação (Mestrado em Enfermagem) – Universidade Federal do Pará, Instituto de Ciências da Saúde, Belém, 2013.
NASCIMENTO, Ícaro Pedro do. Estudo prospectivo da expressão da proteína p16 por imuno-histoquímica em câncer de mama. 2023. Dissertação (Mestrado em Morfotecnologia) – Universidade Federal de Pernambuco, Recife, 2023.
NAYAR, Ritu; WILBUR, David C. The Bethesda System for Reporting Cervical Cytology. 3rd ed. Cham: Springer International Publishing; 2015. 1–321 p.
NICOLÁS, Inmaculada et al. HPV-negative tumors of the uterine cervix. Modern Pathology, v. 32, n. 8, p. 1189-1196, 2019.
OLIVAS, Andrea D.; BARROETA, Julieta E.; LASTRA, Ricardo R. Overview of ancillary techniques in cervical cytology. Acta Cytologica, v. 67, n. 2, p. 119-128, 2023.
PARK, Kay J. et al. Online training and self-assessment in the histopathologic classification of Endocervical adenocarcinoma and diagnosis of pattern of invasion: evaluation of participant performance. International Journal of Gynecological Pathology, v. 40, n. 2 Suppl 1, p. S14, 2021.
POOMSAWAT, Sopee et al. Overexpression of cdk4 and p16 in oral lichen planus supports the concept of premalignancy. Journal of oral pathology & medicine, v. 40, n. 4, p. 294-299, 2011.
QUEIROZ, Antônio et al. Frequência, tratamento e estadiamento dos casos de câncer de colo do útero na região norte do Brasil entre os anos de 2017 a 2021. Research, Society and Development, v. 12, n. 6, p. e11112642138-e11112642138, 2023.
RAYESS, Hani; WANG, Marilene B.; SRIVATSAN, Eri S. Cellular senescence and tumor suppressor gene p16. International journal of cancer, v. 130, n. 8, p. 17151725, 2012.
RIBEIRO, Daniel Vitorino et al. O impacto da vacina contra o HPV no mundo: resultados iniciais e desafios. 2019. Trabalho de Conclusao de Curso (Graduação em Medicina) – Universidade Federal de Santa Catarina. Centro de Ciências da Saúde. Medicina.
SANTOS, Gerusinete Rodrigues Bastos dos et al. HPV 18 variants in women with cervical cancer in Northeast Brazil. Brazilian Journal of Infectious Diseases, v. 27, p. 102734, 2023.
SERRA, Stefano; CHETTY, Runjan. p16. Journal of clinical pathology, v. 71, n. 10, p. 853-858, 2018.
SHAYAN, Nasar Ahmad et al. Cancer prevalence, incidence, and mortality rates in Afghanistan in 2020: A review study. Cancer Reports, p. e1873, 2023.
SMITH, Elizabeth R. et al. New biological research and understanding of P apanicolaou’s test. Diagnostic cytopathology, v. 46, n. 6, p. 507-515, 2018.
TAINIO, Karoliina et al. Clinical course of untreated cervical intraepithelial neoplasia grade 2 under active surveillance: systematic review and meta-analysis. BMJ, v. 360, 2018.
VILLIERS, Ethel-Michele et al. Classification of papillomaviruses. Virology, v. 324, n. 1, p. 17-27, 2004.
VOLKOVA, Larisa V et al. Cervical carcinoma: Oncobiology and biomarkers. International Journal of Molecular Sciences, v. 22, n. 22, p. 12571, 2021.
WANG, Minmin et al. The association of cervical cancer screening and quality of care: A systematic analysis of the Global Burden of Disease Study 2019. Journal of Global Health, v. 13, 2023.
YARBROUGH, Wendell G. et al. Biologic and biochemical analyses of p16INK4a mutations from primary tumors. Journal of the National Cancer Institute, v. 91, n. 18, p. 1569-1574, 1999.
