REGISTRO DOI: 10.69849/revistaft/ni10202602132011
Dr. Marcel Simonetti1
Dra. Mariana Benitez2
Resumo:
Quando o tecido ósseo novo não é produzido tão rapidamente quanto o antigo que é perdido, ocorre a osteoporose. A osteoporose é uma doença metabólica, caracterizada por uma diminuição da densidade mineral óssea e pela destruição da microestrutura óssea. Isso pode levar a uma maior fragilidade óssea e risco de fraturas. Veremos como os estudos epigenéticos são uma ferramenta para detectar disfunções na diferenciação osteogênica, remodelação óssea e outros processos relacionados ao metabolismo ósseo. Devemos considerar o importante papel que os mecanismos epigenéticos têm na regulação do metabolismo ósseo (metilação do DNA, modificação de histonas e RNA não codificante), na diferenciação osteogênica e na patogênese da osteoporose para fornecer uma nova direção para o tratamento de doenças relacionadas ao metabolismo ósseo. Existem diferentes tipos de osteoporose: a idiopática juvenil e a osteoporose do adulto jovem. Também em mulheres na pós-menopausa, nas quais não se observa nenhum fator etiológico. Qualquer osso do corpo pode ser afetado. Existem fatores que aumentam o risco de sofrer de osteoporose, como idade, raça, alimentação, certos medicamentos, estilo de vida sedentário, alterações hormonais e outros problemas médicos. A perda de massa óssea ocorre sem sintomas, por isso só se manifesta quando ocorre alguma complicação em fraturas ósseas. Também existem fatores que aumentam o risco de sofrer desta doença, como a falta de vitamina D e cálcio devido à má nutrição, falta de exercício físico regular, tabaco e álcool. A terapia de oxigenação hiperbárica promove a oxigenação de todos os tecidos, incluindo os danificados, acelerando os processos de cicatrização dos ossos e articulações. Estimula a diferenciação das células formadoras de osso (osteócitos, osteoblastos, osteoclastos), favorecendo assim a reparação óssea. A medicina hiperbárica pode ser aplicada de forma preventiva, fortalecendo o fluxo sanguíneo periférico, uma vez que provoca angiogênese e vasculogênese ao mesmo tempo.
Palavras-chave: osteoporose, vitamina D, hormônios, pósmenopausa, idiopática, tecido ósseo, epigenética, metabolismo, DNA, RNA. Medicina hiperbárica, osteócitos, osteoblastos, osteoclastos
Osteoporose.
A osteoporose ocorre quando o tecido ósseo novo não é produzido tão rapidamente quanto o tecido ósseo velho que é perdido. Quando isso acontece, perde-se demasiada massa óssea e os ossos enfraquecem. Existem fatores que aumentam o risco de sofrer de osteoporose, tais como: sexo, idade, tamanho do corpo, raça, antecedentes familiares, alterações hormonais, alimentação, medicamentos, estilo de vida, outros problemas médicos.
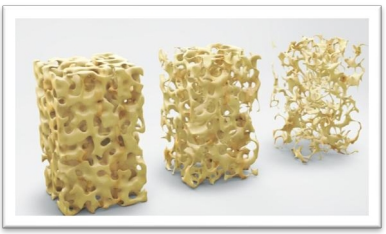
Qualquer osso do corpo pode ser afetado, mas os da coluna vertebral e do quadril são especialmente frágeis. A perda de massa óssea ocorre sem nenhum sintoma, por isso a doença só se manifesta quando ocorrem complicações em fraturas ósseas. Os fatores que aumentam o risco de sofrer desta doença são a falta de cálcio e vitamina D devido a uma má nutrição, vida sedentária, falta de exercício físico regular ou maus hábitos com o consumo de tabaco e álcool. As mulheres são mais propensas a sofrer de osteoporose, devido à deficiência de vitamina D durante a gravidez e a amamentação, de modo que o organismo retira as reservas de cálcio dos ossos, Fig. 1.
Fig. 1: Osso normal, osteopenia, osteoporose.
Classificação da osteoporose.
Osteoporose primária: constitui o grupo mais amplo e inclui os casos de osteoporose em que não é identificada nenhuma doença que a justifique diretamente. Distingue-se entre: osteoporose idiopática juvenil e OP (osteoporose) do adulto jovem. Afeta crianças ou adultos jovens de ambos os sexos com função normal. A OP idiopática juvenil é uma doença rara, que geralmente se inicia entre os 8 e os 14 anos de idade. Manifesta-se pelo aparecimento de dor óssea e fraturas com traumatismos mínimos. A doença remite por si só em muitos casos e a recuperação ocorre espontaneamente num prazo de 4-5 anos. A OP do adulto jovem é observada em homens jovens e mulheres na pré-menopausa, nos quais não se observa nenhum fator etiológico.
Osteoporose pós-menopausa. Tipo I.
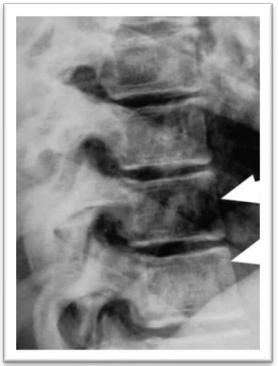
Ocorre em um subgrupo de mulheres pós-menopáusicas de 51 a 75 anos e é caracterizada por uma perda acelerada e desproporcional de osso trabecular. Fraturas dos corpos vertebrais (Fig. 2) e da porção distal do rádio são complicações frequentes.
Fig. 2: Osteoporose dos corpos vertebrais.
Osteoporose senil. Tipo II.
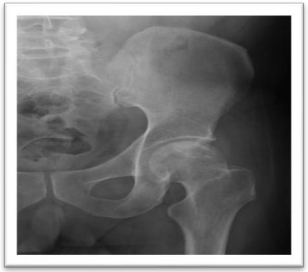
É detectada em algumas mulheres e homens com mais de 70 anos, como consequência de um déficit na função dos osteoblastos (baixa remodelação óssea). Está associada a fraturas do colo do fêmur (Fig. 3), porção proximal do úmero e pelve (Fig. 4), pois afeta tanto o osso cortical quanto o trabecular.
Fig. 3: Osteoporose do fêmur.
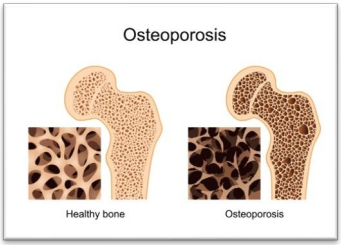
Fig. 4: Fratura da pelve por osteoporose.
Osteoporose secundária.
São classificados neste grupo todos os casos de OP que são uma consequência ou uma manifestação acompanhante de outras doenças ou do seu tratamento: doenças endócrinas, gastrointestinais, distúrbios genéticos, hematológicos, doenças reumáticas, transplante de órgãos, medicamentos, diversos (alcoolismo, amiloidose, sarcoidose, fibrose cística, insuficiência cardíaca congestiva, enfisema, etc.
Existem alguns fatores de risco comuns para o desenvolvimento de osteoporose da coluna vertebral:
- Idade avançada.
- Sexo feminino.
- Menopausa precoce.
- Raça caucasiana ou asiática.
- Histórico pessoais ou familiares de
- Ingestão inadequada de cálcio e vitamina D.
- Consumo excessivo de álcool ou tabaco.
- Pouca atividade física.
- Tratamento prolongado com: esteróides, anticonvulsivantes, heparina, protetores gástricos.
- Hormônio tireoidiano elevado.
- Genética.
Papel da epigenética na osteoporose.
Nos últimos anos, estudos demonstraram que a epigenética na regulação da formação óssea pode afetar significativamente a diferenciação de osteoblastos e osteoclastos. A aplicação da epigenética ao estudo dos mecanismos relacionados à biologia óssea, ao metabolismo ósseo e à exploração dos mecanismos que regulam a diferenciação e proliferação de osteoblastos e osteoclastos é de grande importância para compreender a etiologia e a patogênese das doenças ósseas metabólicas, bem como para desenvolver estratégias adequadas de prevenção e tratamento dessas doenças. A identificação de biomarcadores específicos relacionados à osteoporose melhorará substancialmente o diagnóstico clínico e o tratamento da doença. Amplas evidências apoiam a participação de mecanismos epigenéticos (metilação do DNA, modificações pós-tradução das caudas das histonas e RNA não codificantes) na diferenciação das células ósseas e na transdução mecânica. Os avanços no campo da epigenética destacam as complexas interações entre fatores genéticos e ambientais como determinantes da osteoporose e outras doenças comuns, Fig. 5
Fig. 5: Estrutura do DNA.
Benefícios da TOHB na osteoporose.
A terapia de oxigenação hiperbárica promove a oxigenação de todos os tecidos, incluindo os danificados, acelerando os processos de cicatrização dos ossos e articulações. Estimula a diferenciação das células formadoras dos ossos (osteócitos, osteoblastos, osteoclastos), favorecendo assim a reparação óssea. Essa patologia pode não apresentar sintomas até estar muito avançada, causando enfraquecimento da massa óssea, incapacidade de regenerar esses tecidos e fragilidade dos ossos, que podem fraturar-se. O fluxo sanguíneo no interior do osso deteriora-se e a falta de vitamina D e cálcio na nossa dieta podem ser outros fatores que favorecem a fragilidade dos ossos. A medicina hiperbárica (OHB) pode ser aplicada de forma preventiva, fortalecendo o fluxo sanguíneo periférico, uma vez que provoca angiogênese e vasculogênese ao mesmo tempo. Além disso, aumenta significativamente a síntese de colágeno durante os tratamentos na câmara hiperbárica, melhorando a regeneração do tecido ósseo e conjuntivo (ossos e articulações). A reativação da função circulatória é aumentada pelo aporte de oxigênio a 100% através do plasma sanguíneo. Desta forma, reduz-se a inflamação dos tecidos, diminuindo a dor e melhorando o estado físico geral do paciente. O tratamento com OHB tem se mostrado eficaz na regeneração óssea, aumentando o tecido ósseo quando este se encontra diminuído e diminuindo a capacidade de formação de osteoclastos e a reabsorção óssea de forma dependente do tratamento. Foi demonstrado que a hiperóxia estimula a diferenciação celular, aumentando o número de osteoblastos e acelerando a diferenciação e a formação do nódulo ósseo. Também aumenta a formação de depósitos minerais e o metabolismo fosfocalcico e a atividade da fosfatase alcalina óssea. A função celular e a remodelação óssea realizadas pelas células osteogênicas são dependentes de oxigênio e são estimuladas pela produção de fatores de crescimento em condições de hiperóxia. O efeito angiogênico e a produção de óxido nítrico (NO) também colaboram com a formação óssea e a diferenciação celular.
Melhora também o anabolismo ósseo e acelera a cicatrização de fraturas sem causar danos oxidativos ao DNA ou alteração da homeostase do cálcio plasmático.
Bibliografia:
Bennet MH, Stanford RE, Turner R. Terapia com oxigênio hiperbárico para promover a cicatrização de fraturas e tratar a não união de fraturas. Cochrane Database Syst Rev. Novembro de 2012 14;11(11):CD004712.pub4. PMID:23152225;PMCID:PMC7387126.
Kawada S,Wada E,Matsuda R,Ishii N. A hiperoxia hiperbárica acelera a consolidação de fraturas em camundongos. 2013 PLos ONE 8(8):e72603. Doi:10.1371
Conferência de consenso sobre prevenção, diagnóstico e tratamento da osteoporose. Instituto Nacional de Saúde, EUA. Rev Esp Enf Metab Oseas 2000;9:231-239.
Kanis JA. Avaliação da massa óssea e osteoporose. Em: Kanis JA, ed. Osteoporose. Oxford Blackwell Science, 1994;114-147.
Dai, Z., V. Ramish e J. W. Locasale (2020), “The evolving metabolic landscape of chromatin biology and epigenetics”, Nat. Rev. Genet., 21:737-753.
Carone, B. R. et al. (2010), “Reprogramação ambiental transgeracional induzida pelo pai da expressão gênica metabólica em mamíferos”, Cell, 143: 1084-1096.
Lumey, L. et al. (2007), “Perfil da coorte: Estudo das famílias holandesas durante o inverno da fome”, International Journal of Epidemiology, 36:1196-1204.
Mentch, S. J. et al. (2015), “Histone Methylation Dynamics and Gene Regulation Occur through the Sensing of OneCarbon Metabolism”, Cell Metabolism, 22:861-873.
Shiraki, N. et al. (2014), “Methionine Metabolism Regulates Maintenance and Differentiation of Human Pluripotent Stem Cells”, Cell Metabolism, 19:780-794.
Tobi, E.W. et al. (2014), “Assinaturas de metilação do DNA ligam a exposição pré-natal à fome ao crescimento e ao metabolismo”, Nature Communications, 5:5592.
1Cirurgião Maxilofacial, Mestre em Medicina Hiperbárica-Epigenética
marcesim777@gmail.com
2Cirurgiã Maxilo-Facial, Mestre em Medicina Hiperbárica-Epigenética.
marianaben151@gmail.com
