CANINE HYPOTHYROIDISM: CASE REPORT AND AWARENESS FOR EARLY DETECTION
REGISTRO DOI: 10.69849/revistaft/ar10202512090857
Caroline Beatriz Gomes Oliveira1
Orientador: Manrique Cardoso de Andrés2
Resumo
O hipotireoidismo é uma endocrinopatia comum em cães de meia-idade a idosos, acometendo tanto machos quanto fêmeas, mas mais observado em fêmeas. A doença resulta da secreção insuficiente de hormônios tireoidianos, levando a alterações metabólicas e sistêmicas. Este estudo teve como objetivo relatar um caso clínico de uma paciente canina, sem raça definida, de seis anos de idade, cujo atendimento veterinário foi buscado pelos tutores para vacinação anual contra a raiva, além da queixa de aumento de volume na região axilar direita e presença de um nódulo em membro torácico. Na anamnese os tutores relataram que a paciente já havia apresentado previamente um lipoma. Também mencionaram que ela apresentava sobrepeso e recebia dieta com ração light (23 kg – ECC: 7/9). Foi realizada citologia aspirativa por agulha fina, que apontou lipoma como diagnóstico provável. Como os tutores relataram que a paciente não conseguia perder peso mesmo com dieta específica e passeios três vezes ao dia, foram solicitados exames de triagem, incluindo dosagem de TSH e T4 total, que confirmaram o diagnóstico de hipotireoidismo. A paciente apresentava ainda hipercolesterolemia significativa. O início do tratamento com suplementação hormonal de levotiroxina resultou em perda de peso, melhora da disposição e normalização dos níveis de colesterol. Pode-se concluir que o casso apresentado reforça a importância do diagnóstico precoce e da inclusão do hipotireoidismo entre os diagnósticos diferenciais em cães com dificuldade de perda de peso e dislipidemia, garantindo melhor qualidade de vida e prevenindo complicações secundárias potencialmente graves, como a formação de mucocele em pacientes hipotireoideos.
Palavras-chave: canino, hipotireoidismo, dislipidemia, endocrinopatia.
1 INTRODUÇÃO
O hipotireoidismo canino é uma endocrinopatia frequente em caninos na meia idade, caracterizada pela diminuição da secreção de hormônios tireoidianos como a triiodotironina (T3) e tiroxina (T4). É uma doença de caráter hereditário, acometendo em sua maior parte fêmeas (CLARCK e KEMPPAINEN, 1994; DIXON, 2024) e com predisposição racial para dobermann, golden retirever, labrador, cocker spaniel, schanuser miniatura, teckel, setter irlandês, pastor de shetland, boxer, beagle, borzoi e dogue alemão (MERCHANT e TABOADA, 1997; PANCIERA et al., 2000; CAPEN e MARTIN 2003; GRECCO e STABENFELDT, 2017).
Cerca de 95% dos casos de hipotireoidismo adquirido ao longo da vida são de origem tireoidiana (FELDMAN e NELSON, 2004). Entre essas causas, destaca-se a tireoidite linfocítica, um processo imunomediado caracterizado por reação inflamatória inicial, migração de macrófagos e destruição progressiva do tecido tireoidiano (CATUREGLI et al., 2014; WEETMAN, 2017). Nessa condição, ocorre aumento gradual de autoanticorpos contra antígenos tireoidianos, como T3, T4, pendrina e coloide (ANTONELLI et al., 2015).
A doença inicia-se por uma fase silenciosa, na qual o tecido apresenta aspecto histológico preservado, mas há infiltração por células do sistema monocitário, presença de autoanticorpos e níveis normais de TSH, T3 e T4 (DAYAN e DANIELS, 1996; HIEN et al., 2020). Nessa etapa, há uma tireoidite instalada, porém nem sempre ocorre progressão para o hipotireoidismo, podendo haver estabilização espontânea (TAYLOR et al., 2018).
Posteriormente, pode surgir a fase subclínica, marcada por inflamação histológica mais evidente, presença de autoanticorpos, TSH elevado e T3 e T4 dentro da normalidade, mantidos nos níveis normais decorrentes de uma resposta tireoidiana compensatória onde aumenta TSH para aumentar os níveis de T3 e T4, os deixando assim nos valores de referência.
Quando aproximadamente 75% da glândula está destruída, instala-se a fase clínica, caracterizada por redução de T3 e T4, TSH aumentado e manifestações clínicas e laboratoriais compatíveis com hipotireoidismo (FELDMAN e NELSON, 2015; ETTINGER et al., 2017). Além da tireoidite linfocítica, o hipotireoidismo primário também pode ocorrer devido à atrofia idiopática da tireoide, caracterizada por depleção do parênquima glandular e substituição progressiva por tecido fibroso ou adiposo, sem evidências de inflamação (FELDMAN e NELSON, 2015; ETTINGER et al., 2017).
Embora em humanos exista relação evolutiva entre tireoidite linfocítica e atrofia, não há evidências histopatológicas suficientes em cães que confirmem a mesma progressão (WEETMAN, 2017; CATUREGLI et al., 2014). Nesse quadro, observa-se a perda acentuada da função glandular, resultando em redução marcada de T3 e T4 (FELDMAN e NELSON, 2015).
Outras causas de hipotireoidismo incluem neoplasias, que podem gerar sinais clínicos quando comprometem mais de 75% da glândula, ponto em que a produção hormonal se torna insuficiente (FELDMAN e NELSON, 2015). Além disso, o tratamento com iodo radioativo (I131) pode resultar em destruição extensa do tecido tireoidiano, levando ao hipotireoidismo quando o remanescente funcional é incapaz de manter secreção adequada de hormônios tireoidianos (ANTONELLI et al., 2015; DAYAN e DANIELS, 1996).
Pode haver também o hipotireoidismo primário e secundário, onde o problema não é na tireoide. O hipotireoidismo secundário ocorre quando o problema primário está localizado na hipófise, resultando em produção inadequada de TSH, hormônio essencial para estimular a tireoide. Animais com hipoplasia hipofisária congênita podem apresentar cretinismo, caracterizado por atraso no desenvolvimento físico e mental decorrente de níveis insuficientes de hormônios tireoidianos desde o nascimento. O cretinismo pode ter origem primária (falha da tireoide) ou secundária (deficiência de TSH) (FELDMAN e NELSON, 2020; PETERSON, 2016).
Quando a hipoplasia hipofisária envolve múltiplos hormônios tróficos, pode ocorrer pan-hipopituitarismo, levando a sinais como nanismo, devido à deficiência simultânea de GH e TSH (FELDMAN e NELSON, 2020).
Outra causa relevante de hipotireoidismo secundário são as neoplasias hipofisárias, especialmente macroadenomas, que podem comprimir o tecido normal da hipófise e reduzir a secreção de TSH (PETERSON, 2016; REUSCH, 2018). Procedimentos como hipofisectomia ou radioiodoterapia direcionada a tumores hipofisários também podem resultar em deficiência de TSH e consequente hipotireoidismo (FELDMAN e NELSON, 2020).
Já o hipotireoidismo terciário resulta de alterações no hipotálamo, que diminuem a síntese ou liberação do TRH, hormônio responsável por estimular a hipófise a secretar TSH. Embora raro em cães, pode ocorrer em condições que causem danos ou disfunção hipotalâmica (PETERSON, 2016; REUSCH, 2018).
As manifestações clínicas do hipotireoidismo se tornam evidentes quando há destruição de ≥75% do parênquima tireoidiano (FELDMAN e NELSON, 2020). Nessa condição, ocorre redução aproximada de 15% da taxa metabólica, resultando em sinais como letargia, intolerância ao exercício, termofilia e ganho de peso sem aumento da ingestão calórica (PETERSON, 2016).
O acúmulo de mucopolissacarídeos no tecido subcutâneo leva ao mixedema, frequentemente observado na região facial, mas também em membros e áreas distais (REUSCH, 2018). Alterações oculares incluem depósito lipídico corneano, úlceras de córnea, queratoconjuntivite seca e uveíte, secundárias à alteração da composição lacrimal (FELDMAN e NELSON, 2020).
Disfunções reprodutivas podem ocorrer, como infertilidade, falhas gestacionais e dificuldade de parto, embora menos frequentes (REUSCH, 2018). Em casos raros e graves, o paciente pode evoluir para coma mixedematoso, decorrente da supressão extrema do metabolismo celular (PETERSON, 2016).
Comprometimento neuromuscular, denominado doença do neurônio motor inferior, pode incluir fraqueza generalizada, tetraparesia, ataxia vestibular periférica, paralisia laríngea e megaesôfago (FELDMAN e NELSON, 2020).
Do ponto de vista dermatológico, são comuns alopecia bilateral e simétrica, cauda de rato, hipotricose, despigmentação, galactorreia, fenótipo acromegálico, além de piodermites recorrentes, malasseziose, demodicose, seborreia seca e hiperqueratose, decorrentes da diminuição do turnover epidérmico e da imunidade cutânea (REUSCH, 2018; FELDMAN e NELSON, 2020).
Alterações cardiovasculares incluem redução do débito cardíaco, bradicardia sinusal, baixa amplitude de complexos P e R, inversão da onda T, bloqueios atrioventriculares de primeiro e segundo graus e, raramente, fibrilação atrial. Tais alterações geralmente não comprometem o cotidiano, mas podem aumentar o risco em situações de estresse fisiológico, como anestesia ou fluidoterapia agressiva (PETERSON, 2016; REUSCH, 2018).
O diagnóstico é fundamentado na correlação entre os achados clínicos e laboratoriais, os principais achados laboratoriais em pacientes com hipotireoidismo são: anemia normocítica normocrômica discreta a moderada observada em 32-44% dos cães, resultado da redução da eritropoiese por menor estímulo tireoidiano e pela queda da demanda tecidual de oxigênio (REUSCH, 2018; FELDMAN e NELSON, 2020). Trata-se, em geral, de anemia não regenerativa, com contagem de reticulócitos baixa (PETERSON, 2016).
A hiperlipidemia, especialmente a hipercolesterolemia, está presente em cerca de 75% dos cães hipotireoidianos e pode ocorrer isoladamente ou associada à hipertrigliceridemia. Diferente de outras doenças metabólicas da espécie, no hipotireoidismo o colesterol tende a se elevar mais intensamente do que os triglicerídeos, devendo ser considerado diagnóstico diferencial diante de hipercolesterolemia desproporcional (FORD, 2015; FELDMAN e NELSON, 2020).
Podem ocorrer aumentos de FA e ALT, atribuídos ao infiltrado hepático lipídico decorrente da disfunção metabólica sistêmica (REUSCH, 2018). A elevação de CPK também é descrita, possivelmente relacionada a alterações musculares secundárias, semelhante ao que ocorre em humanos hipotireoidianos (FELDMAN e NELSON, 2020).
Cães hipotireoideos apresentam ainda maior predisposição à mucocele biliar, com risco aproximadamente três vezes maior do que em pacientes sem hipotireoidismo devido à associação entre hipercolesterolemia e redução do relaxamento do esfíncter de Oddi, já que o T4 participa desse mecanismo (MESICH et al., 2009; FELDMAN e NELSON, 2020). O tratamento com levotiroxina tende a melhorar tanto o perfil lipídico quanto a estase biliar.
A redução da taxa de filtração glomerular (TFG) em cães hipotireoideos pode levar a elevação discreta de creatinina e SDMA, sem que haja doença renal primária. Com a reposição hormonal, os valores retornam ao normal, confirmando tratar-se de alteração funcional e reversível (REUSCH, 2018; POLZIN, 2019).
O diagnostico dessa doença endócrina se dá pelos testes hormonais. A avaliação laboratorial do hipotireoidismo baseia-se principalmente na dosagem de TSH, T4 total, T4 livre e, menos frequentemente, T3 total (PETERSON, 2016; FELDMAN e NELSON, 2020). A dosagem de T3 não é recomendada, pois a maior parte desse hormônio é produzida intracelularmente por conversão do T4, não refletindo adequadamente a função tireoidiana e podendo permanecer normal mesmo nos estágios iniciais da doença (PETERSON, 2016).
O TSH encontra-se elevado em grande parte do hipotireoidismo primário, porém pode estar normal ou baixo em 20–40% dos cães devido à cronicidade da doença, secreção pulsátil, isoformas não detectáveis e exaustão hipofisária (REUSCH, 2018; FELDMAN e NELSON, 2020). Assim, quanto menor o T4 e quanto mais alto ou limítrofe superior estiver o TSH, maior a probabilidade de hipotireoidismo (FELDMAN e NELSON, 2020).
O T4 total é o teste mais sensível para o diagnóstico, pois diminui mais precocemente devido ao uso das reservas ligadas às proteínas carregadoras. Também é mais econômico (PETERSON, 2016). No entanto, sofre interferência de doenças não tireoidianas (eutireoideo doente), medicamentos e reação cruzada com autoanticorpos, podendo gerar resultados falsamente baixos (REUSCH, 2018).
Já o T4 livre apresenta maior especificidade, com menor interferência de doenças sistêmicas e medicamentos, mas reduz-se mais tardiamente no hipotireoidismo, podendo produzir falso-negativos iniciais, além disso, é mais caro (PETERSON, 2016; REUSCH, 2018).
Os exames de imagem apresentam utilidade limitada. Radiografias auxiliam principalmente na identificação de alterações compatíveis com hipotireoidismo congênito, como atraso do fechamento físico e retenção de dentes (FELDMAN e NELSON, 2020). Tomografia e ressonância são úteis apenas em casos suspeitos de neoplasias extensas que envolvam tireoide ou hipófise (REUSCH, 2018). A cintilografia permite avaliar tamanho, captação e função glandular, auxiliando na diferenciação entre hipotireoidismo primário, secundário ou terciário (PETERSON, 2016). A ultrassonografia avalia formato, ecogenicidade, parênquima e cápsula dos lobos tireoidianos, embora exista grande variação de volume entre raças (REUSCH, 2018).
O tratamento do hipotireoidismo é realizado por meio da reposição hormonal com levotiroxina sódica administrada por via oral, com o objetivo de restabelecer as concentrações séricas de T4 dentro dos valores de referência. O monitoramento terapêutico deve ser feito pela mensuração do T4 total basal e do T4 total pós-pill, coletado seis horas após a administração do fármaco, permitindo ajustes individualizados da dose conforme a resposta clínica e laboratorial (MOONEY e PETERSON, 2015; PETERSON, 2016).
A terapia de reposição promove melhora significativa das alterações laboratoriais (como hiperlipidemia e alterações hepáticas, anemia) e das manifestações clínicas, incluindo letargia, intolerância ao exercício e alterações dermatológicas. Entretanto, cada caso deve ser avaliado individualmente, sendo necessário instituir cuidados de suporte específicos, tais como: controle de infecções cutâneas secundárias, manejo nutricional para redução de peso quando indicado, controle da hiperlipidemia e tratamento de alterações biliares, como lama biliar ou outras afecções que exijam intervenções complementares (MOONEY e PETERSON, 2015; PETERSON, 2016).
Não existe prevenção para o hipotireoidismo em cães, pois as principais causas são condições espontâneas. O manejo preventivo inclui evitar medicamentos que possam comprometer a função tireoidiana e monitorar animais predispostos para identificação precoce da doença. Muitos casos de hipotireoidismo ainda são identificados tardiamente devido à baixa conscientização dos médicos veterinários quanto à importância do rastreamento periódico em pacientes com dermatopatias recorrentes, obesidade ou hipercolesterolemia. A ausência dessa investigação pode decorrer tanto da falha em correlacionar as manifestações clínicas com a doença quanto das limitações inerentes aos testes hormonais, que podem gerar interpretações equivocadas. Para aprimorar a detecção precoce dessa endocrinopatia, recomenda-se a implementação de ações educativas direcionadas a profissionais da área e a inclusão rotineira da dosagem de hormônios tireoidianos em check-ups anuais (MOONEY e PETERSON, 2015; PETERSON, 2016).
Nesse contexto, este estudo teve como objetivo relatar um caso de hipotireoidismo canino diagnosticado em uma fêmea, sem raça definida (SRD), com 6 anos de idade destacando as alterações laboratoriais e as suas respostas frente ao tratamento instituído. Discutindo a importância do diagnóstico precoce por meio da inclusão rotineira de exames hormonais tireoidianos em check-ups.
2 RELATO DE CASO
Uma paciente canina, sem raça definida (SRD), castrada, 6 anos, foi atendida em uma clínica veterinária localizada na cidade de São Paulo – SP para vacinação anual contra a raiva. Durante a anamnese, os tutores relataram histórico prévio de lipoma, removido cirurgicamente, e informaram que a paciente apresentava dois novos aumentos de volume semelhantes aos anteriores, localizados na região axilar direita e no membro torácico. Relataram ainda que a paciente estava com ganho de peso progressivo há aproximadamente dois anos, passando de 20 kg para 23 kg. Já havia passado em consulta com colega e apesar das orientações de substituição da dieta por ração light e aumento da frequência de passeios, não houve melhora significativa. Segundo os tutores, a paciente também demonstrava menos disposição para passeios.
No exame físico, a cadela apresentava escore de condição corporal (ECC) 7/9, escore de massa muscular (EMM) 2/3, peso corporal 23 kg, PAS 130 mmHg, frequência cardíaca 84 bpm, temperatura retal 37,6ºC, glicemia 88 mg/dL e mucosas discretamente hipocoradas. Diante dos achados clínicos e do relato dos tutores, foram solicitados hemograma, bioquímica sérica, dosagens hormonais, ultrassonografia abdominal, eletrocardiograma e citologia das massas para triagem diagnóstica completa.
Os exames revelaram hemograma, leucograma e plaquetograma dentro dos padrões de normalidade. A bioquímica sérica demonstrou aumento das enzimas hepáticas, hipertrigliceridemia e hipercolesterolemia. As dosagens hormonais evidenciaram elevação de TSH e redução de T4 total, compatíveis com hipotireoidismo. Diante dos achados clínicos, laboratoriais e hormonais, foi estabelecido o diagnóstico de hipotireoidismo canino.
Tabela 1. Eritrograma
| Parâmetro | Resultado | Referência |
| Eritrócito | 6,34 milhões/mm³ | 5,50 – 8,50 |
| Hemoglobina | 16,3 g/dL | 12,0 – 18,0 |
| Hematócrito | 47,0% | 37,0 – 55,0 |
| VCM | 74,1 u³ | 60 – 77 |
| HCM | 25,7 pg | 19,5 – 24,5 |
| CHCM | 34,7 g/dL | 31 – 37,7 |
| RDW | 13,8% | 12 – 18,4 |
| Proteína Total | 11 g/dL | 5,5 – 8,0 |
| Morfologia | Normal | – |
Tabela 2. Leucograma
| Parâmetro | Resultado | Referência |
| Leucócitos | 6,2 mil/mm³ | 6,0 – 17,0 |
| Metamielócitos | 0% | 0 |
| Bastonetes | 0% | 0 – 3 |
| Segmentados | 72% | 60 – 77 |
| Eosinófilos | 4% | 2 – 10 |
| Basófilos | 0% | 0 – 1 |
| Linfócitos | 16% | 12 – 30 |
| Monócitos | 8% | 1 – 10 |
| Morfologia | Normal | – |
Tabela 3. Plaquetograma
| Parâmetro | Resultado | Referência |
| Plaquetas | 276 mil/mm³ | 179 – 555 |
| Avaliação | Presença de fibrina e diversos agregados plaquetários | – |
Tabela 4. Parâmetros bioquímicos
| Parâmetro | Resultado | Referência |
| Ureia | 38 mg/dL | 10 – 60 |
| Creatinina | 0,70 mg/dL | 0,50 – 1,60 |
| ALT | 279 U/L | 7 – 92 |
| FA | 230 U/L | 10 – 155 |
| Triglicérides | 409 mg/dL | 32 – 125 |
| Colesterol | 1498 mg/dL | 116 – 300 |
| T4 Total RIE | 0,34 µg/dL | 1,25 – 3,9 |
| TSH Quimio | 1,67 ng/ml | 0,10 – 0,6 |
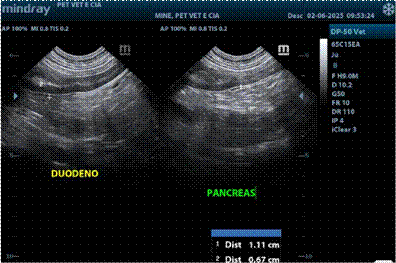
O exame ultrassonográfico abdominal revelou rins com ecogenicidade acentuada difusa e limite corticomedular reduzido. Hepatomegalia, hepatopatia difusa associada a infiltração gordurosa importante (sugestivo de endocrinopatia). Vesícula biliar com repleção moderada e conteúdo anecoico de aspecto denso. Pâncreas com aspecto reacional/infiltração fibroadiposa.
Segmentos intestinais compatíveis com duodenite e enterite. Esplenomegalia.
Figura 1. Exame ultrassonográfico vesícula biliar
Figura 2. Exame ultrassonográfico fígado
Figura 3. Exame ultrassonográfico duodeno e pâncreas
O resultado das citologias aspirativas por agulha fina (CAAF) para os aumentos de volume que os tutores se referiram foi de lipoma. No exame de eletrocardiograma não foram observadas nenhuma alteração na condutividade elétrica do coração, ritmo sinusal e FR de 99bpm.
Em virtude do diagnóstico confirmado de hipotireoidismo canino, paciente foi encaminhada para consulta com endocrinologista veterinário. Foi instituído o tratamento com Tyrox 800 (levotiroxina sódica) sendo iniciado na primeira semana com meio comprimido SID 30 minutos antes da refeição e após a primeira semana meio comprimido BID 30 minutos antes das refeições. Foi prescrito também Zetia 10mg (ezetimiba) 1 comprimido SID até novas recomendações. A orientação dietética foi a troca da ração light para Royal Canin Satiety – 200g/dia. Solicitado manter os passeios 3x ao dia para auxiliar na perda de peso, tendo como peso meta: 19Kg.
Foi solicitado retorno com exames um mês após o início do tratamento – T4 Total Basal e 6 horas pós pill, colesterol, ALT, FA, triglicérides. Os resultados mostraram melhora significativa nos exames laboratoriais da paciente e teste hormonal mostrou tratamento terapêutico satisfatório com a dosagem instituída para a paciente. Além da melhora nos exames laboratoriais, houve melhora na disposição da paciente e houve perda de peso, na reavaliação estava com 21,7Kg (perda de 1,3Kg em 1 mês de tratamento).
Tabela 4. Resultados exames laboratoriais
| Parâmetro | Resultado antes do tratamento | Resultado após o tratamento | Referência |
| FA | 230 U/L | 69 U/L | 10,0 – 155 |
| ALT | 279 U/L | 98 U/L | 7 – 92 |
| Colesterol | 1498 mg/dL | 192 mg/dL | 116 – 300 |
| Triglicérides | 409 mg/dL | 217 mg/dL | 32 – 125 |
Tabela 5. Resultados exames laboratoriais um mês após o início do tratamento
| Parâmetro | Resultado | Referência |
| T4 total basal | 1,63 µg/dL | 1,25 – 3,90 |
| T4 pos pill (6H) | 4,18 µg/dL | 2,50 – 5,00 |
Paciente foi orientada a suspender a medicação Zetia e manter Tyrox até novas recomendações. Foi solicitado reavaliação endócrina em 6 meses para acompanhamento. Tutores demostraram interesse em realizar remoção cirúrgica dos lipomas e envio das amostras para histopatológico. Do ponto de vista endocrinológico paciente foi liberada para seguir para o procedimento. O resultado do histopatológico dos dois aumentos de volume foi confirmado como lipoma através do exame histopatológico.
3 DISCUSSÃO
O caso clínico apresentado evidencia a rápida e eficaz resposta terapêutica de cães hipotireoideos ao uso de levotiroxina sódica, comprovando o que a literatura descreve sobre a boa reversibilidade das manifestações metabólicas e clínicas após a reposição hormonal. Entretanto, observa-se que o diagnóstico do hipotireoidismo tardio em sua grande maioria ocorre decorrente de seus sinais iniciais serem confundidos apenas com sobrepeso ou obesidade decorrente do estilo de vida dos pacientes.
No presente caso, as manifestações clínicas foram inicialmente interpretadas pelos tutores e possivelmente também por colega que atendeu o paciente anteriormente apenas como consequência da ingestão calórica excessiva e da baixa atividade física. Esse cenário é comum na prática veterinária atual: com a crescente urbanização e aumento do número de animais vivendo em apartamentos, que por sua vez estão cada vez menores, tem-se observado redução significativa dos níveis de exercício diário, favorecendo o ganho de peso. Paralelamente, práticas alimentares inadequadas, incluindo oferta de petiscos calóricos e manejo nutricional irregular, contribuem para o agravamento do ganho de peso desses pacientes.
No entanto, conforme discutido em diversos estudos, o sobrepeso e a obesidade não devem ser interpretados isoladamente, devendo sempre levantar suspeita para doenças endócrinas ainda não diagnosticadas, entre elas o hipotireoidismo. As alterações laboratoriais dessa endocrinopatia, como hipercolesterolemia, hipertrigliceridemia e elevação de enzimas hepáticas, são frequentemente silenciosas e podem passar despercebidas quando não há investigação adequada. Além disso, a evolução clínica pode levar a complicações importantes, como mucocele biliar, uma condição potencialmente grave e já associada na literatura a cães hipotireoideos, sobretudo aqueles com dislipidemias acentuadas.
A literatura reforça que o diagnóstico precoce é fundamental não apenas para prevenir as complicações, mas também para melhorar a resposta ao tratamento e a qualidade de vida dos pacientes. O caso analisado demonstra que, mesmo após um período prolongado de evolução clínica, a terapia hormonal adequada promoveu melhora significativa em curto prazo, reafirmando o caráter tratável e controlável da doença quando identificada.
Dessa forma, este relato destaca a importância de uma abordagem mais abrangente durante as consultas veterinárias de rotina, mesmo que seja um atendimento de vacinação.
Animais com sobrepeso, obesidade ou manifestações cutâneas recorrentes devem ter seu quadro investigado de forma criteriosa, incluindo triagem laboratorial com dosagem hormonal. Esse cuidado é essencial, considerando que a obesidade reduz a expectativa de vida e pode mascarar doenças endócrina, na qual a identificação precoce proporciona benefícios s ao bemestar e à expectativa de vida dos pacientes.
4 CONCLUSÃO
O caso apresentado demonstra que cães com dificuldade de perda de peso, sobrepeso ou obesidade devem ser avaliados de forma abrangente, incluindo exames laboratoriais e de imagem, a fim de identificar precocemente possíveis endocrinopatias ou consequências decorrentes do ganho de peso. Devendo sempre triar pacientes com quadro de obesidade e realizar ajuste na dieta mesmo que os pacientes não tenham alterações endócrinas, afinal sobrepeso/obesidade são doenças que merecem a devida atenção a fim de aumentar a qualidade e expectativa dos pacientes.
A resposta favorável ao tratamento com levotiroxina sódica evidencia a eficácia da reposição hormonal no manejo do hipotireoidismo canino, com rápida melhora das manifestações clínicas e das alterações laboratoriais. Diante disso, reforça-se a importância da inclusão de exames laboratoriais para pacientes com quadros de sobrepeso/obesidade e o rastreamento precoce das consequências de o paciente estar acima do peso, podendo diferenciar em alguma alteração metabólica/endócrina ou se é relacionada ao estilo de vida do paciente, garantindo assim diagnósticos mais precisos, intervenções adequadas e mais longevidade e bem estar aos pacientes.
REFERÊNCIAS
ANTONELLI, A. et al. Role of autoimmunity and inflammation in thyroid dysfunction. Nature Reviews Endocrinology, v. 11, n. 2, p. 108–120, 2015.
CATUREGLI, P. et al. Hashimoto’s thyroiditis: clinical and diagnostic criteria. Autoimmunity Reviews, v. 13, n. 4-5, p. 391-397, 2014.
DAYAN, C. M.; DANIELS, G. H. Chronic Autoimmune Thyroiditis. New England Journal of Medicine, v. 335, p. 99-107, 1996.
ETTINGER, S. J.; FELDMAN, E. C.; COHN, L. A. Textbook of Veterinary Internal Medicine: Diseases of the Dog and the Cat. 8. ed. St. Louis: Elsevier, 2017.
FELDMAN, E. C.; NELSON, R. W. Canine and Feline Endocrinology. 5. ed. St. Louis: Elsevier, 2020.
FORD, R. B. Dyslipidemias in dogs: diagnostic approach and clinical relevance.
Compendium on Continuing Education for the Practicing Veterinarian, v. 37, p. 1-10, 2015.
HIEN, V.; CHAKER, L.; PEETERS, R. Thyroid function and autoimmunity across disease stages. Nature Reviews Endocrinology, v. 16, p. 30-44, 2020.
KAHALY, G. J.; DIETLEIN, M. Autoimmune thyroid disease. Endocrine Reviews, v. 41, n. 2, p. 169-201, 2020.
MESICH, R. et al. Gallbladder mucocele in dogs: association with endocrinopathies and hyperlipidemia. Journal of the American Animal Hospital Association, v. 45, n. 2, p. 72– 80, 2009.
PETERSON, M. E. Diagnostic approach to canine hypothyroidism. Journal of Veterinary Internal Medicine, v. 30, n. 3, p. 1-12, 2016.
POLZIN, D. J. Chronic kidney disease: pathophysiology and management. Veterinary Clinics of North America: Small Animal Practice, v. 49, n. 2, p. 387–403, 2019.
REUSCH, C. E. Hypothyroidism in dogs. Veterinary Clinics of North America: Small Animal Practice, v. 48, n. 2, p. 291-305, 2018.
TAYLOR, P. N. et al. Global epidemiology of autoimmune thyroid disease. The Lancet Diabetes & Endocrinology, v. 6, n. 6, p. 469-478, 2018.
WEETMAN, A. P. Autoimmune Thyroid Disease. New England Journal of Medicine, v. 376, n. 26, p. 2543-2554, 2017.
¹Discente do Curso de Especialização em Endocrinologia e Metabologia da Associação Nacional de Clínicos Veterinários de Pequenos Animais – ANCLIVEPA, Campus São Paulo. e-mail: caendocrinovet@gmail.com
²Orientador especialista em Dermatologia Veterinária. e-mail: manrique.vetdermato@gmail.com
