REGISTRO DOI: 10.69849/revistaft/cl10202601221233
Sílvia Mara Haluch1
Flávia Caroline Haluch2
RESUMO:
Vivemos constantemente sendo bombardeados por contaminantes químicos, biológicos e físicos de diversas fontes. Esses poluentes geram efeitos deletérios graves e mortais e chegam em todos os compartimentos do planeta, aos quais se incluem, seres humanos, animais, plantas e todas as cadeias do ecossistema. Dos poluentes relevantes podemos citar os microrganismos de alta resistência e os medicamentos que são lançados nos rios e oceanos por fontes antrópicas. A Organização Mundial da Saúde torna público, em seus relatórios, a realidade assustadora de bactérias multi e Panresistentes a diversos medicamentos, gerando alta taxa de letalidade em todos os países. Esses organismos podem chegar aos humanos por diversas fontes e gerar patologias de alta gravidade, pois não há terapias medicamentosas devido ao fenômeno de resistência microbiana, causado pela maioria das vezes pelo contato dos fármacos lançados ao meio ambiente. Por isso, soluções tecnológicas são um apelo internacional. Esse trabalho relata o uso de ozônio, no intuito de eliminar organismos patogênicos e concomitantemente, clivar compostos de fármacos em resíduos líquidos/solução preparada. Nos testes realizados o ozônio foi eficaz em eliminar as bactérias Escherichia coli NCTC 12241 e Salmonela entérica, cepa Salmonela sorotipo thyphimurium NCTC® 12023 em apenas 1 hora em solução isenta de sólidos e em 3 horas em soluções contendo sólidos suspensos. Para os fármacos testados, Paracetamol foi eliminado em 3 horas, Dipirona em 4 horas, azitromicina, amoxicilina, cefalexina e diclofenaco em 5 horas. Portanto, o uso de ozônio a 5 g/H/L foi altamente eficaz contra males ocultos e altamente disseminados em efluentes domésticos e industriais, sendo uma solução tecnológica de alta performance para o atendimento dos ODS – Objetivos de Desenvolvimento sustentável, levando saúde para todos e preservando o meio ambiente.
Palavras Chave: fármacos, resistência microbiana, efluentes, Enterobacteriaceae, saúde.
ABSTRACT: We constantly live being bombarded by chemical, biological, and physical contaminants from various sources. These pollutants generate severe and deadly effects and reach all compartments of the planet, including humans, animals, plants, and all ecosystem chains. Among these serious pollutants, we can mention highly resistant microorganisms and drugs that are released into rivers and oceans from anthropogenic sources. Among these serious pollutants, we can mention highly resistant microorganisms and drugs that are released into rivers and oceans by anthropogenic sources. The World Health Organization publicly reports, in its reports, the alarming reality of multi- and pan-resistant bacteria to various medications, resulting in a high death rate in all countries. These organisms can reach humans through various sources and generate severe pandemics, as there are no drug therapies available due to the phenomenon of microbial resistance, which is most often caused by the contact of drugs released into the environment. Therefore, technological solutions are an international appeal. This study reports the use of ozone with the aim of eliminating pathogenic organisms and, at the same time, cleaving drug compounds in liquid waste. In the tests carried out, ozone was effective in eliminating the bacteria Escherichia coli NCTC 12241 and Salmonella enterica, Salmonella serotype Typhimurium strain NCTC® 12023 in just 1 hour in a solids-free solution and in 3 hours in solutions containing suspended solids. For the drugs tested, Paracetamol was eliminated in 3 hours, Dipyrone in 4 hours, and azithromycin, amoxicillin, cephalexin, and diclofenac in 5 hours. Therefore, the use of ozone at 5 g/H/L was highly effective against hidden and widely spread contaminants in domestic and industrial effluents, being a technological solution of high relevance for achieving the SDGs – Sustainable Development Goals, bringing health to all and preserving the environment.
Keywords: drugs, microbial resistance, effluents, Enterobacteriaceae, health.
INTRODUÇÃO
Constantemente estamos sendo bombardeados por poluentes oriundos de diversas fontes, como atmosféricas, aquáticas, alimentícias, laboral e acidental (Leithold et al., 2017; Duarte et al., 2022). Esses poluentes são de características químicas, físicas e biológicas, que podem produzir efeitos deletérios gravíssimos em todos os compartimentos do planeta, aos quais incluem, água, solo, atmosfera, seres humanos, outros animais, plantas, ou seja, grupos da cadeia alimentar e ecossistema (PAHO, 2023; Haluch et al., 2023c,d,e WHO, 2017).
Tantos componentes químicos, físicos e biológicos possuem uma capacidade em impactar seres vivos, pois possuem uma especialidade de mecanismos de entrada, como solubilidade, grupos orgânicos facilitadores de atravessar membranas, características voláteis, miscíveis e outros, que constituem a fonte de diversas patologias de interesse clínico médico e veterinário (Haluch, 2019 a, b; WHO,2005).
A partir de 2017, a OMS – Organização Mundial da Saúde, traz ao mundo uma nova preocupação que até então estava inerte e foi reforçada pós Pandemia de SARS – COV19, que chamamos fenômeno da resistência microbiana, que é em resumo, a versatilidade de microrganismos em resistir a ação de substâncias e medicamentos, prevalecendo em todos os compartimentos ambientais e células, ocasionando patologias intratáveis (Haluch et al., 2020; OMS, 2017; ANVISA, 2013; WHO, 2005).
A OMS listou portanto, os organismos mais críticos devido ao perfil de letalidade e resistência, sendo o filo Proteobactérias, classe Gamaproteobactérias, família Enterobacteriaceae de grande interesse científico e farmacêutico, como por exemplo, Klebsiella pneumoniae, Escherichia coli, Enterobacter spp, Serratia spp, Proteus spp, Providencia spp e Morganella spp que são citadas constantemente em relatórios internacionais. (PAHO, 2023; WHO, 2017, OMS, 2017).
Os primeiros mecanismos de resistência, na maioria das vezes, se inicia no contato do microrganismo com um fármaco e a percepção de um ambiente hostil, dando gatilho na busca defesas, sendo em primeiro plano, bloquear e expulsar a substância deletéria de sua célula e depois buscar a mudança em seu código genético de várias formas no intuito de perpetuar e se adaptar (Haluch, 2019ª,b; Tortora, 2017).
Portanto, a resistência a antibióticos e a diversidade de microrganismos altamente especializados, pode ser considerada como uma resposta de exposição aos fármacos pelo contato no ecossistema aquático (Leithold et al., 2017; Haluch, 2019ª,b; Tortora, 2017). Dejetos antrópicos sempre acabam chegando aos rios e aos oceanos causando efeitos indesejáveis (Xie et al., 2016; 2017; 2018).
Os tratamentos desses resíduos ocultos atualmente são ineficazes e os mesmos acabam perpetuando por longos períodos acarretando a resistência microbiana (Haluch et al., 2023D; Sapers et al., 1998). Por esse fato, tanto os fármacos quanto os microrganismos especializados são contaminantes graves, que necessitam de soluções ambientais e um apelo aos cientistas para a busca de garantir um ambiente seguro e saudável.
Uma solução tecnológica é a aplicação de Estação de Ozônio. O Ozônio (O3) é uma substância gasosa derivada do alótropo do Oxigênio (O2), possuindo uma característica altamente oxidante, sendo portanto, um dos processos de oxidação e esterilização mais eficientes em relação a agentes como cloro, quaternários de amônio e outros (Sapers et al., 1998; Oller et al., 2011; Kurmiawan et al., 2006; Hassemer et al., 2002; Langlais et al., 1991; Perchonok et al., 2005).
O sucesso do ozônio em estações de tratamento de efluentes industriais e domésticos, consiste na fragmentação das ligações duplas e triplas entre carbonos e alterar ou desestruturar paredes membranosas de diversos microrganismos (Reynolds et al., 1989; Perchonok et al., 2005; Luis et al., 2013; Anzoli et al, 2018; Duarte et al., 2022; Oller et al., 2011; Languais et al., 1991; Kurniawan et al., 2006; Hassemer et al.,2002; Amorin et al., 2009; Eltech, 1998).
O ozônio em alguns países é utilizado como processo de tratamento de água potável (Bocci, 2005; Luis et al., 2013; Lima et al., 2021; Duarte et al., 2022). Em contato com a água, o processo inicia com a formação de íons hidroxila – OH–, radicais hidroperoxil e superóxido, que participam de diversas reações em cadeia, culminando na degradação e oxidação da matéria orgânica e outros compostos indesejáveis (Ukuku et al., 2012). Além dos íons, o ozônio também participa e reage clivando hidrocarbonetos (Duarte et al., 2022; Reynolds et al., 1989) e em meio alcalino a sua ação se intensifica podendo atuar como meio de arraste (striping), movendo compostos voláteis para a atmosfera gasosa (Duarte et al., 2022; Oliveira et al., 2018; Lima et al., 2021).
Devido a característica química a reação é termodinamicamente espontânea, porém cineticamente lenta, por isso, requer um tempo de permanência estendidas para alcançar o fim pretendido, necessitando estudos caso a caso. Quanto maior a capacidade do gerador, acoplamentos de concentradores de oxigênio, uso de ultravioleta, contando com a característica do material a ser tratado, maior eficiência no poder oxidativo (Amorin et al., 2009; Hassemer et al.,2002; Oller et al., 2011).
Dessa forma, o uso do ozônio pode ser a chave para o sucesso em estações de tratamento de efluentes domésticos ou industriais, com uso duplo, quebrando moléculas de fármacos e eliminando microrganismos de interesse clínico, sendo uma solução de alta performance contra os poluentes persistentes e ocultos, evitando inclusive, novas pandemias e atendendo os ODS – Objetivos de desenvolvimentos sustentável.
MATERIAIS E MÉTODOS
Solução teste microbiológica
A solução teste microbiológica visa expor bactérias de alta importância médica e foram selecionadas de acordo com a patologia a Enterobactéria que é tida como indicadora de contaminação fecal: E. coli Enteropatogênica, que causam gastroenterites graves, infecções generalizadas e até sepse. Outra bactéria de alta relevância é a Salmonela sp que causa a Salmonelose.
Dessa forma, as bactérias utilizadas foram a Escherichia coli NCTC 12241 (WDCM 00013) e Salmonela entérica, cepa Salmonela sorotipo thyphimurium NCTC® 12023 (WDCM 00031), ambas são material de referência certificado de acordo com a NBR ISO 17034 e 17025 da Empresa Control-lab. A solução teste foi contaminada com colônias coletadas com alça de platina e transferida para água deionizada salinizada e estéril, no intuito de gerar pelo menos 104 UFC/mL.
Solução teste de fármacos
A solução teste de fármacos foi preparada com mistura de medicamentos de MRCs – Materiais de referência certificados, ou seja, acreditados segundo a NBR ISO 17025, 17034 e Guia 31. Foram adquiridos as substâncias com maiores usos no Brasil, sendo o Paracetamol código DRE-C15846000 (marca LGC– DR-EHRENSTORFER), Azitromicina código Y0000306 (marca EDQM – European Pharmacopoeia), amoxicilina DRE-C10242500 (marca LGC – DR-EHRENSTORFER), Cefalexina monohidratada G984299 (marca LGC – DR-EHRENSTORFER), dipirona – metamizolsódico, DRE-C14942000 (marca LGC – DR-EHRENSTORFER) e o diclofenaco sódico DRE-C12537500 (marca LGC– DR-EHRENSTORFER). A preparação zelou para que na solução teste iniciasse pelo menos com 10 µg.L-1 de cada componente.
ANÁLISES FÍSICO E QUÍMICAS
A análise de pH– Potencial Hidrogeniônico foi realizada pelo pHmetro Bel seguindo o método SM 4500-PH. Análise de Turbidez foi realizada no equipamento PF12 NM seguindo o método SM 2130 e análise de Sólidos suspensos totais (SST) foi realizada na balança Bioprecisa seguindo o método SM 2540-D (APHA, 2023).
A análise dos fármacos seguiu a técnica de Cromatografia gasosa (CG) pelo uso de detector FID (flame ionization detector), HP 5890 série II, coluna DB 5 30 m, 0,25 mm/ 0,25 micro, temperatura injetor de 200º C, Temperatura detector de 250º C, Gás de arraste Nitrogênio, rampa Início de 50º C por 5 minutos, 10ºC/min até 100ºC, 15º C/min até 250º C por 10 minutos e o solvente extrator foi o diclorometano PA.
ANÁLISES MICROBIOLÓGICAS
As análises biológicas seguiram os protocolos de boas práticas laboratoriais. Foram utilizados os meios de cultivo Mac Conkey, EMB – eosina azul de metileno, agar Salmonela/Shiguela (SS). Os meios sólidos foram confeccionados em placas de petri 90×15, com autoclavação por 15 minutos em 121o C para Enterobacterias e o meio SS apenas dissolução em chapa a 100o C. A incubação seguiram na temperatura de 35 ±0,5o C por 48 horas.
TESTE PILOTO LABORATORIAL
Os testes foram realizados usando o padrão de 1 litro de solução para um gerador de 5g/H de O3 e dispersor para simulação de micro e nano bolhas, sendo portanto, 5g O3/ H/ L.
AMOSTRA TESTE REAL
O efluente real testado é oriundo de fonte hospitalar, coletado segundo os padrões de Standard Methods (APHA, 2023).
RESULTADOS E DISCUSSÃO
A tabela 01 abaixo, traz os resultados dos testes das soluções preparadas no laboratório contendo fármacos e bactérias inoculadas, sendo identificada como bruto, que é a condição inicial antes da dispersão de ozônio até 5 horas de exposição.
Tabela 01: Resultados dos testes da solução preparada antes e depois da dispersão de ozônio.
| Parâmetros | Solução preparada(bruto) | Após 1 hora de exposição | Após 2 horas de exposição | Após 3 horas de exposição | Após 4 horas de exposição | Após 5 horas de exposição |
| Paracetamol (µg.L-1) | 9,2 | 3,1 | 2,2 | <1,0 | <1,0 | <1,0 |
| Dipirona (µg.L-1) | 9,6 | 8,3 | 5,1 | 3,0 | <1,0 | <1,0 |
| Azitromicina (µg.L-1) | 10,1 | 9,2 | 9,0 | 8,6 | 2,9 | <1,0 |
| Amoxicilina (µg.L-1) | 9,7 | 9,5 | 9,3 | 8,4 | 1,8 | <1,0 |
| Cefalexina (µg.L-1) | 9,9 | 9,3 | 9,0 | 8,7 | 2,4 | <1,0 |
| Diclofenaco (µg.L-1) | 10,2 | 9,9 | 9,0 | 4,2 | 1,6 | <1,0 |
| Salmonela patogênica -UFC/mL | 6,0 x 104 | <1 | <1 | <1 | <1 | <1 |
| E. coli Enteropatogênica -UFC/mL | 1,0 x 106 | <1 | <1 | <1 | <1 | <1 |
| pH – U pH | 7,05 | 7,07 | 7,04 | 7,02 | 7,03 | 6,97 |
| Sólidos suspensos totais (mg.L-1) | <10,0 | <10,0 | <10,0 | <10,0 | <10,0 | <10,0 |
| Turbidez ( NTU) | 10 | 6 | <1 | <1 | <1 | <1 |
Fonte: Autores.
A tabela 02 abaixo, descreve os resultados dos testes do efluente real hospitalar, sendo o bruto, a condição inicial antes da dispersão de ozônio e os dados até 5 horas de exposição.
Tabela 02: Resultados dos testes da amostra real hospitalar
| Parâmetros | BrutoEfluente real | Após 1 hora de exposição | Após 2 horas de exposição | Após 3 horas de exposição | Após 4 horas de exposição | Após 5 horas de exposição |
| Paracetamol (µg.L-1) | <1,0 | <1,0 | <1,0 | <1,0 | <1,0 | <1,0 |
| Dipirona (µg.L-1) | <1,0 | <1,0 | <1,0 | <1,0 | <1,0 | <1,0 |
| Azitromicina (µg.L-1) | <1,0 | <1,0 | <1,0 | <1,0 | <1,0 | <1,0 |
| Amoxicilina (µg.L-1) | <1,0 | <1,0 | <1,0 | <1,0 | <1,0 | <1,0 |
| Cefalexina (µg.L-1) | <1,0 | <1,0 | <1,0 | <1,0 | <1,0 | <1,0 |
| Diclofenaco (µg.L-1) | <1,0 | <1,0 | <1,0 | <1,0 | <1,0 | <1,0 |
| Salmonela patogênicaUFC/mL | 2,0 x 102 | <1 | <1 | <1 | <1 | <1 |
| E. coli –UFC/mL enteropatogênica | 9,0 x 105 | 3,5 x 103 | <1 | <1 | <1 | <1 UFC/mL |
| pH – U pH | 6,87 | 6,82 | 6,81 | 6,89 | 6,80 | 6,79 |
| Sólidos suspensos totais (mg.L-1) | 210,0 | 220,0 | 210,0 | 180,0 | 165,0 | 130,0 |
| Turbidez (NTU) | 39 | 27 | 19 | 15 | 12 | 5 |
Fonte: Autores.
Pelos resultados obtidos podemos observar que em ambos os testes, o ozônio foi eficaz em eliminar bactérias patogênicas, sendo que na solução isenta de sólidos suspensos, apenas de 1 hora ocorreu o decréscimo completo e em solução contendo sólidos em 3 horas. Vários autores relatam a descontaminação total em até 15 minutos e outras fontes em 30 minutos, porém todas em unanimidade trazem ozônio com agente esterilizante (Duarte et al., 2022; Oliveira et al., 2018; Lima et al., 2021; Perchonok et al., 2005; Oller et al., 2011; Languais et al., 1991; Amorin et al., 2009; Eltech, 1998).
A figura 01A traz a comparação da placa de meio de cultura da solução preparada antes da exposição e a placa semeada da solução após a exposição de 1 hora (figura 01B) com ozônio na concentração 5 g/L/H.
Figura 01: 01A Solução preparada /bruto. 01B: solução teste após 1 hora de exposição.

Fonte: Autores.
A Escherichia coli patogênica é uma Enterobactéria que causa diversos surtos de diarreia, infecção urinária e mortes por sepsemia em pacientes hospitalizados (Brasil, 2010). A Salmonela spp é a bactéria responsável pelas intoxicações graves alimentares, principal causa de zoonoses e com maior ocorrência em surtos de gastroenterites no mundo (FUNASA, 2004). Por isso, essa solução tecnológica é de suma importância no intuito de garantir o não lançamento de efluentes contendo bactérias nocivas e evitando a contaminação dos ambientes aquáticos.
Para os fármacos, que são chamados de poluentes persistentes, que induzem a resistência microbiana, tivemos remoção de 100% quando foi exposto por 5 horas/L/H.
O Paracetamol foi eliminado em 3 horas, Dipirona em 4 horas e azitromicina, amoxicilina, cefalexina e diclofenaco em 5 horas.
Importante observar pelos cromatogramas obtidos figura 02 e 03, podemos facilmente comparar a solução bruta (figura 02) com a solução teste de 4 horas de exposição (figura 03), sendo nítido que os picos das substâncias aumentam nos primeiros minutos no teste de 4 horas, ou seja, ocorre um aumento de compostos de baixo peso molecular, os quais possuem tempo de retenções menores enquanto a solução bruta inicial, possuem os fármacos com altos pesos moleculares e tempo de retenção maiores, ficando nítido a quebra de cadeias dos fármacos.
Figura 02: Cromatograma da solução bruta contendo fármacos. PM = Peso molecular.
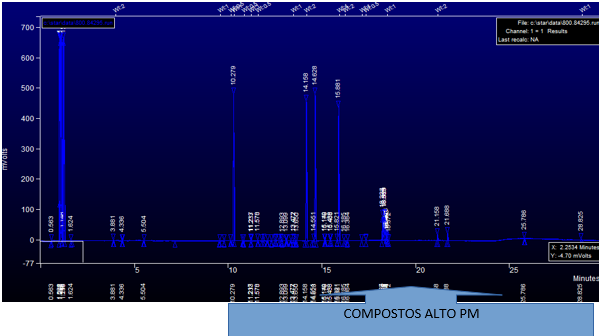
Fonte: Autores
Figura 03: Cromatograma da solução teste após 4 horas de ozônio. PM = Peso molecular.
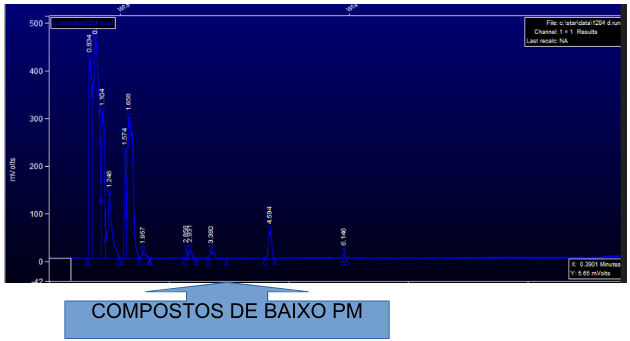
Fonte: Autores.
No cromatograma da figura 04 ocorre a eliminação de diversos componentes de cadeias complexas, demonstrando a eficiência do ozônio na decomposição dos fármacos testados.
Figura 04: Cromatograma da solução de após 5 horas de exposição com ozônio.

Fonte: Autores
Kurniawan et al., 2006; Amorin et al.(2009); Hassemer et al., 2002; Oller et al. (2011) descreveram o poder do ozônio na desregulação de cadeias carbônicas, transformação de compostos e degradação de compostos aromáticos, colaborando com os testes realizados, sendo que Paracetamol foi eliminado em 3 horas e dipirona em 4 horas.
Duarte et al., 2022; Ukuku et al., 2012; Reynolds et al., 1989; Perchonok et al. (2005); Languais et al. (1991) descrevem na degradação da matéria orgânica e eliminação de odores, corantes e turbidez. Nos testes realizados a solução preparada, tabela 01, a turbidez saiu de 10 NTU e em duas horas a solução estava límpida com turbidez < 1 NTU. Já o teste com efluente real de origem hospitalar, tabela 02, a turbidez saiu de 39 NTU para 5 NTU em 5 horas, o que condiz com os autores.
Para os testes de eliminação de bactérias fica evidente que a presença de sólidos suspensos totais é de suma importância para a eficiência do ozônio e uma forma simples de potencializar a instalação de filtros anteriores ao reator de ozônio. Como o tempo de retenção pode ser estendido, alternativas de concentradores de oxigênio, instalação de lâmpadas ultravioletas com comprimento de onda específico, difusores com nanobolhas, coluna d’água, material do tanque, são estratégias para otimizar o sistema. Estudos caso a caso são importantes devido às características de cada efluente a ser tratado, pois o tempo de retenção pode ser até necessário 24 horas, 48 horas ou mais, quando se trata de substâncias de alta estabilidade, simetria e compostos mistos sinérgicos. Como o efluente real não foi encontrada a presença de fármacos, não podemos concluir sobre o impacto de sólidos suspensos na degradação de moléculas persistentes.
Contudo, as Estações de tratamento para atividades hospitalares, domiciliares, farmacêuticas, ou demais que possam possuir características de resíduos químicos persistentes e microrganismos patogênicos precisam contínuo aperfeiçoamento, focando na eliminação de parasitas especializados que possam causar pandemias globais.
CONCLUSÕES
O ozônio se mostrou uma solução tecnológica plausível e de alta eficiência contra males ocultos, ou seja, invisíveis, porém presentes no ecossistema como bactérias e fármacos dissolvidos.
A aplicação correta traz benefícios ao meio ambiente e a saúde humana e animal, evitando que microrganismos altamente resistentes possam chegar aos rios e oceanos e disseminar patologias intratáveis.
Esse trabalho colabora com os ODS – Objetivos de desenvolvimento sustentável buscando saúde para todos e trazendo soluções tecnológicas para problemas reais.
AGRADECIMENTOS
Agradecemos a empresa Goldlab Ciência e Tecnologia pela realização dos ensaios e testes necessários para este trabalho.
REFERÊNCIAS
ANVISA. Agência Nacional de Vigilância Sanitária (ANVISA). Nota Técnica n° 1/2013 – Medidas de prevenção e controle de infecções por enterobactérias multiresistentes. Brasília (DF): ANVISA. 2013.
APHA, AWWA, WEF in: L.S. Clesceri, A. E.; Greenberg, A. D. Eaton (Eds.), Standard Methods for the Examination of Water and Wastewater, 23th ed., American Public Health Association, American Water Works Association, Water Environment Federation,Washington, DC, USA, 2023.
Amorin, C. C.; Leão, M.; Moreira, R. F. P. M. Comparação entre diferentes Processos Oxidativos Avançados para degradação de corante azo. Revista de Eng. Sanitária e Ambiental, Rio de Janeiro, v. 14, n. 4, p. 543-550, out-dez. 2009.
Anzolin, A.P; Bertol,C.D. Ozone therapy as an integrating therapeutic in osteoartrosis treatment: a systematic review. REVIEW ARTICLE. BrJP. 2018.
Bocci, V. Ozone: a new medical drug. 1ª ed., Berlin: Springer, 2005.
BRASIL. Ministério da Saúde. Manual integrado de vigilância, prevenção e controle de doenças transmitidas por alimentos. Brasília: Editora do Ministério da Saúde, 2010.
Duarte, A.; Thomas, N.; Arul, J. Hydrogen Peroxide Can Enhance the Synthesis of Bioactive Compounds in Harvested Broccoli Florets. Frontiers in Sustainable Food Systems. 2022
Eltech Ozone Pvt. Ltd. Effects of Ozone on Bacteria, Ozone Generation System in Mumbai, India. 1998.
FUNASA. Brasil. Ministério da Saúde. FUNASA. CENEPI. Mortalidade Brasil 2004. Brasília: CENEPI/FUNASA; 2004.
Haluch, S.M. Microbiologia clínica. Universidade Positivo. DP Content. [Livro online]. Acesso restrito. 2019a
Haluch, S.M. Microbiologia. Universidade Positivo. DP Content. [Livro online]. Acesso restrito. 2019b
Haluch et al. Haluch, S.M.; Haluch, F.C. DIAGNÓSTICO DE PASSIVOS AMBIENTAIS EM ATERROS HOSPITALARES. Revistaft. 27(124), 30. https://doi.org/10.5281/zenodo.8116930 . 2023c
Haluch et al. . Flávia Caroline Haluch, Gleyciane Martins Rodrigues, Helen Bury, Silvia Mara Haluch e Sandro José Froehner. (2023). CONTROLES E INDICADORES DE DESEMPENHO DE UMA ESTAÇÃO DE TRATAMENTOS DE EFLUENTES INDUSTRIAIS – ESTUDO DE CASO. Revistaft, 27(123), 48. https://doi.org/10.5281/zenodo.8076148 2023. D
Haluch et al. Haluch et al. Investigação da presença de enterobactérias resistentes à antibióticos comerciais em matrizes de aterro hospitalar com vistas em novos parâmetros regulatórios. Revista FT. Ed 122. DOI: 10.5281/zenodo.7991957. 2023. E
Haluch et al. Prospecção de novos antimicrobianos e bactericidas frente a microrganismos de interesse de saúde pública. Brazilian Journal of Animal and Environmental Research Braz. J. Anim. Environ. Res., Curitiba, v. 3, n. 4, p. 3630-3652, out./dez. 2020 ISSN 2595-573X 3. DOI: 10.34188/bjaerv3n4-069. 2020.
Hassemer, M. E. N.; Sens, M. L. Tratamento do efluente de uma indústria têxtil: processo físico-químico com ozônio e coagulação/floculação. Revista Engenharia Sanitária e Ambiental. v. 7, n.1, p. 30-36, 2002.
Kurniawan, T. A.; LO, W.; Chan, G. Y. S. Radicals-catalyzed oxidation reactions for degradation of recalcitrant compounds from landfill leachate. Chemical Engineering Journal, v. 125, p. 35-57, 2006.
Langlais, B.; Reckhow, D. A.; Brink, D.R.; Lewis Publisher. 121 South Main Street, Chelsea, MI 48118. Ozone in Water Treatment: Application and Engineering. Journal of Environmental Quality. 1991.
Leithold, J., Fernandes, C. V. S., Knapik, H. G., Azevedo, J. C. R. (2017) Quali-quantitative characterization of organic matter in urbanized drainage basins as a basis for the application of Water Resources Management Instruments. Brazilian Journal of Water Resources 22, e55. 2017.
Lima, M.JA.; Felix, E.P; APLICAÇÕES E IMPLICAÇÕES DO OZÔNIO NA INDÚSTRIA, AMBIENTE E SAÚDE. Revisão • Quim. Nova 44 (09). 2021.
Luis, J.D.; ABRAHAM, C.M.; CEPERO, S.M. Efeito modulador da terapia com ozônio sobre a atividade do sistema imunológico. Rev Cubana Hematol Inmunol Hemoter, 2013.
Oliveira, L.S.; Eça, K.S.; Aquino, A.C.; Vasconcelos, L.B.. Hydrogen Peroxide (H2O2) for Postharvest Fruit and Vegetable Disinfection. In book: Postharvest Disinfection of Fruits and Vegetables, pp. 91. 2018.
OMS. OMS pública lista inédita de bactérias resistentes a antibióticos. Direitos humanos, 2017. Disponível em: <https://nacoesunidas.org/oms-publica-lista-inedita-de-bacterias-resistentes- a-antibioticos/amp/
Oller, I; Malato, O, S.; Sanchez Perez, J. A. Combination of Advanced Oxidation Processes and Biological Treatments for Wastewater Decontamination: a review. Science of the Total Environment, v. 409, p. 4141-4166, 2011.
PAHO. Resistência antimicrobiana – OPAS/OMS | Organização Pan-Americana da Saúde (paho.org) 2023.
Perchonok, M. H.; French, S. J. Hydrogen Peroxide Treatment of Vegetable Crops. V 114. Journal of aerospace, pp. 362. 2005.
Reynolds, G.; Graham, N.; Perry, R.; Rice, R.G., Aqueous Ozonation of Pesticides: AReview Ozone: Science & Engineering, vol 11, p. 339:382, 1989
Sapers, G., Simmons, G. Hydrogen peroxide disinfection of minimally processed fruits and vegetables. Food Technology. v. 52. n. 2. p. 48. 1998.
Tortora, Gerard J., Funke, B. R., CASE, C.L. Microbiologia, 12th Edition. ArtMed, 2017.
Ukuku, D.O.; Bari, L.; Kawamoto, S. Hydrogen Peroxide. In book: Decontamination of Fresh and Minimally Processed Produce. pp.197. 2012.
Vijayakumar, C.E. Minimum bacteriostatic and bactericidal concentrations of household sanitizers for Escherichia coli strains in tryptic soy broth. Food Microbiology. Volume 19, Issue 4, Elsevier, Pages 383. 2002.
Xie, Y., Wang, J., Wu, Y., Ren, C., Song, C., Yang, S., Yu, H., Giesy, J. P., Zhang, X. (2016) Using in situ bacterial communities to monitor contaminants in river sediments. Environmental Pollution 212, 348-357. 2016.
Xie, Y., Wang, J., Yang, J., Giesy, J. P., Yu, H., Zhang, X. (2017) Environmental DNA metabarcoding reveals primary chemical contaminants in freshwater sediments from different land-use types. Chemosphere 172 (2017) 201-209. 2017.
Xie, Y., Floehr, T., Zhang, X., Xiao, H., Yang, J., Xia, P., Burton Jr., G. A., Hollert, H. (2018) In situ microbiota distinguished primary anthropogenic stressor in freshwater sediments. Environmental Pollution 239, 189-197. 2018.
WHO. World Health Organization. Containing antimicrobial resistance. Geneva, Switzerland: WHO; WHO Policy Perspectives on Medicines. 2005.
WHO. World Health Organization. Health aspects of air pollution with particulate matter, ozone and nitrogen dioxide, disponível em: http://www.euro.who.int/document/e79097.pdf. 2017
1Mestre em Ciências, Biomédica, Química e Biotecnóloga. Pesquisadora e Gerente da Qualidade da Goldlab Ciência e Tecnologia Ltda. Goldlablaboratorios@gmail.com
2Biomédica, Microbiologista, Toxicologista, estudante de pós-graduação em ESG – PUC/PR Pesquisadora e Gerente Técnica da Goldlab Ciência e Tecnologia Ltda. Goldlablaboratorios@gmail.com
