REGISTRO DOI: 10.69849/revistaft/cl10202510281022
Ana Carolina Risson¹, Ana Caroline Mezzalira¹, Ana Paula Jaskulski Sampaio¹, Bruno da Silva Riterbusche¹, Gabriela Escobar Bataioli¹, Guilherme Garcia Sott¹, Júlia do Nascimento Marcon¹, Júlia Nicola Garcia¹, Michel Kovalski Batista¹, Felipe Costa²
RESUMO
A hiperprolactinemia é uma condição comum na prática clínica, tendo os prolactinomas como sua principal causa. Durante a gestação, os elevados níveis de estrogênio podem influenciar o crescimento tumoral, exigindo atenção especial no manejo dessas pacientes. O tratamento padrão envolve o uso de agonistas da dopamina. Entretanto, devido às diferentes manifestações clínicas, a conduta deve ser individualizada. Durante a gestação, recomenda-se a suspensão desses medicamentos. Para pacientes com microadenomas e macroadenomas intrasselares, deve-se interromper a medicação e realizar acompanhamento clínico trimestral. Já nos casos de macroadenomas expansivos ou invasivos, a continuidade do tratamento pode ser considerada a critério médico, com monitoramento rigoroso. Na presença de sintomas sugestivos de efeito de massa, é indicada ressonância magnética selar sem contraste. O aumento sintomático do tumor durante a gravidez pode requerer reintrodução do agonista da dopamina ou intervenção cirúrgica transesfenoidal. Entre as medicações disponíveis, a bromocriptina aparenta ser mais segura que a cabergolina, pois o uso prolongado desta última está associado a maiores taxas de aborto espontâneo. Contudo, não há evidências de aumento na incidência de malformações congênitas em comparação à população geral ou a estudos anteriores. Portanto, em pacientes com microprolactinomas estáveis, a suspensão dos agonistas da dopamina deve ser a primeira conduta após confirmação da gestação. A manutenção ou reintrodução da terapia medicamentosa, assim como a indicação cirúrgica, devem ser avaliadas individualmente, de acordo com as características clínicas de cada gestante.
Palavras-chave: Adenoma secretor de prolactina. Gravidez. Tratamento. Agonistas da dopamina.
INTRODUÇÃO
A hiperprolactinemia, definida por um nível de prolactina sérica (PRL) acima do limite superior padrão da faixa normal, é um achado comum na prática clínica. Os adenomas secretores de PRL, ou prolactinomas, são sua etiologia mais frequente (Sant’ Anna et al., 2019). Epidemiologicamente, os prolactinomas afetam mulheres, sobretudo, na terceira e quarta década de vida. Esses são responsáveis pelo hipogonadismo hipogonadotrófico e a infertilidade (Glezer; Bronstein, 2019). A secreção de PRL sofre influência do ciclo menstrual, da menopausa e da gestação. O estrogênio é considerado um fator de liberação de PRL, uma vez que influencia na sua secreção. Na gestação, o tamanho dos prolactinomas pode ser influenciado pelos elevados níveis de estrogênio (Benetti-Pinto et al., 2024).
Para o diagnóstico, utiliza-se critérios clínicos, laboratoriais e de imagem (Glezer; Bronstein, 2019). Os prolactinomas podem ser classificados como microadenomas (diâmetro <10 mm) ou macroadenomas (diâmetro >10 mm) (Wildemberg et al., 2021). A maioria dos prolactinomas trata-se de microprolactinomas (MIC) com sintomas relacionados ao hipogonadismo e à galactorréia. Nas pacientes com macroprolactinomas (MAC), cefaléia, distúrbios visuais e hipopituitarismo adicional são frequentes (Glezer; Bronstein, 2019).
O manejo adequado é altamente eficaz na normalização dos níveis hormonais e redução do tumor em mais de 80% dos casos, permitindo a gravidez em mulheres com prolactinomas (Wildemberg et al., 2021). Esses tumores são frequentemente tratados com agonistas da dopamina (DA) como método padrão-ouro, a exemplo da cabergolina. Esses medicamentos são eficazes e bem tolerados, embora possam exigir uso contínuo de longo prazo, às vezes, por toda a vida (Sant’ Anna et al., 2019).
Quando mulheres com prolactinomas engravidam, duas questões cruciais surgem: os efeitos dos DA no desenvolvimento fetal inicial e o impacto da gravidez no tamanho do prolactinoma (Huang et al., 2019). Na gestação, os níveis de PRL tendem a aumentar em até dez vezes em comparação aos valores pré-gestacionais. Por isso, a dosagem dos níveis séricos é desaconselhada durante esse período. Sendo assim, devido às suas diferentes manifestações, o manejo do prolactinoma deve ser individualizado durante a gestação (Benetti-Pinto et al., 2024).
MÉTODOS
Este trabalho se fundamentou em revisão sistemática da literatura científica nacional e internacional (Figura 1) sobre o tema Manejo dos prolactinomas na gestação, cujo objeto de análise foi a produção científica veiculada em periódicos indexados no banco de dados National Library of Medicine (MEDLINE), disponíveis no United States National Library of Medicine – PubMed (http://www.ncbi.nlm.nih.gov/pubmed). A pesquisa foi realizada conforme recomendações metodológicas da declaração Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) para trabalhos de revisão sistemática.
A busca dos documentos ocorreu nos meses entre junho e julho de 2024, e para isso foram usados os seguintes descritores: pregnancy AND prolactinoma AND treatment OR dopamine agonist AND pregnancy AND prolactinoma. Na base PubMed foram aplicados os filtros: publicados nos últimos 5 anos e sexo feminino.
Por meio da busca, inicialmente foram rastreados 32 documentos, encontrados na base de dados Medline (PubMed). Em seguida, foram selecionados os trabalhos científicos incluídos no estudo por meio de avaliação dos títulos e resumos, de forma independente por dois pesquisadores, obedecendo aos seguintes critérios de inclusão: publicações compreendidas nos últimos 5 anos; que avaliaram o manejo de prolactinoma em gestantes.
Os seguintes critérios de exclusão foram utilizados: trabalhos que não forneceram resultados absolutos ou percentuais sobre o tratamento; que não citam o manejo do prolactinoma durante a gestação, assim como aqueles que incluíram várias pacientes não-gestantes e não os discriminam nos resultados; demais tumores hipofisários que não prolactinomas; e relatos de caso.
Após avaliação dos títulos e resumos, foram selecionados 15 trabalhos, sendo que destes, após leitura integral e aplicados os critérios de exclusão, 12 foram incluídos. Por fim, depois da análise crítica dos artigos selecionados, realizada por 5 pesquisadores de forma independente, os trabalhos foram classificados por autor, ano da publicação, local da pesquisa, objetivos, tipo de metodologia empregada e resultados apresentados.
Figura 1 Representação esquemática dos métodos de identificação, triagem, elegibilidade e inclusão de trabalhos na revisão, adaptada de acordo com o PRISMA Flow Diagram.
Fonte: elaboração própria do autor.
RESULTADOS
Em relação aos 12 artigos selecionados, foram descritos os dados (Quadro 1), em que são expostos: autor principal, ano da publicação, países da pesquisa e as especialidades médicas estudadas. Do total de artigos incluídos na revisão, 4 continham dados do Brasil, 2 da Itália, 2 da Alemanha, 2 dos Estados Unidos (EUA), e cada um dos países a seguir esteve citado em 1 artigo: Turquia e Áustria.
Quadro 1 Artigos incluídos neste estudo, classificados segundo autor principal, ano da publicação, país da pesquisa e especialidades médicas do estudo.
| Autor | Ano | País | Especialidade |
| Huang MD et al. | 2019 | EUA | Endocrinologia |
| Sant’ Anna et al. | 2019 | Brasil | Endocrinologia |
| O’Sullivan et al. | 2019 | EUA | Endocrinologia |
| Glezer; Bronstein | 2019 | Brasil | Neuroendocrinologia |
| Honegger et al. | 2019 | Alemanha | Neurocirurgia |
| Tanrikulu; Yarman | 2021 | Turquia | Endocrinologia |
| Luger et al. | 2021 | Áustria | Endocrinologia |
| Wildemberg et al. | 2021 | Brasil | Endocrinologia |
| Cozzi et al. | 2022 | Itália | Endocrinologia |
| Petersenn et al. | 2023 | Alemanha | Endocrinologia |
| Prencipe et al. | 2024 | Itália | Endocrinologia |
| Benetti-Pinto et al. | 2024 | Brasil | Ginecologia obstetrícia |
Fonte: Elaboração própria do autor.
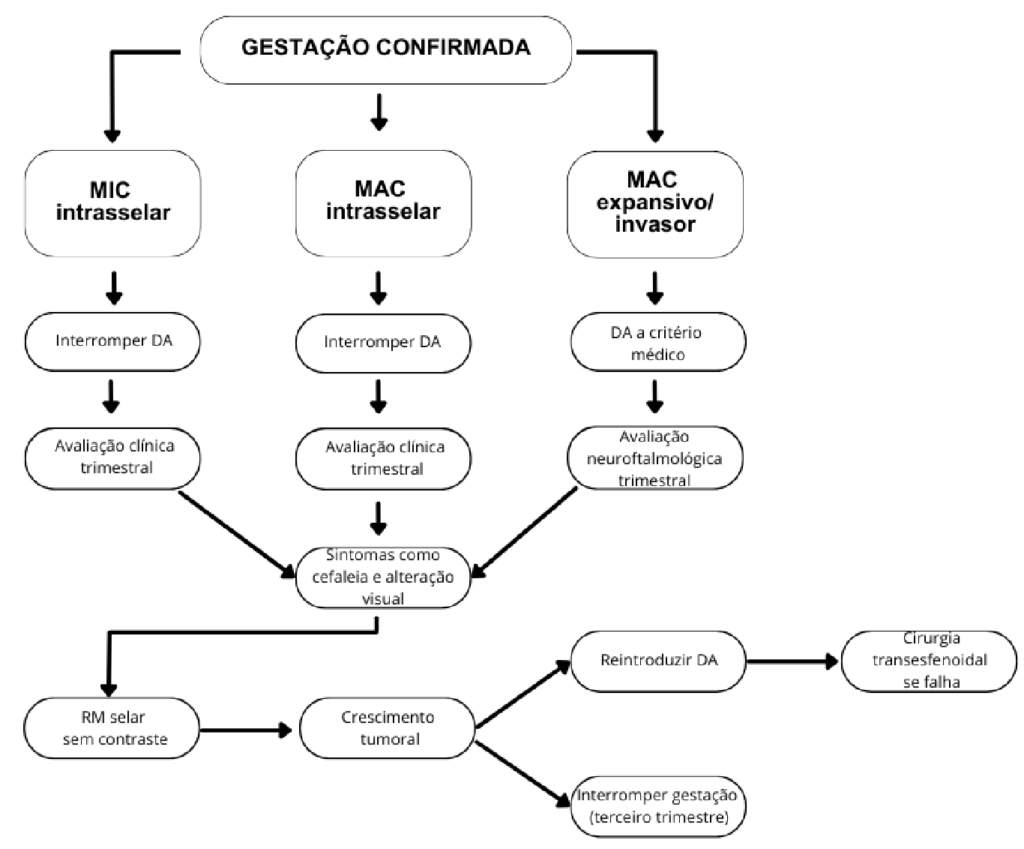
O manejo do prolactinoma durante a gestação é claro na literatura. Nos estudos analisados, os autores esclarecem a importância de individualizar o tratamento. No geral, deve-se analisar a presença de sintomas neurológicos e oftalmológicos associados à compressão de massa, assim como o controle da doença antes da confirmação da gestação e o tamanho do tumor. Neste estudo, levou-se em consideração os diferentes cenários e o manejo adequado em cada um deles, além das possíveis complicações associadas à manutenção do tratamento na gravidez. O manejo do prolactinoma durante a gestação está exposto na Figura 2.
Após análise dos artigos e entendimento dos possíveis cenários, avaliando os prós e contras, estabeleceu-se o manejo seguindo as recomendações propostas pelos autores estudados.
Figura 2 Manejo do prolactinoma durante a gestação.
Fonte: Elaboração própria do autor.
DISCUSSÃO
O prolactinoma é a principal causa de hiperprolactinemia em mulheres entre a terceira e quinta década de vida. Durante a gestação, há um aumento fisiológico dos níveis séricos de PRL pelos elevados níveis de estrogênio e estímulo de lactotrofos. Portanto, dosar os níveis de PRL durante a gestação em mulheres com prolactinoma não é adequado. Nessas pacientes, deve-se avaliar os riscos e benefícios de interromper o tratamento medicamentoso, além de traçar um manejo pela avaliação individual de cada caso (Wildemberg et al., 2021).
Verifica-se que, entre as gestantes que fizeram uso de agonistas dopaminérgicos, há maior risco de parto prematuro e de perda gestacional precoce. Em relação ao aumento sintomático do tumor, caracterizado por cefaleia e comprometimento do campo visual, observa-se que esse evento ocorre em pequena proporção dos microadenomas, em frequência mais elevada nos macroadenomas sem histórico de cirurgia ou radioterapia, e em menor proporção nos macroadenomas previamente tratados. Nos casos de microadenomas ou macroadenomas intrasselares com suspensão do uso de agonistas dopaminérgicos e níveis estáveis de prolactina, o acompanhamento clínico tende a ser suficiente. A suspensão abrupta da medicação deve ser evitada, sendo o tratamento cirúrgico indicado apenas quando não há resposta à terapia medicamentosa ou diante de piora progressiva do quadro (Huang et al., 2019).
O crescimento tumoral sintomático é mais frequentemente observado em macroadenomas tratados com DA, especialmente naqueles macroadenomas previamente submetidos à cirurgia, quando comparados aos microadenomas. Embora a taxa geral de aborto espontâneo seja equivalente à da população geral, é significativamente maior entre as pacientes que matém a cabergolina em comparação com as que suspendem o tratamento imediatamente após confirmar a gravidez. A evidência de segurança do uso de cabergolina durante a gestação não é conclusiva, sobretudo no que diz respeito ao desenvolvimento neurológico infantil (Sant’Anna et al., 2019).
Durante as cinco primeiras semanas de gestação, a exposição à DA não aumenta as adversidades neonatais, resultados da gravidez ou aborto espontâneo em comparação com a população geral, sendo segura. Do mesmo modo, não é observado aumento na incidência de malformações congênitas em relação à população geral ou à relatos de estudos anteriores. Além disso, suspender o tratamento precocemente não aumenta a recorrência da doença no pós-parto e, aproximadamente, um quarto das mulheres com prolactinoma pode alcançar níveis normais de PRL sem tratamento após a gravidez (O’Sullivan et al., 2019).
No contexto da gestação, a recomendação é que o uso de AD seja descontinuado. Quanto ao tamanho tumoral, em caso de MIC e de MAC intrasselar, recomenda-se a retirada do DA, além da avaliação clínica trimestral. Em caso de MAC expansivo ou invasivo, a manutenção do DA fica a critério médico, sendo necessário monitoramento frequente: avaliação clínica mensal e oftalmológica trimestral. Na presença de sintomas de efeito de massa tumoral, necessita-se de ressonância magnética (RM) selar sem contraste. Na presença de crescimento tumoral significativo relacionado ao quadro clínico encontrado na RM selar, recomenda-se a reintrodução dos DA, sendo a bromocriptina a droga de escolha durante o período gestacional. A neurocirurgia, de preferência no segundo trimestre de gestação, fica reservada em caso de falha do tratamento medicamentoso – pode-se considerar a antecipação do parto se a paciente estiver próxima ao final da gestação (Glezer; Bronstein, 2019).
Há chance de aumento sintomático do tumor tanto nos microadenomas quanto nos macroadenomas. Nesses casos de crescimento tumoral após a retirada dos DA, o reinício da medicação é uma estratégia terapêutica. Com a realização de cirurgia transesfenoidal pré-gestação, o risco de crescimento sintomático do MAC diminui consideravelmente. A partir de tal redução, observa-se a cirurgia transesfenoidal como uma opção terapêutica a ser considerada nessas situações Honegger et al.,). O tamanho do adenoma no diagnóstico parece ser um fator significativo para a progressão do tumor, exceto nos casos de macroadenomas que não são grandes ou gigantes durante a gravidez. Portanto, o mantimento do tratamento com DA durante a gestação pode ser uma maneira fácil de proteger os pacientes contra o crescimento potencial de tumores invasivos (Tanrikulu; Yarman, 2021).
As indicações cirúrgicas para tumores hipofisários durante a gestação são raras, sendo principalmente: alteração visual severa devido a apoplexia ou aumento do tumor. Recomenda-se que o tratamento com DA seja cessado quando houver confirmação da gestação, e reiniciado em caso de sintomas de progressão do tumor, sendo a cirurgia uma opção quando houver falha do tratamento medicamentoso. Grande parte dos casos publicados teve a realização da cirurgia durante o segundo trimestre. No terceiro semestre, a indução de parto pré-termo antes da cirurgia deve ser considerada. Porém, cirurgias de emergência devido a oftalmoplegia ou perda severa de visão devem ser feitas durante qualquer um dos trimestres. Deve-se considerar, de mesmo modo, a cirurgia em mulheres grávidas com cefaleia severa atribuída ao aumento do tumor se o tratamento clínico não for efetivo (nível baixo de recomendação), mesmo sem confirmação de aumento tumoral por exames de imagem. Se a cirurgia for indicada, sugere-se a realização de cirurgia transesfenoidal no segundo semestre, caso o curso clínico permita (nível baixo de recomendação). Recomenda-se não realizar radioterapia durante a gravidez, devido ao potencial risco para o feto. Além disso, indica-se realizar uma RM sem contraste na gravidez em caso de sintomas de progressão do tumor ou apoplexia, bem como efetuar exame neuro-oftalmológico para adenomas colidindo com vias oculares ou em caso de suspeita de progressão do tumor ou apoplexia hipofisária. Não há dados indicativos de prevalência maior de malformações após tratamento com medicações para prolactinoma ou hiperprolactinemia do que na população em geral. Ademais, a segurança e teratogenicidade não diferiu entre bromocriptina e cabergolina (Luger et al., 2021).
O uso de bromocriptina pode ser recomendado em pacientes com prolactinoma que expressem o desejo de engravidar no aconselhamento pré-concepcional. Durante a gestação, a gestão clínica envolve a monitorização regular, sem necessariamente medir os níveis de PRL, em MIC e MAC intrasselares. Em casos mais invasivos, a manutenção dos DA, preferencialmente bromocriptina, é recomendada. Evidencia-se também que o uso de DA possa aumentar o risco de perda da gravidez e parto prematuro, sem impacto significativo no desenvolvimento neuropsicomotor infantil até os 24 meses. A cabergolina, em particular, tem sido avaliada com uma taxa de aborto espontâneo mais elevada observada em comparação com a população geral, mas com outros desfechos materno-fetais similares (Wildemberg et al. ).
Os DA são classificados como fator de risco de gravidez B, uma vez que atravessam a placenta, não havendo estudos adequados para a avaliação de risco fetal. Portanto, o uso de DA deve ser interrompido na confirmação da gravidez. Mesmo com a interrupção do uso na confirmação gestacional, ainda há exposição fetal aos DA por cerca de 3-4 semanas de gestação. Em relação aos MIC, o risco de crescimento tumoral significativo durante a gestação é menor que 3% e a paciente deve ser acompanhada clinicamente durante a gravidez. Já nos MAC, o tratamento deve ser individualizado, tendo em conta a gravidade dos sintomas na apresentação, a progressão da doença e a experiência cirúrgica disponível, com um equilíbrio delicado entre os riscos para a mãe e o risco da cirurgia para o bebê (Cozzi et al., 2022).
Para as pacientes com prolactinoma que possuem o desejo de engravidar, é fundamental informar as opções terapêuticas antes da concepção. Para MIC (<10mm), o uso de DA é a primeira linha de tratamento. A escolha cirúrgica deve ser avaliada levando em consideração o risco de hipopituitarismo pós-operatório e, portanto, deve ser realizada por um cirurgião experiente. Em casos de MAC (>10 mm), os casos cirúrgicos ficam reservados para pacientes que apresentam um adenoma não responsivo aos DA e/ou apresentam uma localização muito próxima às estruturas ópticas. Ademais, a troca da cabergolina por bromocriptina em pacientes que desejam engravidar está desaconselhada, pois a troca para bromocriptina pode resultar na perda do controle dos níveis séricos de PRL e afetar negativamente a fertilidade. Durante a gravidez, o uso contínuo de cabergolina está associado a maiores taxas de aborto, sendo recomendada a descontinuação da medicação nesse período (Petersenn et al., 2023).
A interrupção do uso de DA durante a gestação é amplamente recomendada, sendo sua manutenção restrita a situações específicas, como em casos de macroadenomas expansivos ou invasivos. Evidências apontam que o uso dessas medicações nas primeiras semanas da gestação, especialmente em mulheres com tumores secretores de prolactina, apresenta perfil de segurança aceitável tanto para a mãe quanto para o feto. A incidência de abortos espontâneos, partos prematuros e baixo peso ao nascer foi semelhante à observada na população geral, e não foram identificadas malformações associadas ao uso de bromocriptina ou cabergolina. Entretanto, alguns estudos relataram maior frequência de alterações leves e transitórias no desenvolvimento infantil entre os filhos de mulheres tratadas com cabergolina, embora sem correlação com fatores maternos ou neonatais (Prencipe et al., 2024; Benetti-Pinto et al., 2024).
Em gestantes com tumores intrasselares bem controlados clinicamente, recomenda-se a suspensão do tratamento durante a gestação, uma vez que o risco de crescimento tumoral sintomático é baixo, especialmente em microadenomas. Já em macroadenomas não submetidos previamente à cirurgia ou radioterapia, o risco de expansão e apoplexia é mais elevado, podendo justificar a manutenção do DA durante a gravidez, sobretudo quando há compressão ou proximidade das vias ópticas. A decisão deve ser individualizada, considerando a resposta terapêutica prévia e o tempo de uso da medicação. Apesar de associações descritas entre o uso contínuo de DA e maiores taxas de aborto e prematuridade, observa-se redução desses desfechos quando a cabergolina é suspensa após a confirmação da gestação. Durante o acompanhamento, indica-se monitoramento clínico periódico, com avaliação trimestral para microadenomas e mensal para macroadenomas, incluindo testes de campo visual em casos mais extensos. A ressonância magnética deve ser reservada para situações de suspeita clínica de expansão tumoral, sem o uso de contraste. Se houver recidiva de sintomas ou aumento do tumor, recomenda-se a reintrodução do DA, e, na ausência de resposta, a descompressão cirúrgica pode ser indicada, preferencialmente no segundo trimestre gestacional (Benetti-Pinto et al., 2024).
CONCLUSÃO
O manejo do prolactinoma durante o período gestacional irá depender, sobretudo, do tempo de tratamento realizado pela paciente antes da gestação, do crescimento ou estabilização do tamanho tumoral e, consequentemente, da presença ou não de sintomas compressivos. Com isso, a remoção dos agonistas de dopamina é a primeira medida a ser tomada após confirmação da gestação. A reintrodução da medicação ou medidas cirúrgicas devem ser avaliadas conforme características singulares de cada gestante.
CONTRIBUIÇÃO DOS AUTORES
Todos os autores contribuíram substancialmente no delineamento, no levantamento de dados e na sua análise e interpretação, e na elaboração ou aprovação da versão final do manuscrito.
REFERÊNCIAS BIBLIOGRÁFICAS
BENETTI-PINTO, C. L. et al. Treatment of hyperprolactinemia in women: A Position Statement from the Brazilian Federation of Gynecology and Obstetrics Associations (Febrasgo) and the Brazilian Society of Endocrinology and Metabolism (SBEM). Archives of endocrinology and metabolism, v. 68, p. e230504, 5 abr. 2024.
COZZI, R. et al. Italian Association of Clinical Endocrinologists (AME) and International Chapter of Clinical Endocrinology (ICCE). Position statement for clinical practice: prolactin-secreting tumors. European Journal of Endocrinology, v. 186, n. 3, p. P1–P33, 1 mar. 2022.
GLEZER, A; BRONSTEIN, M. Prolactinomas in pregnancy: considerations before conception and during pregnancy. Pituitary Society and the Growth Hormone Research Society, v.23, p. 65–69. 2 dez. 2019.
HONEGGER, J. Surgery for prolactinomas: a better choice? Pituitary Society and the Growth Hormone Research Society, v. 23, p. 45-51, 18 dez. 2019.
LUGER, A. et al. Ese clinical practice guideline on functioning and nonfunctioning pituitary adenomas in pregnancy. European Journal of EndocrinologyBioScientifica Ltd., 1 set. 2021.
MD, H. et al. Pituitary Tumors in Pregnancy. Endocrinology and Metabolism Clinics of North America, v. 48, p. 569-581, set. 2019.
O’SULLIVAN, S. et al. An observational study of pregnancy and post-partum outcomes in women with prolactinoma treated with dopamine agonists. Australian and New Zealand Journal of Obstetrics and Gynaecology, v. 60, p. 405-411, 3 out. 2019.
PETERSENN, S. et al. Diagnosis and management of prolactin-secreting pituitary adenomas: a Pituitary Society international Consensus Statement. Nature Reviews Endocrinology, v. 19, n. 12, p. 722–740, 1 dez. 2023. PRENCIPE, N. et al. Prolactin-secreting tumors, dopamine agonists and pregnancy: a longitudinal experience of a tertiary neuroendocrine center. Pituitary, v. 27, n. 3, p. 269–276, 1 jun. 2024.
SANT’ANNA, B. et al. A Brazilian multicentre study evaluating pregnancies induced by cabergoline in patients harboring prolactinomas. Pituitary Society and the Growth Hormone Research Society, v. 23, p. 120-128, 14 nov. 2019.
TANRIKULU, S.; YARMAN, S. Outcomes of patients with macroprolactinoma desiring pregnancy: Follow-up to 23 years from a single center. Hormone and Metabolic Research, v. 53, n. 6, p. 371–376, 1 jun. 2021.
WILDEMBERG, L. E.; FIALHO, C.; GADELHA, M. R. Prolactinomas. Presse MedicaleElsevier Masson s.r.l., 1 dez. 2021.
¹Acadêmica(o) de Medicina da Universidade Franciscana (UFN).
²Médico Ginecologista e Obstetra pela Universidade Federal de Ciências da Saúde de Porto Alegre. Especialização em Reprodução Humana pela Pontifícia Universidade Católica do Rio Grande do Sul (PUCRS). Docente do curso de Medicina da Universidade Franciscana (UFN).
